Introducción
Los bofedales u oconales (palabra quechua) son un tipo particular de humedal de turbera, característico de la zona altoandina de los Andes tropicales y subtropicales ubicados de 3 800 a 5 000 msnm (Estenssoro, 1991). Se caracterizan por tener suelos ricos en materia orgánica vegetal, parcialmente descompuesta, y por estar saturados de humedad (Osaki & Tsuji, 2015). El agua puede provenir de manantiales, arroyos, deshielo y lluvias, siendo unas más importantes que otras, dependiendo de las características del bofedal. Estos tipos de ambientes con saturación de agua casi permanente, sumado a otros factores, condicionan la presencia de una diversidad única (Maldonado, 2014), con la posible existencia de biota endémica y rara (Coronel et al., 2004; Squeo et al., 2006).
El agua de los bofedales se encuentra casi exclusivamente en el subsuelo. Eventualmente está presente en la superficie, depositada en depresiones de poca profundidad y extensión (Nieto et al., 2016) y como corrientes de agua de escaso caudal que circulan por cauces de poca profundidad y pendiente (Maldonado, 2014; Salvador et al., 2015). La frecuencia, persistencia y volumen de éstas se halla directamente relacionada con la saturación del suelo, así como por la presencia de lluvias.
Existen investigaciones sobre la biodiversidad en los bofedales, principalmente sobre vegetales terrestres, reportando la presencia de más de 61 especies de plantas para Ayacucho y Huancavelica en Perú (Maldonado, 2010) y de 62 para Salta en Argentina (Nieto et al., 2016). Sin embargo, el conocimiento es limitado para otros ensamblajes acuáticos, como fitoplancton, zooplancton, perifiton, plantas acuáticas y macroinvertebrados.
Los cuerpos de agua lóticos asociados con los bofedales, por su ubicación latitudinal y altitudinal, pueden ser considerados como arroyos andinos de tierras altas tropicales (Jacobsen, 2008). Estos parches dentro de los bofedales son ideales para el establecimiento de ensamblajes de organismos acuáticos con menor diversidad y composición diferente, comparado con sistemas fluviales ubicados a menor altitud (Villamarín, Rieradevall & Prat, 2020). Esto podría deberse a la baja disponibilidad de oxígeno, temperaturas extremas (Crespo-Pérez et al., 2016; Jacobsen, 2003, Jacobsen, 2008; Jacobsen & Marín, 2007; Jacobsen, Rostgaard & Vásconez, 2003; Madsen et al., 2015), menor productividad (Crespo-Pérez et al., 2016; Madsen et al., 2015), y elevada insolación solar (Lewis et al., 1995), lo cual impone un alto estrés fisiológico a los organismos que ahí habitan (Jacobsen & Marín, 2007; Jacobsen, 2008; Jacobsen & Brodersen, 2008).
A escala global y regional la riqueza de especies tiende a disminuir con el incremento de la altitud, mientras que aumenta desde los polos hasta el Ecuador (Whittaker et al., 2001; Willig et al., 2003). Dicho patrón es observado en muchos grupos de especies tanto vegetales y animales (Jacobsen, 2004). Varios autores sostienen que esta distribución ocurre como respuesta al efecto de las condiciones ambientales que se hacen más rigurosas con la mayor latitud y altitud (Vannote et al., 1980; Rahbek, 1995). Para el caso de los macroinvertebrados acuáticos, la riqueza específica tiene poca o ninguna relación con la altitud (Cressa, 2000; Monaghan et al., 2000).
La literatura científica de macroinvertebrados para arroyos andinos tropicales (> 3 000 msnm) asociados a bofedales, donde las condiciones ambientales son extremas, es escasa (Jacobsen, 2008), así como para cuerpos de agua lénticos en comparación a otro tipo de sistemas (Ramírez & Gutiérrez, 2014). Con la información disponible, se ha determinado que la composición comunitaria cambia en comparación con sistemas ubicados a menor altitud, como es el caso de ríos asociados a bosques montanos (2 000 a 3 500 msnm) comparado con los ubicados a elevaciones mayores (Villamarín et al., 2020).
Los estudios de la estructura de los macroinvertebrados a nivel global (hemisferios, regiones biogeográficas) y regional (cuencas) son frecuentes, al igual que a nivel local (microcuencas o un bofedal); sin embargo, son escasos para arroyos asociados a bofedales, o inexistentes para esta área de estudio. A nivel local, es de suponer que los ensambles sean similares por la proximidad de las zonas de estudio y la continuidad del sistema en la que se encuentran (Lampert & Sommer, 2007), además con condiciones climáticas, edáficas y otros, similares. Sin embargo, existen factores como la heterogeneidad de hábitat que son fuente de variación (Villamarín et al., 2020), sumado a factores poco estudiados, como la contribución de aguas ácidas y elevada conductividad proveniente de manantiales o fuentes de agua subterránea que generan abruptas variaciones de su calidad (pH, conductividad, dureza, entre otros) con la consecuente variación del ensamblaje de los macroinvertebrados.
Por lo general, la lluvia es una de las principales fuentes de agua para los bofedales, sin embargo en algunas de ellas puede sumarse los manantiales que se originan en áreas que rodean al bofedal, cambiando la calidad del agua, cuya magnitud depende de la naturaleza de la roca madre de donde se origina (Cooper et al., 2010). Por otro lado, el tamaño del área donde se aprecia esos cambios abruptos de la calidad de agua es variable, dependiendo del número de manantiales, volumen y de la forma como discurre sus aguas en la superficie. La magnitud de los cambios locales de riqueza, composición y abundancia de los macroinvertebrados, depende en igual medida de los cambios de las características fisicoquímicas del agua (Alba, 1996; Ramírez & Gutiérrez, 2014; Roldán, 2003) que en caso de los arroyos asociado a algunos bofedales, estaría determinado por la presencia de manantiales. El objetivo de la investigación fue determinar la composición y estructura del ensamblaje de macroinvertebrados en los arroyos de dos bofedales Altoandinos de Ayacucho (Perú) que reciben aguas provenientes de manantiales.
Materiales y métodos
Área de estudio: El presente estudio se realizó en arroyos asociados a dos bofedales, denominados Guitarrachayocc (G) y Pichccahuasi (P), ubicados en la ecorregión altoandina de Perú (Tabla 1). Esta zona corresponde a la tundra pluvial - alpino subtropical, caracterizada por ser generalmente fría y seca, con biotemperatura media anual mínima de 1.5 ºC y máxima de 3 ºC, precipitación anual entre 500 a 1 000 mm de marcada estacionalidad y con promedio de evapotranspiración potencial que varía entre 0.125 a 0.25 veces el valor de precipitación (ONERN, 1976). Los bofedales evaluados se localizan en la naciente del río Apacheta que pertenece a la cuenca del Mantaro; este último da origen al río del mismo nombre, posteriormente al río Ene, Ucayali y finalmente el Amazonas antes de desembocar en el mar Atlántico. Los bofedales distan 1.5 km, uno de otro (Fig. 1), cuyos efluentes se unen cuenca abajo, para formar el río Supaymayo, principal tributario del río Apacheta.
TABLA 1 TABLE 1 Características generales de las estaciones de muestreo en arroyos de dos bofedales General characteristics of sampling stations in two high Andean wetland streams
| Arroyos | Estaciones de muestreo | Longitud del arroyo (m) | Nº replicas | Coordenadas | Altitud (msnm) | Área (ha) | Pendiente (%) | |
| Este | Sur | |||||||
| Bofedal G | G1 | 1 150 | 28 | 13°24’32.82” | 74°41’26.83” | 4 592 | 43 | 1.52 |
| G2 | 13°24’32.72” | 74°41’22.47” | 4 587 | |||||
| G3 | 13°24’35.63” | 74°41’11.79” | 4 589 | |||||
| G4 | 13°24’31.05” | 74°41’16.69” | 4 583 | |||||
| G5 | 13°24’26.79” | 74°41’18.49” | 4 582 | |||||
| G6 | 13°24’18.09” | 74°41’11.72” | 4 577 | |||||
| G7 | 13°24’10.98” | 74°41’2.95” | 4 569 | |||||
| Bofedal P | P1 | 740 | 8 | 13°23’31.78” | 74°41’49.40” | 4 503 | 28 | 5.44 |
| P2 | 13°23’28.94” | 74°41’44.27” | 4 501 | |||||
| P3 | 13°23’23.45” | 74°41’41.93” | 4 491 | |||||
| P4 | 13°23’16.14” | 74°41’35.54” | 4 483 | |||||
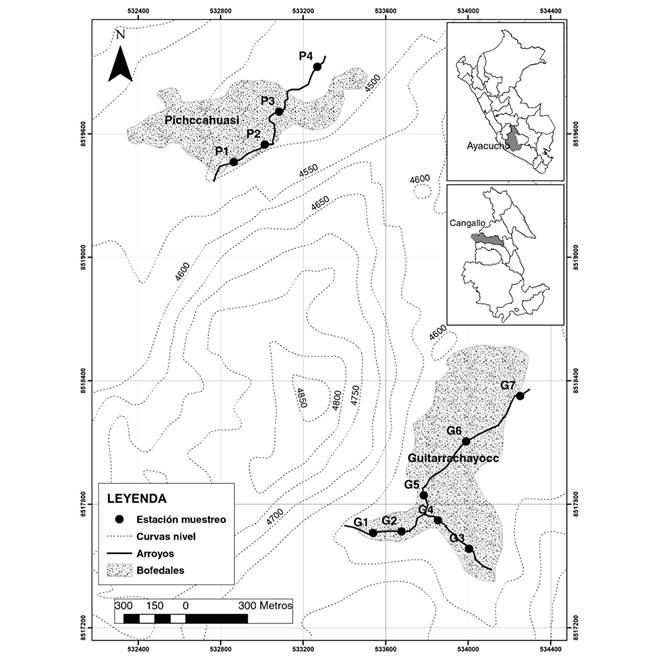
Fig. 1 Fig. 1 Localización de los arroyos y bofedales muestreados, Ayacucho, Perú. Location of sampled streams in high Andean wetlands, Ayacucho, Peru.
El bofedal G, se caracteriza por presentar dos pequeños arroyos, los que se unen para formar un arroyo único (Fig. 1); su caudal no excede los 50 L/s en la época húmeda, transitando cauces de ancho no mayor a 2 m y con profundidades que no sobrepasan los 40 cm; el lecho está constituido por guijarros, además de limo y arcilla (Wentworth, 1922). En algunas áreas se encuentra materia orgánica vegetal en descomposición, el agua proviene de excedentes del subsuelo y de charcos superficiales, en la zona baja se observa la presencia de un manantial que se origina en áreas circundantes al bofedal. La pendiente del terreno es de 1.52 %.
El arroyo ubicado en el bofedal P es único, el lecho está constituido por canto rodado y por abundante material arcilloso blanco, con caudal de hasta 200 L/s en época lluviosa. Tiene el mismo origen que el bofedal G, con la diferencia que la contribución de manantiales ocurre de oeste a este de la estación 1 al 4 (Fig. 1), abarcando gran parte de la ribera del arroyo. La pendiente del terreno donde se ubica este bofedal es de 5.44 %.
Recolecta de muestras: En el bofedal G se ubicaron siete estaciones de muestreo, dos en cada uno de los arroyos ubicados en la parte alta y tres en el arroyo resultado de la unión de los dos primeros, mientras en P, se ubicaron cuatro estaciones (Fig. 1), la diferencia del número de estaciones se debe a la longitud de los arroyos examinados. Los muestreos se desarrollaron siguiendo la gradiente altitudinal, desde octubre de 2016 a abril de 2017, con una frecuencia mensual, entre las 8 a 10 horas del día.
Se utilizó una red Surber de 0.3 mm de luz de malla con un área de muestreo de 1 200 cm2. La toma de muestras se realizó en diferentes hábitats determinado por la morfología del cauce (orilla y parte central del cauce) y características del lecho (diferentes tamaños de partículas). Cada muestra estuvo compuesta por cinco colectas que fueron homogenizadas y depositadas en un recipiente plástico de 500 mL y conservado con etanol al 96 %, posteriormente depositados en recipientes (cooler), para su transporte al laboratorio.
Simultáneamente al muestreo de macroinvertebrados, se realizaron determinaciones de las siguientes variables ambientales del agua in situ: pH, conductividad, sólidos disueltos totales y temperatura. Para ello se utilizó un analizador multiparamétrico portátil Hanna modelo Combo. Adicionalmente se recolectaron 700 mL de agua en recipientes plásticos los cuales fueron transportados al laboratorio en un recipientes con refrigeración (5±1ºC), para la determinación de alcalinidad total, dureza total, dureza cálcica y cloruros, utilizando metodología recomendada por American Public Health Association (APHA, 1992).
Procesamiento de muestras: Los organismos fueron separados bajo lupa y luego colocados en frascos con etanol al 70 %. La identificación se realizó siguiendo las claves de Domínguez y Fernández, (2009), Prat et al., (2011) y Merritt et al., (2008), llegando a los niveles taxonómicos más bajos posibles. Los especímenes recolectados fueron depositados en la colección del Departamento de Hidrobiología del Museo de Historia Natural de la Universidad Nacional de San Cristóbal de Huamanga.
Análisis de datos: Se empleó el análisis de coordenadas principales (ACoP, índice de Bray-Curtis) basado en la composición y abundancia de macroinvertebrados. De manera complementaria se realizó un análisis no paramétrico de varianza (NP-MANOVA, 9999 repeticiones; α = 0.05) con la finalidad de poner a prueba la hipótesis de la existencia de diferencia entre las estaciones de muestreo. Para comparar las abundancias absolutas de los principales taxa hallados en los arroyos de los bofedales se empleó la prueba no paramétrica de Kruskal - Wallis (α = 0.05), dado que los datos no mostraron una distribución normal. Así mismo, para comparar las características fisicoquímicas del agua de las estaciones de muestreo, se aplicó la prueba NP-MANOVA, (9999 repeticiones), complementada con un análisis de componentes principales (ACP) utilizando los componentes de mayor explicación de la variancia. Todas las pruebas fueron realizadas con el programa InfoStat, versión 2018p y PAST 2.17c.
Resultados
Tabla 2 Table 2 Promedios, valores máximos y mínimos de las características fisicoquímicas del agua de los arroyos de dos bofedales por estación de muestreo Averages, maximum and minimum values of the physicochemical characteristics of streams water in two high Andean wetlands for each sampling station
| Arroyos | Estaciones de muestreo | Alcalinidad total (mg/L CaCO3) | Dureza total (mg/L CaCO3) | Dureza cálcica (mg/L Ca) | Dureza magnésica (mg/L Mg) | Cloruros (mg Cl/L) | pH | Conductividad (µS/cm) | Sólidos Disueltos Totales (mg/L) | Temperatura (ºC) |
|---|---|---|---|---|---|---|---|---|---|---|
| Bofedal G | G1 | 39 (66-26) | 66.5 (86-26) | 51 (64-24) | 15.5 (28-10) | 6 (8-4) | 7.3 (7.6-6.9) | 177.8 (319.8-44) | 92.3 (170.4-22) | 8.4 (9.8-7.1) |
| G2 | 46 (76-26) | 78 (106-44) | 59.5 (88-24) | 18.5 (24-12) | 5.6 (7.5-3.5) | 7.3 (7.5-6.9) | 169.1 (284.8-47) | 87.3 (149.3-24) | 9.1 (12.3-6.4) | |
| G3 | 41.5 (52-28) | 86 (128-38) | 67.5 (106-20) | 18.5 (22-16) | 5.4 (7.5-3.5) | 7.4 (7.5-7.3) | 195.6 (321.2-48) | 100.5 (165.6-24) | 9.3 (14.1-5.6) | |
| G4 | 38.5 (48-24) | 89 (122-34) | 71.5 (96-24) | 17.5 (26-10) | 7.4 (9-5.5) | 7.6 (7.6-7.4) | 208.3 (313.6-50) | 106.8 (161.9-25) | 10.8 (14.2-9.4) | |
| G5 | 45 (60-26) | 82.5 (110-36) | 60.5 (88-20) | 22 (34-16) | 4.9 (7.5-2.5) | 7.4 (7.6-7.3) | 168.9 (250.5-57) | 86.8 (128.5-28) | 10.4 (11.7-9.4) | |
| G6 | 0.0 (0-0) | 315 (428-48) | 223 (332-40) | 92 (194-8) | 1 168.8 (3 375-117.5) | 3.2 (3.5-2.6) | 1 117 (1 261-910) | 567.4 (647.9-454) | 12 (13.5-10.4) | |
| G7 | 46.5 (58-34) | 81.5 (120-40) | 65 (110-28) | 16.5 (32-10) | 7.1 (10-5) | 7.2 (7.6-6.4) | 191.8 (289.4-55) | 98 (148.7-27) | 10.7 (14.2-8.8) | |
| Bofedal P | P1 | 25 (30-20) | 101 (104-98) | 71 (74-68) | 30 (36-24) | 520.8 (1 025-16.5) | 6.5 (6.5-6.5) | 432.5 (639-226) | 215.5 (318-113) | 12 (12.4-11.5) |
| P2 | 25 (30-20) | 121 (159-86) | 72 (72-72) | 49 (84-14) | 212.5 (375-50) | 6.5 (6.5-6.4) | 465.5 (645-286) | 233 (323-143) | 11.2 (11.7-10.6) | |
| P3 | 20 (20-20) | 126 (154-98) | 73 (76-70) | 53 (78-28) | 167.8 (300-35.5) | 6.4 (6.5-6.3) | 460.5 (647-274) | 230.5 (324-137) | 11 (11.4-10.6) | |
| P4 | 19 (20-18) | 125 (150-100) | 83 (88-78) | 42 (62-22) | 139.8 (240-40) | 6.6 (6.6-6.6) | 512 (719-305) | 253.5 (354-153) | 11.3 (11.9-10.7) |
Características fisicoquímicas: Se observó una alta variabilidad entre las estaciones de muestreo ubicados en los arroyos (Tabla 2). Con pH mínimo de 3.2 (± 0.4) y máximo de 7.6 (± 0.1), siendo en G los que presentaron valores ligeramente más alcalinos, con promedio mínimo de 7.2 (± 0.5) y máximo de 7.6 (± 0.1), con excepción de G6 que presentó 3.2 (± 0.4). En P, el agua fue ligeramente ácida, con un pH de 6.4 (± 0.1) a 6.6 (± 0). La conductividad fluctuó de 168.9 (± 91) µS/cm a 1 117 (± 159.3) µS/cm, éste último hallado en G6. Los cloruros variaron entre 6 (± 2) mg/L (G1) y 1 168 (± 1.534) mg/L, con rangos muy amplios en el bofedal G. Los sólidos disueltos totales tuvieron valores desde 86.2 (± 47.5) mg/L a 567.4 (± 89.6) mg/L. La temperatura entre las 8 a 10 horas registró un mínimo de 8.4 ºC (G1) a un máximo de 12 ºC (G6). Las características de los arroyos en los dos bofedales no mostraron diferencia de manera global (F=0.4386; p=0.63), corroborado con la prueba de permutación no paramétrica (NP-MANOVA, 9999 repeticiones). Sin embargo, al ser comparados cada estación por separado, G6 (Guitarrachayocc) mostró diferencia significativa (F=4.055; p<0.001).
El ACP explicó a través de sus dos primeros componentes el 95.6 % de variabilidad y mostró a G6 (Fig. 2) alejado del resto de las estaciones de muestreo, reafirmando la diferencia hallada entre las estaciones de muestreo. Además, se observó a las variables ambientales del agua como dureza magnésica (DMg), conductividad (CE), sólidos disueltos totales (STD), cloruros (Cl), dureza total (DT) y dureza cálcica (DCa) orientadas en la dirección de G6, debido a que en ella fueron registrados los máximos valores.
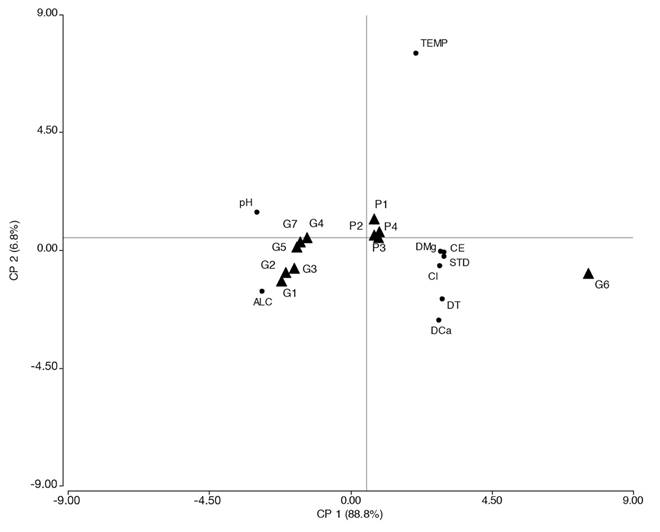
Fig. 2 Fig. 2 Análisis de componentes principales (ACP) de las estaciones de muestreo según las características fisicoquímicas del agua. P1, P2, P3, P4 (estaciones de muestreo en el arroyo de P); G1, G2, G3, G4, G5, G6, G7 (estaciones de muestreo en los arroyos de G). TEMP= Temperatura, ALC= Alcalinidad, DCa= Dureza cálcica, DMg= Dureza magnésica, DT= Dureza total, CE= Conductividad. Principal component analysis (PCA) of the sampling stations according to the physicochemical characteristics of the water. P1, P2, P3, P4 (sampling stations in stream of P); G1, G2, G3, G4, G5, G6, G7 (sampling stations in streams of G). TEMP= Temperature, ALC= Alkalinity, DCa= Calcium hardness, DMg= Magnetic hardness, DT= Total hardness, CE= Conductivity.
Diversidad y abundancia de los macroinvertebrados acuáticos: En los arroyos de los dos bofedales, se identificaron 26 taxa pertenecientes a 22 géneros, 20 familias, 11 órdenes y cinco clases. Los órdenes encontrados fueron Plecoptera (Claudioperla sp.), Ephemeroptera (Andesiops sp., Meridialaris sp.), Heteroptera (Ectemnostega spp.), Trichoptera (Cailloma sp., Ochrotrichia sp., Antartoecia sp.), Coleoptera (Macrelmis sp., Lancetes sp.), Diptera (Alotanypus sp., Cricotopus sp., Dicrotendipes sp., Lymnophyes sp., Oliveriella sp., Pentaneura sp., Rheotanytarsus sp., Chelifera sp., Limnophora sp., Tabanus sp., Molophilus sp., Pedrowygomyia sp.), Lumbriculidae, Planorbidae (Basommatophora), Amphipoda (Hyalella sp.), Haplotaxida (Tubificidae) y Tricladida (Planariidae). Los insectos fueron el grupo más diverso, representado por el 80.7 % del total de los taxa y dentro de estos, la familia Chironomidae (Diptera) con el 26.9 %. Los arroyos del bofedal G presentaron 13 taxa exclusivos y P solo uno. Por estaciones de muestreo, en G, se registró un máximo de 11 (G4, G5) y un mínimo de 4 (G6); mientras para P, 8 (P2, P3 y P4) y 7 (P1) (Tabla 3). La densidad de macroinvertebrados para los dos bofedales fue de 376 ind. m-2, donde las familias con mayor abundancia relativa fueron Elmidae (Coleoptera), Chironomidae (Diptera), Gripopterygidae (Plecoptera), Baetidae (Ephemeroptera) que en conjunto representan un poco más del 78 %. En G, se recolectaron 475 ind. m-2 siendo los taxa Macrelmis sp., Dicrotendipes sp., Claudioperla sp., Meridialaris sp., Andesiops sp. más abundantes, representan en conjunto el 84.9 % del total. Para P, la densidad fue de 31 ind. m-2, con Pedrowygomya sp., Hyalella sp., Dicrotendipes sp., Tubificidae, Limnophora sp., que evidencia el 84.1 % (Tabla 3). En los arroyos de G, la densidad de individuos fue mayor a P (p<0.05). Por otro lado, a nivel de estaciones de muestreo, G6 es diferente al resto (p<0.05), debido a que presentó el menor número de taxa.
TABLA 3 TABLE 3 Abundancia relativa y densidad de taxa de macroinvertebrados en arroyos por bofedal y estaciones de muestreo Relative abundance and density of macroinvertebrate taxa by high Andean wetlands and sampling stations
| Taxa | Estaciones de muestreo en arroyos | Total capt. (nº) | Total capt. (%) | Densidad en G (ind. m-2) | Densidad en P (ind. m-2) | Densidad total (ind. m-2) | ||||||||||
| Bofedal G | Bofedal P | |||||||||||||||
| G1 | G2 | G3 | G4 | G5 | G6 | G7 | P1 | P2 | P3 | P4 | ||||||
| Macrelmis sp. (C) | 19.2 | 31.6 | 17.9 | 24.3 | 41.7 | 0.0 | 35.3 | 1.4 | 6.3 | 4.0 | 4.2 | 2 632 | 32.39 | 156.25 | 1.46 | 121.85 |
| Dicrotendipes sp. (D) | 18.6 | 17.8 | 31.5 | 18.0 | 11.5 | 77.3 | 16.9 | 25.1 | 33.3 | 33.3 | 9.3 | 1 658 | 20.40 | 97.26 | 5.00 | 76.76 |
| Claudioperla sp. (P) | 24.0 | 15.1 | 6.3 | 14.1 | 12.8 | 0.0 | 8.3 | 0.0 | 2.1 | 0.0 | 8.3 | 1 110 | 13.66 | 65.89 | 0.63 | 51.39 |
| Meridialaris sp. (E) | 10.5 | 5.0 | 12.0 | 14.2 | 9.6 | 0.0 | 11.1 | 0.0 | 0.0 | 0.0 | 0.0 | 946 | 11.64 | 56.31 | - | 43.80 |
| Andesiops sp. (E) | 12.7 | 17.0 | 11.6 | 7.8 | 7.4 | 0.0 | 12.9 | 0.0 | 0.0 | 0.0 | 0.0 | 553 | 6.81 | 32.92 | - | 25.60 |
| Pedrowygomyia sp. (D) | 0.3 | 0.4 | 4.6 | 4.7 | 8.8 | 0.0 | 7.5 | 14.3 | 10.4 | 40.7 | 25.0 | 269 | 3.31 | 13.99 | 7.08 | 12.45 |
| Rheotanytarsus sp. (D) | 3.8 | 5.8 | 4.2 | 4.9 | 2.7 | 0.0 | 0.7 | 0.0 | 0.0 | 0.0 | 0.0 | 211 | 2.60 | 12.56 | - | 9.77 |
| Limnophora sp. (D) | 2.7 | 1.1 | 2.1 | 3.5 | 1.0 | 1.8 | 2.1 | 16.8 | 2.1 | 12.0 | 8.3 | 178 | 2.19 | 9.70 | 3.13 | 8.24 |
| Pentaneura sp. (D) | 3.2 | 0.3 | 2.3 | 1.6 | 1.3 | 0.0 | 1.8 | 5.6 | 0.0 | 0.0 | 0.0 | 112 | 1.38 | 6.61 | 0.21 | 5.19 |
| Oliveriella sp. (D) | 0.7 | 3.7 | 0.8 | 2.9 | 1.3 | 0.0 | 0.5 | 0.0 | 0.0 | 0.0 | 0.0 | 103 | 1.27 | 6.13 | - | 4.77 |
| Antartoecia sp. (Tch) | 1.7 | 1.4 | 0.0 | 0.6 | 0.4 | 0.0 | 1.2 | 5.7 | 4.2 | 0.0 | 0.0 | 62 | 0.76 | 3.33 | 1.25 | 2.87 |
| Chelifera sp. (D) | 1.2 | 0.5 | 0.1 | 0.3 | 0.1 | 0.0 | 0.7 | 0.0 | 0.0 | 2.0 | 0.0 | 60 | 0.74 | 3.51 | 0.21 | 2.78 |
| Lumbriculidae (L) | 0.0 | 0.0 | 0.0 | 2.0 | 1.1 | 0.0 | 0.0 | 0.0 | 0.0 | 2.0 | 0.0 | 46 | 0.57 | 2.68 | 0.21 | 2.13 |
| Hyalella sp. (A) | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.2 | 0.0 | 0.0 | 4.0 | 41.0 | 35 | 0.43 | 0.06 | 7.08 | 1.62 |
| Cricotopus sp. (D) | 0.0 | 0.0 | 5.4 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 32 | 0.39 | 1.90 | - | 1.48 |
| Cailloma sp. (T) | 0.5 | 0.1 | 0.1 | 0.6 | 0.0 | 0.0 | 0.3 | 0.0 | 0.0 | 0.0 | 0.0 | 31 | 0.38 | 1.85 | - | 1.44 |
| Tabanus sp. (D) | 0.0 | 0.3 | 0.4 | 0.2 | 0.0 | 0.0 | 0.4 | 0.0 | 0.0 | 0.0 | 0.0 | 21 | 0.26 | 1.25 | - | 0.97 |
| Tubificidae (Ha) | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 31.1 | 37.5 | 2.0 | 0.0 | 20 | 0.25 | - | 4.17 | 0.93 |
| Ectemnostega spp. (He) | 0.3 | 0.0 | 0.0 | 0.0 | 0.0 | 19.0 | 0.0 | 0.0 | 4.2 | 0.0 | 2.6 | 19 | 0.23 | 0.89 | 0.83 | 0.88 |
| Lymnophyes sp. (D) | 0.2 | 0.0 | 0.2 | 0.1 | 0.0 | 0.0 | 0.1 | 0.0 | 0.0 | 0.0 | 0.0 | 9 | 0.11 | 0.54 | - | 0.42 |
| Ochrotrichia sp. (Tch) | 0.2 | 0.0 | 0.0 | 0.0 | 0.1 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 6 | 0.07 | 0.36 | - | 0.28 |
| Alotanypus sp. (D) | 0.0 | 0.1 | 0.2 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 1.3 | 5 | 0.06 | 0.24 | 0.21 | 0.23 |
| Lancetes sp. (C) | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 2.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 5 | 0.06 | 0.30 | - | 0.23 |
| Molophilus sp. (D) | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 1 | 0.01 | 0.06 | - | 0.05 |
| Planariidae (Tcl) | 0.0 | 0.0 | 0.1 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 1 | 0.01 | 0.06 | - | 0.05 |
| Planorbidae (B) | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0.1 | 0.0 | 0.0 | 0.0 | 0.0 | 1 | 0.01 | 0.06 | - | 0.05 |
| Total taxa (nº) | 10 | 9 | 10 | 11 | 11 | 4 | 9 | 7 | 8 | 8 | 8 | 26 | 100.0 | 25 | 13 | 26 |
| 25 | 13 | |||||||||||||||
A= Amphipoda, B= Basommatophora, C= Coleoptera, D= Diptera, E= Ephemeroptera, Ha= Haplotaxida, He= Hemiptera, L= Lumbriculida, P= Plecoptera, Tcl= Tricladida, Tch= Trichoptera.
El ACoP dio como resultado dos componentes que explican el 70.7 % de la varianza (Fig. 3); este agrupa a las estaciones de muestreo en dos regiones claramente diferenciadas; por un lado los ubicados en el bofedal P (P1, P2, P3 y P4) a los cuales se agrega G6 (bofedal G) y por el otro, las estaciones correspondientes al bofedal G (G1, G2, G3, G4, G5 y G7), lo que indicaría la existencia de diferencia entre los ensambles hallados en los dos bofedales, además de que G6 es diferente dentro del bofedal G. El análisis NP-MANOVA confirmó lo hallado en la prueba de coordenadas principales al comparar las estaciones de muestreo (F=7.927; p=0.0001).
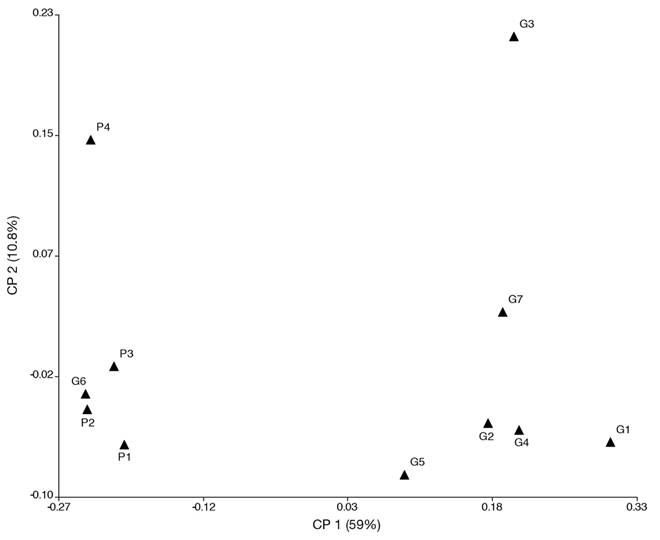
Fig. 3 Fig. 3 Análisis de coordenadas principales (ACoP, índice Bray-Curtis) para las estaciones de muestreo según la composición (familias y géneros) de macroinvertebrados. P1, P2, P3, P4 (estaciones de muestreo en el arroyo de P); G1, G2, G3, G4, G5, G6, G7 (estaciones de muestreo en los arroyos de G). Principal coordinate analysis (PCoA, Bray-Curtis index) for sampling stations according to the composition (families and genders) of macroinvertebrates. P1, P2, P3, P4 (sampling stations in stream of P); G1, G2, G3, G4, G5, G6, G7 (sampling stations in streams of G).
Discusión
En el presente estudio hallamos que los macroinvertebrados en arroyos asociados a dos bofedales están representados por 26 taxa, cuya riqueza, exclusividad y densidad son mayores en los arroyos de G, con dominancia ejercida por diferentes taxa. La calidad de agua no difiere en forma general entre los arroyos de los dos bofedales; sin embargo, a nivel de estaciones de muestreo, G6 tiene características únicas (pH extremadamente bajo, conductividad y cloruros muy elevados) como producto de la influencia de un manantial. La variación de la calidad del agua es determinante en los cambios observados en el ensamblaje de los macroinvertebrados.
La cercanía geográfica de los dos bofedales estudiados supuso similitud a nivel de las variables ambientales del agua y el ensamblaje de los macroinvertebrados, cumpliéndose solo la primera. A nivel de estaciones de muestreo, se esperó mayor similitud entre ellas en un mismo arroyo, cumpliéndose solo en P.
Se observó que el suelo de los bofedales estudiados (principalmente G) donde emergen los manantiales, son de color pardo a naranja con incrustaciones de cristal y cubierta vegetal reducida, características a ser consideradas como indicadores de cambios radicales que puedan suceder a nivel de la calidad de agua y ensamblaje de los macroinvertebrados en ambientes acuáticos aledaños.
Las condiciones ambientales encontradas en los arroyos asociados a los bofedales fueron altamente variables. Esto concuerda con lo esperado para los bofedales per se (Madriñán et al., 2013), donde la amplitud térmica ambiental puede ser de 20 ºC (Wasson et al., 1989), la concentración de oxígeno en el agua baja -como consecuencia de la menor presión parcial atmosférica-, y el aporte pluvial estival característico de zonas semidesérticas (Cooper et al., 2010; Salvador et al., 2015). Observamos que los arroyos que drenan de los bofedales G y P se mantuvieron dentro de la variación natural, es el caso de la temperatura del agua, que registró hasta 9 ºC de diferencia en pocas horas, algo que no es llamativo ya que en arroyos de ambientes similares como del altiplano de Bolivia, registran variaciones de hasta 20 °C a lo largo del día (Wasson et al., 1989). A diferencia, los páramos son menos adversos al estar ubicados de 3 200 a 4 200 msnm (Maldonado, 2014; Betrán et al., 2009).
En forma general, las características fisicoquímicas del agua de los arroyos en los dos bofedales son semejantes, pese a que es ligeramente ácida en P y alcalina en G, así mismo en ésta última, el pH, conductividad y cloruros, fluctúan con mayor amplitud. La estación G6 muestra valores que son responsables de la gran amplitud descrita, presenta los mínimos valores de pH y los máximos de conductividad y cloruros, como consecuencia de la incorporación del agua proveniente de un manantial que tiene origen en un área aledaña al bofedal cuya calidad (pH, conductividad y posiblemente nutrientes) está determinada por las características de la roca madre del lugar de donde se origina (Cooper et al., 2010). El manantial ubicado en G, abarca una pequeña área, su contribución es mayor en la zona más baja del bofedal y probablemente mayor en la época seca (Cooper et al., 2010; Salvador et al., 2015). Es llamativo que la calidad de agua en G7, pese a distar en aproximadamente 200 m de G6, es diferente, pero similar a G1 - G5, posiblemente por el efecto diluyente que ejerce el agua del bofedal (subsuelo y superficial) al drenar al arroyo (Valois et al., 2020), factores asociados al suelo, interacciones químicas de los solutos del agua e incluso a la vegetación acuática y microorganismos con capacidad de inmovilizar elementos (Palomino, 2007); queda pendiente identificar con más detalle la causa.
Los bajos valores de pH encontrados, podrían deberse a la influencia de la materia orgánica y turba de los bofedales que caracteriza a la vegetación hidromórfica y mésica con dominancia de Distichia muscoides y Plantago rígida, con valores mínimos de 4.5 y 5.3 (Salvador et al., 2015), además de la humedad permanente debido al manto freático próximo al nivel del suelo que registra pH de 4 a 5 (Benavides, 2014). Sin embargo, los valores registrados en la estación G6 fueron menores, siendo consecuente la presencia de otros factores determinantes. Se reporta aguas muy ácidas (pH de 3.44 e incluso de 3.3) para el arroyo Lunar de Oro en la cabecera del río Ramis ubicado en la Región Puno en Perú, afectado por minería aurífera y que desemboca en el lago Titicaca (Gammons et al., 2006; Loza & Ccancapa, 2020). La extrema acidez de sus aguas se debe a la oxidación de minerales sulfurados como pirrotita (FeS), pirita (FeS2) y arsenopirita (FeAsS), expuestos por la actividad minera. Probablemente lo descrito ocurre de manera natural en las aguas del manantial no afectado por actividad minera. De igual manera, la conductividad es elevada, debido a las mismas consideraciones señaladas para el pH, además del tipo de suelo por donde circulan los arroyos, que son nitisoles húmicos, ferralsoles y andosoles (Reading et al., 1995).
Dadas las características sobresalientes de este ambiente y la presencia del manantial, la influencia de las características del agua sobre la estructura de los macroinvertebrados fue previsible, donde el bajo valor de pH, alta conductividad y probablemente presencia de metales pesados, podrían estar influenciando las características del ensamblaje estudiado (Hamel & Van Damme, 1999) principalmente en la estación de muestreo G6. Sin embargo, la riqueza de los ensambles de macroinvertebrados registrada en los arroyos estudiados, fue similar a lo encontrado en vegas en la ecorregión de Puna y Altoandina en Argentina (Nieto et al., 2016), pero con mayor número de familias. En forma general, la riqueza es baja en los bofedales y vegas, tomando como referencia otros arroyos ubicados en los páramos y Valle Central de Ecuador, ubicados de 2 600 a 4 000 msnm en los que se reportan 34 taxa (Jacobsen & Encalada, 1998); pero similar a los arroyos del Altiplano (La Paz - Titicaca) en Bolivia y superior a lo hallado en la Cordillera Oriental, Prepuna y Puna de Cochabamba Bolivia que presentan 19 y 15 taxa respectivamente (Jacobsen & Marín, 2007; Maldonado & Goitia, 2003).
Los componentes de los macroinvertebrados recolectados en los arroyos de los bofedales, son similares a los que presentan ríos altoandinos de América del Sur, siendo común los géneros Claudioperla sp. (Gripopterigidae, Plecoptera), Andesiops sp. (Baetidae, Ephemeroptera), Meridialaris sp. (Leptophlebidae, Ephemeroptera), Macrelmis sp. (Elmidae, Coleoptera), Pedrowygomyia sp. (Simuliidae, Diptera), varios géneros de la familia Chironomidae (Diptera) e Hyalella (Hyalellidae) para Colombia (Muñoz, 2004), Ecuador (Jacobsen, 2008; Maldonado et al., 2011), Bolivia (Jacobsen & Marín, 2007) y Perú (Nieto et al., 2016). Chironomidae es la familia con el mayor número de taxa principalmente en los arroyos del bofedal G. Sin embargo, es menor a los 46 taxa registrados para ríos altoandinos de 18 cuencas de Colombia, Ecuador y Perú (Prat et al., 2014), probablemente debido a la mayor amplitud del área de estudio.
La densidad estimada para los macroinvertebrados en los arroyos evaluados, fue menor que en los páramos ecuatorianos con 6 000 individuos por m2 (Jacobsen, 2008). También, se registró que la mayor abundancia relativa de macroinvertebrados lo representan Macrelmis sp., Dicrotendipes sp., Claudioperla sp., Meridialaris sp., Andesiops spp., que difiere de 15 arroyos del páramo ecuatoriano, donde Orthocladiinae (35.5 %), Baetidae (11.6 %), Hydroptilidae (8.7 %), Elmidae (7.7 %), Planariidae (6.8 %) son los más abundantes (Jacobsen, 2008). Por otro lado, la clase Insecta es la más abundante, con aproximadamente el 99 % del total de organismos recolectados, semejante para arroyos altoandinos de Cochabamba en Bolivia, donde los insectos son ampliamente dominantes por su diversidad y abundancia (Maldonado & Goitia, 2003), superiores a los arroyos de Ecuador en los que representa el 82 % (Jacobsen, 2008). Es importante mencionar que Ectemnostega spp. (Corixidae) e Hyalella spp. (Amphipoda), son componentes comunes y abundantes en los ecosistemas acuáticos altoandinos como del altiplano boliviano (Jacobsen & Marín, 2007), en cambio su presencia es mínima en los arroyos estudiados, debido a sus requerimientos ambientales, no compatibles con las corrientes de agua.
La cantidad inferior de taxa en los bofedales y vegas, comparado con arroyos ubicados a menor altitud, es aparentemente congruente con la afirmación de que la diversidad biológica (a nivel de especies) está inversamente relacionado con la latitud y altitud (Urdanigo et al., 2019). Sin embargo, para los macroinvertebrados la relación es inexistente, tal como ocurre en ríos de Venezuela (Cressa, 2000); o de poca magnitud, como sucede en 45 arroyos de Ecuador ubicados en el rango de 780 a 3 940 msnm (Monaghan et al., 2000). Abunda información que afirma que la diversidad en los arroyos ubicados a menor altitud es mayor, es el caso de dos quebradas en el departamento de Antioquía, Colombia ubicados entre 898 a 2 140 msnm que reportan 147 géneros en 58 familias (Galeano-Rendón & Mancera-Rodríguez, 2018), para cuatro cuencas en los Andes del Norte de Ecuador y en ríos de los Andes Centrales del Perú y del Altiplano que registraron 74 géneros en 34 familias (Villamarín, 2008; Meza et al., 2012; Rodríguez et al., 2017; Ramírez et al., 2018). Una posible explicación para este patrón es la presencia de mejores condiciones ambientales en ríos ubicados a menor altitud que contribuye a una mayor diversidad de organismos.
Llama la atención las diferencias entre los arroyos de los dos bofedales estudiados, considerando su proximidad y similar altitud. La mayor diversidad se registró en los arroyos de G, comparten solo 12 de los 26 taxa registrados; en P no se halla ninguno del orden Ephemeroptera, solo uno de Trichoptera, seis de Diptera y Tubificidae es exclusivo. La densidad promedio de macroinvertebrados fue mayor en G, con taxa dominantes (mayor densidad relativa) que difieren de P. Las diferencias señaladas para los dos bofedales y para las estaciones de muestreo (G6), se debe a las condiciones locales de los arroyos, la calidad de agua, la velocidad de la corriente, características del lecho como los principales factores, que promueve la diversidad y densidad en G, limitando en P.
Dentro de las estaciones de muestreo, G6 es diferente al resto, ya que presenta menor número de taxa y densidad, por influencia de las aguas del manantial que se une al arroyo entre las estaciones G5 y G6, variando sus características fisicoquímicas y consecuentemente de los macroinvertebrados.
Las diferencias de las características fisicoquímicas de los arroyos, más aún en el ensamblaje de macroinvertebrados, no solo ocurren entre bofedales cercanos, también dentro de los mismos, es el caso de G6, influenciado por un manantial. Por lo señalado, un bofedal es un ecosistema heterogéneo (principalmente aquellos con presencia de manantiales), en cuanto a sus características abióticas y consecuentemente de los macroinvertebrados.
Declaración de ética: los autores declaran que están de acuerdo con esta publicación y que han hecho aportes para justificar su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

