Introducción
Los sifonóforos son cnidarios coloniales, polimórficos con un alto grado de especialización funcional (Harvell, 1994; Pugh, 1999; Siebert et al., 2015); son pelágicos y depredadores, de importancia relevante en los estudios de las cadenas tróficas marinas por su abundancia y porque se alimentan principalmente de copépodos, ostrácodos, anfípodos y moluscos, así como huevos y larvas de otros crustáceos y peces, entre otros (Bigelow, 1911, Bigelow,1926; Alvariño, 1967a; Alvariño, 1981; Purcell, 1981; Mackie, Pugh, & Purcell, 1987; Purcell, 1997; Båmstedt, Fosså, Martinussen, & Fosshagen, 1998; Pugh, 1999; Hosia & Båmstedt, 2008; Mapstone, 2009, Mapstone,2014). Tienen una amplia distribución mundial, pero la mayoría de las especies habitan en el cinturón trópico-ecuatorial oceánico (Bigelow, 1911; Alvariño 1971, Alvariño 1981; Pugh, 1975; Purcell, 1997). Además, estos organismos se pueden reproducir rápidamente (Licandro, Souissi, Ibañez, & Carré, 2012).
Dentro de los estudios más relevantes sobre los sifonóforos destacan los de Bigelow (1911), quien hace una excelente monografía del grupo con muestras tomadas por el “Albatross” en una amplía región del Pacífico Tropical Oriental, incluyendo algunas localidades oceánicas cercanas a la Isla Coco y principalmente estaciones costeras de los países de Centro América, donde se ubica el área de surgencia de Costa Rica. Alvariño (1971) hace una cuidadosa revisión de los trabajos de sifonóforos en el Pacífico proporcionando excelente información de las especies que han sido registradas en las aguas del Pacífico centroamericano, entre ellos sus artículos de 1969a y 1974. Gasca & Suárez-Morales (1992) describen los sifonóforos recolectados durante la campaña oceanográfica DOMO III en noviembre de 1981 y Vicencio-Aguilar & Fernández-Álamo (1996) enlistan 45 especies determinadas de las muestras recolectadas de los cruceros DOMO I, II, III y IV. Rodríguez-Saénz & Gasca (2009) proporcionan una lista de especies de estos cnidarios en las aguas de Costa Rica, tanto del Mar Caribe como del Pacífico.
El propósito de este trabajo es contribuir al conocimiento de la composición específica, la densidad, la distribución y la caracterización ecológica de los sifonóforos que habitan las aguas de Domo de Costa Rica, durante los meses de febrero y marzo de 1979, correspondiente a la campaña oceanográfico Domo I.
Materiales y métodos
El Domo de Costa Rica, situado en el Pacífico Tropical Oriental, es una región de intenso afloramiento de aguas profundas hacia la superficie, donde existen las condiciones físico-químicas para la fotosíntesis y con la elevada concentración de nutrientes que llevan permiten un gran desarrollo de la productividad primaria. Con ello se incrementa toda la compleja red alimentaria, trayendo para la región una intensa riqueza en la biodiversidad y una importancia económica sobresaliente en la producción pesquera (Fiedler, 2002; Fiedler & Talley, 2006; Ballestero, 1999; Wehrtmann &Córtes, 2009; Wehrtmann, Córtes, & Echeverría-Saénz, 2009; Jiménez, 2016).
El material zooplanctónico fue recolectado durante el crucero oceanográfico Domo I a bordo del B/O “Mariano Matamoros”, que se realizó durante febrero y marzo de 1979; se hicieron 37 arrastres de zooplancton. Los muestreos se realizaron utilizando una red estándar tipo CalCoFi con una malla de 0.3 mm mediante arrastres oblicuos en la zona epipelágica (0-200 m). Se colocó un contador de flujo TSK-946 en la boca de la red, previamente calibrado, con el fin de poder determinar el volumen de agua filtrada; los muestreos se incrementaron al detectar la zona de afloramiento del Domo de Costa Rica, de tal manera, que la mayor parte de las estaciones provienen del área comprendida entre los paralelos 7° a 12° de latitud Norte y 86° a 92° de longitud Oeste (Tabla 1).
Tabla 1 Localización de las estaciones de muestreo en el Domo de Costa Rica durante la campaña oceanográfica DOMO I-1979
| Estación | Fecha | Hora local | Latitud N | Longitud W |
| 1 | 05/II/1979 | 14:10 | 15°20’ | 95°04’ |
| 3 | 06/II/1979 | 04:08 | 14°20’ | 94°59’ |
| 4 | 06/II/1979 | 12:15 | 13°41’ | 94°56’ |
| 6 | 07/II/1979 | 00:00 | 12°42’ | 95°02’ |
| 7 | 07/II/1979 | 06:00 | 12°33’ | 95°07’ |
| 15 | 09/II/1979 | 06:05 | 7°23’ | 94°58’ |
| 18 | 10/II/1979 | 00:00 | 5°15’ | 94°57’ |
| 19 | 10/II/1979 | 06:15 | 4°46’ | 95°00’ |
| 21 | 10/II/1979 | 18:05 | 3°32’ | 95°00’ |
| 22 | 10/II/1979 | 23:50 | 2°55’ | 94°59’ |
| 23 | 11/II/1979 | 06:05 | 2°59’ | 94°32’ |
| 25 | 11/II/1979 | 18:05 | 3°00’ | 93°46’ |
| 26 | 12/II/1979 | 00:03 | 3°02’ | 93°14’ |
| 28 | 12/II/1979 | 00:00 | 2°59’ | 92°10’ |
| 30 | 13/II/1979 | 00:15 | 3°30’ | 91°27’ |
| 31 | 13/II/1979 | 06:00 | 3°28’ | 90°51’ |
| 33 | 13/II/1979 | 18:10 | 3°34’ | 89°35’ |
| 37 | 14/II/1979 | 18:10 | 3°29’ | 87°13’ |
| 42 | 15/II/1979 | 21:10 | 5°13’ | 85°57’ |
| 43 | 16/II/1979 | 03:15 | 5°54’ | 85°55’ |
| 44 | 16/II/1979 | 09:10 | 6°33’ | 86°02’ |
| 47 | 17/II/1979 | 03:15 | 7°42’ | 85°59’ |
| 48 | 17/II/1979 | 08:52 | 8°12’ | 85°58’ |
| 50 | 17/II/1979 | 23:55 | 8°56’ | 86°21’ |
| 58 | 19/II/1979 | 21:05 | 9°02’ | 91°12’ |
| 74 | 23/II/1979 | 21:05 | 7°48’ | 88°59’ |
| 76 | 24/II/1979 | 09:00 | 9°09’ | 89°01’ |
| 85 | 25/II/1979 | 21:05 | 10°26’ | 88°01’ |
| 91 | 26/II/1979 | 21:10 | 8°02’ | 87°42’ |
| 95 | 27/II/1979 | 14:12 | 9°19’ | 86°56’ |
| 97 | 27/II/1979 | 21:05 | 10°17’ | 86°56’ |
| 104 | 28/II/1979 | 21:05 | 9°59’ | 87°24’ |
| 110 | 1/III/1979 | 21:00 | 10°32’ | 89°57’ |
| 112 | 2/III/1979 | 06:05 | 11°31’ | 89°58’ |
| 117 | 3/III/1979 | 02:05 | 10°20’ | 91°02’ |
Los parámetros físico-químicos como salinidad, oxígeno disuelto, temperatura y fluorescencia, fueron procesados en el Laboratorio de Oceanografía Física del Instituto de Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México.
Los sifonóforos fueron separados de las muestras completas, con la ayuda de un microscopio de disección y pinzas de relojero; posteriormente fueron identificados empleando los trabajos de Sears (1953), Totton & Barmann (1965), Alvariño (1981), Pugh (1999) y Mapstone (2014). El número total de organismos de las especies del suborden Calycophorae se determinó, tanto en la fase poligástrica (tomando en cuenta la cantidad más grande entre los nectóforos superiores e inferiores), como en la fase eudoxia (tomando en cuenta la cantidad más grande entre las brácteas y los gonóforos). Mientras que para los organismos del suborden Physonectae se consideraron sólo los pneumatóforos para su cuantificación (Ramírez-Arriaga, 1988).
Se calculó la densidad relativa de las especies y se expresó en número de org/ 1000m3 de agua filtrada (Fig. 1). La distribución de las especies de sifonóforos se presenta en la Fig. 2, en donde la densidad se proporciona en los siguientes intervalos de abundancia: escasa (1-10), intermedia (11-100), abundante (101-200) y muy abundante (>201).
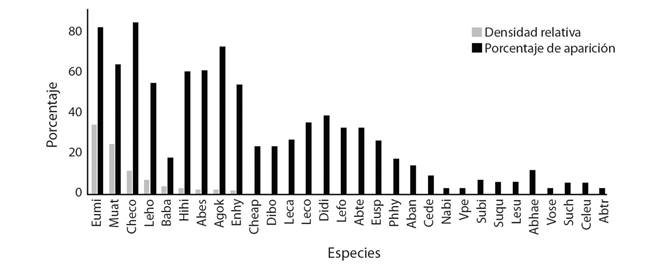
Fig. 1 Fig. 1. Comparación entre la densidad relativa y el porcentaje de aparición de las especies durante la campaña oceanográfica DOMO I al Domo de Costa Rica durante febrero-marzo de 1979. Comparison between relative density and the percentage of appearance of the species during the oceanographic campaign DOMO I, Costa Rica Thermal Dome, February-March 1979.
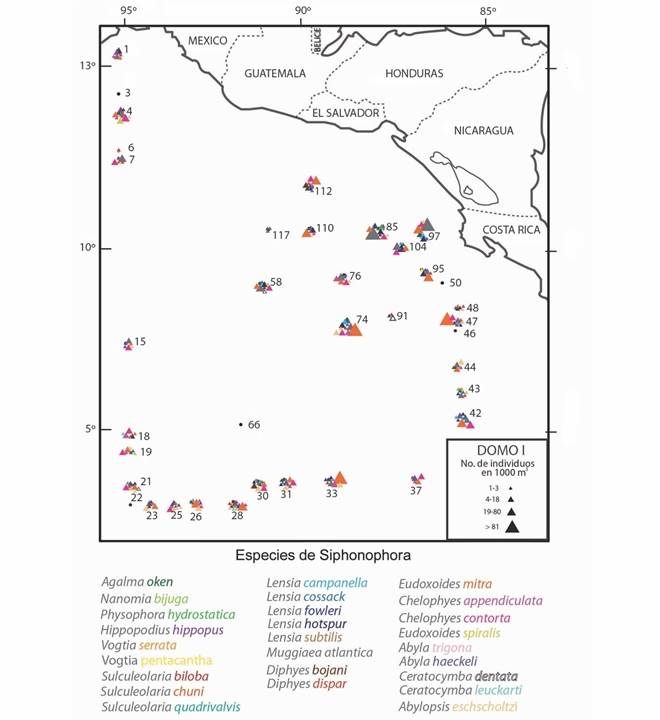
Fig. 2. Fig. 2. Distribución y densidad de las especies de sifonóforos en el Domo de Costa Rica durante la campaña oceanográfica DOMO I, febrero-marzo de 1979. Distribution and density of siphonophores species in the Costa Rica Dome during the oceanographic campaign DOMO I, February-March 1979.
Para determinar la jerarquización ecológica de las especies se realizó la prueba de asociación de dos variables de Olmstead-Tukey (Sokal & Rohlf, 1995), que relaciona la densidad (org./1000m3) con el porcentaje de su aparición en el área de estudio, proporcionando un gráfico sencillo.
Con la finalidad de identificar los patrones de distribución de las especies de sifonóforos, separando los estadios reproductivos o eudoxias de las formas poligástricas, se utilizó un análisis de agrupamiento de dos vías usando la abundancia estandarizada. Para disminuir la varianza se transformaron los valores a Log(x+1) y se utilizó el método de Sorensen (Bray-Curtis) con la distancia ß flexible -0.25 para conservar mejor los espacios de los grupos (McCune & Grace, 2002). El análisis se realizó utilizando software PC-ORD 6 siguiendo las recomendaciones de McCune & Grace (2002).
Resultados
Se identificó un total de 30 especies, las cuales se enlistan siguiendo el arreglo taxonómico propuesto por Schuchert (2019).
Phylum Cnidaria Verril, 1865
Clase Hydrozoa Owen, 1843
Subclase Hydroidolina Collins, 2000
Orden Siphonophorae Eschscholtz, 1829
Suborden Calycophorae Leuckart, 1824
Familia Abylidae L. Agassis, 1862
Abyla trigona Quoy & Gaimard, 1827
A. haeckeli Lens & van Riemsdijk, 1908
*Abylopsis anomala (Sears, 1953)
A. eschscholtzii (Huxley, 1859)
A. tetragona (Otto, 1823)
Bassia bassensis (Quoy & Gaimard, 1833)
Ceratocymba dentata (Bigelow, 1918)
C. leuckartii (Huxley, 1859)
Enneagonum hyalinum Quoy & Gaimard, 1827
Familia Diphyidae Quoy & Gaimard, 1827
Chelophyes appendiculata (Eschscholtz, 1829)
Ch. Contorta (Lens & van Riemsdijk, 1908)
Diphyes bojani (Eschscholtz, 1825)
D. dispar Chamisso & Eysenhardt, 1821
Eudoxoides mitra (Huxley, 1859)
E. spiralis (Bigelow, 1911)
Lensia campanella (Moser, 1917)
L. cossack Totton, 1941
L. fowleri (Bigellow, 1911)
L. hotspur Totton, 1941
L. subtilis (Chun, 1886)
Muggiaea atlantica Cunningham, 1892
Sulculeolaria biloba (Sars, 1846)
S. chuni (Lens & van Riemsdijk, 1908)
S. quadrivalvis Blainville, 1830
Familia Hippopodiidae Kölliker, 1853
Hippopodius hippopus (Forsskål, 1776)
Vogtia pentacantha Kölliker, 1853
V. serrata (Moser, 1925)
Suborden Physonectae Haeckel, 1888
Familia Agalmatidae Brand, 1834
Agalma okenii Eschscholtz, 1825
Nanomia bijuga (Delle Chiaje, 1841)
Familia Physophoridae Eschscholtz, 1829
Physophora hydrostatica Forsskål, 1775
*Taxón de validez incierta o discutida por diferentes expertos (taxon inquirendum) (Schuchert, 2019)
Del total de las 30 especies determinadas, el suborden Calycophorae mostró la mayor diversidad con 27, mientras que solo tres pertenecen a Physonectae, lo que coincide con los resultados en la mayoría de los trabajos sobre sifonóforos, por ejemplo, el de Lo & Biggs (1996). De Calycophorae se identificaron tres familias, presentando Diphyidae la mayor riqueza con 15 especies, seguida por Abylidae con nueve y tres especies corresponden a la familia Hippopodiidae; mientras que en Physonectae, dos especies son de la familia Agalmatidae y una de la familia Physophoridae.
Las especies con mayor densidad relativa fueron los difidos Eudoxoides mitra, Muggiaea atlantica, Chelophyes contorta y Lensia hotspur (Fig. 1); en cuanto al porcentaje de aparición en la región de estudio, Chelophyes contorta ocupó el 85 % de las estaciones de muestreo, seguida por E. mitra, M. atlántica, Abylopsis eschscholtzi y Agalma okeni se presentaron en el 82%, 73%, 64% y 61%, respectivamente, perteneciendo las dos primeras a Diphydae, la tercera a Abylidae y la última al fisonéctido de la familia Agalmatidae (ver Lista taxonómica y Tabla 2).
Tabla 2 Table 2 Sifonóforos en el Domo de Costa Rica durante la campaña oceanográfica DOMO I-1979 Siphonophores Dome of Costa Rica during the DOMO I-1979 oceanographic campaign
| Taxa | D | D% | A | FA | ||
| Eudoxoides mitra | [Eumi] | 2644 | 35 | 1621 | 82 | |
| Muggiaea atlantica | [Muat] | 1885 | 25 | 946 | 64 | |
| Chelophyes contorta | [Checo] | 905 | 12 | 557 | 85 | |
| Lensia hotspur | [Leho] | 544 | 7 | 275 | 55 | |
| Bassia bassensis | [Baba] | 265 | 3 | 144 | 18 | |
| Hippopodius hippopus | [Hihi] | 231 | 3 | 134 | 61 | |
| Abylopsis eschscholtzi | [Abes] | 188 | 2 | 116 | 61 | |
| Agalma okeni | [Agok] | 140 | 2 | 76 | 73 | |
| Enneagonum hyalinum | [Enhy] | 122 | 2 | 80 | 55 | |
| Chelophyes appendiculata | [Cheap] | 119 | 1 | 74 | 24 | |
| Diphyes bojani | [Dibo] | 83 | 1 | 54 | 24 | |
| Lensia campanella | [Leca] | 75 | 1 | 38 | 27 | |
| Lensia cossack | [Leco] | 62 | 1 | 44 | 36 | |
| Diphyes dispar | [Didi] | 67 | 1 | 40 | 39 | |
| Lensia fowleri | [Lefo] | 59 | 1 | 37 | 33 | |
| Abylopsis tetragona | [Abte] | 43 | 0.5 | 29 | 33 | |
| Eudoxoides spiralis | [Eusp] | 31 | 0.4 | 19 | 27 | |
| Physophora hydrostatica | [Phhy] | 29 | 0.3 | 20 | 18 | |
| Abylopsis anomala | [Aban] | 25 | 0.3 | 17 | 15 | |
| Ceratocymba dentata | [Cede] | 22 | 0.2 | 12 | 9 | |
| Nanomia bijuga | [Nabi] | 9 | 0.1 | 6 | 3 | |
| Vogtia pentacantha | [Vpe] | 10 | 0.1 | 4 | 3 | |
| Sulculeolaria biloba | [Subi] | 14 | 0.1 | 10 | 6 | |
| Sulculeolaria quadrivalvis | [Suqu] | 10 | 0.1 | 8 | 6 | |
| Lensia subtilis | [Lesu] | 11 | 0.1 | 8 | 6 | |
| Abyla haeckeli | [Abhae] | 12 | 0.1 | 6 | 12 | |
| Vogtia serrata | [Vose] | 7 | 0.09 | 5 | 3 | |
| Sulculeolaria chuni | [Such] | 4 | 0.05 | 2 | 6 | |
| Ceratocymba leuckarti | [Celeu] | 3 | 0.03 | 2 | 6 | |
| Abyla trigona | [Abtr] | 1 | 0.01 | 1 | 3 | |
| Total | 3533 | |||||
D=Densidad, D%=Densidad relativa, A=Abundancia, FA= frecuencia de aparición, [abreviatura de las especies de sifonóforos].
Eudoxoides mitra presentó la densidad más alta en el área de estudio (2 644 org./1 000 m3), con valores altos de 407, 294, 282, en las localidades 37, 74 y 47, posiblemente ubicadas sobre o cerca de la surgencia. También fue una especie dominante en el estudio de Lo & Biggs (1996) en el Atlántico noroccidental cerca de Bermudas y en el Atlántico sur (Alvariño, 1981; Pugh, 1999). Es importante destacar que en general, la fase poligástrica fue la más abundante en las especies estudiadas y solo se observó la fase reproductora o eudoxia en Diphyes dispar, Eudoxoides mitra, Chelophyes appendiculata, Ceratocymba dentata, Abylopsis eschscholtzi, Abylopsis tetragona, Bassia bassensis y Enneagonum hyalinum.
De acuerdo a estos parámetros y aplicando la prueba de asociación de Olmstead-Tukey, la jerarquización ecológica de la comunidad de sifonóforos fue la siguiente: como especies dominantes quedaron Chelophyes contorta, Eudoxoides mitra, Agalma okeni, Muggiaea atlantica, Abylopsis eschscholtzi, Hippopodius hippopus, Lensia hotspur, y Enneagonum hyalinum. En la categoría de ocasionales se observaron a Diphyes dispar, Lensia campanella, Lensia fowleri, Lensia cossack, Chelophyes appendiculata, Diphyes bojani y Bassia bassensis, mientras que las 15 especies restantes quedaron en la categoría de raras (Fig. 3).
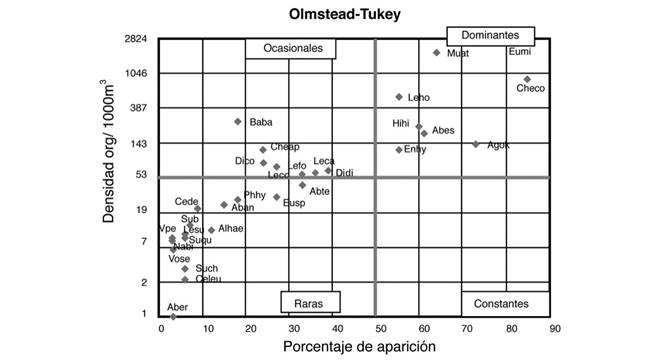
Fig. 3. Fig. 3. Análisis de dominancia específica de los sifonóforos del Domo de Costa Rica durante febrero-marzo de 1979. Analysis of the specific dominance of siphonophores in the Costa Rica Dome during February-March 1979.
La Fig. 2 muestra la distribución y la densidad de las 30 especies de sifonofóros determinadas en este estudio, en el Pacífico centroamericano. Se puede apreciar que, en general, la mayor riqueza de especies y la mayor densidad de algunas de ellas se presentan en la región frente a las costas de El Salvador, Nicaragua y Costa Rica.
Mediante el análisis de agrupamiento de dos vías se definieron tres grupos de especies de sifonóforos (12.5% de similitud) y tres grupos de estaciones (25% y 18.5% de similitud). El grupo A conformado por las especies que presentaron sus mayores densidades en las estaciones influenciadas por la zona de surgencias; el grupo B estuvo formado por las especies que mantuvieron abundancias intermedias y con una mayor presencia de especies al margen de la región de surgencias. El grupo C estuvo constituido por especies raras y con baja frecuencia de aparición Fig. 4.
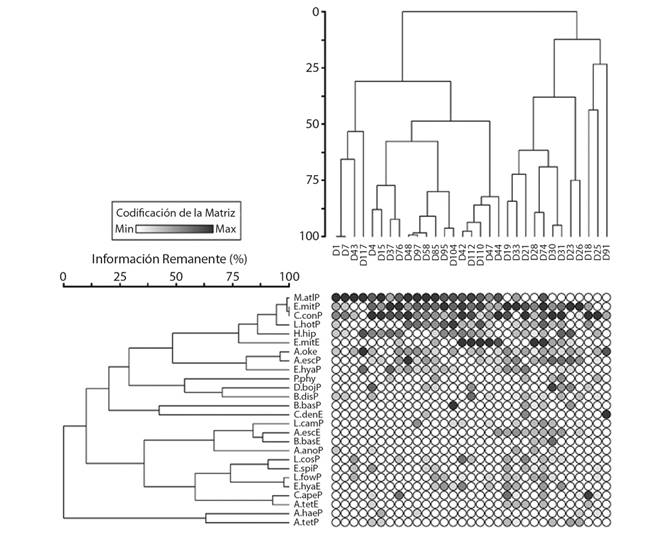
Fig. 4. Fig. 4.Clustering Análisis de agrupamiento de dos vías de las especies de sifonóforos en el Domo de Costa Rica en febrero-marzo de 1979. P= fase poligástrica; E= fase eudoxia. Muggiaea atlantica (M.atlP), Eudoxoides mitra (E.mitP), Chelophyes contorta (C.conP), Lensia hospur (L.hotP), Hyppodius hippopus (H.hip), Eudoxoides mitra (E.mitE), Agalma okeni (A.oke), Abylopsiseschscholtzii (A.escP), Enneagonum hyalinum (E.hyaP), Physophora hydrostatica (P.phyP), Diphyes bojani (D.bojP), Diphyes dispar (D.disP), Bassia bassensis (B.basP), Chelophyes dentata (C.denE), Lensia campanella (L.camP), Abylopsiseschscholtzii (A.escE), Bassiabassensis (B.basE), Abylopsis anomala (A.anoP), Lensia cossak (L.cosP), Eudoxoides spiralis (E.spiP), Lensia fowleri (L.fowP), Enneagonum hyalinum (E.hyaE), Chelophyes appendiculata (C.apeP), Abylopsistetragona (A.tetE), Abylopsishaeckeli (A.haeP), Abylopsistetragona (A.tetP). analysis of two pathways of the siphonophores species in the Costa Rica Dome during February-March of 1979. P= polygastric phase; E= eudoxia phase. Muggiaea atlantica (M.atlP), Eudoxoides mitra (E.mitP), Chelophyes contorta (C.conP), Lensia hospur (L.hotP), Hyppodius hippopus (H.hip), Eudoxoides mitra (E.mitE), Agalma okeni (A.oke), Abylopsiseschscholtzii (A.escP), Enneagonum hyalinum (E.hyaP), Physophora hydrostatica (P.phyP), Diphyes bojani (D.bojP), Diphyes dispar (D.disP), Bassia bassensis (B.basP), Chelophyes dentata (C.denE), Lensia campanella (L.camP), Abylopsiseschscholtzii (A.escE), Bassiabassensis (B.basE), Abylopsis anomala (A.anoP), Lensia cossak (L.cosP), Eudoxoides spiralis (E.spiP), Lensia fowleri (L.fowP), Enneagonum hyalinum (E.hyaE), Chelophyes appendiculata (C.apeP), Abylopsistetragona (A.tetE), Abylopsishaeckeli (A.haeP), Abylopsistetragona (A.tetP).
Discusión
Actualmente los estudios sobre sifonóforos se han incrementado demostrando su importancia en varios aspectos biológicos, ecológicos y filogenéticos (Mapstone, 2014; Munro et al., 2018). Por lo tanto, el conocimiento sobre sifonóforos es esencial en los ecosistemas marinos y en particular constituyen una herramienta biológica importante en la comprensión de varios fenómenos oceanográficos. La información que aquí se presenta es importante para comprender mejor el Domo Térmico de Centro América.
En general, las 30 especies de sifonóforos determinadas en este trabajo tienen una amplia distribución en todos los océanos y mares del planeta y, de acuerdo a Ekman (1953) desde finales del siglo XIX varias de ellas se han usado en estudios zoogeográficos que ayudan a comprender diferentes aspectos de la oceanografía. En este sentido es interesante observar que Alvariño (1969b) describió que las especies Chelophyes contorta y C. appendiculata mostraron una distribución alopátrica, con la primera dominando en aguas cálidas y la segunda en aguas frías y por lo tanto eran indicadoras en la región del golfo de California. Alvariño (1974) lo que nota es una distribución y abundancia mayores de C. appendiculata en el Mar Caribe y una aparición escasa, limitada a pocas localidades en el Pacífico Centroamericano y lo opuesto sucede con C. contorta que justamente es lo que se observa en este trabajo y Pugh (1974) en su trabajo de Sifonóforos del Atlántico sur, solo la ubica en el suroeste de África en la región epipelágica. Moser (1925) incluye algunas de las especies registradas en el área de estudio, como Abylopsis eschscholtzii, Diphyes dispar y Physophora hydrostatica y las define como especies con distribución circumglobal, lo que es confirmado con los resultados obtenidos en este trabajo. En el Atlántico norte Pugh (1974) y Mackie et al. (1987) describen los aspectos zoogeográficos de las poblaciones de sifonóforos, mencionando que su distribución está influenciada por las masas de agua y por la posición de la termoclina, lo cual en general sucede en la mayoría de los integrantes del plancton, pero sin embargo no siempre está documentado.
Tomando en consideración los antecedentes de estos cnidarios coloniales en la región de estudio (Tabla 3), se encontró que de las especies definidas como dominantes en este trabajo, seis de ellas fueron registradas previamente en el área de estudio o en las regiones aledañas con ese mismo carácter, mientras que Lensia hospur y Enneagonium hylinun se observaron con una distribución muy aislada o con la categoría de raras (Alvariño, 1971; Gasca & Suárez-Morales, 1992).
Tabla 3 Table 3 Estudios previos de los Sifonóforos en el Domo de Costa Rica y regiones adyacentes Previous studies of the Siphonophores in the Dome of Costa Rica and adjacent regions.
| Especie | Localidad | Autor |
| Eudoxoides mitra | Costas de Guatemala y Costa Rica y en la isla de Cocos | [Bi] |
| Manzanillo, México hasta Panamá | Como Diphyopsis mitra[Al1] | |
| En las aguas del Domo de Costa Rica | [G&S], [V&F] | |
| Muggiaea atlantica | Costa de Guatemala | [Bi] |
| Golfos de Panamá y Tehuantepec | [Al1] | |
| En las aguas del Domo de Costa Rica | [G&S], [V&F] | |
| Chelophyes contorta | Guatemala, Golfo de Panamá y Galápagos | [Bi] |
| Manzanillo, México hasta Panamá | [Al1] | |
| En las aguas del Domo de Costa Rica | [G&S], [V&F] | |
| Hippopodius hippopus | W plataforma de Albatross y Galápagos | [Bi] |
| Manzanillo, México hasta Panamá | [Al1] | |
| En las aguas del Domo de Costa Rica | [G&S], [V&F] | |
| Abylopsis eschscholtzi | Frente a Costa Rica | [Bi] |
| Manzanillo, México hasta Panamá | [Al1] | |
| En las aguas del Domo de Costa Rica | [G&S], [V&F] | |
| Agalma okeni | Costa de Guatemala, Costa Rica, entre el Golfo de Panamá y Galápagos y plataforma de Albatross | [Bi] |
| Punta San Telmo, México hasta el Golfo de Panamá | [Al1] | |
| En las aguas del Domo de Costa Rica | [G&S], [V&F] | |
| Lensia hospur | En el Pacífico nororiental frente a las costas de California y Baja California | [Al2] |
| En las aguas del Domo de Costa Rica | [G&S], | |
| Enneagonum hyalinum | Guatemala, Golfo de Panamá, Galápagos y Perú | [Bi] |
| En las aguas del Domo de Costa Rica | [G&S] |
Bi = Bigelow (1911); Al1 y Al2 = Alvariño (1969a), Alvariño (1971); G&S = Gasca & Suárez-Morales (1992); V&F = Vicencio-Aguilar & Fernández-Álamo (1996).
Sulculeolaria chuni apareció con una abundancia muy baja y una distribución restringida a solo dos estaciones y no fue citada por Alvariño (1971) en su listado de especies del Pacífico. De las especies con categoría de raras, tiene especial importancia V. serrata que no fue registrada en los trabajos de Bigelow (1911), Bigelow (1931) y Alvariño (1969a), Alvariño (1971), Alvariño (1974). Sin embargo Alvariño (1967a) describe a V. kuruae como nueva especie que habita las aguas mesopelágicas en muestreos realizados frente a San Diego, California y vuelve a nombrarla en Alvariño,1967b y Alvariño,1971. Schuchert (2019) actualmente la considera no válida y en sinonimia con V. serrata, por lo tanto la primera observación para las aguas del Domo fue la realizada por Vicencio-Aguilar & Fernández-Álamo (1996) como V. kuruae. Bigelow & Sears (1937) observaron a V. serrata a considerables profundidades (1066 a 2900 m) en la Bahía de Cádiz, España y Moser (1925) considera que esta especie puede aparecer ocasionalmente en la superficie y la pregunta importante es si su presencia en el área de estudio se debe que fue sacada a la superficie por el afloramiento del Domo y por lo tanto puede ser considerada como especie indicadora de dicho fenómeno.
En general podemos resumir que el gran número de organismos y la gran diversidad de sifonóforos encontrada en este estudio en el Domo de Costa Rica, muestra la gran importancia que tienen dentro de la productividad secundaria y su relación con la presencia del Domo (Fig. 5). El Domo de Costa Rica es una zona de alta productividad primaria, que genera un aumento considerable en las comunidades de zooplancton, lo que se reflejó durante el presente estudio con el registro de altas concentraciones de sifonóforos en la parte central y occidental del Domo, entre los 9° y 11° N y entre los 85° y 91°W, confirmando los resultados obtenidos por De la Torre (1982) y Flores (1985), quienes registran los valores más altos de biomasa planctónica en esta región y se ha documentado que los sifonóforos tienen una significativa contribución en la biomasa total del zooplancton (Robinson, 2004).
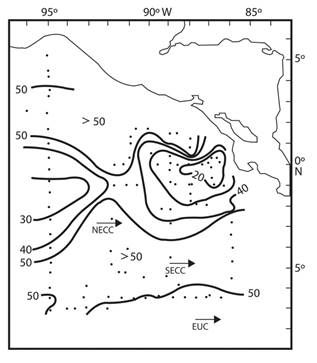
Fig. 5 Fig. 5.Distribution Distribución de las profundidades de la isoterma de los 20 °C en el Domo de Costa Rica durante febrero-marzo de 1979. Modificado de Barberán, Gallegos, Fernández, & Meet (datos sin publicar). of the 20 °C isotherm in the Costa Rica Dome, during February-March, 1979. Modified from Barberán, Gallegos, Fernández, & Meet (unpublished data).
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

