Introducción
Las lagunas costeras son sistemas estuarinos importantes para el desarrollo del ciclo de vida de los peces costeros y una de sus funciones principales es servir como áreas de crianza para los peces juveniles de muchas especies, una parte de las cuales tienen importancia comercial (Franco et al., 2006). La presencia de peces juveniles en las lagunas costeras en la región del Pacífico de México ha sido documentada por numerosos autores (Amezcua, Madrid-Vera, & Aguirre-Villaseñor, 2006; Díaz-Ruiz, Aguirre-León, & Cano-Quiroga, 2006; Mendoza, Castillo-Rivera, Zárate-Hernández, & Ortiz-Burgos, 2009; Rodríguez-Romero et al., 2011) pero en general, no hay mucha información cuantitativa sobre las tallas de los peces examinados que permita conocer la proporción de estadios inmaduros en la ictiofauna. Una excepción importante es el trabajo de González-Sansón et al., (2014), que presentó información detallada sobre la composición por especies y las tallas de los individuos recolectados y concluyó que la ictiofauna de la laguna Barra de Navidad (Jalisco) está compuesta por especies que se encuentran mayormente en estadio juvenil (> 70 %).
La correlación entre variables abióticas (p.e. salinidad, temperatura) y la composición de la ictiofauna ha sido investigada en sistemas estuarinos a nivel mundial (Barletta, Barletta-Bergan, Saint-Paul, & Hubold, 2005; Franco et al., 2006; Barletta et al., 2008; Reis-Filho & de Alcântara Santos, 2014; Kamrani, Sharifinia, & Hashemi, 2016). En la costa del Pacífico de México existen también estudios sobre las variaciones espaciales y temporales de la ictiofauna estuarina y su relación con variables ambientales (Castillo-Rivera, Zárate, & Ortiz, 2005; González-Acosta, De la Cruz-Agüero, De la Cruz-Agüero, & Ruiz-Campos, 2005; Castillo-Rivera, Ortiz-Burgos, & Zárate-Hernández, 2011; Mendoza et al., 2009; Rodríguez-Romero et al., 2011; Aguirre-León, Pérez-Ponce, & Díaz-Ruiz, 2014). Es notoria, sin embargo, la muy escasa información existente sobre la influencia de las características del sedimento en la variación espacial de los peces estuarinos. Investigaciones recientes realizadas sobre la ictiofauna demersal de zonas profundas en la laguna Barra de Navidad permitieron encontrar evidencia de una alta correlación entre la distribución espacial de los peces y las características del sustrato (Cabrera-Páez, Aguilar-Betancourt, González-Sansón, Negrete-Rodríguez, & Gray, 2018; González-Sansón, Aguilar-Betancourt, & Kosonoy-Aceves, 2018). Por otra parte, la composición por especies y abundancia de los peces, principalmente peces juveniles, que habitan en zonas someras de la laguna, fue objeto de un estudio que se enfocó a los cambios temporales y analizó los efectos de un huracán sobre esa porción de la ictiofauna de la laguna (González-Sansón et al., 2016). Ese estudio encontró también evidencia cualitativa de cambios espaciales asociados a las características diferentes del sedimento en dos sitios de muestreo.
El objetivo principal de este trabajo fue investigar la posible correlación de la salinidad, la temperatura, la granulometría del sedimento y el contenido de materia orgánica del mismo con la composición de la ictiofauna en las zonas someras de la laguna Barra de Navidad. Tres preguntas guiaron nuestro estudio: 1) ¿Existen cambios espaciales y temporales significativos en la composición de la ictiofauna?; 2) ¿Cuáles son los factores abióticos que se pueden correlacionar mejor con esos cambios?; 3) ¿Explican los factores abióticos gran parte de la variación observada o es posible que factores bióticos también estén influyendo en los cambios observados?
Materiales y métodos
Área de estudio: La laguna Barra de Navidad (Fig. 1) se ubica en el litoral centro occidental mexicano del Océano Pacífico (19°11’25’’ N & 104°39’53’’ W). Es un sistema lagunar euhalino (salinidad media ˃ 30) con comunicación permanente con el mar (Bahía de Navidad) por medio de una boca permanente. Cuenta con 3.76 km2 de superficie de espejo de agua y profundidades típicas que no exceden los dos metros, aunque en algunas zonas específicas, como el canal de entrada, pueden ser de hasta cuatro metros (González-Sansón et al.,2014). En época de secas (noviembre a mayo) la entrada de agua dulce es mínima y la salinidad media equivale a la del mar adyacente. En época de lluvias (junio a octubre) la laguna recibe entradas de agua superficiales desde los ríos Marabasco y Arroyo Seco, que son corrientes de agua estacionales y se unen a una distancia de aproximadamente 600 m al este del margen oriental de la laguna. En esta etapa, las aguas lagunares adquieren, por periodos breves de tiempo, un carácter mixohalino (0.5-30), aunque la intensa mezcla por la acción de las mareas restituye rápidamente el carácter euhalino del sistema. En la laguna y sus márgenes existe un desarrollo notable de actividades de pesca artesanal, turísticas y recreacionales.
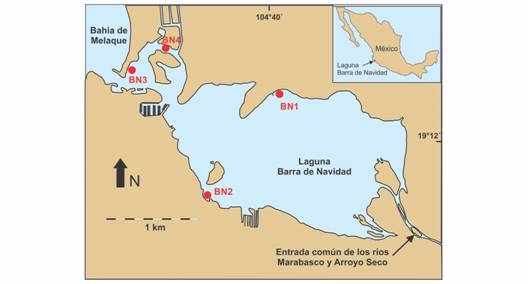
Fig. 1 Fig. 1 Laguna Barra de Navidad que muestra la posición de los sitios de muestreo. Barra de Navidad lagoon showing the location of sampling sites.
Variables abióticas: Simultáneamente con los muestreos de la ictiofauna, que se describen a continuación, se midieron los valores de salinidad y temperatura con una sonda YSI-30 previamente a la operación de captura en cada sitio. Al comienzo del estudio, se caracterizó el sedimento en todos los sitios. Para esto se tomaron muestras de sedimento mediante una draga Van Veen, en cuatro meses seleccionados a lo largo de periodo de muestreo que se consideran representativos del sedimento dominante al final de las épocas de lluvia y de seca respectivamente (diciembre de 2015 y 2016, mayo de 2016 y 2017). Se determinó el porcentaje con respecto al peso seco de las fracciones grava (> 2.00 mm), arena (> 0.0625 y ≤ 2.00 mm), lodo (≤ 0.0625 mm) y materia orgánica según Folk (1974). El contenido de materia orgánica se estimó según Dean (1974), y fue expresado en porcentaje del peso seco total del sedimento.
Muestreo de la ictiofauna: En el periodo comprendido desde septiembre 2015 hasta septiembre 2017, se realizaron muestreos de la ictiofauna en cuatro sitios de la laguna Barra de Navidad (Fig. 1). En cada muestreo se realizaron cinco lances por sitio, empleando un chinchorro playero experimental de 1.75 m de altura, 10 m de ancho, 3 m de largo y 1 cm de luz de malla en el copo. La captura de los cinco lances fue combinada para obtener una sola muestra en cada sitio y fecha de muestreo. Las recolectas se realizaron mediante arrastres efectuados desde una distancia de 25 m hasta la orilla, entre las 4:00 pm y las 7:00 pm. Durante el primer año de muestreo las recolectas se realizaron mensualmente. Al cabo de ese tiempo, se hizo un análisis preliminar de los datos obtenidos y este arrojó poca variabilidad en cuanto a los factores abióticos y la ictiofauna entre meses, por lo que se decidió para el segundo año realizar los muestreos en meses alternos.
Los peces capturados en todos los sitios de muestreo fueron guardados en bolsas debidamente rotuladas, conservadas en hielo y transportadas al laboratorio. Posteriormente los individuos se cuantificaron e identificaron hasta nivel de especie según Fischer (1995) y Robertson y Allen (2015). Los nombres válidos de las especies se presentan según Fricke, Eschmeyer, y van der Laan (2020) y los nombres y arreglo sistemático de las familias y órdenes según Nelson, Grande, y Wilson (2016). A cada espécimen se le determinó la longitud total (cm) con un ictiómetro. Los ejemplares de mayor talla, como las rayas, fueron fotografiados, medidos in situ y devueltos a la laguna. Se estimó el porcentaje de individuos que estaban por debajo de la longitud de maduración y se consideró que se encontraban en estadio juvenil. La longitud de maduración y el tipo de alimentación de las especies principales incluidas en esta investigación se obtuvieron de la base de datos en línea Fishbase (Froese & Pauly, 2019) y de literatura científica (Piñón, Amezcua, & Duncan,2009; Lucano-Ramírez, Ruiz-Ramírez, González-Sansón, & Ceballos-Vázquez, 2014; Aguilar-Betancourt et al., 2016; Ruiz-Ramírez, et al., 2017; Lucano-Ramírez et al., 2019).
Procesamiento estadístico: Para visualizar la tendencia temporal en los valores de salinidad y temperatura, se utilizó el método de suavizado por regresión local (LOESS). Para el análisis de la composición de la ictiofauna se utilizó el procedimiento PERMANOVA (Anderson, 2008) basado en una matriz de afinidades utilizando el índice de similitud de Bray-Curtis calculado sobre la raíz cuarta de los datos del número de individuos para cada especie en cada operación de muestreo. Se definieron como factores de efectos fijos los sitios y las estaciones del año, considerando los meses de muestreo dentro de cada estación como un factor aleatorio anidado en la combinación sitios x estación. El procesamiento se realizó con el paquete de análisis PRIMER 6.0 (Clarke & Gorley, 2006).
La relación ambiente-especies fue estimada usando un análisis de redundancia (RDA) (Legendre & Legendre 2012). Previo al análisis, los datos fueron transformados según lo sugerido por Legendre y Gallagher (2001) para obtener una ordenación basada en distancia de Hellinger. El escalado fue enfocado sobre las correlaciones interespecies, los puntajes (scores) de especies fueron divididas por la desviación estándar y los datos fueron centrados por especies. La significación estadística de los ejes canónicos fue determinada mediante una prueba de Monte Carlo no restringida basada en 9 999 permutaciones. En el RDA se incluyeron como variables ambientales los porcentajes de lodo, arena y materia orgánica en el sedimento. El porcentaje de grava en los sedimentos no se incluyó para evitar la colinealidad con las fracciones de lodo y arena. Se incluyeron además la temperatura y la salinidad. Los gráficos conjuntos (“biplots”) fueron usados para la representación de los resultados y su interpretación se basó en los criterios de Legendre y Legendre (2012). El procesamiento se realizó con el programa CANOCO 4.5 (ter Braak & Smilauer, 2002).
Resultados
Factores abióticos: Los valores medios de salinidad fueron muy similares entre sitios y dentro de cada sitio presentaron poca variación entre estaciones del año. La diferencia fue ligeramente más marcada en los sitios más cercanos a la entrada principal de agua dulce (Tabla 1). Un análisis más detallado de esta variable por meses y sitios permitió verificar disminuciones en los meses finales de la época de lluvias (Fig. 2). En estos meses también se presentó una mayor diferencia entre los valores de salinidad por sitios, sugiriendo la existencia de un gradiente. Estos cambios, sin embargo, fueron de corta duración y una homogeneidad en la salinidad de los sitios se restableció rápidamente. Los valores medios de la temperatura también fueron muy similares entre sitios y resultaron siempre mayores en la época de lluvias en cada sitio, con diferencias estacionales alrededor de 3 a 4 °C (Tabla 1). El análisis de la variación mensual de los valores de temperatura permitió verificar una tendencia temporal que coincidió bien con la oscilación esperada para esta variable asociada con las estaciones del año (Fig. 2).
TABLA 1 TABLE 1 Valores medios y error estándar (ee) de salinidad, temperatura, fracciones del sedimento y materia orgánica por estaciones en cada sitio de muestreo Mean values and standard error (ee) of salinity, temperature (°C), sediment fractions and percentage organic matter by seasons at each sampling site
| Sitio | Estación | Salinidad | Temperatura | % grava | % arena | % lodo | % MO |
| BN1 | lluvia | 28.2 ± 3.78 | 33.4 ± 0.41 | 1.4 ± 0.85 | 16.7 ± 9.20 | 81.9 ± 15.9 | 8.3 ± 0.72 |
| seca | 31.1 ± 3.10 | 30.1 ± 0.49 | 0.1 ± 0.06 | 2.1 ± 0.49 | 97.9 ± 0.5 | 17.1 ± 4.3 | |
| BN2 | lluvia | 29.3 ± 3.83 | 31.9 ± 0.39 | 8.4 ± 5.77 | 13.0 ± 5.46 | 78.6 ± 17.4 | 9. 3 ± 1.7 |
| seca | 31.1 ± 2.94 | 28.2 ± 0.46 | 0.1 ± 0.03 | 1.6 ± 0.21 | 98.3 ± 0.2 | 18.6 ± 5.9 | |
| BN3 | lluvia | 32.4 ± 1.60 | 31.0 ± 0.29 | 25.1 ± 1.48 | 73.4 ± 1.31 | 1.5 ± 0.2 | 1.8 ± 1.2 |
| seca | 31.5 ± 2.69 | 27.2 ± 0.71 | 3.7 ± 1.52 | 83.9 ± 3.15 | 12.5 ± 2.9 | 1.6 ± 0.4 | |
| BN4 | lluvia | 29.6 ± 3.71 | 31.6 ± 0.32 | 17.8 ± 8.69 | 73.5 ± 13.80 | 8.6 ± 6.7 | 1.1 ± 0.1 |
| seca | 30.9 ± 2.89 | 28.1 ± 0.56 | 16.9 ± 7.31 | 80.4 ± 7.34 | 2.5 ± 0.1 | 0.9 ± 0.1 |
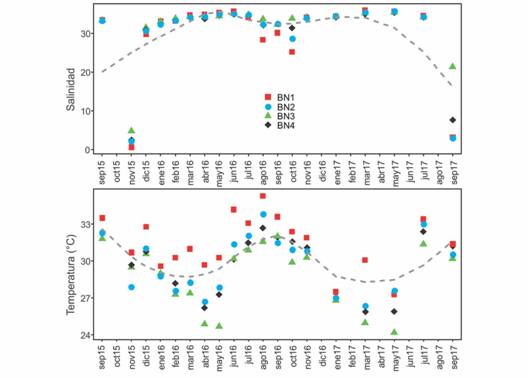
Fig. 2 Fig. 2 Valores mensuales por sitios de salinidad y temperatura del agua (o C) en la laguna Barra de Navidad, México. La línea interrumpida indica la tendencia suavizada (LOESS). Monthly values by sites of salinity and water temperature (o C) in Barra de Navidad lagoon, Mexico. Dashed line indicates the smoothed trend (LOESS).
La composición granulométrica del sedimento (Tabla 1) varió notablemente entre los sitios. En BN1 y BN2 predominó ampliamente la fracción lodo (siempre por encima de 78 %) con fracciones mucho menores de grava y arena. Por el contrario, en los sitios BN3 y BN4, el sedimento estuvo dominado por la arena y en menor medida la grava con fracciones de lodo siempre por debajo del 13 %. Diferencias similares se encontraron para el porciento de materia orgánica, con valores relativamente altos (> 8 %) en BN1 y BN2 y valores muy bajos (menores de 2 %) en los sitios BN3 y BN4. En los casos del lodo y la materia orgánica, se observaron valores más bajos en época de lluvia en los sitios BN1 y BN2, mientras que una tendencia contraria se encontró para la grava y la arena en los mismos sitios (Tabla 1).
Composición general de la ictiofauna: Se recolectaron 13 487 individuos de 69 especies, pertenecientes a 36 familias, agrupadas en 21 órdenes y dos clases. La familia con mayor representación en número de especies fue Carangidae con ocho especies, seguida de las familias Gerreidae, Gobiidae, Oxudercidae y Lutjanidae con cuatro especies y las familias Tetraodontidae, Eleotridae y Centropomidae con tres especies. El resto de las familias (28) presentaron una o dos especies. Cinco especies (E. currani, M. setosus, Anchoa sp., D. brevirostris, C. robalito) conformaron más del 80 % de la abundancia y fueron muy dominantes en las capturas. El 98 % de la abundancia total estuvo conformado por 26 especies. En 14 de estas especies, los ejemplares capturados fueron peces juveniles en todos los casos. En otras nueve especies, más del 50 % de los individuos capturados eran peces juveniles. Dos especies presentaron un porciento de adultos por encima del 60 % (P. turrubarensis, Anchoa sp.) y una (C. manglicola) apareció como adulto casi en su totalidad. El resto de las especies (43), se presentaron en números muy bajos. Las especies que conformaron más del 98 % de los individuos capturados mostraron hábitos alimentarios que incluyen principalmente el consumo de zooplancton e invertebrados bentónicos, algunas especies además incorporan peces a su dieta y otras se alimentan exclusivamente de detrito (Tabla 2).
TABLA TABLE 2 2 Especies que contribuyen al 98 % de los individuos recolectados, ordenadas según el número medio de individuos capturados por muestreo (N). Código = Etiquetas de especies formadas por las tres primeras letras del género y las tres primeras letras de la especie Species contributing 98 % of all collected individuals, ordered after the mean number of individuals by sampling operation (N). Código = Tags for the species formed by three first letters of Genus and three first letters of specific name
| Especies | Código | N | % | % acu | LTm | ee | Mín | Máx | LM | % < LM | A |
| Eucinostomus currani | Euccur | 11.99 | 33.3 | 33.3 | 3.4 | 0.04 | 1.0 | 12.0 | 13.4 | 100 | IB |
| Mugil setosus | Mugset | 7.71 | 21.4 | 54.8 | 7.5 | 0.08 | 2.0 | 20.0 | 23.1 | 100 | D |
| Anchoa sp | Anchoa | 7.60 | 21.1 | 75.9 | 5.3 | 0.06 | 2.2 | 9.5 | 4.7 | 35.7 | ZP |
| Diapterus brevirostris | Diabre | 1.02 | 2.8 | 78.7 | 7.4 | 0.14 | 2.4 | 18.9 | 18.5 | 99.7 | IB |
| Centropomus robalito | Cenrob | 0.77 | 2.1 | 80.9 | 6.4 | 0.21 | 3.4 | 18.7 | 20.9 | 100 | PIB |
| Sphoeroides annulatus | Sphann | 0.70 | 1.9 | 82.8 | 4.6 | 0.24 | 1.0 | 38.0 | 25.9 | 99.6 | IB |
| Lutjanus argentiventris | Lutarg | 0.66 | 1.8 | 84.7 | 8.3 | 0.19 | 2.0 | 17.6 | 32.6 | 100 | PIB |
| Haemulopsis elongatus | Haeelo | 0.58 | 1.6 | 86.3 | 8.0 | 0.16 | 3.0 | 17.5 | 18.5 | 100 | IB |
| Ctenogobius sagittula | Ctesag | 0.53 | 1.5 | 87.8 | 7.0 | 0.23 | 1.8 | 17.5 | 12.9 | 93.9 | D |
| Anchovia macrolepidota | Ancmac | 0.53 | 1.5 | 89.2 | 9.8 | 0.25 | 6.6 | 16.5 | 15.4 | 92.5 | ZP |
| Caranx sexfasciatus | Carsex | 0.37 | 1.0 | 90.3 | 9.4 | 0.20 | 5.0 | 15.5 | 48.4 | 100 | PIB |
| Lutjanus guttatus | Lutgut | 0.33 | 0.9 | 91.2 | 4.2 | 0.05 | 3.7 | 5.6 | 35.1 | 100 | PIB |
| Poeciliopsis turrubarensis | Poetur | 0.28 | 0.8 | 91.9 | 3.7 | 0.08 | 1.2 | 5.5 | 3.1 | 18.6 | ZP |
| Lutjanus novemfasciatus | Lutnov | 0.28 | 0.8 | 92.7 | 8.8 | 0.36 | 1.8 | 19.6 | 85.6 | 100 | PIB |
| Rhonciscus bayanus | Rhobay | 0.27 | 0.7 | 93.5 | 8.5 | 0.28 | 3.0 | 25.2 | 29.5 | 100 | PIB |
| Syacium ovale | Syaova | 0.26 | 0.7 | 94.2 | 8.6 | 0.62 | 1.9 | 20.3 | 9.5 | 65.6 | PIB |
| Eucinostomus dowii | Eucdow | 0.21 | 0.6 | 94.7 | 5.9 | 0.33 | 1.9 | 13.1 | 12.9 | 98.6 | IB |
| Erotelis armiger | Eroarm | 0.20 | 0.6 | 95.3 | 8.4 | 0.27 | 2.2 | 14.9 | 9.7 | 76.0 | PIB |
| Gobionellus microdon | Gobmic | 0.18 | 0.5 | 95.8 | 7.8 | 0.35 | 2.5 | 13.6 | 8.8 | 61.2 | IB |
| Caranx caninus | Carcan | 0.16 | 0.4 | 96.3 | 9.1 | 0.32 | 5.1 | 16.7 | 54.0 | 100 | PIB |
| Achirus mazatlanus | Achmaz | 0.15 | 0.4 | 96.7 | 10.8 | 0.83 | 1.7 | 20.2 | 10.8 | 54.4 | PIB |
| Oligoplites saurus | Olisau | 0.14 | 0.4 | 97.1 | 7.7 | 0.29 | 2.1 | 12.2 | 21.2 | 100 | PIB |
| Larva leptocefala | Lepto | 0.13 | 0.4 | 97.4 | 3.2 | 0.11 | 1.6 | 6.8 | - | 100 | PIB |
| Centropomus medius | Cenmed | 0.10 | 0.3 | 97.7 | 8.7 | 0.40 | 2.5 | 12.0 | 36.6 | 100 | PIB |
| Ctenogobius manglicola | Cteman | 0.09 | 0.3 | 97.9 | 2.7 | 0.08 | 1.6 | 3.4 | 2.0 | 8.6 | D |
| Gerres simillimus | Gersim | 0.07 | 0.2 | 98.2 | 6.7 | 0.66 | 2.0 | 21.3 | 24.4 | 100 | IB |
LTm = Longitud total media (cm), ee = error estándar de la LTm, Mín y Máx = Valores mínimos y máximos de la longitud total (cm), LM = Longitud de maduración (cm), % < LM = Porciento de individuos con LTm por debajo de la LM, A: Alimentación (IB: Invertebrados bentónicos, D: detrito, PIB: Peces e invertebrados bentónicos, ZP: Zooplancton).
Variaciones espacio-temporales de la ictiofauna: El procedimiento PERMANOVA mostró que la interacción no fue significativa entre los factores sitios y estaciones. Este análisis, además, no arrojó diferencias significativas entre meses para sitios y estaciones (Tabla 3). Sin embargo, cada factor (sitios y estaciones) por separado presentó diferencias significativas entre sus niveles. La prueba de comparaciones múltiples encontró que todos los sitios son diferentes entre sí.
TABLA 3 TABLE 3 Resultados del PERMANOVA sobre los datos de número de individuos (transformados con raíz cuarta) Results of PERMANOVA performed on the number of individuals (fourth root transformed)
| Factor | GL | Pseudo-F | P |
| Sitios (Si) | 3 | 7.92 | 0.0001 |
| Estaciones (Es) | 1 | 2.42 | 0.0088 |
| Si x Es | 3 | 1.18 | 0.2397 |
| Meses (Si x Es) | 44 | 1.12 | 0.1611 |
| Residual | 23 | ||
| Total | 74 |
GL = grados de libertad, P = probabilidad de Pseudo-F basada en permutaciones.
GL = Degrees of freedom, P = probability of Pseudo-F based in permutations.
El análisis gráfico de la composición por especies permitió identificar cuáles especies caracterizan a cada sitio en cada estación (Fig. 3). La mayor diversidad de especies y los números de individuos capturados más altos se encontraron en el sitio BN1, mientras que en el sitio BN4 se encontró el número más bajo de especies y en general, el menor número de individuos. En todos los sitios, las especies E. currani y M. setosus estuvieron bien representadas en ambas estaciones del año. El resto de las especies mostraron diferencias entre sitios más o menos notables. Las especies del género Anchoa estuvieron bien representadas en los sitios BN1 y BN2, pero su representación disminuyó en general en los otros sitios. Las especies S. annulatus, H. elongatus, L. guttatus y E. dowii presentaron una clara tendencia a ser más abundantes en los sitios BN3 y BN4. Otras especies estuvieron bien representadas en el sitio BN1, pero fueron escasas en el resto de los sitios. Entre estas se encuentran C. robalito, C. sagittula, A. macrolepidota, C. sexfasciatus, P. turrubarensis, L. novemfaciatus, R. bayanus, S. ovale y E. armiger. En muchas especies se pudieron verificar diferencias estacionales en su representación numérica con casos extremos de especies que fueron recolectadas en una estación del año, pero no en la otra.
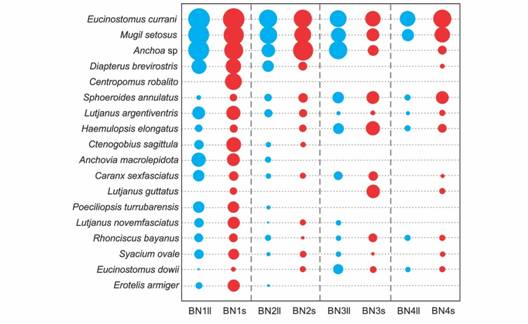
Fig. 3 Fig. 3 Composición de la ictiofauna por sitios y estaciones (ll = lluvia; s = seca), en la laguna Barra de Navidad, México. Se muestran las especies más abundantes que suman el 95 % del total de individuos (abreviaturas definidas en la Tabla 2). Los diámetros de los círculos son proporcionales al logaritmo del número de individuos. Composition of the ichthyofauna by sites and seasons (ll = rainy; s = dry) in the Barra de Navidad lagoon, Mexico. Most abundant species adding to 95 % of total individuals are shown (acronyms defined in Table 2). Circles have diameters proportional to logarithm of number of individuals.
El modelo RDA ajustado explicó el 18.1 % de la variación total en los datos de especies (Tabla 4). El primer eje canónico fue significativo (F = 6.928, P = 0.001) y explicó el 50.4 % de la relación especies-ambiente. El segundo eje canónico también fue significativo (F = 3.581, P = 0.025) pero explicó un porcentaje más bajo (22.2 %) de la relación especies-ambiente.
TABLA 4 TABLE 4 Análisis de redundancia Redundancy analysis
| Sumario de la ordenación de los ejes | 1 | 2 | 3 | 4 |
| Valores propios | 0.091 | 0.040 | 0.032 | 0.013 |
| Correlación especies-ambiente | 0.768 | 0.637 | 0.575 | 0.398 |
| Porcentaje de varianza acumulada | ||||
| Datos de especie | 9.1 | 13.1 | 16.3 | 17.6 |
| Relación especies-ambiente | 50.4 | 72.6 | 90.3 | 97.5 |
| Suma de todos los valores propios | 1.000 | |||
| Suma de todos los valores propios canónicos | 0.181 |
El gráfico conjunto (“biplot”) de muestras y variables ambientales (Fig. 4) mostró una ordenación de muestras a lo largo del primer eje canónico. Este eje está altamente correlacionado con el porcentaje de lodo y materia orgánica en los sedimentos y se correlaciona negativamente con el porcentaje de arena, lo que se puede interpretar como un gradiente de disminución del tamaño de partículas. La proyección de las muestras sobre este eje permite identificar dos grupos claramente diferenciados de sitios; un grupo está formado por los sitios BN1 y BN2 donde predomina un fondo lodoso y un segundo grupo incluye a los sitios BN3 y BN4 donde el sustrato es principalmente arenoso (y en algunos casos tiene una fracción importante de grava). Esto demuestra claramente un importante componente espacial de variabilidad. El segundo eje está relacionado positivamente con la salinidad y negativamente con la temperatura. Esto se refleja en el 38.3 % de las muestras durante la temporada de seca y que se encuentran en los cuadrantes superiores. Este eje refleja un segundo gradiente más débil relacionado con el cambio estacional. Un “biplot” de especies y variables ambientales (Fig. 4) permitió definir dos grupos principales de especies. Un primer grupo altamente correlacionado con el eje principal y que incluyó cuatro de las cinco especies más abundantes (E. currani, M. setosus, D. brevirostris y C. robalito). El segundo grupo se correlacionó negativamente con el primer eje e incluyó las especies H. elongatus, S. annulatusE. dowii y R. bayanus como las más significativas. Estas especies se presentan con una abundancia relativamente baja en comparación al primer grupo. La especie L. guttatus y la tercera en abundancia, Anchoa sp., mostraron una correlación alta con el segundo eje. Un patrón similar pero correlacionado negativamente con el segundo eje se observa en la especie poco abundante C. sexfasciatus.
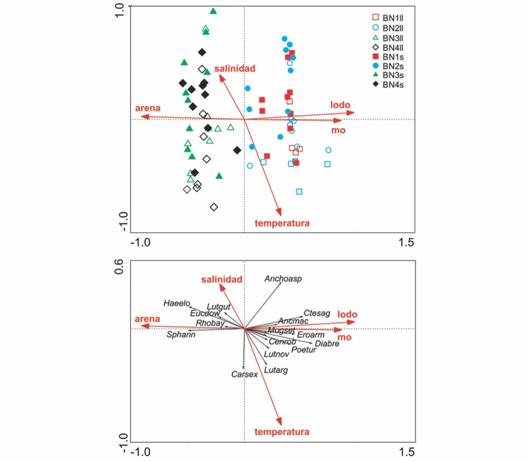
Fig. 4 Fig. 4 Gráficos conjuntos de A. variables abióticas con sitios y estaciones (ll = lluvia, s = seca) y B. variables abióticas con especies basados en los resultados del análisis de redundancia, en la laguna Barra de Navidad, México. Biplots of A. abiotic variables and sites and seasons (ll = rainy, s = dry) and B. abiotic variables and species based on the results of redundancy analysis, in the Barra de Navidad lagoon, Mexico.
Discusión
La composición general de la ictiofauna de zonas someras encontrada en el presente estudio coincide bien con lo encontrado por otros autores en sistemas estuarinos de la costa mexicana del Pacífico. Diversos estudios plantean que las especies predominantes en estos ecosistemas variables pertenecen a las familias Gerreidae (Castillo-Rivera et al., 2005; Rodríguez-Romero et al., 2011; Aguirre-León et al., 2014; González-Sansón et al., 2016; Cabrera et al., 2018; Romero-Berny, Velázquez-Velázquez, Schmitter-Soto, & Salgado-Ugarte, 2020); Mugilidae (Cabral-Solis & Espino-Barr, 2004; Castellanos-Galindo, Krumme, Rubio, & Saint-Paul, 2013; González-Sansón et al., 2018); Centropomidae (Álvarez-Rubio, Amezcua-Linares, & Yáñez-Arancibia, 1986; Díaz-Ruiz et al., 2006) y Engraulidae (González-Acosta et al., 2005, Castellanos-Galindo et al., 2013; Padilla-Serrato et al., 2017). Las especies de estas familias presentan un amplio rango de tolerancia a los cambios de salinidad (Mendoza et al., 2009) y tienen una distribución circunglobal, en áreas templadas y tropicales (Nelson et al., 2016).
La laguna Barra de Navidad pudiera considerarse como un hábitat importante de peces juveniles debido al gran número de individuos capturados que presentaban una talla muy por debajo de la longitud de primera maduración reportado en la literatura. La abundancia alta de especies en fase juvenil encontradas en este trabajo refuerza el criterio de la función de área de crianza potencial de este sistema, argumento que ha sido planteado por otros autores para este y otros ecosistemas estuarinos (Álvarez-Rubio et al., 1986; Acevedo, 1997; Nagelkerken et al.,2001; González-Acosta et al.,2005; Amezcua et al., 2006; Rodríguez-Romero et al., 2011; González-Sansón et al., 2014; González-Sansón et al., 2016; Cabrera et al., 2018).
La tendencia al incremento del número de especies y una representación numérica mayor en época de secas, encontrada en esta investigación, pudiera estar asociada a un incremento de la salinidad, que permite el ingreso al sistema de especies marinas más estenohalinas. Por otra parte, la aparición casi exclusiva en el sitio BN1 de especies más afines con salinidades bajas o agua dulce como son C. sagittula, P. turrobarensis y E. armiger indica también una influencia de esta variable en la distribución de los peces en este sistema estuarino. Numerosos estudios han encontrado que la salinidad constituye el principal factor responsable de los cambios estacionales y estructuran las comunidades ícticas (Barletta et al., 2005, Faunce & Serafy, 2006; Sosa-López, Mouillot, Ramos-Miranda, Flores-Hernandez, & Chi, 2007; Selleslagh et al., 2009; Rodríguez-Climent, Caiola, & Ibáñez, 2013; Kamrani et al., 2016). Sin embargo, la variación estacional de la salinidad documentada en nuestra investigación fue moderada y sugiere una limitada influencia de este factor sobre la composición y abundancia de la ictiofauna estuarina, si se tiene en cuenta que la mayoría de los peces que habitan en la laguna Barra de Navidad presentan alta tolerancia a cambios de salinidad.
La temperatura estuvo relacionada inversamente con la salinidad porque la estación de secas coincide con la etapa invernal y la de lluvias con el verano. Por eso es difícil distinguir por separado el efecto de estos factores en la composición de la ictiofauna. Otros estudios han encontrado que la temperatura constituye uno de los factores causantes de los cambios estacionales en las comunidades de peces (Acevedo, 1997; González-Acosta et al., 2005; Rodríguez-Romero et al., 2011), pero en la presente investigación, la poca variación de la temperatura media entre estaciones (diferencia alrededor de 4 oC) presenta poca relevancia ecológica.
Es común que las comunidades de peces presenten diferencias estacionales en la composición por especies como resultado de los desfases en los tiempos de desove y las migraciones secuenciales de los peces (Castillo-Rivera et al.,2011). Por tanto, la variabilidad estacional en la composición y abundancia de la ictiofauna presente en este trabajo puede estar influenciada por procesos biológicos estacionales como la reproducción, facilitando el reclutamiento de muchas especies en determinada época del año (Barletta et al., 2008; Selleslagh et al., 2009; Sheaves & Johnston, 2009). Estos eventos biológicos actúan de forma sinérgica con los factores abióticos y dificultan una interpretación más completa de los resultados obtenidos, por lo que se hace necesario realizar un estudio del ciclo de vida de las especies más abundantes en esta laguna.
Los resultados obtenidos muestran que el tipo de sedimento y el contenido de materia orgánica influyen notablemente en la abundancia y composición por especies de la ictiofauna en la laguna en las zonas someras cerca de la orilla. La influencia del sustrato en la distribución espacial de invertebrados y peces ha sido documentada por varios autores (Anderson, 2008; Selleslagh et al., 2009; Rodríguez-Romero et al., 2011; Reis-Filho & de Alcântara Santos,2014; González-Sansón et al., 2016; González-Sansón et al., 2018). El incremento en número de individuos y abundancia de especies de peces en los sitios donde el sustrato es lodoso y presenta alto por ciento de materia orgánica, pudiera estar estrechamente relacionado con la alimentación; esta tendencia ha sido planteada por Rodríguez-Romero et al., (2011) en una laguna costera en Baja California Sur. Numerosos autores argumentan la alta dependencia de los invertebrados bentónicos al tipo de sustrato y a los nutrientes de origen orgánico (Acevedo, 1997; Vinagre, Fonseca, Cabral, & Costa, 2006; Franco et al., 2006; Anderson, 2008; Van der Wal et al,2008; Alves, Sutherland, & Gill, 2012, Van Colen et al., 2014). En general, la mayoría de las especies capturadas en esta investigación se alimentan de invertebrados bentónicos y peces pequeños, y estos últimos, a su vez, tienen a los invertebrados pequeños como componente principal en su dieta (Álvarez-Rubio et al., 1986; Arenas-Granados & Acero, 1992; Cruz-Agüero, Arellano-Martínez, Cota-Gómez, & Cruz-Agüero,1997; Bussing, 1998; Flores-Ortega et al,2015; Padilla-Gutiérrez, González-Sansón, Aguilar-Betancourt, & Flores-Ortega, 2020). Otras especies de peces se alimentan de detrito (González-Sansón et al., 2016). Se puede asumir, por tanto, que la distribución de los peces está respondiendo a la distribución de su fuente principal de alimento. El sustrato podría influir también de otras formas que no están relacionadas directamente con la presencia y abundancia de organismos presas. Tal es el caso de una especie de lenguado (S. ovale), en la cual su distribución espacial podría estar fuertemente relacionada con la conducta de enterrarse en el fondo lodoso para escapar de los depredadores (Selleslagh et al., 2009).
En resumen, la composición granulométrica del sedimento y el contenido de materia orgánica del mismo, constituyen los factores abióticos con mayor influencia en las variaciones espaciales de la composición y abundancia de la ictiofauna en las zonas más someras de la laguna Barra de Navidad. Por otro lado, las variaciones estacionales de la temperatura y salinidad presentan menor influencia. Una parte importante de la variación espacio-temporal no pudo ser explicada por las variables abióticas. Por ese motivo, se puede asumir que las mismas son probablemente el resultado de una combinación de factores ambientales y biológicos actuando simultáneamente. La alta abundancia de peces juveniles demuestra la importancia de este sistema estuarino y de su función como área de crianza potencial en el completamiento del ciclo de vida de muchas de las especies dependientes de este ecosistema.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

