Introducción
Los estudios de los ciclos anuales en aves neotropicales adquieren cada vez una mayor importancia, debido a la amenaza bajo la que se encuentran los ecosistemas prístinos en esta región y a la alta diversidad que albergan, en especial los bosques nublados. Por otro lado, las aves presentan patrones estacionales definidos en su reproducción, muda y otras actividades (Skutch, 1950; Snow & Snow, 1964; Ward, 1969; Fogden, 1972; Stiles, 1975, Stiles,1980, Stiles,1985, Stiles,1995). El conflicto de estas demandas se encuentra relacionado con la disponibilidad de recursos, definiendo el ciclo anual de una especie (Gill, 2005). Por esto el uso de nectarívoros para investigar dicho ciclo resulta ventajoso, ya que a pesar de que una parte de su dieta está constituida por artrópodos, los recursos críticos en términos de sus ciclos de vida son las flores (Stiles, 1975), actuando además como polinizadores muy eficientes (Stiles, 1980). En este sentido se han realizado numerosos estudios de las comunidades de colibríes en diversos países del neotrópico, como Colombia, Costa Rica, Bolivia, Brasil, Peru (Stiles, 1978; Snow 1980; Sazima, Buzato, & Sazima, 1996; Dalsgaard et al., 2009; Las-Casas, Azevedo Júnior, & Dias Filho, 2012; González & Loiselle, 2016, entre muchos otros); sin embargo, este es el primer estudio de este tipo para Venezuela.
El Paso de Portachuelo es un abra utilizado por una gran diversidad de especies de aves, bien sea como residentes o durante movimientos estacionales o migratorios. Se han reportado más de 300 especies de aves para esta localidad, y solo para la familia Trochilidae se han reportado 32 especies (Lentino, M., 2020, datos sin publicar). El objetivo de este trabajo consistió en estudiar las variaciones en la abundancia y composición dinámica anual del ensamble de colibríes que utiliza el Paso de Portachuelo a lo largo del tiempo.
Materiales y métodos
Área de estudio: El área donde se realizaron los muestreos es el Paso de Portachuelo, en el Parque Nacional Henri Pittier, ubicado a unos 12 Km de Maracay, una de las ciudades con mayor desarrollo urbanístico de Venezuela. Este Paso se encuentra a 1 136 m de altura, a unos trescientos metros de la Estación Biológica de Rancho Grande (10° 21’ 30” N, 67° 38’ 13.37” W). El clima de la zona es biestacional, con una estación seca de diciembre a marzo y una lluviosa de abril a noviembre (Huber, 1986). La carretera Maracay-Ocumare, cruza la Cordillera de la Costa en el Paso Portachuelo, el cual es un Paso para las aves migratorias que vienen de Norteamérica (Lentino, Rodríguez, Malave, Rojas, & García, 2016).
Periodos de muestreo: El ensamble de colibríes se caracterizó en términos de riqueza, abundancia y composición. Para ello, se realizaron muestreos de su avifauna durante dos periodos de tiempo: marzo 1990 - diciembre 1994, y junio 2010 - noviembre 2013. Se realizaron salidas de campo mensuales de tres días de duración, para cuantificar la variación mensual de las abundancias por especie y de toda la familia.
Muestreo: En cada muestreo se colocaron entre cinco y ocho redes de neblina de 12 metros de largo y 1.8 metros de altura, las cuales operaban desde las 06:00 am hasta las 05:30 pm. Para cada ejemplar capturado se reportó: fecha, hora de captura, localidad y ubicación de la red, tomando en cuenta el lado de la red donde el individuo fue localizado (norte o sur), seguidamente se determinó su sexo y edad.
Análisis de datos: Se calculó el número de horas red. Como convención, una hora de una red abierta de tamaño estándar (12 x 2.5 m) constituye 1 hora-red (Ralph, Geupel, Pyle, Martin, DeSante, & Milá, 1996). También se calculó la abundancia relativa por especie por año de muestreo y por mes.
Cálculo del índice SOI: El SOI o “índice de oscilación sur” mide la Oscilación del Sur al correlacionar valores de presión atmosférica obtenidos en el Pacífico occidental con los del Pacífico central. Valores negativos del SOI indican años Niño y valores positivos se asocian con años Niña (Australian Goverment Burou of Meteorology, 2017), de acuerdo a la siguiente formula:SOI = 10[Pdif − Pdifav]/SD(Pdif)
Pdif = (promedio en Tahiti MSLP de un mes) - (promedio en Darwin MSLP de un mes), MSLP = Es una estandarización fuera de una función normal de la Diferencia Marina de Nivel de Presión Media entre Tahití y Darwin.
Pdifav P difav = promedio del “Pdif” para el mes SD Pdif = desviación estándar de largo término de “Pdif” para el mes Tomado de Australian Goverment Burou Meteorology (2017).
Para el análisis estadístico de los datos se utilizó una Permanova (Permutacional Manova)(Clarke & Gorley, 2006), la cual corresponde a una prueba multivariada no paramétrica que compara grupos de variables, cuya hipótesis nula es que los centroides y la dispersión de los datos es equivalente para todos los grupos, el rechazo de dicha hipótesis asume que el centroide es diferente entre grupos (Anderson, 2001). Para estos análisis, se realizaron dos pruebas donde se agruparon los datos de maneras diferentes, en uno de los análisis cada año de muestreo constituyo una muestra, y en el otro se analizaron por bloques de 5 años. Adicionalmente se comparó la abundancia relativa de los colibríes con el índice SOI utilizando un ANDEVA, y se correlacionaron ambas variables con un Coeficiente de correlación de Spearman.
Resultados
A lo largo de los años de muestreo se capturaron 14 685 individuos, pertenecientes a 25 especies (Tabla 1). En base a la abundancia relativa por especie en cada uno de los meses de muestreo se separó el ensamble en cuatro grupos: A- Colibríes con abundancias altas: Aglaiocercus kingi, Chalybura buffoni, Chrysuronia oenone, Coeligena coeligena, Heliodoxa leadbeateri y Sternoclyta cyanopectus, estas especies fueron las más abundantes y se consiguen durante todo o la mayor parte del año(Fig. 1A y Fig. 1B, Tabla 2 y Tabla 3). B- Colibríes con abundancias bajas: Adelomyia melanogenys, Amazilia tobaci, Campylopterus falcatus, Chlorostilbon mellisugus, Colibrí delphinae, Florisuga mellivora, Klais guimeti, Ocreatus underwoodii, Schistes geoffroyi (Fig. 2, Tabla 4). C- Colibríes raros: Anthracothorax nigricolis, Chaetocercus jourdanii, Chrysolampis mosquitus, Colibri coruscans, Colibri cyanotus (Fig. 3). D- Phaethornithinae: Glaucis hirsuta, Phaethornis augusti, Phaethornis anthophilus y Phaethornis striigularis (Fig. 4, Tabla 5).
TABLA 1 TABLE 1 Especies de colibríes capturadas en el Paso de Portachuelo durante los periodos de muestreo de 1991-1994 y de 2010-2013 Hummingbird species captured in the Portachuelo Pass during the samplings from 1991-1994 and 2010-2013
| Especie | N 1991-1994 | N 2010-2013 |
| Sternoclyta cyanopectus | 1 048 | 437 |
| Heliodoxa leadbeateri | 605 | 202 |
| Chrysuronia oenone | 846 | 112 |
| Aglaiocercus kingi | 251 | 61 |
| Amazilia tobaci | 201 | 61 |
| Chalybura buffoni | 132 | 37 |
| Coeligena coeligena | 135 | 34 |
| Schistes geoffroyi | 39 | 21 |
| Klais guimeti | 14 | 12 |
| Ocreatus underwoodii | 40 | 9 |
| Campylopterus falcatus | 77 | 7 |
| Chlorestes notatus | 327 | 7 |
| Glaucis hirsuta | 114 | 6 |
| Adelomyia melanogenys | 57 | 4 |
| Phaethornis striigularis | 0 | 5 |
| Colibri delphinae | 18 | 2 |
| Phaethornis augusti | 0 | 2 |
| Anthracothorax nigricollis | 10 | 1 |
| Chaethocercus jourdanii | 2 | 1 |
| Chrysolampis mosquitus | 8 | 1 |
| Colibri coruscans | 3 | 1 |
| Colibri thalassinus | 7 | 1 |
| Florisuga mellivora | 73 | 1 |
| Lophornis stictolophus | 9 | 1 |
| Phaethornis anthophillus | 0 | 1 |
TABLA 2 TABLE 2 Número de individuos / horas red de las especies más frecuentes del ensamble de colibríes del Paso de Portachuelo durante los periodos de muestreo de 1991-1994 Number of individuals / hours net of most frequent species of the hummingbird assemblage in Portachuelo Pass Pass during the samplings from 1991-1994
| Año | Meses | Aglaiocercus kingi | Chalybura buffoni | Chrysuronia oenone | Coeligena coeligena | Heliodoxa leadbeateri | Sternoclyta cyanopectus |
| 1991 | Enero | 0.017 | 0.004 | 0.007 | 0.011 | 0.026 | 0.059 |
| Febrero | 0.007 | 0.004 | 0.013 | 0.007 | 0.020 | 0.059 | |
| Marzo | 0.022 | 0.000 | 0.025 | 0.006 | 0.043 | 0.071 | |
| Abril | 0.008 | 0.000 | 0.024 | 0.008 | 0.038 | 0.020 | |
| Mayo | 0.009 | 0.003 | 0.003 | 0.003 | 0.008 | 0.014 | |
| Junio | 0.012 | 0.002 | 0.022 | 0.011 | 0.017 | 0.028 | |
| Julio | 0.009 | 0.002 | 0.023 | 0.014 | 0.014 | 0.042 | |
| Agosto | 0.007 | 0.002 | 0.024 | 0.004 | 0.020 | 0.024 | |
| Septiembre | 0.027 | 0.044 | 0.032 | 0.009 | 0.035 | 0.044 | |
| Octubre | 0.005 | 0.002 | 0.031 | 0.002 | 0.010 | 0.021 | |
| Noviembre | 0.019 | 0.000 | 0.176 | 0.009 | 0.042 | 0.079 | |
| 1992 | Enero | 0.006 | 0.000 | 0.009 | 0.000 | 0.032 | 0.083 |
| Febrero | 0.000 | 0.000 | 0.000 | 0.000 | 0.014 | 0.028 | |
| Marzo | 0.019 | 0.007 | 0.007 | 0.014 | 0.046 | 0.046 | |
| Abril | 0.013 | 0.012 | 0.063 | 0.039 | 0.083 | 0.074 | |
| Mayo | 0.003 | 0.002 | 0.014 | 0.014 | 0.023 | 0.023 | |
| Junio | 0.000 | 0.005 | 0.019 | 0.005 | 0.009 | 0.023 | |
| Julio | 0.012 | 0.000 | 0.023 | 0.005 | 0.046 | 0.111 | |
| Septiembre | 0.006 | 0.003 | 0.090 | 0.003 | 0.083 | 0.142 | |
| Octubre | 0.005 | 0.005 | 0.058 | 0.001 | 0.018 | 0.030 | |
| Noviembre | 0.019 | 0.006 | 0.147 | 0.006 | 0.019 | 0.057 | |
| 1993 | Marzo | 0.037 | 0.000 | 0.015 | 0.013 | 0.059 | 0.074 |
| Abril | 0.019 | 0.002 | 0.009 | 0.014 | 0.037 | 0.042 | |
| Junio | 0.003 | 0.002 | 0.005 | 0.002 | 0.015 | 0.024 | |
| Julio | 0.000 | 0.009 | 0.000 | 0.009 | 0.019 | 0.009 | |
| Agosto | 0.014 | 0.005 | 0.014 | 0.005 | 0.023 | 0.051 | |
| Septiembre | 0.006 | 0.000 | 0.025 | 0.000 | 0.015 | 0.028 | |
| Octubre | 0.009 | 0.011 | 0.071 | 0.002 | 0.031 | 0.056 | |
| Noviembre | 0.004 | 0.008 | 0.062 | 0.000 | 0.012 | 0.038 | |
| 1994 | Enero | 0.006 | 0.000 | 0.000 | 0.000 | 0.015 | 0.003 |
| Febrero | 0.014 | 0.000 | 0.009 | 0.023 | 0.046 | 0.060 | |
| Marzo | 0.019 | 0.005 | 0.019 | 0.005 | 0.037 | 0.088 | |
| Abril | 0.009 | 0.003 | 0.009 | 0.003 | 0.012 | 0.019 | |
| Mayo | 0.006 | 0.006 | 0.019 | 0.006 | 0.019 | 0.065 | |
| Junio | 0.002 | 0.007 | 0.007 | 0.002 | 0.007 | 0.025 | |
| Agosto | 0.002 | 0.000 | 0.007 | 0.002 | 0.024 | 0.009 | |
| Septiembre | 0.019 | 0.003 | 0.059 | 0.000 | 0.034 | 0.059 | |
| Octubre | 0.009 | 0.002 | 0.004 | 0.003 | 0.019 | 0.066 |
TABLA 3 TABLE 3 Número de individuos / horas red de las especies más frecuentes del ensamble de colibríes del Paso de Portachuelo durante los periodos de muestreo de 2010-2013 Number of individuals / hours net of most frequent species of the hummingbird assemblage in Portachuelo Pass Pass during the samplings from 2010-2013
| Año | Mes | Aglaiocercus kingi | Chalybura buffoni | Chrysuronia oenone | Coeligena coeligena | Heliodoxa leadbeateri | Sternoclyta cyanopectus |
| 2010 | Junio | 0.007 | 0.025 | 0.004 | 0.000 | 0.018 | 0.054 |
| Julio | 0.004 | 0.004 | 0.007 | 0.004 | 0.022 | 0.123 | |
| Agosto | 0.004 | 0 | 0 | 0 | 0 | 0.036 | |
| Septiembre | 0.008 | 0.004 | 0.032 | 0.003 | 0.029 | 0.054 | |
| Octubre | 0.002 | 0.001 | 0.016 | 0.001 | 0.008 | 0.024 | |
| 2011 | Enero | 0.014 | 0.004 | 0.014 | 0.000 | 0.011 | 0.047 |
| Febrero | 0.018 | 0.007 | 0.025 | 0.018 | 0.025 | 0.080 | |
| Abril | 0 | 0 | 0.018 | 0.004 | 0.033 | 0.018 | |
| Mayo | 0.000 | 0.004 | 0.008 | 0.008 | 0.020 | 0.036 | |
| Junio | 0.011 | 0 | 0.000 | 0.000 | 0.025 | 0.011 | |
| Julio | 0.000 | 0 | 0.000 | 0.011 | 0.054 | 0.040 | |
| Septiembre | 0.006 | 0.010 | 0.015 | 0.001 | 0.022 | 0.049 | |
| Octubre | 0.001 | 0.006 | 0.014 | 0.001 | 0.014 | 0.022 | |
| Noviembre | 0.004 | 0.016 | 0.088 | 0.000 | 0.044 | 0.156 | |
| Diciembre | 0.016 | 0 | 0.020 | 0.000 | 0.016 | 0.068 | |
| 2012 | Enero | 0.012 | 0.016 | 0.008 | 0.020 | 0.040 | |
| Febrero | 0.008 | 0.004 | 0.004 | 0.016 | 0.012 | 0.044 | |
| Mayo | 0.018 | 0.000 | 0.000 | 0.007 | 0.036 | 0.072 | |
| Junio | 0.004 | 0.000 | 0.007 | 0.018 | 0.080 | 0.094 | |
| Julio | 0.004 | 0.000 | 0.022 | 0.004 | 0.043 | 0.094 | |
| Septiembre | 0 | 0.005 | 0.014 | 0.000 | 0.014 | 0.045 | |
| Octubre | 0.003 | 0.013 | 0.010 | 0.001 | 0.022 | 0.059 | |
| 2013 | Febrero | 0.042 | 0.000 | 0.000 | 0.008 | 0.033 | 0.150 |
| Marzo | 0.021 | 0.000 | 0.010 | 0.021 | 0.052 | 0.094 | |
| Abril | 0.013 | 0.020 | 0.033 | 0.013 | 0.013 | 0.060 | |
| Mayo | 0.017 | 0.017 | 0.000 | 0.026 | 0.035 | 0.061 | |
| Junio | 0.034 | 0.023 | 0.017 | 0.000 | 0.091 | 0.069 | |
| Julio | 0.000 | 0.011 | 0.033 | 0.005 | 0.060 | 0.103 | |
| Agosto | 0.029 | 0.006 | 0.018 | 0.000 | 0.065 | 0.124 | |
| Septiembre | 0.004 | 0.007 | 0.035 | 0.002 | 0.030 | 0.133 | |
| Octubre | 0.002 | 0.007 | 0.029 | 0.000 | 0.016 | 0.125 | |
| Noviembre | 0.015 | 0.000 | 0.015 | 0.000 | 0.088 | 0.162 |
TABLA 4 TABLE 4 Número de individuos / horas red de las especies poco abundantes del ensamble de colibríes del Paso de Portachuelo durante los periodos de muestreo de 2010-2013 Number of individuals / hours net of low abundance species on the assemblage of hummingbirds in Portachuelo Pass during the samplings from 2010-2013
| Año | Mes | Adelomiya melanogenys | Amazilia tobaci | Klais guimeti | Ocreatus underwoodii | Schistes geoffroyi | Campylopterus falcatus | Chlorostilbon notatus | Colibri delphinae | Florisuga mellivora |
| 2010 | Junio | 0 | 0.011 | 0 | 0.011 | 0.011 | 0.004 | 0 | 0 | 0 |
| Julio | 0 | 0 | 0 | 0 | 0 | 0 | 0.004 | 0 | 0 | |
| Agosto | 0 | 0.0036 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Septiembre | 0.0008 | 0.0017 | 0.003 | 0.003 | 0.001 | 0.007 | 0.003 | 0 | 0 | |
| Octubre | 0 | 0 | 0.002 | 0.001 | 0.002 | 0.003 | 0.001 | 0 | 0.001 | |
| 2011 | Enero | 0 | 0 | 0 | 0.004 | 0.007 | 0.000 | 0 | 0 | 0.004 |
| Febrero | 0 | 0 | 0.004 | 0 | 0.004 | 0.004 | 0.004 | 0 | 0 | |
| Abril | 0 | 0 | 0 | 0 | 0.011 | 0 | 0.000 | 0.004 | 0 | |
| Mayo | 0 | 0.008 | 0 | 0 | 0.004 | 0 | 0.000 | 0 | 0 | |
| Junio | 0 | 0.0036 | 0 | 0 | 0 | 0.004 | 0.000 | 0 | 0 | |
| Julio | 0 | 0.0109 | 0 | 0 | 0 | 0 | 0.000 | 0 | 0 | |
| Septiembre | 0.0004 | 0 | 0.0004 | 0 | 0.0017 | 0.0013 | 0.003 | 0.0004 | 0.001 | |
| Octubre | 0 | 0 | 0.0007 | 0 | 0.0015 | 0.0015 | 0.005 | 0 | 0.001 | |
| Noviembre | 0 | 0 | 0.004 | 0 | 0 | 0.004 | 0 | 0 | 0 | |
| Diciembre | 0 | 0.008 | 0.012 | 0.004 | 0.004 | 0.004 | 0.008 | 0.004 | 0 | |
| 2012 | Enero | 0 | 0 | 0 | 0.004 | 0.004 | 0 | 0 | 0 | 0 |
| Febrero | 0 | 0 | 0.008 | 0 | 0.004 | 0.008 | 0 | 0 | 0 | |
| Mayo | 0 | 0 | 0 | 0 | 0.014 | 0 | 0 | 0 | 0 | |
| Julio | 0 | 0.0072 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Septiembre | 0.001 | 0.0013 | 0.003 | 0.003 | 0.001 | 0.001 | 0.001 | 0.0003 | 0.0007 | |
| Octubre | 0 | 0.0029 | 0 | 0 | 0.0029 | 0.0029 | 0.0014 | 0 | 0 | |
| 2013 | Febrero | 0.008 | 0 | 0.008 | 0 | 0 | 0 | 0 | 0 | 0 |
| Marzo | 0 | 0 | 0.010 | 0.021 | 0 | 0 | 0 | 0 | 0 | |
| Abril | 0 | 0 | 0 | 0 | 0.013 | 0 | 0 | 0 | 0 | |
| Mayo | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Junio | 0.011 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Julio | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| Agosto | 0.006 | 0 | 0 | 0.005 | 0 | 0 | 0.006 | 0 | 0 | |
| Septiembre | 0.0008 | 0.0008 | 0.0008 | 0 | 0.0008 | 0.0025 | 0.0033 | 0.0008 | 0.0008 | |
| Octubre | 0.0000 | 0.0004 | 0.0004 | 0.0004 | 0.0000 | 0.0018 | 0.0040 | 0 | 0.0004 |
TABLA 5 TABLE 5 Número de individuos / horas red de las especies de Phaeornithinae del ensamble de colibríes del Paso de Portachuelo durante los periodos de muestreo de 2010-2013 Number of individuals / hours net of Phaeornithinae species on the assemblage of hummingbirds in Portachuelo Pass during the samplings from and 2010-2013
| Año | Meses | Glaucis hirsuta | Phaethornis augusti | Phaethornis anthophilus | Phaethornis striigularis |
| 2010 | Junio | 0.000 | 0 | 0 | 0.004 |
| Julio | 0.004 | 0 | 0 | 0 | |
| Septiembre | 0.003 | 0 | 0 | 0.001 | |
| Octubre | 0.001 | 0 | 0 | 0 | |
| 2011 | Enero | 0 | 0 | 0 | 0 |
| Febrero | 0 | 0 | 0 | ||
| Abril | 0 | 0 | 0 | 0 | |
| Mayo | 0 | 0.007 | 0 | 0 | |
| Junio | 0 | 0.000 | 0 | 0 | |
| Julio | 0 | 0.000 | 0.001 | 0 | |
| Septiembre | 0.001 | 0 | 0.0004 | ||
| Octubre | 0.003 | 0 | 0 | ||
| Noviembre | 0.004 | 0 | 0 | 0 | |
| Diciembre | 0 | 0 | 0 | 0.004 | |
| 2012 | Enero | 0 | 0 | 0 | 0 |
| Febrero | 0 | 0 | 0 | 0 | |
| Mayo | 0.0072 | 0 | 0 | 0 | |
| Junio | 0 | 0 | 0 | 0 | |
| Julio | 0.004 | 0 | 0 | 0 | |
| Septiembre | 0.001 | 0 | 0.0007 | ||
| Octubre | 0.004 | 0 | 0 | 0 | |
| 2013 | Febrero | 0 | 0 | 0 | 0 |
| Marzo | 0 | 0 | 0 | 0 | |
| Abril | 0 | 0 | 0 | 0 | |
| Mayo | 0 | 0 | 0 | 0 | |
| Junio | 0 | 0 | 0 | 0.006 | |
| Julio | 0 | 0 | 0 | 0 | |
| Agosto | 0 | 0 | 0 | 0.006 | |
| Septiembre | 0.003 | 0 | 0 | 0 | |
| Octubre | 0.003 | 0 | 0 | 0 |
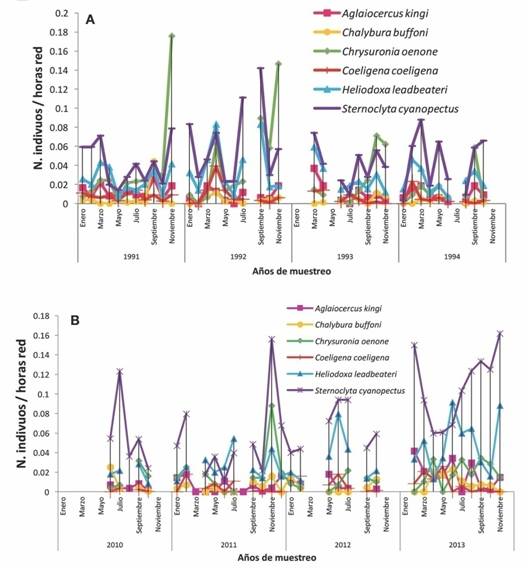
Fig. 1 Fig. 1 Abundancias de las especies más frecuentes del ensamble de colibríes del Paso de Portachuelo durante los periodos de muestreo A) 1991-1994 y B) 2010-2013. Abundance of the most frequent species of hummingbirds in the assemblage of Portachuelo Pass during the samplings from A) 1991-1994 and B) 2010-2013.
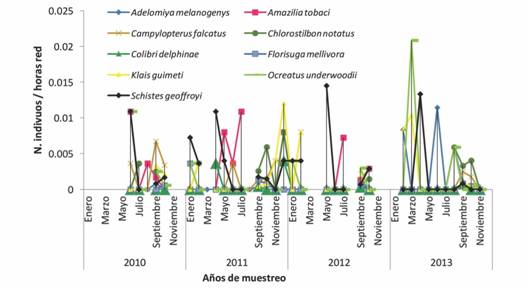
Fig. 2 Fig. 2 Especies que presentan abundancias bajas en el ensamble de colibríes en el Paso de Portachuelo durante el periodo de muestreo 2010-2013. Species that present low abundances in the hummingbird assemblage of Portachuelo Pass during the samplings from 2010-2013.
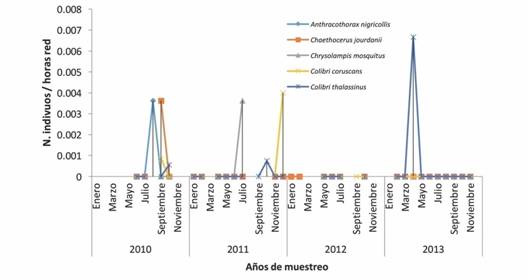
Fig. 3 Fig. 3 Abundancias de especies raras en el ensamble del Paso de Portachuelo durante el periodo de muestreo 2010-2013. Abundance of rare species in the hummingbird assemblage of Portachuelo Pass during the samplings from 2010-2013.
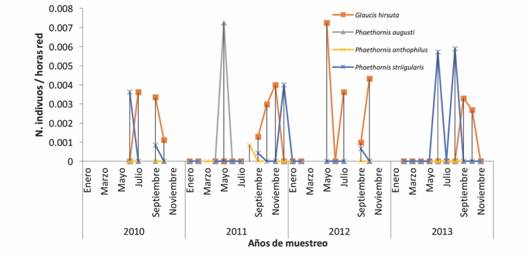
Fig. 4 Fig. 4 Abundancias de las especies pertenecientes a la subfamilia Phaethornithinae del Paso de Portachuelo durante el periodo de muestreo 2010-2013. Abundance of species that belong to subfamily Phaethornithinae of the Portachuelo Pass during the samplings from 2010-2013.
En cuanto al análisis de los años de muestreo, el que presentó una mayor abundancia fue el 1991, seguido del 2013. Dentro de cada año se observaron variaciones en cuanto a la abundancia registrada durante los meses, en general los de mayor abundancia fueron octubre y noviembre. Los análisis de Permanova indican que existe diferencias significativas entre las comunidades de colibríes a lo largo de los años de muestreo, con un p=0.0001, así como también se encontraron diferencias significativas al analizar los años por bloques (p=0.0001).
Para las especies mayoritarias, la más abundante fue S. cyanopectus en ambos periodos de muestreo (Fig. 1A y Fig. 1B). En esta especie se observaron altas abundancias en julio excepto para el 2012. Para H. leadbeateri se observaron máximos en julio y noviembre durante el 2010 y 2011; para junio 2012 y junio y noviembre 2013, siendo este último el año donde se presentó una mayor abundancia. C. oenone presentó dos máximos en octubre de 1991 y 1992, sobrepasando incluso a la especie mayoritaria el resto de los meses, S. cyanopectus; mientras que para los muestreos entre 2002 y 2013, se observó un máximo en septiembre 2011. Para C. coeligena, su año de mayor abundancia fue el 2013, presentando máximos en febrero 2011, mientras que para el 2012 vemos dos máximos, en junio y en noviembre. Es de resaltar que las abundancias de todas las especies mayoritarias fueron mucho mayores durante el periodo 1991-1994 que entre el 2010-2013 (Tabla 1).
En cuanto a los colibríes de menor abundancia, S. geoffroyi fue uno de los más comunes a lo largo de los cuatro años de muestreo. O. underwoodi tuvo sus mayores abundancias en marzo 2013, mientras que K. guimeti en noviembre 2011 y en marzo 2013. F. mellivora tuvo su máximo en junio 2013. A. tobaci tuvo su máximo en mayo y julio 2011 y julio 2012, C. falcatus en septiembre 2012 y C. notatus en octubre 2011. En el caso de C. delphinae, fue uno de los que presentó menores abundancias en este grupo, siendo sus máximos en octubre 2011 y agosto 2013.
En cuanto a la subfamilia Phaethornithinae, no se observó una especie predominante a lo largo de los cuatro años; en lugar de eso, cada especie presentó máximos por año. G. hirsutus fue el que presentó abundancias más uniformes a lo largo del tiempo, con un máximo en mayo de 2012; P. striigularis también estuvo en todos los años de muestreo, aunque en el 2012 solo se capturó en septiembre, y sus máximos estuvieron en mayo y agosto 2013. P. augusti y P. anthophilus se capturo solo para el 2011.
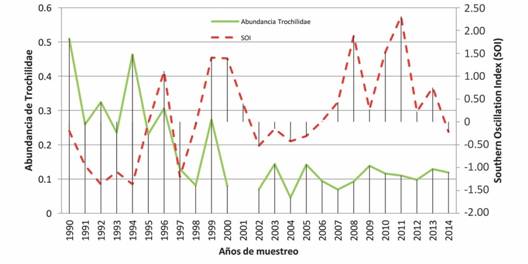
Al observar las abundancias relativas por año por especies (Fig. 5), si comparamos los datos de los años 1990-1994 con los años más recientes, vemos una disminución en la abundancia relativa para las especies de colibríes analizadas. En cuanto a la abundancia de las especies y el índice SOI, se observó que en los años del niño hay una mayor abundancia de colibríes (Fig. 5), sin embargo, no se obtuvieron diferencias estadísticamente significativas, Test ANDEVA, P=0.1029, F=3,005). Finalmente se observó una correlación negativa entre la abundancia total de los colibríes y el índice SOI, pero esta no fue significativa (Correlación linear, r=-0.33017) (Fig. 6).
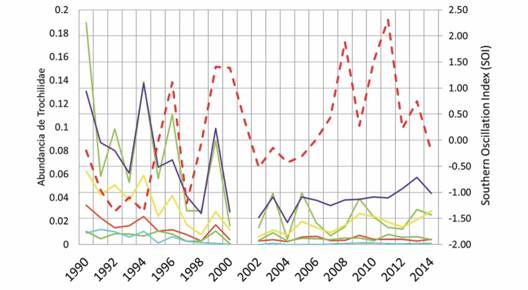
Fig. 5 Fig. 5 Abundancia relativa de los individuos pertenecientes a las especies Aglaiocercus kingi, Chalybura buffoni, Chrysuronia oenone, Coeligena coeligena, Heliodoxa leadbeateri y Sternoclyta cyanopectus en el Paso de Portachuelo, e Indice SOI durante el periodo 1990-2013. Relative abundance of individuals that belong to species Aglaiocercus kingi. Chalybura buffoni. Chrysuronia oenone. Coeligena coeligena, Heliodoxa leadbeateri and Sternoclyta cyanopectus in the Portachuelo Pass, and SOI Index during the period 1990-2013.
Discusión
La riqueza de la familia Trochilidae encontrada en Portachuelo es mayor que la de otros habitas del PN Henri Pittier, como por ejemplo el bosque nublado del Pico Guacamaya, donde se reportaron 13 especies (Verea, Navas, & Solórzano, 2011), o los bosques deciduos de la vertiente sur del Parque, donde se registraron nueve (Verea, Fernández-Badillo, & Solórzano, 2000).
Los resultados obtenidos demuestran que el Paso de Portachuelo constituye una zona que alberga un complejo ensamble de colibríes, siendo este cambiante a lo largo del tiempo. Se observó que, de los cuatro grupos de colibríes encontrados, en el de los más abundantes, las especies predominantes fueron S. cyanopectus y H. leadbeateri. Ambas especies probablemente sean las más abundantes también en toda la comunidad de aves de la zona de estudio. Se ha demostrado que el tamaño en los colibríes favorece la defensa del territorio (Temles, Pan, & Brennan, 2000), lo cual es consistente con que ambas especies son de un tamaño relativamente grande, así como picos largos (Lentino et al., 2016; Malpica, 2014; Indriago, 2016), en comparación con especies raras o menos abundantes, lo cual propicia su abundancia en el Paso de Portachuelo. Adicionalmente, estudios de dieta en la misma localidad para ambas las describen como especies generalistas, debido a la diversidad de plantas que visita en búsqueda de néctar (Malpica, 2014, Indriago, 2016). En general, se obtuvo una mayor abundancia por especie y total durante el periodo de muestreo 1991-1994, con respecto al 2010-2013, este fenómeno ha sido registrado para la zona en otras especies de aves (Lentino et al., 2016; Sainz-Borgo & Lentino, 2012); lo cual es un indicativo de las presiones de origen antrópico que afectan este ecosistema, como aumento en los terrenos urbanizados, deforestación y cambio global (Rodríguez, Rojas-Suárez, & Giraldo Hernández, 2010), que disminuyen biodiversidad del PN Henri Pittier.
Al analizar los resultados por especie vemos que cada una presenta un patrón de abundancia diferente a lo largo del tiempo. Esto podría indicar movimientos estacionales de cada una, además que se debe tomar en cuenta que Portachuelo es un paso migratorio, por lo que probablemente parte de esos individuos capturados se encontraban solo de paso, lo cual hace más variable el patrón de abundancia. Seis de las especies son sumamente abundantes y se registraron durante todo o la mayor parte del año en la zona de estudio (A. kingi, C. buffoni, C. oenone,C. coeligena, H. leadbeateri y S. cyanopectus). En cuanto al segundo grupo, es decir las de abundancias bajas pero que están presentes a lo largo de los años, vemos especies muy comunes en otros hábitats, como es A. tobaci, sumamente común en zonas perturbadas y urbanas (Restall, Rodner, & Lentino, 2006). El resto de las especies de este grupo (C. falcatus,Ch. notatus, F. mellivora, K. guimeti, O. underwoodii y S. geoffroyi), están presentes, aunque también en bajas abundancias en muchos hábitats boscosos del país (Restall et al., 2006). Para F. mellivora se ha señalado que presenta dimorfismo en uso de hábitat con machos más hacia el dosel (Stiles, 1978), del resto de las especies es muy poco lo que se conoce de su biología. Por otra parte, los patrones de abundancia en colibríes probablemente se encuentren muy relacionados con la disponibilidad del néctar, el cual se distribuye de forma estacionaria (Stiles, 1985), lo cual favorece procesos de inmigración, ya que lo individuos presentan una demanda continua de néctar que deben suplir (Feinsinger 1980; Stiles, 1980). Para poder determinar parte de la fuente de estas variaciones en las abundancias sería necesario estudiar la fenología de floración de las plantas visitadas por estas especies al mismo tiempo que se determina la abundancia de los colibríes.
Cuatro de las especies que presentan abundancias bajas (A. melanogenys,C. delphinae,G. hirsuta y P. striigularis), probablemente utilicen la zona de manera estacional, sin embargo, no se tienen registros de desplazamientos a lo largo del territorio; aunque en el caso de C. delphinae, Stiles (1985) si reporta movimientos estacionales para la Estación Biológica La Selva en Costa Rica, y también eran poco abundantes. En este sentido, se ha planteado que los movimientos estacionales podrían ser parte de las estrategias de las especies de colibríes por satisfacer las demandas energéticas, debido a la variación de la disponibilidad del néctar en los diversos hábitats (Stiles, 1980). Por otra parte, las bajas capturas de las especies raras (A. nigricollis,C. jourdanii,C. mosquitus, C. coruscans,C. thalassinus y L. stictolophus) podrían deberse a que no presentan movimientos de desplazamiento y prefieren otros hábitats, encontrándose en Portachuelo de paso u ocasionalmente. En el caso particular de C. thalassinus y A. nigricollis, especies características de dosel, la baja abundancia podría deberse al tipo de muestreo, ya que las redes de neblina tienden a capturar mayormente aves que se desplazan en el sotobosque (Hilty, 2002).
Luego de observar estas variaciones, cabe preguntarse cuáles serían los factores que determinan dichas diferencias en la composición entre especies y en el tiempo. Existe un consenso acerca de que las condiciones climáticas influencian el desarrollo de las plantas, y que los ecosistemas con alta productividad presentan una mayor cantidad de recursos que serán repartidos entre las especies (Evans, Greenwood, & Gaston, 2005). La riqueza se encuentra relacionada aparentemente con la diversidad de tipos de alimento o la disponibilidad de dichos recursos; siendo Trochilidae una de las familias más dependientes de dicha disponibilidad (Abrahamczyk & Kessler, 2010); tal es el caso de las comunidades de colibríes en bosques secos, donde la mayor abundancia en las capturas era en la época de mayor floración (Blake & Loiselle, 1991). Otro de los fenómenos que podría determinar la composición de la comunidad es la competencia entre las diversas especies. Es posible que las especies más abundantes sean dominantes con respecto al resto, en este sentido se ha reportado que un mayor peso, picos más largos y una mayor carga del disco alar determinan la dominancia (Wolf, Stiles, & Hainsworth, 1976; Kodrick Brown & Brown, 1978; Morse 1978; Carpenter et al., 1993; Rico-Guevara y Araya-Salas, 2014; Fernandes, 2018). Comparativamente tanto H. leadbeateri como S. cyanopectus son especies de picos más largos y con mayor peso que muchas de las especies que se encuentran en menos abundancia. Se ha reportado que ambas especies son agresivas y territoriales (Hilty 2002, Restall et al., 2006), y en el caso de H. leadbeateri constituye una de las especies dominantes en comederos artificiales de colibríes en una zona periurbana (Fernandes, 2018).
Con respecto a los resultados de las abundancias por especies, se observó una disminución entre los muestreos de los años noventa y el periodo 2010-2013; al igual que lo observado para las abundancias totales, lo cual puede encontrarse relacionado, como se mencionó anteriormente, con un aumento en las temperaturas debido al cambio climático, entre otros factores (Lentino et al., 2016). Es de destacar la ausencia de correlación entre el índice SOI y las abundancias generales y por especie. En este sentido, aun no se tiene una correlación clara entre las precipitaciones y los años niña, pudiendo oscilar entre periodos secos y lluviosos, de lo que si se tienen evidencias es que en años niña las temperaturas tienden a disminuir (Maturana, Bello, & Manley, 1997), y esto podría generar cambios en la disponibilidad de los parches florales con las consecuentes modificaciones del ensamble de colibríes; sin embargo, este fenómeno no se observó durante los muestreos.
Los ermitaños se diferencian morfológica y ecológicamente del resto de los colibríes, caracterizados por presentar un pico más largo, encontrarse más restringidos a forrajear en zonas sombreadas y que rara vez defienden el territorio; a diferencia del resto de los colibríes, que presentan picos más cortos, ocupan una mayor variedad de hábitats y defienden el territorio agresivamente (Stiles, 1975), por dicha razón se consideraron en este estudio como un grupo aparte del resto. Adicionalmente se ha registrado que los ermitaños a diferencia del resto de los colibríes no suelen abandonar el bosque por disminución de los recursos florales (Stiles, 1978). En el Paso de Portachuelo ningún ermitaño formaba parte de las especies más abundantes, siendo más bien raras; esto podría deberse a que no forman parte de la comunidad de especies residentes de Portachuelo, sino que más bien se encuentran de paso o en “tránsito”. Stiles (1975) plantea que los ermitaños prefieren hábitats abiertos, este sería el caso de P. anthophilus, que no es una especie de bosque nublado (Restall et al., 2006), y sin embargo se cuantifico siete veces durante los muestreos, además todas en octubre, lo cual es un indicativo de que probablemente use Portachuelo como paso, y que hay un patrón de estacionalidad.
Es de destacar que para Pico Guacamaya la especie de colibrí más abundante fue A. kingi, seguido de C. coeligena y de S. cyanopectus (Verea et al., 2011), mientras que para los bosques caducifolios fue C. mellisugus (Verea et al., 2000). Estas diferencias indican que el hábitat con sus diferencias en la oferta de recursos florales, se encuentra determinando la composición del ensamble de los Trochilidae en el área de estudio. Al compararla con otros bosques nublados la riqueza de Portachuelo sigue siendo elevada, como por ejemplo en Colombia, con 16 especies en bosques altoandinos (Toloza-Moreno et al., 2014).
Al comparar los resultados obtenidos con otros estudios de comunidades de colibríes en el neotrópico (Skutch, 1950; Stiles, 1978; Stiles, 1985, en Costa Rica; Snow & Snow, 1964, en Trinidad; Gutiérrez et al., 2004, Rodríguez-Flores & Stiles, 2005 y Toloza-Moreno et al., 2014, en Colombia, entre otros), encontramos que estos se encuentran determinados por la disponibilidad de los recursos florales del bosque; indicando que a mayor precipitación probablemente habrán ciclos anuales, ya que la comunidad de plantas de cada sitio evoluciona como una unidad diferente, donde la presencia de una determinada especie cambia toda la dinámica. En este sentido, para determinar cuáles son las causas que determinan la estructura y dinámica de un ensamble de colibríes, se debería realizar un seguimiento de la abundancia de flores en la zona de estudio y de cuales son consumidas por cada especie de colibrí, sin embargo, es poco el conocimiento que se tiene sobre esto. Por ejemplo, para S. cyanopectus, se ha reportado que su dieta comprende siete especies de plantas monocotiledóneas (Seres & Ramírez, 1995); mientras que Malpica (2014) obtuvo nueve especies, siendo las más representativas: Heliconia bihai, Helicona revoluta y Heliconia acuminata, ambos reportes fueron en elPN Henri Pittier. En el caso de H. leadbeateri, se han registrado también para este parque el consumo de 17 especies de plantas, pertenecientes a 11 familias, la proporción varió a lo largo del año, siendo la familia Heliconiaceae consumida durante todo el período de muestreo, las familias Acanthaceae y Gesnerieaceae se consumieron durante la mayor parte de los meses, mientras que Lorantaceae solo durante dos meses (Indriago, 2016). En cuanto al resto de las especies de colibríes encontradas en Portachuelo, es muy poco lo que se conoce de su dieta y de su biología en general. Es de destacar, que quizás las interacciones de S. cyanopectus y H. leadbeateri con el resto de los colibríes tenga importancia a la hora de la composición del ensamble en la zona de estudio, lo cual es consistente con lo planteado por Gutiérrez et al. (2004), en un estudio sobre la dinámica anual de Trochilidae en Colombia, en el que las características poblacionales de la especie dominante definieron algunos rasgos poblacionales de las especies coexistentes, por efecto de la competencia por el acceso a los recursos florales.
Los resultados de este estudio indican que el ensamble de colibríes del Paso de Portachuelo presenta una mayor riqueza que los de zonas aledañas del PN Henri Pittier y de otros bosques neotropicales, constituyendo un espacio de suma importancia para la conservación de estas especies. Por otra parte, se observó que la dinámica de este ensamble a lo largo del tiempo es sumamente compleja, dominada principalmente por las especies mayoritarias S. caynopectus y H. leadbeateri. Sin embargo, es poca la información que se tiene sobre la disponibilidad a lo largo del tiempo de los recursos florales, los cuales pueden ser el factor determinante en dicha dinámica, por lo cual es necesario una mayor cantidad de estudios en dicha zona sobre las dinámicas de floración y su uso por parte de los colibríes, para comprender cuál es el origen de la variabilidad en las abundancias de las especies a lo largo del tiempo.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio