Introducción
Pteridium aquilinum (L.) Kuhn es un helecho que pertenece a la familia Dennstaedtiaceae, conocido como helecho de potrero o helecho macho (Mora-Alvarado, 2003; Rincón, Díaz, & Gardner, 2016). Se encuentra ampliamente distribuido alrededor del mundo (Le Duc, Pakeman, & Marrs, 2000). P. aquilinum posee amplias capacidades ecológicas: propagación subterránea, gran producción de esporas, alta resistencia al fuego y a la sequía, características que le permiten colonizar lugares inhóspitos, áreas perturbadas y actuar como planta pionera e invasora (Tinklin & Bowling, 1969; Gliessman, 1978; Navar, Fernández, & Del Amor, 1987; Moran, 1993; Dolling, 1999; Watrud et al., 2003; Riege & Del Moral, 2004; Rámirez, Pérez, & Orozco, 2007; Ramirez-Trejo, Pérez-García, Pérez-Salicrup, & Orozco-Segovia, 2010). Esta planta produce metabolitos secundarios con una amplia acción biológica que le confieren propiedades alelopáticas, de defensa contra la herbívoria y antimicrobianas (Gliessman & Muller, 1972, Gliessman & Muller, 1977; Gliessman, 1976; Schereiner, 1981; San Francisco & Cooper-Driver, 1984; Navar et al., 1987; Dawra, Kurade, & Sharma, 2002; Rasmussen, Kroghsbo, Frisvad, & Hansen, 2003; Beniston & Campo, 2005; Selvaraj, De Brito, & Sahayaraj, 2005).
El ciclo de vida de esta especie, consta de dos fases heteromórficas, la esporofítica productora de esporas, que es la dominante y la gametofítica productora de gametos. Debido a que es difícil observar ambas fases del ciclo reproductivo de los helechos en el campo, se ha recurrido al cultivo in vitro como una herramienta para la observación de estas fases y su propagación bajo condiciones controladas y asépticas. (Morel & Wetmore, 1951; Breznovits & Mohay, 1985; Fernández & Revilla, 2003; Juárez-Orozco, Orozco-Segovia, Mendoza-Ruiz, & Pérez-García, 2013). Con lastécnicasin vitro se han estudiado varios aspectos de la biología de P. aquilinum. En la fase gametofítica (haploide) se ha descrito porcentaje de germinación, desarrollo protálico y formación del esporofito de poblaciones silvestres (Conway, 1949); inducción de esporofitos apogámicos bajo diferentes concentraciones de glucosa y sacarosa (Whittier & Steeves, 1960; Whittier, 1964); el efecto de la luz en el patrón de división celular en las primeras etapas de desarrollo del gametofito, en específico de fase filamentosa a fase bidimensional (2D) (Sobota & Partanen, 1966); para la observación de gametofitos maduros y de los anterozoides (Elmore & Adams, 1976); y la caracterización del transcriptoma de la fase gametofítica (Der, Barker, Wickett, & Wolf, 2011). En la fase esporofítica (diploide) los estudios son pocos: se encuentra el trabajo de cultivo y desarrollo de las raíces in vitro (Partanen & Partanen, 1963); y el de propagación de esporofitos para la obtención de ecdisteroides, metabolito utilizado para el control de plagas en cultivos (Macek & Vaněk, 1994). A pesar de que se ha utilizado este helecho para diferentes objetivos usando el cultivo in vitro, no hay investigaciones que abarquen la descripción de su ciclo de vida completo. El objetivo de este estudio fue aportar información morfológica y anatómica de la fase gametofítica y esporofítica de P. aquilinum, utilizando la técnica “in vitro”, dado queexisten trabajos escasos sobre este tópico, usando microscopía fotónica y microscopía electrónica de barrido (MEB). Se describe el tipo y ornamentación de esporas, la germinación, el desarrollo protálico y la anatomía del esporofito (raíces, tallos y hojas).
Materiales y métodos
Material biológico: Se recolectaron esporas de P. aquilinum en la localidad de “La Cantera” (20°39’54.3’’ N & 98°39’56.2’’ W, y altitud 2 036 mnsm) ubicada en el Municipio de Zacualtipán, Hidalgo. Estas se desecaron naturalmente a temperatura ambiente, se tamizaron de acuerdo con el procedimiento de Muñiz, Pérez-García, Márquez-Guzmán y Mendoza-Ruiz (2008) y se mantuvieron a 4 ºC hasta su siembra.
Cultivo in vitro: Durante la siembra in vitro, se tomaron 90 mg de esporas, se lavaron con una solución al 0.3 % de NaClO y se agitaron por dos minutos. Se recuperaron las esporas de la solución utilizando papel filtro. Posteriormente se realizaron cinco lavados con agua desionizada estéril, y finalmente se resuspendieron en 10 ml de agua desionizada estéril. Se tomaron 250 µl de la suspensión de esporas y se sembraron en cajas de Petri de 10 cm con 25 ml de medio ½ MS (Murashige & Skoog, 1962). Después de 15 días de la siembra los gametofitos fueron trasplantados a ½ MS y regados dos veces por semana con 5 ml de agua desionizada estéril, hasta la aparición de los esporofitos jóvenes y éstos se mantuvieron en condiciones in vitro hasta que tuvieron alrededor de cuatro meses.
Técnica para microscopia electrónica de barrido (MEB): Se tomaron muestras de la fase gametofítica en los diferentes estadios de desarrollo, así como del esporofito joven y fragmentos de 1x1 cm de las hojas del esporofito de 60-70 días de edad. Con tres esporofitos de cuatro meses se realizaron cortes transversales de raíz, rizoma, base de pecíolo y raquis. El material obtenido se fijó en FAA (formaldehído, alcohol etílico, ácido acético glacial y agua; 1:5:0.5:3.5) y se realizó la deshidratación gradual en etanoles (30, 50, 70, 85, 96 y 100 %). Una vez que las muestras estuvieron en etanol al 100 % se desecaron a punto crítico (Quorum Q150R ES). Las muestras desecadas de los gametofitos, esporofitos y las esporas, se montaron en porta muestras de aluminio sobre cinta de carbón hiperconductora, y fueron cubiertas con una solución de oro-paladio en spray (EMITECH k850). Las observaciones y las fotomicrografías se realizaron en un microscopio electrónico de barrido HITACHI SUI510 en formato TIFF y se editaron con Photoshop CS6 portátil.
Técnica histológica de inclusión en parafina para microscopia fotónica: Se realizaron cortes de 0.5 cm de longitud de raíz adventicia, rizoma, base del pecíolo, raquis y hoja, y se fijaron en FAA. Para la inclusión en parafina las muestras se deshidrataron en una serie gradual de etanol por 24 h (30, 50, 70, 85, 96 y 100 %), para la infiltración en parafina se pasaron por una mezcla de xilol-etanol (1:1), xilol, xilol: parafina (2:1, 1:1, 1:2) en cambios de 12 h cada uno, posteriormente se incluyeron en Paraplast® a 58-60 °C. Una vez incluidas se realizaron cortes transversales de 8 μm de grosor con un micrótomo semiautomático de rotación (Leica RM2165). Los cortes se desparafinaron y se tiñeron con la técnica de safranina-verde rápido en metilcelosolve y se montaron en portaobjetos con resina sintética de acuerdo con López, Márquez Guzmán y Murguía Sánchez (2005). Las microfotografías se tomaron con un microscopio con cámara incluida (Leica ICC50 E).
Para el tamaño de las esporas se midió eje polar y eje ecuatorial de 30 esporas. Para la descripción del tipo de germinación y desarrollo protálico se utilizó la terminología propuesta por Nayar y Kaur (1971), para corroborar los tiempos de desarrollo se realizaron tres réplicas independientes. La descripción anatómica de las estructuras del esporofito se realizó de acuerdo con Ogura (1972) y Talip et al. (2014), se midieron tres individuos y se reportaron promedio ± desviación estándar.
Resultados
Fase gametofítica: Las esporas son globosas, tetrahédricas, con lesura trilete y ornamentación granulada, de color marrón y aclorofílicas, su diámetro polar es 33.7 ± 3.6 µm y su diámetro ecuatorial es 37.4 ± 3.4 µm, la vista proximal es triangular a subtriangular-globosa y la vista distal es globosa (Fig. 1A, Fig. 1B). La germinación es asincrónica y ocurre de tres a cinco días posteriores a la siembra (Fig. 1C) y corresponde al tipo Vittaria, donde la primera división es perpendicular al eje polar de la espora y da origen a la célula rizoidal. La segunda división es perpendicular a la primera y genera a la célula protálica (Fig. 1D). El desarrollo protálico se presenta sincrónico y corresponde al tipo Adiantum,el cual se caracteriza por la presencia de filamentos cortos de 4-6 células a partir del sexto día (Fig. 1E). El desarrollo de la fase bidimensional (2D) comienza a partir entre el séptimo y octavo día, originando gametófitos simétricos y desnudos, comienza a diferenciarse la célula meristemática por divisiones anticlinales en el ápice (Fig. 1F). A partir del día 11 se observa un talo de espatulado a cordiforme, desnudo, con alas desarrolladas y un meristemo apical en la zona de la muesca (Fig. 1G). Los gametófitos masculinos se observan a partir de los trece días posteriores a la siembra lo que hace a esta especie protándrica. Los anteridios se encuentran en la superficie ventral de la lámina, ocupan 2/3 partes de la superficie del talo, entre los rizoides (Fig. 1H), y presentan tres células: la célula basal, la célula media y la célula opercular (Fig. 1I). Los arquegonios se formaron a partir de los 17 días, en la superficie ventral del gametofito, cercanos a la muesca y como se observan orientados hacia adentro es indicación de autofecundación (Fig. 1J). Los cuellos tienen un largo de cuatro células y la boca de los arquegonios están formados por 4 células (Fig. 1K). La mayoría de los gametófitos son dioicos y presentan un claro dimorfismo sexual, los prótalos masculinos son espatulados y pequeños, los femeninos son de mayor tamaño, cordiformes y presentan a las amplias. Es posible observar gametofitos monoicos al día 21. La primera hoja de los esporofitos se observa entre 60 y 70 días posteriores a la siembra de las esporas, la primera hoja del esporofito es flabelada con venación dicotómica abierta (Fig. 1L).
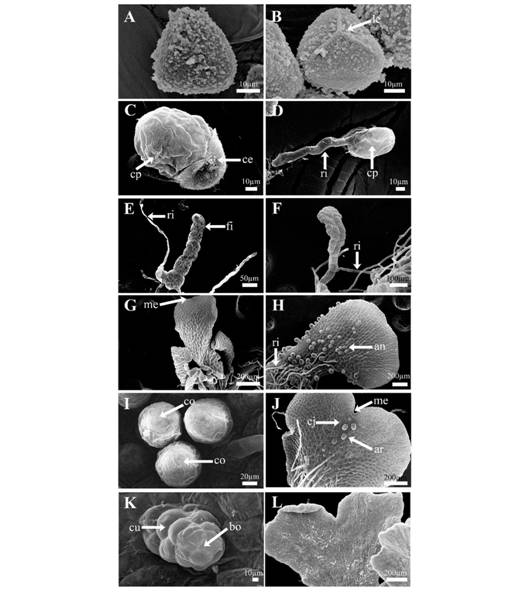
Fig. 1. Fig. 1 Fase gametofítica de P. aquilinum. A. Espora en vista distal. B. Espora trilete en vista proximal. C y D. Germinación tipo Vittaria, 3-5 días. E. Fase filamentosa, 6 días. F. Inicios de la fase 2D, 7-8 días. G. Gametofitos espatulados, 11 días. H. Gametofitos con anteridios ventrales, 13 días. I. Detalle de anteridios. J. Gametofito con arquegonios, 17 días. K. Detalle de boca y cuello del arquegonio. L. Primera hoja del esporofito, 60-70 días. An = anteridios, ar = arquegonios, bo = boca, cb = célula basal, ce = cubierta de la espora, cj = cojinete, co = célula opercular, cp = célula protálica, cr = célula rizoidal, cu = cuello, fi = filamento, le = lesura, me = meristemo y ri = rizoide. Gametophytic generation from P. aquilinum. A. Spore distal face. B. Trilete spore proximal face. C y D. Vittaria-type germination, 3-5 days. E. Filamentous phase, 6 days. F. Beginning of 2D phase, 7-8 days. G. Gametophytes with spatulated-shape, 11 days. H. Gametophyte with mature antheridia, 13 days. I. Antheridia. J. Gametophyte with archegonia, 17 days. K. View of neck and mouth cells from archegonium. L. Sporophyte first leaf, 60-70 days. an = antheridia, ar = archegonia, bo = mouth, cb = basal cell, ce = exospore, cj = cushion, co = opercular cell, cp = prothallic cell, cr = rhizoid cell, cu = neck, fi = filamentous, le = lesure, me = meristem and ri = rhizoid.
Fase esporofítica: Los esporofitos de 60-70 días de edad presentan raíces adventicias, las cuales tienen un diámetro de 276.2 ± 36 µm y se aprecian los tres sistemas de tejidos bien desarrollados. La rizodermis es monoestratificada 16.4 ± 6.2 µm de grosor; el córtex 66.1 ± 27.6 µm de grosor y está constituido por 3-4 capas de células parenquimáticas de paredes delgadas, que conforme se acercan a la endodermis aumenta el grosor de las paredes; la endodermis está constituida por células alargadas con engrosamientos tangenciales de suberina en sus paredes; el periciclo consta de una o dos capas de células de grosor; el sistema vascular es del tipo monarca con un diámetro de 92.16 ± 5.6 µmcon xilema exarco (Fig. 2A, Fig. 3A).
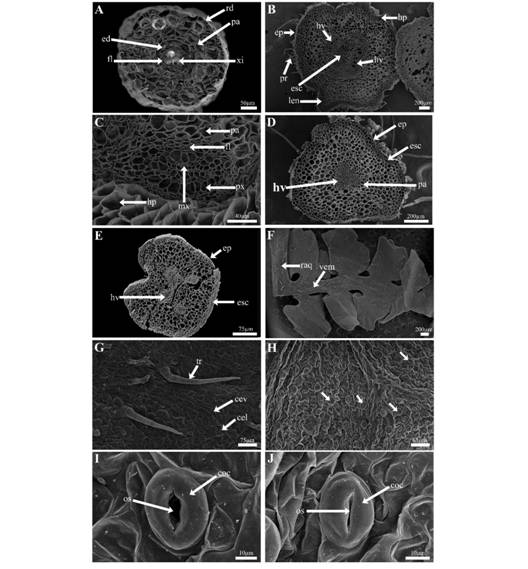
Fig. 2. Fig. 2 Anatomía de la fase esporofítica de P. aquilinum. A. Corte transversal de raíz adventicia. B. Corte transversal de rizoma. C. Acercamiento a haz vascular del rizoma. D. Corte transversal de la base del peciolo. E. Corte transversal de raquis de primer orden. F. Pinna joven. G. Vista de la epidermis de la cara adaxial de la hoja. H. Vista de la epidermis de la cara abaxial de la hoja (flechas señalan a los estomas). I. Estoma anomocítico abierto. J. Estoma anomocítico cerrado. Cel = células epidérmicas del limbo de la hoja, cev = célula epidérmica asociadas al haz vascular, coc = células oclusivas, e = estomas, ed = endodermis, ep = epidermis, esc = esclerénquima, fl = floema, hp = hipodermis, hv = haz vascular, len = lenticela, mx = metaxilema, os = ostiolo, pa = parénquima, px = protoxilema, tr = tricoma rz = rizodermis, vem = vena media y xi = xilema. Sporophytic generation anatomy from P. aquilinum. A. Adventitious root cross section. B. Rhizome Cross section of. C. Rhizome vascular bundle. D. Petiole base cross section. E. First order rachis cross section. F. Young pinna. G. View of adaxial face from leaf epidermis. H. View of abaxial face from leaf epidermis (arrows point the stomata). I. Anomocyticstoma open. J. Anomocyticstoma closed. cel = epidermal leaf limb cells, cev = epidermal cell associated with vascular bundle, coc = occlusive cells, e = stomata, ed = endodermis, ep = epidermis, esc = sclerenchyma, fl = floem, hp = hipodermis, hv = vascular bundle, len = lenticel, mx = metaxylem, os = ostiolus, pa = parenchyma, px = protoxylem, tr = tricome rz = rhizodermis, vem = middle vein and xi = xylem.
El rizoma tiene un diámetro ecuatorial de 2.13 ± 0.23 mm y un diámetro meridional de 1.70 ± 0.43 mm (Fig. 2B, Fig. 3B). En los extremos de la región ecuatorial se aprecian las lenticelas. La epidermis es monoestratificada 23.3 ± 6.7 µm de grosor. La hipodermis es pluriestratificada de 8-9 capas de células y de 64.4 ± 56.7 µm de grosor. El tipo de estela que presenta es dictiostela con 3-6 haces vasculares concéntricos (Fig. 3C). En el caso del xilema se observa el protoxilema maduro en la región periférica y el metaxilema aún está conformado por células vitalizadas debido a la corta edad de los individuos (Fig. 2C, Fig. 3D). La médula está constituida por células parenquimáticas y en proceso de diferenciación una banda central en forma de “C” de esclerénquima paralela al eje ecuatorial (Fig. 3C).
La base del pecíolo es de contorno cilíndrico a subtriangular y de 1.28 ± 0.31 mm de grosor (Fig. 2D, Fig. 3F). En corte transversal la epidermis es monoestratificada compuesta por células isodiamétricas de 14.4 ± 0.5 µm de grosor (Fig. 3E). En posición subepidérmica se encuentra el tejido de sostén, concélulas isodiamétricas de paredes primarias o secundarias engrosadas de 1 a 5 capas de 36.1 ± 18.7µm de grosor y parénquima de paredes delgadas de 850 ± 191.6 µm (Fig. 3F); el sistema vascular se encuentra en la porción central y está constituido por un haz vascular en un arreglo triangular (Fig. 3G).
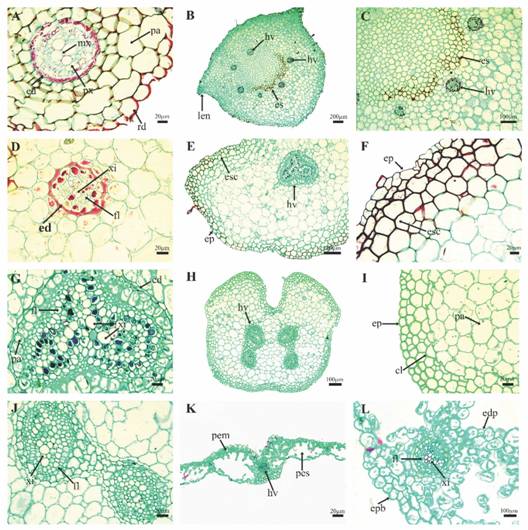
Fig. 3. Fig. 3 Anatomía de la fase esporofítica de P. aquilinum con microscopía fotónica. A. Corte transversal de raíz adventicia. B. Corte transversal de rizoma. C. Acercamiento a la banda de esclerénquima. D. Acercamiento del haz vascular. E. Corte transversal de base de pecíolo. F. Acercamiento de epidermis y tejido de sostén de la base del pecíolo. G. Acercamiento del haz vascular de la base del pecíolo. H. Corte transversal de raquis de primer orden. I. Acercamiento de epidermis y tejido de sostén de raquis de primer orden. (J) Haz vascular de raquis de primer orden. K. Corte transversal de lámina. L. haz vascular primario de lámina. Cl = colénquima, ed = endodermis, esc = esclerénquima, edp = epidermis adaxial, epb = epidermis abaxial, fl = floema, hp = hipodermis, hv = haz vascular, len=lenticela, mx = metaxilema, pa = parénquima, px = protoxilema, pem = parénquima en empalizada, pes = parénquima esponjoso y xi = xilema. Sporophytic generation anatomy from P. aquilinum by photonic microscopy. A. Adventitious root cross section. B. Rhizome cross section. C. Sclerenchyma strand. D. Vascular bundle. E. Petiole base cross section. F. Epidermis and collenchyma from petiole base. G. Vascular bundle from petiole base. H. Cross section from first order rachis. I. Epidermis and support tissue from first order rachis. J. Vascular bundle from first order rachis. K.Leaf blade cross section. L. primary vascular bundle. cl = collenchyma, ed = endodermis, esc = sclerenchyma, edp = adaxial epidermis, epb = abaxial epidermis, fl = floem, hp = hipodermis, hv = vascular bundle, len = lenticel, mx = metaxylem, pa = parenchyma, px = protoxylem, pem = palisade parenchyma cells, pes = spongy parenchyma cells and xi = xylem.
El contorno adaxial del raquis es – cilíndrico, el contorno de la cara abaxial es convexo en forma de “V” y de 867.8 ± 143.7 µm de ancho (Fig. 2E, Fig. 3H). En corte transversal la epidermis es simple conformada por células isodiamétricas de un grosor de 13.6 ± 1.7 µm (Fig. 3I). En la región subepidérmica hay un tejido de sostén con células lignificadas de 41.9 ± 11.5 µmde grosor, conformada por células de rectangulares a isodiamétricas, dispuestas en dos a cuatro capas y posteriormente se encuentra tejido parenquimático de paredes delgadas, el sistema vascular está constituido por cuatro haces vasculares de largo de 168.8 ± 55.6 µm y ancho de 115.8± 8.8 µm en un arreglo radial (Fig. 3J).
La lámina es 1-pinnado-pinnatífida profusamente lobada (Fig. 2F). Las células epidérmicas de la cara adaxial de la lámina son sinuosas y de forma irregular, presenta tricomas aciculares pluricelulares de tres a cuatro células (Fig. 2G). Las células epidérmicas de la cara abaxial son iguales a las de la cara adaxial, presenta estomas anomocíticos y funcionales de 35.8 ± 4 µm largo y 36.5 ± 5.5 µm de ancho y la densidad estomática es de 72.5 ± 19.8 estomas/mm2 (Fig. 2H, Fig. 2I y Fig. 2J). En corte transversal, la lámina presenta una epidermis monoestratificada en ambas caras, en la cara abaxial es de 20.3 ± 3.8 µmde grosor y en la cara abaxial es de 13 ± 1.3 µm de grosor (Fig. 3K). El mesófilo se encuentra diferenciado en empalizada 51 ± 5 µmde grosor orientado hacia la cara adaxial y esponjoso de 63.3 ± 11.5 µmde ancho, orientado hacia la cara opuesta, el haz vascular principal tiene un diámetro de 70 ± 3.4 µm (Fig. 3L).
Discusión
La morfología de las esporas en P. aquilinum corresponde a los estudios previamente realizados por Tryon y Lugardon (1991), siendo la forma y la ornamentación la misma. En P. aquilinum la germinación es asincrónica, e inicia de 3-5 días posteriores a la siembra. El tiempo de germinación es semejante al reportado para otras especies de la familia, ya que en todas ocurre durante la primera semana después de la siembra (Campbell, 1936; Kaur, 1972; Zhang, Liu, & Tan, 2008; Ramírez-Trejo, Pérez-García, Mendoza-Ruiz, Valdéz-Ávila, & Espinosa-Matías, 2013; Martínez, Chambi, & Avilés, 2014). Sin embargo, en P. aquilinum el tiempo de germinación es menor con respecto a las especies que conforman la familia, a excepción de P. caudatum en el que se reporta a los dos días posteriores a la siembra (Ramírez-Trejo et al., 2013). La germinación de P. aquilinum es del tipo Vittaria al igual que en las especies ya antes estudiadas como: Dennstaedtia scabra (Wall. ex Hook.) J. Sm. (Kaur, 1972), D. appendiculata var. elwesii (Wall. ex Hook.) J. Sm. (Kaur, 1972), D. globulifera (Poir.) Hieron. (Martínez et al., 2014), Histiopteris incisa (Thunb.) J. Sm. (Campell, 1936), H. poeppigii (Kunze) R. Rodr. (Martínez et al., 2014),Microlepia platyphylla (D. Don) J. Sm. (Zhang et al., 2008), M. strigosa (Thunb.) C. Presl (Zhang et al., 2008) y Pteridium caudatum (L.) Maxon (Ramírez-Trejo et al., 2013), todas incluidas en la familia Dennstaedtiaceae de acuerdo a la Smith et al. (2006).
El desarrollo protálico es del tipo Adiantum al igual que el resto de las especies en la familia Dennstaedtiaceae (Campbell, 1936; Kaur, 1972; Zhang et al., 2008; Ramírez-Trejo et al., 2013; Martínez et al., 2014). Sin embargo, la morfogénesis de la fase sexual en esta especie, es más rápida que en el resto de los miembros de la familia, ya que a los 15 días en condiciones in vitro se observan gametofitos con anteridios y arquegonios. Esta condición no ha sido mencionada para otras especies en las que se ha estudiado la morfogénesis protálica, en los cuales los tiempos de desarrollo registrados son de uno a ocho meses (Reyes-Jaramillo, Peréz-García, & Mendoza, 1995; Ramírez-Trejo et al., 2013).
En esta especie las primeras hojas del esporofito se observan entre los 60-70 días posteriores a la siembra, un tiempo muy parecido al observado en P. caudatum, en la que el tiempo desde la morfogénesis del gametofito hasta la formación del esporofito joven fue de 78 días (Ramírez-Trejo et al., 2013). El tiempo reducido de desarrollo protálico y la aparición del esporofito quizás sea una de las características que le permite a esta especie tener alta capacidad de ser pionera y colonizadora de sitios perturbados, y no solo, las características ecológicas adjudicadas al esporofito maduro, como la alelopatía entre otras (Moran, 1993; Ramírez et al., 2007; Ramírez-Trejo et al., 2010).
Las plantas vasculares en condiciones in vitro, debido a que se encuentran en un medio heterótrofo (medio suplementado con sacarosa) y condiciones de alta humedad pueden presentar varias anomalías anatómicas como: vitrificación, donde las células presentan paredes delgadas y una falta de diferenciación entre los sistemas de tejidos de los órganos; el mesófilo de las hojas sin diferenciación en empalizada y esponjoso, o solo la presencia de esponjoso; los estomas no funcionales o con mal formaciones en las células oclusivas (ausencia de ostíolo); y ausencia de cutícula (Reuther, 1987; Capellades, Fontarnau, Carulla, & Debergh, 1990; Hazarika, 2006; Mohamed & Alsadon, 2010; Gao, Xia, An, Xin, & Liang, 2017). En P. aquilinum no se observa vitrificación en ningún órgano y se presentan los tres sistemas de tejidos bien diferenciados. La anatomía de las raíces adventicias es la típica descrita para esta especie (Kraehmer & Baur, 2013), el rasgo particular observado en este estudio, es la ausencia de la capa de esclerénquima que normalmente rodea al haz vascular, ya que corresponde a la anatomía de los esporofitos de dos meses de edad. El rizoma típicamente presenta una dictiostela policíclica, con dos bandas de esclerénquima en la región ecuatorial, en este trabajo solo se observó un solo ciclo de haces vasculares y una banda de esclerénquima lo que concuerda con el desarrollo ontogenético para la especie (Ogura, 1972). La anatomía de la base del pecíolo debido a la corta edad de los individuos no presenta el sistema vascular en forma de águila bicéfala característico de la especie. Por otro lado, el raquis de primer orden presenta cuatro haces vasculares, rasgo reportado por primera vez. Las hojas son los órganos más afectados en las plantas in vitro (Capellades et al., 1990; Hazarika, 2006; Mohamed & Alsadon, 2010), sin embargo, en P. aquilinum se observan los estomas anomocíticos funcionales en la cara adaxial, en corte transversal se diferencia bien el mesófilo en empalizada y el esponjoso y la cutícula es delgada.
La ausencia de daño en el desarrollo in vitro del gametofito y del esporofito de esta especie, podría significar, que, durante la aclimatación en condiciones de invernadero, la supervivencia de los individuos podrá ser mayor en individuos cultivados in vitro a partir de esporas.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 

