Introducción
A pesar del compromiso asumido en la COP-21 para frenar la tala de bosques (Brasil-iNDC, 2015), la tasa de deforestación en la Amazonia legal aumentó un 13.7 % en el último año (2017-2018) (INPE, 2019), lo cual convirtió a Brasil en el país con mayor pérdida de cobertura vegetal con 1.33 Mha (Global Forest Watch, 2019). Se estima que tan solo, en el estado de Maranhão, 25 211 km² de la Amazonia legal fueron eliminados desde 1990 (INPE, 2019). Ante este panorama, los bosques ribereños pueden considerarse uno de los ecosistemas más amenazados en la actualidad (Capon et al., 2013), ya que comúnmente constituyen las únicas zonas forestales remanentes en regiones antropizadas y sufren una fuerte presión por la continua ocupación debido a la facilidad de acceso al recurso hídrico (Nunes et al., 2014). Pese a existir leyes para su protección (Presidencia de la República de Brasil, 2012) y ser consideradas áreas muy blandas (Brancalion et al., 2016), estas no prevalecen ante la necesidad de subsistencia de las comunidades que dependen de estos ecosistemas como fuente de recursos para satisfacer sus necesidades fundamentales.
Como focos de diversidad (Rodrigues, Brancalion, & Isernhagen, 2009) y otros servicios ecosistémicos (Lima & Zakia, 2004; Ballinger & Lake, 2006), estos ambientes de transición albergan comunidades consideradas de suma importancia para el funcionamiento general de los ecosistemas; por ejemplo, la macrofauna edáfica. Asimismo, algunos grupos de macroinvertebrados del suelo cumplen un papel ecológico fundamental y son considerados “ingenieros de los ecosistemas” (Jones, Lawton, & Shachak, 1994). Según Bardgett et al. (2001), la presencia y actividad de estos organismos (con tamaño superior a 2 mm) influyen directa e indirectamente en las rutas hidrológicas, la descomposición de la materia orgánica y su transferencia del suelo al agua. Por su parte, las hormigas (Hymenoptera: Formicidae), por medio de la construcción de corredores, cámaras y nidos, aumentan la porosidad del suelo, la captura y el drenaje del agua - tanto en la superficie como en sus horizontes internos - y favorecen la mineralización de nutrientes (Folgarait, 1998; Bardgett et al., 2001). También contribuyen en la dispersión, germinación de semillas y viabilidad de plántulas (Dáttilo, Marques, Falcão, & Moreira, 2009; Leal, Leal, & Andersen, 2015; Tanaka, Ogata, Mukai, Yamawo, & Tokuda, 2015), así como en el control de poblaciones de artrópodos y la polinización (Hölldobler & Wilson, 1994; Del-Claro, Rodriguez-Morales, Calixto, Martins, & Torezan-Silingardi, 2019).
No obstante, la presencia y actividad de formícidos es afectada por la mudanza en el componente forestal (Vasconcelos, 1999; Neves, Queiroz-Dantas, Rocha, & Delabie, 2013; Leal, Silva, Sousa-Souto, & Neves, 2016). Con la reducción de la heterogeneidad del ecosistema, se disminuye la complejidad de los microhábitats y la diversidad de alimentos, limitando así el forrajeo y nidificación de estos organismos (Vasconcelos & Vilhena, 2006). Asimismo, tiene un efecto en las actividades íntimamente ligadas con la hojarasca que cubre el suelo (García-Martínez, Escobar-Sarria, López-Barrera. Castaño-Meneses, & Valenzuela-González, 2015, 2017) y la presencia de plantas con las que interactúan (Lopes et al., 2012). De esta forma, tras un impacto antropogénico como la tala de la vegetación, la compactación del suelo aumenta e influye negativamente en el establecimiento de hormigas epígeas en bosques ribereños y en la dinámica de desplazamiento de especies a escala del paisaje (García-Martínez et al., 2015, 2017).
Debido a que la familia Formicidae cumple un papel fundamental en estos ambientes (Bardgett et al., 2001; García-Martínez et al., 2017), refleja los cambios a nivel estructural y funcional del suelo (García-Martínez et al., 2015), es abundante (Pinzón et al., 2015) y son pocos los estudios realizados en bosques ribereños, el presente trabajo tiene como objetivos evidenciar el aporte referencial de Formicidae en estas zonas y establecer diferencias en su riqueza, frecuencia y composición a través del gradiente de sucesión forestal. Las hipótesis consideradas en este estudio fueron que (1) existe una relación positiva entre el gradiente de sucesión forestal y la riqueza y frecuencia de Formicidae; (2) las áreas de sucesión comparten mayor número de especies y se distancian de áreas de uso antrópico; (3) la riqueza y frecuencia de este grupo es afectada por la cobertura de dosel, el altura de los árboles y el periodo de recolecta.
Materiales y Métodos
Área de estudio: El trabajo se realizó en los bosques ribereños Pepital (44°27'57'' - 44°26'31.9" W & 2°20'55.4" - 2°21'42" S) y Grande (44°28'31.4” - 44°29'01.3" W & 2°20'49.5” - 2°20'52.7" S), los cuales se encuentran severamente degradados por actividades agro-extractivistas (Zelarayán et al., 2015). Las dos cuencas están situadas en el municipio de Alcântara al norte del estado de Maranhão, Brasil.
Diseño experimental: Se categorizaron visualmente cuatro niveles de sucesión forestal basados en la estimación de la altura media de la vegetación y la abertura del dosel (Celentano et al., 2016). También, se establecieron tres bloques de muestreo por bosque, cada uno con cuatro parcelas de 50 x 20 m - una para cada nivel de sucesión forestal - sumando un total de 24. Estas últimos correspondían a la sucesión 1 (áreas abiertas o de uso antrópico, con cultivos o pastizales y cobertura del dosel menor a 19 %); sucesión 2 (matorral menor a 7 m, cobertura del dosel entre 20 y 69 %); sucesión 3 (bosque secundario entre 7 y 15 m con dosel entre 70 y 89 %); y la sucesión 4 (bosque secundario mayor a 15 m con más del 80 % del dosel). Las parcelas fueron establecidas distantes del lecho del río para evitar posibles inundaciones (Celentano et al., 2016).
Como parte de un programa de muestreo de macrofauna edáfica, la recolecta se llevó a cabo durante los períodos seco de noviembre 2012 (precipitación media mensual de 5.25 mm) y lluvioso de junio 2013 (precipitación media mensual de 94.25 mm) (datos proporcionados por el LabMet/UEMA). Previo al muestreo, se empleó una versión modificada del método Tropical Soil Biology and Fertility - TSBF (Anderson & Ingram, 1993) que consistió en la extracción de 5 monolitos de 25 cm2 y 10 cm de profundidad retirados en zigzag a 2 m de la línea media de la parcela (más detalles en Pinzón et al., 2015).
Los formícidos, tanto del suelo como de la hojarasca, fueron separados de la macrofauna, contados y determinados hasta el nivel de especies y morfoespecies. Las morfoespecies fueron posteriormente identificadas y convalidadas por el especialista Jacques Delabie en el Laboratorio de Mirmecología en el Centro de Investigación de Cacao-CEPLAC en llhéus, Bahia, Brasil. Actualmente, el material forma parte de la Colección de Invertebrados del Suelo de Maranhão-CISMA, inscrita al Laboratorio de Artrópodos y Microbiología del Suelo-LAMS de la Universidad Estadual de Maranhão-UEMA en São Luis, Maranhão, Brasil.
Análisis estadísticos: Fueron construidas curvas de acumulación de especies (o de recolector) con 100 aleatorizaciones que evalúan la eficiencia del método usado para representar la subcomunidad de hormigas en los bosques ribereños con la adición de nuevas especies en función del esfuerzo amostral. Las curvas y sus desviaciones estándar se calcularon con el paquete estadístico EstimateS versión 9.1.0 (Colwell, 2013). Por otro lado, para estimar la riqueza de especies fueron utilizados Chao 2 y Jackknife 1.
Los datos de abundancia fueron analizados utilizando la frecuencia reportada en los registros de las especies en cada área muestreada y no por el número de individuos. Esta medida es considerada el parámetro más adecuado para insectos sociales debido a la divergencia entre el número de individuos por colonia (Longino, Coddington, & Colwell, 2002). Asimismo, debido a la corta distancia, los cinco monolitos fueron considerados como una única muestra por parcela para evitar el reconteo de individuos de la misma colonia y sobreestimar la frecuencia relativa por nivel de sucesión forestal.
Tras observar la homogeneidad de las varianzas de los residuos, fueron realizados Modelos Lineales Mixtos (LMM, siglas en inglés) para establecer el efecto de la interacción entre la sucesión, la temporada de recolecta y el bosque ribereño en la riqueza y frecuencia de Formicidae. Al confirmar que no hubo efecto significativo por parte del bosque ribereño (Pepital o Grande), el modelo fue establecido de la siguiente forma: los cuatro niveles de sucesión (1-4) y el período de recolecta (seco y lluvioso) fueron considerados como factores fijos, mientras tanto, el bloque (tres por bosque) como factor aleatorio. Este modelo fue escogido debido a que obtuvo el valor más bajo en el criterio de información Akaiko (Di Rienzo, Macchiavelli, & Casanoves, 2009).
Posteriormente, los promedios fueron comparados mediante la prueba de Tukey (p ≤ 0.05). El análisis fue realizado con el paquete multcomp (Hothorn et al., 2016) de la plataforma R (R Development Core Team, 2009). También, fueron realizadas regresiones polinómicas para determinar la relación entre las variables riqueza y frecuencia de hormigas con la cobertura del dosel y la altura de la vegetación ya que, de acuerdo con Celentano et al. (2016), las variables estructurales fueron las que reflejaron el estado de degradación forestal local. Estos análisis de hicieron con ayuda del software Minitab 18 (Minitab, 2018).
Finalmente, la semejanza en la composición de especies fue representada a través del índice de similitud de Jaccard, el más indicado en matrices de datos de presencia - ausencia (Legendre, Borcard, & Peres-Neto, 2005) y usado para observar el grado de semejanza entre los niveles de sucesión y las parcelas amostradas. Estos análisis fueron realizados a través del software Primer v7 (Clarke & Gorley, 2015) para las cuatro sucesiones y con el paquete vegan (Oksanen et al., 2018) del software R (R Development Core Team, 2009) para las 24 parcelas.
Resultados
Se muestreó un total de 1 940 individuos separados en 86 especies y morfoespecies, 15 tribus y 8 subfamilias de las 14 conocidas para el Neotrópico (Apéndice 1). De los 663 registros totales, las especies más frecuentes fueron Pheidole radoszkowskii (60 registros), Nylanderia sp.1 (43), Hypoponera sp.1 (34), Hypoponera sp.3 (32) y Brachymyrmex sp.1 (30). Por otro lado, los géneros Pseudomyrmex y Camponotus fueron los más diversos con 9 y 8 morfoespecies respectivamente. Estos últimos representan el 21 % del número de especies recolectadas. Asimismo, Hypoponera, Pheidole y Solenopsis, con 5 morfoespecies cada uno, sumados corresponden al 17 % de número total de especies encontradas. Por otra parte, 15 morfoespecies fueron registradas una única vez (singletons) y equivalían al 16 % de la riqueza total.
Las curvas de acumulación de especies mostraron una estabilización con ambos estimadores de riqueza Jackknife 1 y Chao 2 (Apéndice 2). Por lo tanto, se constató que, con el método de recolecta, se alcanzó el 84.1 y 92.6 % (Jackknife 1 y Chao 2, respectivamente) de los valores estimados para el número de especies probables en la subcomunidad local de hormigas. También, se determinó que el modelo estadístico usado para los LMM se ajustó de manera adecuada (a través del test chi cuadrado - χ2 Wald Tipo II) al considerar la interacción del nivel de sucesión por período para los datos de riqueza (χ2 = 9.08, g.l. = 3, P = 0.028) y frecuencia (χ2 = 12.62, g.l. = 3, P = 0.005) de Formicidae.
De acuerdo con los resultados, las medias de riqueza y frecuencia fueron significativamente más altas en el nivel de sucesión más avanzado (4) durante el periodo seco (Media Riqueza = 15.17, ES = 1.24; Media Frecuencia = 23.69, ES = 2.12), las cuales se diferenciaron significativamente de los valores presentados en el nivel de sucesión temprana (1) en el mismo periodo (Media Riqueza = 5.31, ES = 1.21; Media Frecuencia = 7.32, ES = 2.09), como se observa en la Fig. 1A y la Fig. 1B.
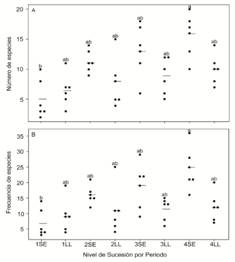
Fig. 1. Fig. 1 A) Variabilidad de la riqueza y B) frecuencia de Formicidae en los niveles de sucesión vegetal (1-4) y el período de recolecta (LL: periodo lluvioso, SE: periodo seco) en los bosques ribereños Pepital y Grande, Alcântara, Maranhão. Los puntos con letras diferentes en el mismo grupo fueron estadísticamente distintos al 5 % de probabilidad de acuerdo con la prueba de Tukey. A) Variability of Formicidae richness and B) frequency in the vegetation sucessional levels (1-4) and the sampling season (LL: rainy season, SE: dry season) in Pepital and Grande riparian forests, Alcântara, Maranhão. The points with different letters in the same group were statistically different at 5 % probability, according to the Tukey test.
Asimismo, los resultados de las regresiones polinómicas (Apéndice 3) mostraron que el 62 % de la variabilidad de la riqueza de hormigas fue explicada por el modelo ajustado en relación con el porcentaje de cobertura del dosel (r² = 0.62, F = 10.70, P < 0.0001) durante el período seco, un 58 % la frecuencia de hormigas (r² = 0.58, F = 9.05, p = 0.001). De igual manera, tanto la riqueza como la frecuencia de especies de hormigas tuvieron un efecto moderado en relación con la altura de la vegetación (r² = 0.52, F = 7.31, P = 0.002; r² = 0.52, F = 7.13, P = 0.002) en el mismo período. Cuando se consideraron las dos épocas juntas y solamente el período lluvioso, el ajuste de los modelos fue bajo.
Por otra parte, según el análisis de similitud de Jaccard para la composición de especies de Formicidae en los cuatro niveles sucesionales (Tabla 1) se observó que: la sucesión 1 fue la más disímil con solo 40 % de especies compartidas con las demás (correspondiente a 34 spp.); la sucesión 2 con 50 % de semejanza (43 spp.); las sucesiones 3 y 4 compartieron un 58 % del total (50 spp.). El Coeficiente de Correlación Cofenética (CCC) para este agrupamiento mostró un grado de fidelidad de 89 % (CCC = 0.89).
TABLA 1: TABLE 1: Valores de riqueza de especies (en la diagonal), índice de similitud de Jaccard (debajo de la diagonal) y número de especies compartidas de Formicidae (encima de la diagonal) en los diferentes niveles de sucesión (CCC: 0.89) Values of species richness (diagonal), Jaccard similarity index (below the diagonal) and number of shared species of Formicidae (above the diagonal) in different degradation levels (CCC: 0.89)
| Nivel de sucesión | 1 | 2 | 3 | 4 |
| 1 | 37 | 15 | 13 | 16 |
| 2 | 0.413 | 52 | 24 | 29 |
| 3 | 0.359 | 0.452 | 54 | 31 |
| 4 | 0.429 | 0.554 | 0.581 | 63 |
Por otro lado, el clúster de especies compartidas entre parcelas mostró una agrupación de cinco áreas (Fig. 2). La mayor parte de las sucesiones 3 y 4 en las dos cuencas se encontraban en un grupo que compartió el 28 % de semejanza en la composición de especies. Con dos representantes por nivel, las sucesiones temprana, intermediaria y avanzada (2-4) se agruparon y presentaron una similitud cercana al 26 %. Además, para los niveles de sucesión 1 y 2, se observan dos aglomerados: uno donde tres de las parcelas de uso antrópico (1) se agruparon con dos parcelas de la sucesión temprana (2) de las dos cuencas, representando un 25 % de semejanza y otro de dos parcelas de sucesión 1 y 2 con semejanza del 20 %. Por último, el grupo formado por las parcelas de sucesión 1 y 3 del bosque Pepital fue el más disímil ya que se separó del resto, con un mero 14 % de similitud de especies.

Fig. 2 Fig. 2 Clúster de agrupamiento de las parcelas en función de la composición de especies de hormigas, basado en el índice de similitud de Jaccard (CCC: 0.79). Sucesión 1-S1: áreas abiertas, cultivos o pastizales; sucesión 2-S2: matorral menor a 7 m de altura; sucesión 3-S3: bosque secundario entre 7 m y 15 m; sucesión 4-S4: bosque secundario mayor a 15 m. P1, P2, P3: repeticiones del bosque ribereño Pepital; G1, G2, G3: repeticiones del bosque ribereño Grande. Cluster of grouping plots according to the composition of ant species, based on the Jaccard similarity index (CCC: 0.79). Succession 1-S1: open areas, crops or pastures; succession 2-S2: shrub below 7 m height; succession 3-S3: secondary forest between 7 m and 15 m; succession 4-S4: secondary forest over 15 m. P1, P2, P3: repetitions of Pepital riparian forest; G1, G2, G3: repetitions of Grande riparian forest.
DISCUSIÓN
De acuerdo con los resultados, la abundancia total de hormigas fue menor que lo observado por Oliveira, Silva, & Santana (2014) en bosques ribereños y de galerías del Cerrado brasilero, quienes registraron más de 10 mil individuos con los métodos de recolecta tradicionales para este grupo (trampas de caída Pitfall y cebos con sardina). No obstante, la riqueza registrada en dicho estudio fue de solamente 47 especies; en este estudio se identificaron 86 spp. Por otra parte, usando TSBF, se obtuvieron valores cercanos a los de Rousseau, Silva, Celentano, & Carvalho (2014) en pastajes, bosques primarios y de sucesión secundaria en la Amazonia Oriental con 2 186 individuos registrados.
Las subfamilias Myrmicinae y Formicinae fueron las más frecuentes, caracterizadas por la diversidad de hábitos alimenticios y preferencia particular de hábitats (Baccaro et al., 2015). En esta línea, la diversidad de especies de los géneros Pseudomyrmex y Camponotus puede deberse a la amplia distribución de las especies de estos grupos, su alimentación generalista y la capacidad de habitar ambientes con distintos grados de antropización, comúnmente la vegetación y la hojarasca (Baccaro et al., 2015). Sin embargo, de las especies recolectadas en el presente estudio, 44 (equivalente al 51 %), tienen hábito hipogéico o críptico de acuerdo con Schmidt & Solar (2010). Esto puede deberse al método de recolecta utilizado.
Aunque el TSBF considera el procesamiento de un volumen mayor de suelo en relación con la hojarasca, lo cual demanda un mayor tiempo y esfuerzo, las especies no edáficas (arborícolas, nómades y de la hojarasca) tuvieron una buena representación (49 %) en este estudio, de modo que la relación costo-beneficio de su uso fue favorable. Por otro lado, a pesar que el TSBF no es indicado como método de recolecta específico para hormigas, las curvas del recolector indicaron una estimación promedio del 88 % de las especies probables localmente. Estos estimadores utilizados son indicadores de riqueza eficientes en otros estudios de diversidad de Formicidae (Lutinski, Lutinski, Iop, & Garcia, 2013; Vasconcelos et al., 2014). Asimismo, de acuerdo con Melo (2004), son los menos influenciados por el tamaño amostral de las especies.
No obstante, la estabilización de estas curvas puede presentarse sin que muchas especies hayan sido registradas debido al turnover (entrada y salida) de especies en gradientes ambientales, la presencia natural de especies muy raras (Whittaker, 1972) y la estabilidad espacio-temporal de las especies (Longino et al., 2002). De esta forma, el TSBF tiene un gran potencial para la recolecta de estos organismos y puede representar un complemento eficiente para los métodos tradicionalmente utilizados. Otros métodos no permiten recolectar formícidos hipogéicos (Schmidt & Solar, 2010), hormigas de hábito subterráneo que suscitan un alto interés por considerarse la “frontera final” en estudios de diversidad de Formicidae (Wilkie, Mertl, & Traniello, 2007). Sin embargo, es necesario realizar estudios comparando la eficiencia del TSBF respecto a otros métodos de recolecta.
Por otra parte, el efecto del período lluvioso se evidenció en la disminución tanto en la riqueza como en la frecuencia de hormigas (11 especies y solo 137 registros). Esto puede deberse a que en algunas parcelas de sucesión avanzada se registró un alto contenido de carbono y limo (producto de la vegetación) y, por ende, una mayor retención de agua en el suelo (Celentano et al., 2016). Esto pudo ocasionar un desplazamiento parcial de especies debido a la pérdida de sitios de nidificación, condición básica para el sustento de estos organismos en los ecosistemas (Vasconcelos & Vilhena, 2006). Estos resultados son contrarios a Vasconcellos, Segat, Bonfim, Baretta, & Cardoso (2013) donde se observó un aumento en la riqueza durante el período lluvioso en bosques ribereños de Mata Atlántica. No obstante, García-Martínez et al. (2015) registraron un aumento en la riqueza y la frecuencia de hormigas durante el periodo seco en bosques ribereños altamente intervenidos.
Otra razón que justifique la disminución de riqueza (41 a 24 %) y frecuencia (56 a 40 %) de hormigas puede ser la creciente transformación de bosques en sistemas agropecuarios. Esta variación dependió del grado de sucesión vegetal, revelando que cuánto más avanzada fuera la sucesión secundaria, mayor número y frecuencia de especies de hormigas se encontraban. Es importante tener en cuenta que la selección de las variables de cobertura de dosel y altura de la vegetación se hizo debido a que son las indicadoras del estado de degradación/conservación de estos bosques como se muestra en Celentano et al., (2016). La riqueza de especies de árboles y arbustos (no presentada en este estudio) no fue superior a las variables abordadas por lo cual se descartó. En otros estudios se ha mostrado que, cuando es significativa, puede explicar parcialmente la riqueza de hormigas.
Por lo tanto, la pérdida natural e inducida de la cobertura del dosel parece responder en parte a esta disminución, ya que su efecto se hizo más notorio durante el período seco y en las áreas de uso antrópico. La sequía torna los ambientes menos heterogéneos, con menor diversidad estructural en áreas degradadas, lo que resulta en menos hábitats y alimento disponible y un aumento en la competitividad intra e inter específica (Oliveira et al., 2014). En ese sentido, la similitud en la riqueza y composición de especies de Formicidae entre las áreas de sucesión media y avanzada (3 y 4) podría deberse a la semejanza estructural de la vegetación.
Además, puede asumirse que los bosques ribereños estudiados todavía representan un continuum para muchas especies debido a que el grado de fragmentación y aislamiento no es tan elevado, facilitando así la colonización y turnover de las especies entre el gradiente sucesional. En otros estudios se ha mostrado que, en fragmentos Amazónicos distanciados hasta en 300 m, ocurrió un turnover gracias al estado de conservación y tamaño de los fragmentos (Vasconcelos, Vilhena, Magnusson, & Albernaz, 2006). De igual manera, el efecto de borde también fue registrado en bosques ribereños por Gollan, De Bruyn, Reid, Smith, & Wilkie (2011), quienes afirman que no hubo diferencia estadística entre la riqueza de hormigas y el gradiente de sucesión vegetal.
Para concluir, este estudio mostró una aproximación satisfactoria de la riqueza de hormigas presentes en los bosques ribereños estudiados considerando el método de recolecta usado, cuyo costo-beneficio fue favorable. También, se determinó que hubo efecto del período seco en áreas de uso antrópico en la comunidad de hormigas, evidenciado en la disminución de la riqueza y frecuencia de estos organismos. Este detrimento en la riqueza y frecuencia se observó de manera más marcada en el periodo seco por la pérdida natural e inducida en la cobertura del dosel. Así entonces, el incremento de la diversidad de hormigas de acuerdo con la sucesión puede indicar una mejoría de las condiciones microclimáticas en cuanto a la oferta de alimento y hábitats que favorecen la diversidad de estos organismos.
Finalmente, este grupo reflejó el impacto a nivel poblacional que tiene la degradación de los bosques ribereños, ecosistemas claves para la manutención del suministro de bienes y servicios indispensables para las comunidades humanas. Por ello, deben considerarse prácticas agropecuarias en las tierras adyacentes a los bosques ribereños, como los sistemas agroforestales y silvopastoriles, que medien la necesidad de las personas de garantizar su subsistencia con un bajo impacto ambiental.












 uBio
uBio 

