Introducción
En ecología, una de las preguntas más importantes es: ¿cuáles son los factores que explican la alta diversidad de especies de plantas en los bosques tropicales? Este tema representa una de las principales preguntas que la ecología tropical debe responder en los próximos años (Pennisi, 2005); por ello, se han planteado varias hipótesis para resolver esta interrogante. Una de ellas predice una relación positiva entre la diversidad de especies de plantas y la precipitación (Gentry, 1982a, 1988; Wright, 1992; Specht & Specht, 1993; Clinebell, Phillips, Gentry, Stark, & Zuuring, 1995; Aplet, Hughes, & Vitousek, 1998). Esto se ha podido confirmar tanto a escalas continentales como locales (Bjorholm, Svenning, Skov, & Baslev, 2005; Slik et al., 2009; Eiserhardt, Svenning, Kissling, & Balslev, 2011). Otra hipótesis postula que la diversidad florística está relacionada con la fertilidad del suelo; sin embargo, los estudios muestran evidencias contradictorias, así que la diversidad puede tanto aumentar con la fertilidad del suelo (Gentry, 1988; Clinebell et al., 1995; Duivenvoorden, 1994; Tuomisto, Zuquim, & Cárdenas, 2014) o disminuir (Huston, 1980; Tuomisto et al., 2002; Slik et al., 2009; Peñas-Claros et al., 2012). De igual manera, puede presentarse un pico intermedio donde existe una correlación positiva en varias partes del gradiente edáfico, negativa en otras (Ashton, 1992), o simplemente no existe una relación entre la fertilidad de los suelos y la riqueza de las comunidades de plantas (Quinto-Mosquera & Moreno-Hurtado, 2014). Los que mantienen que hay una relación proponen que las diferencias se deben a la heterogeneidad de los suelos y la metodología de los muestreos. En el neotrópico, los trabajos que relacionan las variables edáficas con la composición florística de las comunidades de palmas se han centrado en la Amazonia y en el noroccidente de Panamá (Vormisto, Svenning, Hall, & Balslev, 2004; Andersen, Turner, & Dalling, 2010; Kristiansen et al., 2012; Cámara-Leret, Tuomisto, Ruokolainen, Balslev, & Kristiansen, 2017; Olivares, Svenning, Va Bodegom, Valencia, & Balslev, 2017; Stevenson, Aldana, Cardena, & Negret, 2018). Además, se ha determinado que, en los bosques tropicales, la presencia y ausencia de algunas especies de plantas está directamente relacionada con la disponibilidad o concentración de ciertos nutrientes en el suelo (John et al., 2007).
Por ejemplo, se ha reportado que existen asociaciones pronunciadas de muchas especies de árboles (Condit, Engelbrecht, Pino, Pérez, & Turner, 2013) y palmas (Cámara-Leret et al., 2017) a diferentes concentraciones de fósforo, lo que sugiere un papel predominante de este nutriente en la distribución y abundancia de las especies de plantas tropicales (Vitousek, 1984; Swaine, 1996; Potts, Ashton, Kaufman, & Plotkin, 2002). El Chocó biogeográfico es uno de los lugares con mayor diversidad de plantas del mundo (Gentry, 1982b, 1986, 1993; Forero & Gentry, 1989; Faber-Langendoen & Gentry, 1991; Galeano, 2001). Su gran diversidad se ha explicado por la alta precipitación en la región (que pueden alcanzar los 11 000 mm anuales en la parte central) y por las bajas concentraciones de nutrientes (como Ca, Mg, K, P, Na) (Gentry, 1986; Faber-Langendoen & Gentry, 1991). En general, los suelos se caracterizan por ser muy pobres en nutrientes, son de extrema acidez, alta saturación de aluminio y de gran concentración de materia orgánica (Faber-Langendoen & Gentry, 1991; Quinto-Mosquera & Moreno-Hurtado, 2016). Sus alto niveles de acidez se deben a la alta precipitación y lixiviación de nutrientes como Ca, Mg, K, y Na (Quinto-Mosquera & Moreno-Hurtado, 2016).
Las palmas son un ícono de los bosques tropicales donde, a menudo, son muy diversas localmente hiperdominates (Henderson, 2002; Dransfield et al., 2008; 57; Balslev, Bernal, & Fay, 2016). Presentan muchas formas de crecimiento (Balslev et al., 2011) y juegan un rol determinante en el funcionamiento de los ecosistemas (Kahn & de Granville, 1992; Henderson, 2002). En los bosques de tierras bajas del Chocó, las comunidades de palmas están representadas por un conjunto de especies de géneros comunes como Geonoma y Bactris que son los más diversos (Henderson, Galeano, & Bernal, 1995; Galeano & Bernal, 2010; Balslev, Pedersen, Navarrete, & Pintaud, 2015). Estas comunidades de palmas son reconocidas por su alta diversidad y densidad de especies (Tabla 1).
TABLA 1: y abundancia de palmas en diferentes estudios realizados en el Chocó biogeográfico. TABLE 1: Palm diversity and abundance in different studies made in the Chocó region
| Número de especies | Número de individuos | Área muestreada | Localidades | Referencia |
| 33 | 2098 | 2.5 ha | Chocó central | Ramírez-Moreno & Galeano (2011) |
| 33 | - | 3.75 ha | Chocó central | Cámara-Leret et al. (2014) |
| 21 | - | 2.25 ha | Chocó sur | Cámara-Leret et al. (2014) |
| 23 | 1016 | 22 ha | Chocó sur | Browne & Karubian (2016) |
| 57 | 3162 | 12 ha | Chocó norte, central, sur | - |
| 33 | 1831 | 5 ha | Chocó norte y sur | Esta investigación |
Adicionalmente, tienen multiplicidad de usos en esta zona (Ledezma-Renteria & Galeano, 2014; Cámara-Leret, Copete, Balslev, Soto-Gómez, & Macia, 2016; Schneider, Cámara-Leret, Barfod, & Weckerle, 2017) y ha sido catalogada como la segunda familia más usada después de Lauraceae (Galeano, 2000). Por estas razones, las palmas son un excelente grupo para estudiar cómo influyen los factores edáficos sobre la composición florística en la localidad antes descrita.
En las comunidades de palmas, las especies de sotobosque suelen ser más diversas y abundantes que las del dosel, patrón que algunas comunidades de árboles también siguen (Gentry & Dodson, 1987; Duivenvoorden, 1994; Balslev et al., 2011). Sin embargo, son escasos los estudios ecológicos que han analizado las preferencias edáficas de ambas formas de crecimiento (Duque, Sánchez, Cavelier, & Duivenvoorden, 2002; Costa, Jean-Louis, Albertina, & Ocirio, 2009; Kristiansen et al., 2012; Cámara-Leret et al., 2017). En el Chocó, pocas investigaciones han evaluado la influencia de los nutrientes sobre la composición florística. Tampoco existen estudios a nivel de comunidad de palmas o de especies individuales. Entre los trabajos antes realizados, se destaca el de Quinto-Mosquero & Moreno-Hurtado (2014), quienes realizaron un inventario florístico en dos parcelas permanentes de una hectárea en Salero (Chocó central) y encontraron que la diversidad de flores está positivamente correlacionada con la concentración de aluminio (Al) y negativamente con la topografía.
En este estudio se exploró la relación entre la composición florística de comunidades de palmas y la concentración de nutrientes en el suelo. Para ello, utilizamos datos florísticos y edáficos recolectados en 20 transectos distribuidos en el Chocó norte (Colombia) y Chocó sur (Ecuador). Específicamente, se analizó (1) cuánto varía la concentración de los nutrientes del suelo entre las dos localidades; (2) cuál es la relación entre los nutrientes del suelo y la composición florística de palmas; (3) cuáles nutrientes explican mejor la variación en la composición florística de las comunidades de palmas; y (4) cómo varía la abundancia de las especies más dominantes de sotobosque y de dosel a lo largo del gradiente de concentración de los nutrientes más importantes (bases intercambiables y fósforo).
MATERIALES Y MÉTODOS
Área de estudio: El Chocó biogeográfico se extiende desde el extremo sur de Panamá hasta el norte de Ecuador y cubre aproximadamente 1 500 km (Conservation International, 2014). Presenta una alta precipitación de ~ 11 000 mm en el centro del Chocó biogeográfico, la cual va disminuyendo hasta 2 000 - 3 000 mm en los extremos norte y sur. La temperatura media anual es de 27 °C y la humedad relativa es 90 % (Eslava, 1992; Poveda, Rojas, Rudas, & Rangel, 2004). El trabajo se realizó en Colombia en el departamento de Chocó, Municipio Acandí, corregimiento de Capurganá (2 983 mm) y en Ecuador en la provincia de Santo Domingo de los Tsáchilas (3 340 mm).
Muestreo de campo y análisis de suelos: En el 2011 y 2017, recolectamos datos sobre la distribución y abundancia de especies de palmas en dos localidades del Chocó: Capurganá y Santo Domingo (Tabla 2). Utilizamos imágenes satelitales para encontrar sitios apropiados para establecer 20 transectos en bosques de tierras bajas no inundables sin aparente influencia humana (10 en Capurganá y 10 en Santo Domingo). Cada transecto tuvo un tamaño de 5 × 500 m y fue dividido en 100 subunidades de 5 × 5 m. Estos se ubicaron estratificadamente a una distancia de 500 m cada uno siguiendo el protocolo establecido por Balslev et al. (2010). Se registró la localización geográfica en el punto medio de cada transecto con un GPS utilizando el sistema de coordenadas Universal Transversal Mercator (UTM). En cada subunidad, identificamos y contamos todos los individuos de palmas presentes de todos los estados de crecimiento (plántulas, juveniles, subadultos y adultos) siguiendo las definiciones de categorías de crecimiento propuestas por Balslev et al. (2010). Las muestras de las especies recolectadas fueron depositadas en los herbarios de la Universidad Nacional de Colombia sede Medellín (MEDEL) y la Pontificia Universidad Católica del Ecuador (QCA).
TABLA 2: Localidades de los 20 transectos de comunidades de palmas realizados en el Chocó biogeográfico TABLE 2: Localities of 20 transects of palm communties in the Chocó region
| Localidades | Provincia | País | Altura | Latitud | Longitud |
| Capurganá | Acandí | Colombia | 235 | 8°38'40.0" | 77°21'40.0" |
| Capurganá | Acandí | Colombia | 189 | 8°38'43.8" | 77°21'39.1" |
| Capurganá | Acandí | Colombia | 355 | 8°38'28.2" | 77°21'49.2" |
| Capurganá | Acandí | Colombia | 294 | 8°38'38.6" | 77°22'01.3" |
| Capurganá | Acandí | Colombia | 197 | 8°36'42.2" | 77°21'22.4" |
| Capurganá | Acandí | Colombia | 275 | 8°36'53.0" | 77°21'30.6" |
| Capurganá | Acandí | Colombia | 395 | 8°37'11.3" | 77°22'38.4" |
| Capurganá | Acandí | Colombia | 225 | 8°36'48.8" | 77°21'29.8" |
| Capurganá | Acandí | Colombia | 104 | 8°36'52.2" | 77°20'54.3" |
| Capurganá | Acandí | Colombia | 233 | 8°36'46.9" | 77°20'6.03" |
| Sto. Domingo | Sto. Domingo | Ecuador | 232 | 0° 02'04.19" | 79°24'18.73" |
| Sto. Domingo | Sto. Domingo | Ecuador | 238 | 0° 01'21.74" | 79°23'54.74" |
| Sto. Domingo | Sto. Domingo | Ecuador | 236 | 0° 01'08.92" | 79°23'33.66" |
| Sto. Domingo | Sto. Domingo | Ecuador | 251 | 0° 00'54.42" | 79°23'13.76" |
| Sto. Domingo | Sto. Domingo | Ecuador | 159 | 0° 35'24.52" | 79°21'36.58" |
| Sto. Domingo | Sto. Domingo | Ecuador | 193 | 0° 35'32.73" | 79°21'50.59" |
| Sto. Domingo | Sto. Domingo | Ecuador | 195 | 0° 35'41.00" | 79°21'40.59" |
| Sto. Domingo | Sto. Domingo | Ecuador | 519 | 0° 17'15.29" | 79°08'22.27" |
| Sto. Domingo | Sto. Domingo | Ecuador | 573 | 0° 14'22.73" | 79°09'21.14" |
| Sto. Domingo | Sto. Domingo | Ecuador | 198 | 0° 35'37.21" | 79°21'45.35" |
Las muestras de suelos fueron recolectadas a lo largo de cada transecto a 0, 250 y 500 m, correspondiendo a las subunidades 1, 50 y 100. En total, se analizaron 57 muestras de suelo, tres por cada transecto (Capurganá: 28, Santo Domingo: 29). Para tres de ellos, solo se analizaron dos muestras de suelo. Cada una fue obtenida al mezclar cinco submuestras recolectadas en cada esquina y en el centro de la subunidad a una profundidad de 0 - 10 cm. Primero, se retiró la capa de materia orgánica, las piedras, raíces y material diferente al suelo. Las muestras fueron secadas al aire libre y almacenadas en bolsas ziploc en campo. Seguidamente, se analizaron en el laboratorio de suelos de la Universidad de Aarhus de Dinamarca. La extracción de nutrientes (Al, Ca, Mg, K, Na y P) se realizó con la técnica Mehlich-III (Mehlich, 1984) y las concentraciones se analizaron con espectrometría de emisión con plasma de acoplamiento inductivo (ICP-OES). Para los análisis, se utilizó el promedio de la concentración de nutrientes de cada transecto.
Análisis de los datos: Para calcular la similitud florística entre transectos, se utilizó el índice de Sørensen, para datos de presencia - ausencia, y el índice de Steinhaus, para datos de abundancia. Para calcular este último, se utilizó la fórmula 2 W / (A + B), donde W es la abundancia de especies compartidas entre dos transectos, A es la suma de las abundancias de todas las especies en el primer transecto y B es la suma de las abundancias de todas las especies en el segundo transecto (Legendre & Legendre, 2012). Para explorar las diferencias en la composición florística entre los sitios de muestreo, se realizó una ordenación usando la prueba de escalamiento multidimensional no métrico (NMDS), la cual mapea los valores de disimilitud florística entre sitios en un espacio de ordenación con un número predefinido de dimensiones (Minchin, 1987). También se produjo una ordenación bidimensional utilizando la función metaMDS en el paquete R VEGAN (Oksanen et al., 2016) y se proyectaron las variables de suelo en la ordenación utilizando la función envfit. Asimismo, se calcularon los coeficientes de correlaciones al cuadrado (R2) para cada predictor en relaciones con los ejes NMDS y se determinó su importancia o probabilidad estadística con una prueba de permutación de Monte Carlo utilizando 999 permutaciones aleatorias.
Distancias geográficas: Para medir la distancia geográfica entre sitios y transectos, se utilizaron las coordenadas geográficas (UTM). Por su parte, la matriz de distancia geográfica se calculó utilizando la distancia euclidiana con datos transformados a logaritmo en base 10 (Andersen et al., 2010). Adicionalmente, se aplicó una transformación logarítmica con el fin de hacer más simétrica la distribución de los datos y con el fin de que se acercara más a la distribución normal.
Test de Mantel y Mantel parcial: Se realizó esta prueba para calcular si la disimilitud en composición florística está correlacionada con la disimilitud en la concentración de nutrientes de suelo. Este se aplicó tanto con datos de presencia - ausencia como con datos de abundancias. Es importante aclarar que transformamos todas las variables edáficas al logaritmo en base 10 antes de los análisis. Cada una de ellas se estandarizó (promedio = 0, varianza = 1) antes de combinarlas en una matriz de distancia euclidiana. Asimismo, se realizó un test parcial de Mantel para controlar la autocorrelación espacial y así evitar inflar la importancia de las variables ambientales. Se utlizó el estadístico de Mantel (rM) y establecimos la significancia estadística de las correlaciones en P < 0.001 con un test de Monte Carlo con 999 permutaciones aleatorias. Por último, para observar la relación entre la abundancia de las palmas del sotobosque, dosel y las bases intercambiables, se realizó un análisis de correlación y regresión lineal simple. Todos las pruebas con Mantel y Mantel parcial fueron realizadas con la función mantel en R, del paquete VEGAN (Oksanen et al., 2016) y, en general, todos los análisis fueron realizados con el programa estadístico R versión 3.3.2. (R Development Core Team, 2017).
RESULTADOS
Patrones generales florísticos y edáficos: Un total de 9 158 individuos y 33 especies de palmas fueron registrados en 20 transectos que cubren una área de 5 ha (Tabla 3). La abundancia de palmas en los trasenctos varió en un rango de 96 - 1 670 individuos (media ± DS: 868 ± 319) y 7 - 15 especies (media ± DS: 6 ± 2). Las especies más frecuentes fueron Synechanthus warscewiczianus (presente en 18 de 20 transectos), Socratea exorrhiza (17 / 20) y Geonoma cuneata (16 / 20). Las más abundantes fueron Welfia regia (2 060 individuos), Phytelephas macrocarpa (1 726) y Synechanthus warscewiczianus (1 088). Cuatro especies (Attalea allenii, Desmoncus cirrhifer, Geonoma calyptrogynoidea y Geonoma undata) fueron encontradas en solo un transecto y siete (Astrocaryum standleyanum, Bactris barronis, Bactris gasipaes var. chichagui, Chamaedorea pinnatifrons, Geonoma interrupta, Iriartea deltoidea, Phytelephas macrocarpa) se identificaron en al menos 10 transectos (Tabla 3). De las 33 especies registradas, 15 fueron exclusivas de Santo Domingo y 11 de Capurganá. Únicamente siete se comparten entre los dos sitios. Las especies de dosel más abundantes fueron Welfia regia y Socratea exorrhiza y las del sotobosque fueron Phytelephas macrocarpa y Synechanthus warscewiczianus (Tabla 3). Los valores de disimilitud florística para el índice de Sørensen fueron 0.04 - 0.90 (media = 0.48), y para el índice de Steinhaus fueron 0.19 - 0.99 (media = 0.77).
TABLA 3: Abundancia y frecuencia de las 33 especies registradas en 20 transectos en dos regiones del Chocó biogeográfico. TABLE 3: Abundance and frequency of the 33 species recorded in 20 transects in two regions in the Chocó
| Especie | Abundancia | Promedio ± DS | Frecuencia | Capurganá | Sto. Domingo | Sotobosque | Dosel |
| Welfia regia H. Wendl. ex Andres | 2060 | 686.66 ± 670.20 | 3 | 2 060 | - | - | x |
| Synechanthus warscewiczianus H.Wendl. | 1088 | 57.26 ± 98.13 | 18 | 88 | 1000 | x | - |
| Phytelephas macrocarpa Ruiz & Pav. | 1726 | 86.3 ± 107.92 | 10 | 1 726 | - | x | - |
| Socratea exorrhiza (Mart.) H. Wendl. | 511 | 28.38 ± 38.11 | 17 | 329 | 182 | - | x |
| Bactris barronis L. H. Bailey | 453 | 22.65 ± 29.76 | 10 | 453 | - | x | - |
| Geonoma cuneata H. Wendl. ex Spruce | 407 | 25.43 ± 33.74 | 16 | 322 | 85 | x | - |
| Geonoma interrupta (Ruis & Pav.) Mart. | 383 | 19.15 ± 24.94 | 10 | 383 | - | x | - |
| Iriartea deltoidea Ruiz & Pav. | 370 | 25.33 ± 36.27 | 11 | 86 | 284 | - | x |
| Wettinia kalbreyeri (Burret) R. Bernal | 349 | 87.25 ± 29.71 | 4 | 349 | - | - | x |
| Prestoea ensiformis (Ruiz & Pav.) H. E.Moore | 316 | 158 ± 19.79 | 2 | - | 316 | x | - |
| Chamaedorea pinnatifrons (Jacq.) Oerst. | 279 | 25.36 ± 37.26 | 10 | 273 | 6 | x | - |
| Bactris gasipaes Kunth var. chichagui (H. Karst.) A. J. Hend. | 201 | 20.02 ± 16.52 | 10 | 201 | - | - | x |
| Phytelephas aequatorialis Spruce | 129 | 16.125 ± 12.92 | 8 | - | 129 | x | - |
| Chamaedorea allenii L. H. Bailey | 127 | 6.35 ± 10.75 | 9 | 127 | x | - | |
| Chamaedorea linearis (Ruiz & Pav.) Mart. | 102 | 17 ± 22.88 | 6 | - | 102 | x | - |
| Astrocaryum standleyanum L. H. Bailey | 100 | 4.4 ± 5.15 | 13 | 88 | 12 | - | x |
| Pholidostachys dactyloides H. E. Moore | 83 | 16.6 ± 18.32 | 5 | - | 83 | x | - |
| Bactris maraja Mart. | 82 | 4.1 ± 7.62 | 8 | 82 | - | x | - |
| Wettinia aequalis (O. F.Cook & Doyle) R. Bernal | 62 | 31 ± 2.82 | 2 | - | 62 | x | - |
| Calyptrogyne costatifrons (L. H. Bailey) de Nevers | 58 | 2.9 ± 10.80 | 3 | 58 | - | x | - |
| Wettina quinaria (O. F. Cook & Doyle) Burret | 47 | 4.27±8.50 | 5 | 37 | 10 | - | x |
| Bactris hondurensis Standl. | 46 | 2.3 ± 12.51 | 2 | 46 | - | x | - |
| Attalea colenda (O. F.Cook) Balslev & A. J. Hend. | 41 | 20.5± 19.09 | 2 | 41 | - | - | x |
| Attalea allenii H. E. Moore | 37 | 3.9 ± 10.29 | 1 | 37 | - | x | - |
| Hyospate elegans Mart. | 30 | 10 ± 7 | 3 | - | 30 | x | - |
| Bactris coloradonis L. H. Bailey | 26 | 4.72 ± 10.27 | 2 | 26 | - | x | - |
| Oenocarpus bataua Mart. | 15 | 3.75 ± 4.27 | 4 | - | 15 | - | x |
| Desmoncus orthacanthos Mart. | 8 | 0.4 ± 0.94 | 5 | 8 | - | x | - |
| Aiphanes tricuspidata Borchs. et al | 6 | 0.3 ± 1.12 | 2 | - | 6 | x | - |
| Geonoma undata Klotzsch | 6 | 6 | 1 | - | 6 | x | - |
| Chamadorea deneversiana Grayum & Hodel | 5 | 2.5 ± 2.12 | 2 | - | 5 | x | - |
| Desmoncus cirrhifer A.H. Gentry & Zardini | 4 | 4 | 1 | - | 4 | x | - |
| Geonoma calyptrogynoidea Burret | 1 | 1 | 1 | 1 | - | x | - |
Por su parte, las concentraciones de nutrientes no presentaron mayores diferencias entre regiones (t = 1.34, P = 0.21). Sin embargo, los suelos de Capurganá presentaron concentraciones más altas que los de Santo Domingo (Tabla 4). La concentración de bases intercambiables (Ca, K, Mg) fue cuatro veces mayor en Capurganá que en Santo Domingo y presentó una alta variación entre transectos en ambas regiones. Los nutrientes que más contribuyeron a la concentración de bases intercambiables fueron Ca y Mg (Tabla 4). Cabe agregar que la concentración de los nutrientes como Ca, Mg y Na fueron mayores en Capurganá, mientras que el Al, pH, K, P fueron mayores en Santo Domingo (Tabla 4).
TABLA 4: Promedioy rango de la concentración de nutrientes en dos localidades del Chocó biogeográfico .TABLE 4: Means and ranges of nutrient concentrations in two localities in the Chocó region
| Variable edáfica | Localidad | - |
| - | Capurganá | Sto. Domingo |
| Ca + K + Mg | 44.53 (18.79 - 71.47) | 10.44 (5.59 - 18.52) |
| ECE | 45.25 (19.30 - 72.39) | 10.68 (5.72 - 18.64) |
| Al | 0.01 (0.01 - 0.04) | 0.02 (0.01 - 0.09) |
| pH | 4.97 (4.66 - 5.36) | 5.23 (4.91 - 5.69) |
| Ca | 30.08 (7.66 - 52.71) | 8.31 (4.24 - 15.10) |
| K | 0.07 (0.004 - 0.30) | 1.66 (0.82 - 2.79) |
| Mg | 14.42 (6.90 - 21.41) | 0.19 (0.08 - 0.44) |
| Na | 0.42 (0.07 - 0.71) | 0.05 (0.04 - 0.06 ) |
| P | 2.20 (1.63 - 3.23) | 5.15 (1.06 - 11.67) |
Las concentraciones de Al, Ca, K Mg y Na en cmolc/kg. Concentraciones del P en mg/kg.
Los nutrientes que más aportaron a la variación de la composición florística en las regiones fueron Ca, Mg, Na, K y P (Tabla 5) según el análisis de NMDS. Los valores de correlaciones del NMDS muestran que la composición florística y abundancia de palmas está fuertemente correlacionada con todas las variables edáficas, con excepción del Al y el pH (Tabla 5, Fig. 1). Además, el pH, P y K muestran un patrón similar y son más importantes en Santo Domingo (Fig. 1). El pH y el Al fueron las variables que menos se correlacionaron con el resto de las variables, mientras que el Na y Mg presentaron las mayores correlaciones (r = 0.90), seguidos por Ca y Mg (r = 0.88) (Tabla 6).
TABLA 5: Coeficientes de correlación de las variables edáficas según un escalamiento multidimensional no métrico (NMDS) de 20 transectos en el Chocó biogeográfico. TABLE 5: Correlation coefficients of edaphic variables according to a non-metric multidimensional scaling ordination of 20 transects in the Chocó region
| - | NMDS1 | NMDS2 | R2 | P-valor |
| Bases intercambiables (Ca + K + Mg) | -0.969 | -0.243 | 0.702 | 0.001*** |
| Al | 0.873 | 0.486 | 0.152 | 0.212 |
| pH | 0.578 | -0.815 | 0.262 | 0.064 |
| Ca | -0.933 | -0.359 | 0.617 | 0.001*** |
| K | 0.954 | -0.299 | 0.596 | 0.003** |
| Mg | -0.999 | -0.005 | 0.909 | 0.001*** |
| Na | -0.981 | -0.192 | 0.600 | 0.003** |
| P | 0.373 | -0.927 | 0.469 | 0.008** |
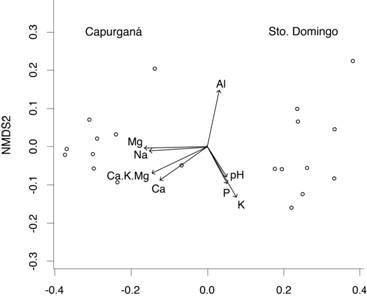
Fig. 1 Escalamiento multidimensional no métrico (NMDS) que muestra las proyecciones de las variables edáficas en 20 transectos en el Chocó biogeográfico, basado en la disimilitud en la composición florística medida con del índice de Steinhaus (Stress = 0.071). Fig. 1. Non-metric multidimensional scaling (NMDS) with projection of soil variables in 20 transects in the Chocó region, based on the dissimilarity of floristic composition as measured with the Steinhaus index (Stress = 0.071).
TABLA 6: Coeficiente de correlación lineal de Pearson entre las variables edáficas en 20 transectos en el Chocó biogeográfico. TABLE 6: Linear Pearson correlation coefficient between edaphic variables in 20 transects in the Chocó region
| - | - | - | - | Variables edáficas | - | - | - | |
| Variables edáficas | Mg | Ca | Na | K | P | Al | Ca+K+Mg | ECE |
| pH | -0.56 | -0.35 | -0.56 | 0.62 | 0.59 | 0.01 | -0.42 | -0.43 |
| Mg | - | 0.88 | 0.90 | -0.71 | -0.47 | -0.34 | 0.94 | 0.94 |
| Ca | - | - | 0.81 | -0.56 | -0.33 | -0.45 | 0.98 | 0.98 |
| Na | - | - | - | -0.64 | -0.45 | -0.33 | 0.86 | 0.87 |
| K | - | - | - | - | 0.52 | 0.009 | -0.62 | -0.62 |
| P | - | - | - | - | - | 0.14 | -0.38 | -0.38 |
| Al | - | - | - | - | - | - | -0.43 | -0.43 |
| Ca+ K+ Mg | - | - | - | - | - | - | - | -0.43 |
Relación entre la composición florística y edáfica: La correlación entre las matrices de disimilitud en composición florística y edáfica, según los datos de presencia - ausencia, fue 0.69 y, según los datos de abundancia, fue 0.63 (P = 0.001 para ambos casos). Por otro lado, la correlación entre la disimilitud florística y geográfica fue estadísticamente significativa, tanto para los datos de presencia - ausencia (rM = 0.75, P = 0.001) como de abundancia (rM = 0.71, P = 0.001) (Tabla 7A). Todas estas relaciones entre la distancia geográfica y las variables edáficas fueron estadísticamente significativas excepto para el pH y el Al (Tabla 7B). El test de Mantel parcial entre las matrices de disimilitud florística y edáfica, que controlaba el efecto de la distancia geográfica, también arrojó resultados estadísticamente significativos para datos de presencia - ausencia (rM = 0.31, P = 0.001) y de abundancia (rM = 0.24, P = 0.002) (Tabla 7A).
TABLA 7: Test de Mantel entre las matrices de disimilitud florística y edáfica en 20 transectos en el Chocó biogeográfico y test de Mantel parcial (A) y test de Mantel entre las variables edáficas individuales y la distancia geográfica (B). TABLE 7: Mantel test between floristic and edaphic dissimilarities in 20 transects in the Chocó region, and partial Mantel test (A) and Mantel test between individual edaphic variables and geographic distance (B)
| (a) | - | - | |||
|---|---|---|---|---|---|
| - | Test de Mantel | Test Parcial de Mantel | |||
| Variables edáficas | Presencia/ ausencia | Abundancia | Presencia/ ausencia | Abundancia | |
| Todos los suelos | 0.69 *** | 0.63*** | 0.31 *** | 0.24** | |
| Bases intercambiables | 0.63*** | 0.57*** | 0.31*** | 0.23** | |
| Distancia geográfica | 0.75*** | 0.71*** | |||
| Al | 0.12** | 0.21** | 0.20** | 0.32** | |
| ECEC | 0.63*** | 0.57*** | 0.31*** | 0.22*** | |
| pH | 0.05 | 0.04 | -0.17 | -0.15 | |
| Ca | 0.50*** | 0.46*** | 0.21** | 0.16** | |
| K | 0.33*** | 0.26*** | 0.03 | -0.04 | |
| Mg | 0.77*** | 0.67*** | 0.46*** | 0.29*** | |
| Na | 0.58*** | 0.44*** | 0.14** | -0.08 | |
| P | 0.36*** | 0.35*** | 0.15** | 0.14** | |
| (b) | rM | P - valor | - | - | |
| Ca+K+Mg | 0.63 | 0.001 | - | - | |
| CEC | 0.63 | 0.001 | - | - | |
| Al | -0.01 | 0.502 | - | - | |
| pH | 0.21 | 0.012 | - | - | |
| Ca | 0.51 | 0.001 | - | - | |
| K | 0.41 | 0.001 | - | - | |
| Mg | 0.75 | 0.001 | - | -- | |
| Na | 0.67 | 0.001 | - | - | |
| P | 0.36 | 0.001 | - | - | |
Relación entre bases intercambiables y abundancia: Se registraron 24 especies de palmas del sotobosque (Fig. 2A, Fig. 2B, Fig. 2C, Fig. 2D, Fig. 2E y Fig. 2F) y nueve del dosel (Fig. 2G, Fig. 2H, Fig. 2I, Fig. 2J, Fig. 2K y Fig. 2L). Al considerar ambas localidades conjuntamente, se encontró una relación significativa entre las bases intercambiables (Ca + K+ Mg) y la abundancia de las palmas del sotobosque (r2 = 0.37, P = 0.004). Sin embargo, al analizar por separado ambas zonas, se encontró un patrón diferente. En Capurgná, por un lado, las bases intercambiables no presentaron una relación estadísticamente significativa con la abundancia de palmas del sotobosque (Fig. 3A) o dosel (Fig. 3B). Por otro lado, en Santo Domingo las bases intercambiables sí presentaron una relación estadísticamente significativa con la abundancia de palmas de sotobosque (Fig. 3C), pero no con las de dosel (Fig. 3D).

Fig. 2 Ejemplo de especies de palmas de sotobosque (A - F) y dosel (G - L) que crecen en los bosques del Chocó biogeográfico. (A) Phytelephas macrocarpa, (B) Chamaedorea allenii, (C) Bactris barronis, (D) Geonoma cuneata, (E) Chamaedorea deneversiana, (F) Aiphanes tricuspidata, (G) Attalea colenda, (H) Astrocaryum standleyanum, (I) Bactris gasipaes var. chichagui, (J) Iriartea deltoidea, (K) Socratea exorrhiza, (L) Wettinia quinaria. Fig. 2. Examples of palm species of the understory (A - F) and canopy (G - L) that grow in the Chocó region’s forests. (A) Phytelephas macrocarpa, (B) Chamaedorea allenii, (C) Bactris barronis, (D) Geonoma cuneata, (E) Chamaedorea deneversiana, (F) Aiphanes tricuspidata, (G) Attalea colenda, (H) Astrocaryum standleyanum, (I) Bactris gasipaes var. chichagui, (J) Iriartea deltoidea, (K) Socratea exorrhiza, (L) Wettinia quinaria.
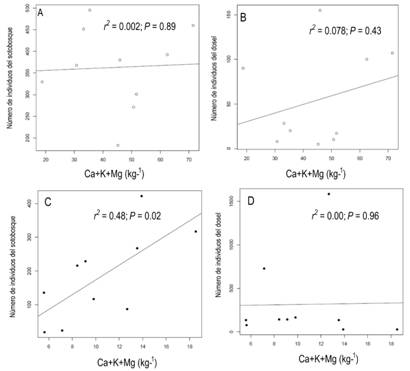
Fig. 3 Relación entre el número de individuos de palmas de (A) sotobosque de Capúrganá, (B) dosel de Capurganá, (C) sotobosque de Santo Domingo, (D) dosel de Santo Domingo con el promedio de concentración de bases intercambiables (Ca + Mg + K) en el Chocó biogeográfico. Fig. 3. Relationship between the number of palm individuals in the (A) understory of Capurganá, (B) canopy of Capurganá, (C) understory of Santo Domingo, (D) canopy of Santo Domingo with the concentration of mean exchangeable bases (Ca + Mg + K) in the Chocó region.
Respuesta de las palmas más abundantes a las bases intercambiables y P: Las especies de sotobosque Geonoma cuneata, G. interrupta y Phytelephas macrocarpa fueron las más abundantes a bajas concentraciones de P, mientras que Synechanthus warscewiczianus fue la más abundante en suelos con altas concentraciones de P (Fig. 4A). A su vez, S. warscewiczianus mostró preferencia por suelos con bajas concentraciones de bases intercambiables, mientras que G. cuneata, G. interrupta y P. macrocarpa abundaron en los transectos con altas concentraciones de bases intercambiables (Fig 4B). Entre las palmas del dosel, se encontró que Socratea exorrhiza crecía más en todo el gradiente de P y bases intercambiables (Fig. 4C, Fig. 4D, mientras que Iriartea deltoidea lo hacía en suelos con concentración intermedias de P y bases intercambiables (Fig. 4C, Fig. 4D).
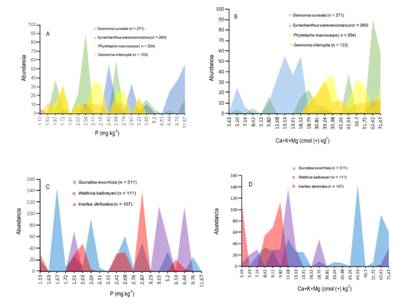
Fig. 4 Abundancia de las palmas del sotobosque y del dosel a lo largo del gradiente de concentración de fósforo (P) y bases intercambiables (Ca + K + Mg) en 20 transectos en el Chocó biogeografico: (A - B) sotobosque. (C - D) dosel. Fig. 4. Abundance of understory and canopy palms along the concentration gradient of phosphorus (P) and exchangeable bases (Ca + K + Mg) in 20 transects in the Chocó region: (A - B) understory. (C - D) canopy.
DISCUSIÓN
La concentración de nutrientes de los suelos de Capurganá y Santo Domingo presentó una variación que está dentro de los rangos resgistrados anteriormente en el Chocó biogeográfico (Faber-Langendoen & Gentry, 1991; Galeano, 2001; Quinto-Mosquera & Moreno-Hurtado, 2016) y en la Amazonia que también posee los suelos de tierras firmes y un promedio similar de precipitación (Poulsen, Tuomisto, & Balslev, 2006; Kristiansen et al., 2012). Una explicación a la alta variación en la concentración de nutrientes de los suelos en esta investigación es que los suelos en el Chocó suelen ser más ricos en nutrientes en lugares donde la precipitación es menor (Quinto-Mosquera & Moreno-Hurtado, 2016) y, en este estudio, se muestrearon transectos con un rango de precipitación de 2 983 - 3 340 mm, donde presentaban mayores promedios de concentración las bases intercambibles en Capurganá que en Santo Domingo. Mientras tanto, en el caso del P, por ejemplo, la concentración promedio en Santo Domingo fue más del doble que en Capurganá (Tabla 4).
Nuestros resultados apoyan la hipótesis general de que la composición florística de los bosques tropicales está relacionada con los nutrientes del suelo. Si bien esto se ha demostrado en bosques amazónicos y en Panamá (Poulsen et al., 2006; Kristiansen et al., 2012; Garibaldi, Nieto-Ariza, Macía, & Cayuela, 2014; Tuomisto et al., 2014; Cámara-Leret et al., 2017; Stevenson et al., 2018; Muscarella et al., 2018), nuestro estudio es el primero en resaltar que, en las tierras bajas del Chocó, la composición de las comunidades de palmas está relacionada con los nutrientes: los suelos con concentraciones bajas en bases intercambiables son más ricos en especies.
Asimismo, en esta investigación, las variables edáficas mayormente correlacionadas con la composición florística, según el test de Mantel, fueron Mg, Ca, Na, y P. Esto sugiere que, al igual que en Amazonia (Peñas-Claros et al., 2012, Cámara-Leret et al., 2017), en las tierras bajas del Chocó biogeográfico las bases intercambiables y el P son los factores importantes que determinan la composición de las comunidades de palmas. El rol del P como determinante de la distribución de árboles también se ha comprobado en las Dipterocarpaceae en Borneo (Paoli, Curran, & Zak, 2006) y Entandrophragma en África (Hall, Mckenna, Ashton, & Gregoire, 2004). Las bases intercambiables son más importantes para explicar la composición de especies de palmas en Capurgana, mientras que, en Santo Domingo, el P explica la riqueza de especies (Fig. 1). Nuestros resultados son consistentes con los de Garibaldi et al. (2014) quienes, en la Península Azuero de Panamá, encontraron que la fertilidad y el P presentan una alta correlación con la composición florística.
Por otra parte, se encontró una pequeña relación positiva entre las bases intercambiables y la abundancia de palmas de sotobosque en las tieras bajas del Chocó biogeográfico. Estos resultados son el reflejo de las altas abundancias de algunas especies de palmas del sotobosque como Phytelephas macrocarpa que es una especie indicadora de suelos ricos en nutrientes (Kahn & Mejia, 1990). Aunque no se detectó una diferencia significativa entre las bases intercambiables y las palmas del dosel, esto puede deberse a que esas plantas tienden a ser más generalistas. Por ejemplo, Socratea exorrhiza (una palma de dosel) estuvo presente en casi todos los transectos y con abundancias muy semejantes entre cada uno. Lo mismo se ha reportado en la Amazonia (Cámara-Leret et al., 2017), donde Socratea exorrhiza crece tanto en suelos pobres como ricos en nutrientes. Lastimosamente, nuestros datos no permiten explorar la respuesta de especies de dosel con baja abundancia, como Oenocarpus bataua, la cual crece en suelos pobres en nutrientes en la Amazonia occidental (Cámara-Leret et al., 2017).
Las bajas correlaciones entre la fertilidad y palmas, tanto de sotobosque como de dosel, pueden deberse al que las muestras se limitaron a una parte del gradiente climático del Chocó (Capurganá al norte y Santo Domigo al sur). También se observó que algunas especies fueron más abundantes en sitios con determinada concentración de nutrientes, por ejemplo, la palma de dosel Iriartea deltoidea fue más abundante en suelos medianamente fértiles y con concentración medias de P. Esto es similar a lo reportado en la Amazonia occidental (Cámara-Leret el al., 2017). Otras palmas como Geonoma cuneata son más abundantes en suelos pobres en bases intercambiables y con baja concentración de P. Igualmente, Wettia quinaria, Welfia regia y Oenocarpus bataua eran más frecuentes en suelos pobres en nutrientes y en lugares con altas precipitaciones. Por el contrario, especies como Phytelephas macrocarpa y Astrocayrum standleyanum fueron muy abundantes en sitios ricos en nutrientes.












 uBio
uBio 

