Introducción
La familia Felidae comprende 37 especies recientes, de las cuales 13 se distribuyen en América: 10 son de afinidad principalmente tropical, dos Neártica y una de distribución casi continental (Wilson & Mittermeier, 2009). Sin embargo, el 15 % se encuentra en la categoría En Peligro o Peligro Crítico, 17.5 % Cerca de Amenaza y 32.5 % Vulnerable (IUCN, 2017), y han perdido parte de su área de distribución original, por lo que requieren de estrategias de conservación, como el manejo de felinos en áreas cercanas a poblaciones humanas, reintroducción, reproducción en cautiverio o conservación de corredores biológicos y de hábitat (Nowell & Jackson, 1996). Además de la integración del factor humano en la conservación de estas especies, las estrategias requieren del conocimiento básico de la biología y ecología de las especies, incluyendo información acerca del tamaño poblacional y sus tendencias, lo cual es desconocido para muchas especies, debido a características conductuales o ecológicas como la talla pequeña, hábitos crípticos, ámbitos hogareños grandes o hábitat de difícil acceso (Nowell & Jackson, 1996; Gittleman & Gompper, 2005). Para otro conjunto de especies, entre las que se encuentra el jaguar (Panthera onca), hay datos que permiten conocer la distribución del tamaño poblacional y pueden ser usados para identificar las regiones con las poblaciones más abundantes (Tôrres et al., 2012; Martínez-Meyer, Díaz-Porras, Peterson, & Yáñez-Arenas, 2013), o prioritarias para establecer estrategias efectivas de conservación (Nowell & Jackson, 1996).
El tamaño poblacional es variable entre las regiones donde se distribuye una especie, presenta valores altos en pocos lugares y es baja en la mayoría de las localidades donde está presente (Brown, 1984). Está afectada por factores bióticos y abióticos en como la disponibilidad de recursos, condiciones ambientales e interacciones bióticas y es una respuesta de la población a lo bien que un sitio específico satisface sus necesidades para sobrevivir y reproducirse (Brown, 1984; Maguire, 1973; VanDerWal, Shoo, Johnson, & Williams, 2009).
Se han formulado varias hipótesis para tratar de explicar la variación espacial del tamaño poblacional, especialmente con el objetivo de predecir dónde se encontrarán las poblaciones más grandes o dónde estarían las poblaciones más susceptibles de desaparecer. Brown (1984) considera que las poblaciones presentan mayor abundancia en el centro de su distribución geográfica, porque ese lugar cuenta con las mejores condiciones ambientales, que le permiten tener una mayor tasa reproductiva y menor tasa de mortandad. Esto posteriormente fue conocido como la hipótesis del centro-abundancia. Aunque hay estudios que avalan este patrón (Bayne, Boutin, & Moses, 2008; Williams, Ives, & Applegate, 2003), otro conjunto de estudios concluye que hay factores que deben considerarse, incluyendo las variaciones micro ambientales, la historia geológica de las áreas, la capacidad de adaptación de la especie a cada región (Sagarin, Gaines, & Gaylord, 2006), así como su relación positiva con la productividad y la latitud (Bitetti et al., 2008).
También se ha propuesto que la variación espacial de la abundancia poblacional puede inferirse a través de modelos de idoneidad ambiental (VanDerWal et al., 2009). Estos modelos intentan reflejar las condiciones ambientales donde la especie está presente a través de cuantificar la relación entre las variables ambientales de los sitios con presencia confirmada de la especie (i.e., localidades donde se ha registrado a la especie; Soberón, 2010). Los sitios con mayor idoneidad ambiental representarían las mejores condiciones ambientales para la especie según sus óptimos fisiológicos, por lo que el tamaño poblacional es alto, mientras que las poblaciones menos numerosas se ubicarían en regiones con menor idoneidad ambiental (VanDerWal et al., 2009). Así que la relación entre la idoneidad ambiental predicha de los modelos generados a partir de datos de presencia y la abundancia local debería ser positiva, como efectivamente lo corroboran varios estudios (VanDerWal et al., 2009; Oliver et al., 2012; Carrascal, Aragón, Palomino, & Lobo, 2015). Sin embargo, en otro conjunto de especies, la relación es débil o inexistente (Pearce & Ferrier, 2001; Jiménez-Valverde, Diniz, de Azevedo, Borges, & 2009; Filz, Schmitt, & Engler, 2013).
También se ha propuesto otra vía de análisis para determinar el patrón del tamaño poblacional a través del nicho ecológico (Maguire, 1973; Martínez-Meyer et al., 2013). Teóricamente el nicho presenta una estructura interior, donde la población sobrevive y se reproduce exitosamente sin la necesidad de inmigración, y áreas periféricas, donde las tasas de supervivencia y reproducción decrecen hasta llegar a los límites del nicho (Maguire, 1973). Tomando en cuenta esta situación, las poblaciones más abundantes de una especie estarían ubicadas en el centroide del nicho y el tamaño poblacional declinaría conforme aumenta la distancia a él (Yáñez-Arenas, Martínez-Meyer, Mandujano, & Rojas-Soto, 2012; Martínez-Meyer et al., 2013). Para este caso, el nicho, desde la perspectiva Grinneliana, es definido como un conjunto de variables escenopoéticas (i.e., variables climáticas o físicas) que permiten a una población sobrevivir y reproducirse (Soberón, 2010). Varios estudios proporcionan evidencia que documentan la relación negativa entre el tamaño poblacional y la distancia al centroide del nicho ecológico, incluyendo P. onca, el coyote (Canis latrans), y venado cola blanca (Odocoileus virginianus), entre otras (Lira-Noriega & Manthey, 2013; Martínez-Meyer et al., 2013; Manthey et al., 2015; Ureña-Aranda et al., 2015; pero ver Santini, Pironon, Maiorano, & Thuiller, 2018).
Debido a que los datos de presencia de una especie son más fáciles de obtener que otra información, como el tamaño poblacional, estos pueden servir para generar un mecanismo viable en la identificación de áreas con poblaciones grandes o áreas susceptibles de extinción local y el establecimiento de acciones de conservación efectivas. Sin embargo, la información del tamaño poblacional y sus variaciones a través de la distribución de las especies de felinos es desconocida para la mayoría, sólo P. onca cuenta con más de 70 estudios donde se estima su abundancia (Tobler & Powell, 2013), y los del ocelote (Leopardus pardalis), el lince (Lynx rufus), y el puma (Puma concolor) se están incrementando. Así que estas cuatro especies fueron elegidas por presentar un mayor número de datos del tamaño poblacional y pueden ser usados para identificar los patrones de la distribución del tamaño poblacional para estas especies. El objetivo de este estudio fue evaluar la relación del tamaño poblacional con la idoneidad ambiental y el nicho en cuatro especies silvestres de la familia Felidae presentes en América: P. onca y L. pardalis, ambas de distribución principalmente Neotropical, así como L. rufus, de distribución Neártica, y P. concolor, de distribución amplia en América. Se espera que la densidad poblacional de los felinos esté correlacionada positivamente con la idoneidad ambiental y negativamente con el centroide del nicho.
Materiales y métodos
Recopilación de datos de tamaño poblacional: La medida del tamaño poblacional usada en este estudio fue la densidad, es decir, el número de individuos por unidad de superficie. Los valores densidad poblacional de las cuatro especies de felinos fueron obtenidos a partir de datos publicados hasta 2016 en revistas científicas, tesis y libros. Para cada registro se tomaron datos relativos a: 1) localidad: latitud, longitud, región, país, 2) especie, 3) origen de datos: método usado en la recolecta de datos, año, área de estudio y método usado en la estimación y 4) valor del tamaño poblacional estimado. Los valores de densidad poblacional fueron estandarizados como el número de individuos en 100 km2.
Recopilación de localidades de presencia: Los datos de presencia se obtuvieron de bases de datos en línea: Global Biodiversity Information Facility (GBIF; http://www.gbif.org), ARCTOS Multi-Institution-Multi-Collection-Museum Data-Base (http://arctos.database.museum/), Vernet Data-base (http://portal.vertnet.org/search), Instituto de Ciencias Naturales de la Universidad Nacional de Colombia (http://www.biovirtual.unal.edu.co); SpeciesLink de Brasil (http://www.splink.org.br), y la base de datos SNIB-CONABIO (www.conabio.gob.mx/remib). Se excluyeron datos asociados a ciudades, museos y registros de zoológicos. Se utilizó Google Maps para georreferenciar las localidades que no presentaran datos de latitud y longitud. Para ello se usaron los datos del nombre de la localidad, región y país, así como los mapas de las localidades presentes descritas en las fuentes originales.
Construcción de mapas de idoneidad ambiental: Se delimitó un área potencialmente accesible para cada especie para determinar el área geográfica a modelar (Manthey et al., 2015). Esta región fue seleccionada considerando 1) literatura publicada de la distribución de cada especie, 2) datos disponibles de presencia de la especie, 3) datos publicados de nuevas localidades y la ampliación del área de distribución, y 4) tipos de hábitat usados por la especie tomando como base la capa de Ecoregiones Global (http://maps.tnc.org/files/metadata/TerrEcos.xml). Se realizaron los modelos de idoneidad a través del programa MaxEnt versión 3.3.3 (Phillips, Anderson, & Schapire, 2006) y se usaron las 19 variables ambientales derivadas de valores promedios, máximos y mínimos de la precipitación y temperatura de WorldClim (Hijmans, Cameron, Parra, Jones, & Jarvis, 2005), con una resolución de 0.08 º. Se obtuvieron 10 modelos individuales para cada especie y se utilizó el 70 % del total de registros de presencia para la construcción del modelo y el resto para la validación. El modelo final fue el promedio de los 10 modelos. La evaluación de la calidad del modelo fue a través del área bajo la curva (AUC por sus siglas en inglés) y ROC (Receiver Operating Characteristic) parcial. El AUC es un estadístico generado directamente del programa MaxEnt, que mide el ajuste del modelo a los datos, puede ser usado cuando se evalúa una misma especie y área de estudio, y se entiende como la probabilidad de que un dato de presencia escogido al azar sea asignado a un área donde no hay registros. Valores cercanos a 1 indican que el modelo puede distinguir entre datos de presencias y datos del ambiente donde no se ha registrado a la especie (background), mientras que valores cercanos a 0.5 indican una predicción no es distinta de la obtenida por azar (Phillips et al., 2006). La ROC parcial fue obtenida mediante el paquete pROC (Robin et al., 2011). Los valores de cada pixel del modelo final generado a través de MaxEnt fueron usados como un índice de idoneidad ambiental, que va de 0 (sitios poco idóneos) a 1 (sitios con alta idoneidad, Duncan, Crespi, Mattheus, & Rissler, 2015). El límite de corte (i.e., umbral para distinguir las condiciones adecuadas y no adecuadas para la especie) fue el valor fijo acumulado de 1, debido a que proporciona un área más grande y un intervalo amplio de valores de idoneidad ambiental. Se utilizó el programa ArcMap versión 10.2.2 (Esri, 2014) para la preparación de las capas y la elaboración de los mapas finales de idoneidad ambiental.
Estimación del centroide del nicho ecológico: Para realizar el cálculo de centro de nicho se siguió el procedimiento propuesto por Yáñez-Arenas et al. (2012) y Martínez-Meyer et al. (2013). Cada variable usada en la construcción del modelo fue considerada como un eje del nicho. Primero, para cada especie se realizó un modelo binario (0 = ausencia; 1 = presencia) a partir del modelo de idoneidad generado en MaxEnt. El valor de límite de corte fue igual que para el modelo de idoneidad y los valores por debajo del umbral fueron igualados a 0 mientras y el resto fueron considerados como 1. Segundo, las áreas con los valores del modelo igualados a 1 fueron usadas como límite de corte para extraer datos de cada variable, así el área total abarcada por cada una de las 19 capas correspondió al total del área abarcada por el modelo. Se extrajeron los datos de cada variable y los valores fueron estandarizados de manera separada como la diferencia del valor de la media y el valor de cada pixel y dividida por su desviación estándar. Después, se calculó la Distancia Euclidiana (D = √(∑( x j − x ji ) 2 donde 𝑥 fue la media de la variable j y x ji fue el valor de la variable j en la localidad i con un dato de densidad poblacional) entre cada localidad con un valor de densidad conocida de la especie y el centroide del nicho. El centroide (i.e., punto de convergencia donde cada eje tuviera su óptimo) fue el punto el cual el valor de todas las variables fue igual a cero, dado que las variables originales fueron estandarizadas (Yáñez-Arenas et al., 2012; Martínez-Meyer et al., 2013).
Para probar la relación entre abundancia e idoneidad ambiental se realizaron análisis de correlaciones (lineal, exponencial, potencial o cúbica). El valor de la idoneidad ambiental correspondiente a cada localidad con un dato de densidad poblacional fue obtenido directamente del modelo de idoneidad generado por MaxEnt para cada especie. La relación entre la densidad poblacional y la distancia al centroide del nicho fue evaluada mediante correlaciones (exponencial, logarítmica o cúbica; Martínez-Meyer et al., 2013; Manthey et al., 2015). El valor de distancia al centroide del nicho fue obtenido directamente del cálculo de la distancia a través de la Distancia Euclidiana mencionado arriba. Las pruebas fueron realizadas con los programas Statistica version7 (Statsoft, 2005) y NCSS 2007 (Hintze, 2010) y se consideraron significativas cuando P ≤ 0.05. La correlación final fue la que tuviera un valor mayor en el coeficiente de correlación (Zar, 1999).
Resultados
Se obtuvieron 8 726 registros de presencia de las cuatro especies analizadas (Tabla 1; Apéndice 1). Los modelos generados a través de MaxEnt presentaron un valor del AUC entre 0.77 y 0.80 (Tabla 1). Se registraron 278 estudios con datos de densidad poblacional (Apéndice 2), la mayor cantidad fue para P. onca (n = 102) y la menor para L. rufus (n = 39; Tabla 1). La densidad promedio de L. pardalis fue 22 individuos / 100 km2 (DE = 19); la de L. rufus 16 individuos / 100 km2 (DE = 11); P. concolor y P. onca con 3 individuos / 100 km2 (DE = 2).
TABLA 1 TABLE 1 Registros de presencia, densidad poblacional y datos de los modelos de nicho para cuatro especies de Felidae presentes en América Presence records, pupulation densities and niche model data for four felid species present in América
| L. pardalis | L. rufus | P. onca | P. concolor | |
| Total de registros | 1 198 | 3 597 | 1 253 | 2 678 |
| Registros de construcción | 578 | 1 213 | 645 | 939 |
| Registros de validación | 247 | 519 | 276 | 402 |
| AUCa | 0.78 (0.014) | 0.77 (0.006) | 0.80 (0.07) | 0.80 (0.006) |
| pROCb | 0.67 (0.01) | 0.69 (0.01) | 0.65 (0.05) | 0.71 (0.001) |
| Total de estudios | 62 | 39 | 102 | 75 |
| Densidadc | 22 (19) | 16 (11) | 3 (2) | 3 (2) |
a Área bajo la curva. Valor de la desviación estándar de 10 réplicas entre paréntesis.
b Parcial del Receiver Operating Characteristic (ROC, por sus siglas en inglés).
c Número de individuos en 100 km2. Valor de la desviación estándar en paréntesis.
Idoneidad ambiental: Los valores de la correlación fueron mayores en el modelo lineal en comparación con los otros evaluados y sólo para una especie (L. rufus) fue más adecuado el modelo potencial. En general, los valores del coeficiente de correlación fueron bajos para las cuatro especies, de -0.002 a 0.36 (Tabla 2). La relación entre la densidad poblacional y el índice de idoneidad ambiental fue positiva y significativa para L. rufus (P = 0.02, Fig. 1), y negativa pero no significativa en las otras tres especies (P > 0.23; Tabla 2). Las áreas con mayor idoneidad ambiental para L. rufus fueron las regiones de la costa del Pacífico, las montañas Rocallosas, Grandes Lagos y la Península de Florida en Estados Unidos, así como en la Sierra Madre Occidental, la costa del Golfo de México y el Eje Neovolcánico en México (Fig. 1). Para P. onca y L. pardalis fueron las costas del Pacífico y Golfo de México y en la Península de Yucatán en México, así como la Selva Maya, el oeste de Ecuador, las tierras bajas del Amazonas, el Pantanal y la selva Atlántica en Brasil (Fig. 1). Para P. concolor las regiones idóneas fueron la costa del Pacífico, las montañas Rocallosas, la Península de Florida en Estados Unidos, así como la Selva Maya, tierras bajas del Amazonas, el Paraná y la Patagonia Chilena en el Neotrópico (Fig. 1).
TABLA 2 TABLE 2 Coeficientes de correlación (r) entre la densidad poblacional y los valores del índice de idoneidad y la distancia al centroide de nicho en cuatro especies de Felidae presentes en América Correlation coefficients (r) between population density and suitability index values and the distance to the niche centroid for four species of felids present in América
| Idoneidad Ambiental | |||
| Especie | Modelo | r | P |
| L. pardalis | Densidad = 23.7 - 3.01 * Idoneidad | -0.016 | 0.89 |
| L. rufus | Densidad = 34.8 * Idoneidad0.979 | 0.369 | 0.02 |
| P. onca | Densidad = 4.1 - 0.9 * Idoneidad | -0.002 | 0.98 |
| P. concolor | Densidad = 5 - 3.5 * Idoneidad | -0.138 | 0.23 |
| Distancia al centroide de nicho | |||
| L. pardalis | Densidad = 28.3 -1.62 * Distancia | -0.001 | 0.99 |
| L. rufus | Densidad = 7.13 * Distancia0.186 | 0.527 | <0.001 |
| P. onca | Densidad = 5.14 * Distancia-0.312 | -0.252 | 0.01 |
| P. concolor | Densidad = 3.15 * Distancia0.015 | 0.002 | 0.98 |
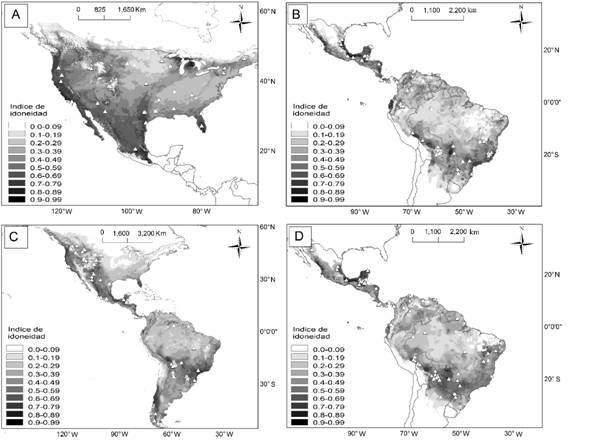
Fig. 1. Fig. 1 Idoneidad ambiental y localidades de las poblaciones con estimaciones de densidad poblacional (triángulos) para L. rufus (A), L. pardalis (B), P. concolor (C), y P. onca (D). Regiones con áreas oscuras indican una idoneidad alta mientras que las cercanas al blanco indican valores bajos. Environmental suitability and localities of the populations with density estimations (triangles) for L. rufus (A), L. pardalis (B), P. concolor (C), y P. onca (D). The darker the regions the more suitability, while whiter regions mean less suitability.
Centroide del nicho: El modelo lineal fue el más adecuado para L. pardalis, el exponencial para L. rufus y P. concolor y el potencial para P. onca. Los valores de las correlaciones variaron entre -0.001 a 0.52, y la relación fue negativa en dos especies, pero significativa sólo para P. onca, y positiva en dos especies (L. rufus y P. concolor), pero significativa sólo para L. rufus (Tabla 2). Para L. rufus y P. concolor las regiones más cercanas al nicho fueron la región central de Norteamérica, para L. pardalis y P. onca fueron la Selva Maya, tierras bajas del Amazonas, el Paraná, y la Mata Atlántica (Fig. 2).
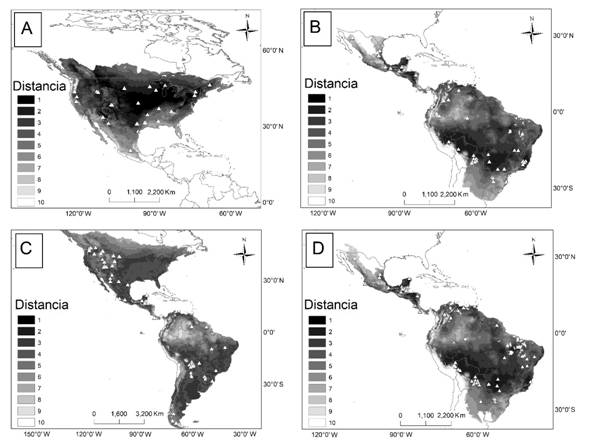
Fig. 2. Fig. 2 Distancias al centroide del nicho y localidades de las poblaciones con estimaciones de densidad poblacional (triángulos) para L. rufus (A), L. pardalis (B), P. concolor (C), y P. onca (D). Regiones con áreas oscuras indican una menor distancia al centroide. Distances to the niche centroid and the loclaities with population density estimations (triangles) for L. rufus (A), L. pardalis (B), P. concolor (C), y P. onca (D). The darker are closer to the niche centroid.
Discusión
En este estudio se evaluó el patrón de distribución geográfica de la densidad poblacional de cuatro especies de felinos silvestres. Se esperaba que las poblaciones registraran mayor densidad poblacional en áreas con mayor idoneidad ambiental (VanDerWal et al., 2009) o en áreas cercanas al centroide de nicho (Yáñez-Arenas et al., 2012). Contrario a ello, los valores del índice de idoneidad ambiental no reflejaron el patrón esperado en la densidad poblacional en la mayoría de las especies analizadas. Únicamente para L. rufus los valores altos de densidad coincidieron con valores altos de idoneidad ambiental, como en la costa del Pacífico y la costa del Golfo de México en Norteamérica (Heilbrun, Silvy, Tewes, & Peterson, 2003; Alonso, McClintock, Lyren, Boydston, & Crooks, 2015). Aunque la relación no fue significativa para las otras especies, algunas regiones con mayor idoneidad ambiental coincidieron con valores de densidad poblacional altas, particularmente las tierras bajas del Amazonas y la selva Maya para P. onca y L. pardalis, (Kelly, 2003; Silver et al., 2004). Otras regiones con menor idoneidad ambiental presentaron valores bajos de densidad, como en Caatinga y El Chaco en Sudamérica (de Paula, Campos, & Oliveira, 2012; Quiroga, Boaglio, Noss, & Di Bitetti, 2014) o la Sierra Madre Occidental en México para P. onca (Rosas-Rosas & Bender, 2012; Gutiérrez-González, Gómez-Ramírez, & López-González, 2012). Esto concuerda con la relación triangular entre la abundancia y la idoneidad del hábitat observada previamente, en donde los sitios con idoneidad alta pueden presentar densidades poblacionales altas o bajas, pero en sitios con idoneidad baja se observan densidades poblacionales bajas (VanDerWal et al., 2009). En contraste, la relación inversamente proporcional entre la densidad poblacional y la distancia al centroide del nicho se observó sólo en P. onca, lo cual fue consistente con un estudio previo (Martínez-Meyer et al., 2013). Contrario a lo esperado, la relación fue positiva en L. rufus posiblemente por la cantidad y distribución espacial de los datos disponibles de estudios de densidad poblacional. En un estudio reciente, relación entre densidad poblacional de 108 especies de aves y mamíferos con la distancia al centroide del nicho no mostró el patrón esperado según la hipótesis de centralidad de nicho (Santini et al., 2018).
Posiblemente la falta de relación entre la densidad poblacional y los sitios adecuados, incluyendo los cercanos al centroide del nicho, es consecuencia del origen y cantidad de los datos de densidad poblacional, el tipo de modelado usado, los cambios severos en el hábitat, o las características biológicas de las especies analizadas. Los valores de densidad poblacional usados en este estudio fueron calculados con varios diseños de muestreo y métodos de análisis, por lo que es probable un sesgo en los resultados por estas diferencias. Además, es posible que la cantidad baja de datos analizados (n = 39 para L. rufus). La distribución de los estudios y la falta de datos de densidad poblacional para las especies en algunas áreas (Costa pacífica de Norteamérica para L. rufus y P. concolor, Golfo de México para L. pardalis y P. onca o el centro de México para L. rufus) sea un factor determinante de los resultados. Aunque los datos obtenidos a través de una metodología única podrían mostrar un patrón de distribución de densidades más claro a lo largo de toda la distribución de los felinos, en estudios previos donde se usaron datos obtenidos con metodología estandarizada, la variación en la idoneidad ambiental no reflejó la variación en la densidad poblacional en especies de artrópodos, vertebrados y plantas vasculares (Pearce & Ferrier, 2001; Jiménez-Valverde et al., 2009). El algoritmo implementado en MaxEnt ha sido usado en varias ocasiones para evaluar la relación entre los sitios idóneos y la abundancia poblacional (VanDerWal et al., 2009; Saavedra-Sotelo et al., 2013; Manthey et al., 2015). Este algoritmo tiene la ventaja de utilizar datos de presencia únicamente, que son los tipos de registros disponibles para la mayoría de las especies y regiones, incluyendo a los felinos. Este estudio abarcó la totalidad del área geográfica conocida de las especies y delimitada por las eco-regiones de América. Así que los modelos generados en este estudio representaron las condiciones climáticas de la distribución potencial de las especies analizadas.
Se ha mencionado que en sitios con alta idoneidad ambiental se puede observar una abundancia alta o baja (VanDerWal et al., 2009). Sin embargo, algunas regiones consideradas con mayor idoneidad ambiental pudieron haber sufrido cambios severos en su estructura y cobertura vegetal, conectividad y disponibilidad de recursos, que generan cambios en la densidad poblacional a nivel local (Tôrres et al., 2012). Por otra parte, los depredadores de talla corporal grande son más susceptibles a los disturbios antropogénicos y han perdido parte de su distribución original o han sido extirpados en varias regiones (Rabinowitz & Zeller, 2010; Campbell, 2016), lo que podría alterar la relación de la densidad observada con la idoneidad ambiental o el nicho ecológico. El grado de actividad antropogénica (e.g., densidad e intensidad de tránsito en carreteras, cacería no regulada, fragmentación y cambio de uso de suelo) es un factor que disminuye la tasa de supervivencia y dispersión de individuos, como se ha observado en L. pardalis, L. rufus y P. concolor en Norteamérica (Haines, Tewes, & Laack, 2005; Real et al., 2008; McKinney, Smith, & Waddell, 2009; Miotto, Cervini, Begotti, & Galetti, 2012) y P. onca en Sudamérica (Rabinowitz & Zeller, 2010). En contraste, las especies más generalistas pueden aprovechar los recursos alimenticios generados en zonas urbanas y aumentar de tamaño poblacional, como se ha observado en poblaciones de gatos ferales (Sunquist & Sunquist, 2002), zorrillos, mapaches (Booth-Binczik, 2001; Smith & Engeman, 2002) e inclusive en osos (Beckmann & Berger, 2003). Esta disponibilidad adicional de recursos alimenticios es consecuencia de los cambios de origen antropogénico e independiente de las condiciones climáticas donde se distribuyen las especies. Además, como depredadores activos, los felinos dependen altamente de la disponibilidad de presas y en áreas donde esta disponibilidad disminuye, su tamaño poblacional también decrece, aun en condiciones climáticamente favorables (Bayne et al., 2008; Real et al., 2008). Esto es consistente con lo observado en otros depredadores, para quienes la disponibilidad de alimento y la estructura social son factores determinantes para explicar las variaciones en el tamaño poblacional (Estrada & Arroyo, 2012). En otros estudios se ha encontrado que factores como las interacciones bióticas, condiciones de microhábitat y disturbios (VanDerWal et al., 2009; Tôrres et al., 2012), así como la capacidad de dispersión de las especies (Osorio-Olvera, Falconi, & Soberón, 2016), están involucrados en la relación entre tamaño poblacional y el ambiente.
El conocimiento de la distribución de la densidad o del tamaño poblacional de las especies y sus variaciones espaciales contribuye a entender los cambios ecológicos y reproductivos, las restricciones ambientales y geográficas, la susceptibilidad a las variaciones ambientales e inclusive la calidad del hábitat (Brown, 1984). Dada la dificultad de obtener datos de densidad poblacional para varias especies de felinos, el uso de los modelos de nicho para predecir los sitios de mayor abundancia puede ser útil y de bajo costo. Sin embargo, los resultados de este estudio sugieren que la relación entre la densidad de felinos y el ambiente puede no seguir un patrón generalizado. Esto es consistente con el reciente estudio donde no se registró un patrón del tamaño poblacional acorde a la hipótesis del centro - abundancia en 108 especies de mamíferos y aves (Santini et al., 2018). Factores tales como la biología, ecología, incluyendo la capacidad de adaptación a sitios con disturbio, pueden tener repercusiones a escalas de paisaje en estas especies. Las especies de felinos dependen altamente de las presas y de las condiciones de perturbación local, por ello es conveniente incorporar información relativa a estos factores para mejorar el poder predictivo los modelos de nicho ecológico de estas especies y de otros depredadores.












 uBio
uBio 

