Introducción
Actualmente alrededor de 36.4 mil ha de bosques templados en México están infestados por insectos descortezadores del género Dendroctonus y otros barrenadores (Fonseca-González, de los Santos-Posadas, Rodríguez-Ortega, & Rodríguez-Laguna, 2014). Lo anterior, es considerado un serio problema debido a que México es considerado centro de diversificación de especies de pino, alberga cerca del 30 % de todas las especies del mundo aunado a su valor económico, ecológico y cultural (Sánchez-González, 2008). El impacto del cambio climático en general es perjudicial para los bosques; ya que promueve un desarrollo acelerado de las poblaciones de insectos patógenos y cambios en las dinámicas poblacionales que favorecen el aumento de plagas forestales, incluso se ha evidenciado que los episodios de calentamiento global anteceden a incrementos poblacionales de descortezadores (Chen, Jackson, Ott, & Spittlehouse, 2015; Régnière, Powell, Bentz, & Nealis, 2012). Se ha observado que los incendios forestales también incrementan los brotes de estos insectos, dado que la mortandad de los bosques aumentó significativamente en Hidalgo posteriormente a estos fenómenos (Fonseca-González et al., 2014).
Las disrupciones poblacionales de la mayoría de las especies plaga se considera que son multifactoriales, los elementos ambientales como la temperatura y humedad son determinantes debido a que están intrínsecamente relacionados al desarrollo de las poblaciones en insectos (Berg, Henry, Fastie, Volder, & De Matsuoka, 2006). Hoy en día se especula sobre el conjunto de factores que ocasionan el aumento en la abundancia de los escarabajos descortezadores; por ejemplo, se observa que la temperatura es uno de los factores de mayor importancia del fenómeno del cambio climático, que influye directamente en la fisiología de las plagas acelerando el crecimiento poblacional y la reproducción (Bale et al., 2002). Por otro lado, la información detallada sobre los procesos fisiológicos dependientes de la temperatura es limitada para la mayoría de las especies de descortezadores en el suroeste de Estados Unidos y México (Bentz, Duncan, & Powell, 2016).
En el género Dendroctonus Erichson 1836 históricamente los incrementos poblacionales y las grandes infestaciones se han relacionado principalmente con la temperatura y al sistema de precipitación (Allen et al., 2010; Bentz & Jönsson, 2015; Six & Bracewell, 2014). Los brotes recientes de escarabajos descortezadores en el sureste de los EE.UU se han atribuido al incremento de la temperatura promedio de 3.3 °C en la temperatura invernal mínima desde 1960 a 2004 (Tran, Ylioja, Billings, Regniere, & Ayres, 2007) otros autores describen los impactos del escarabajo descortezador del pino de montaña (Dendroctonus ponderosae Hopkins 1902) a partir de su incremento poblacional que llego a ser de proporciones epidémicas en Canadá occidental donde durante varios años dicho crecimiento se asoció a factores térmicos (Bentz et al., 2016) debido a ello se espera que la abundancia de poblaciones de descortezadores aumente de acuerdo a las condiciones térmicas (De Lucía, Casteel, Nabity, & O’Neill, 2008).
En México una de las especies de descortezador de mayor importancia es Dendroctonus frontalis (Zimmerman 1868) por ocasionar pérdida de masa forestal. Este escarabajo es una especie de escolítido perteneciente a la familia Curculionidae, que está relacionada evolutivamente al desarrollo de bosques de pino (Zúñiga, Cisneros, Salinas-Moreno, Hayes, & Rinehart, 2006). D. frontalis, se distribuye desde el centro de Utha y Colorado (EE.UU), hasta México y Honduras (Sullivan et al., 2012), y se ha registrado en un amplio rango de hospederos que incluyen, Pinus arizonica Engelm, P. durangensis Ehren, P. greggii Engelm, P. maximinoi H.E. Moore, P. oocarpa Shiede, P. pringlei Shaw, P. tecunumannii Eguiluz y J.P. Perry, P. teocote Shiede ex Schltdl, P. echinata Mill, P. engelmannii Carr, P. glabra Walter, P. palustris Mill, P. ponderosa Douglas ex C. Lawson, P. rigida Mill, P. strobus Linnaeus, P. taeda Linnaeus y P. virginiana Linnaeus. El estado de Hidalgo en México es considerado como una de las entidades con mayor riqueza de especies de pino así como áreas infestadas por D.frontalis (Sánchez-González, 2008). Por lo anterior, es muy importante conocer cómo los factores climáticos (temperatura y precipitación) asociados a la altitud influyen en la abundancia de D. frontalis en un bosque de pino-encino. La hipótesis fue: las diferencias altitudinales aunadas a las variables climáticas afectan la abundancia de poblaciones de insectos descortezadores como D. frontalis en los bosques de pino del estado de Hidalgo en México.
Materiales y métodos
Sitio de estudio: El estudio se realizó en el bosque de pino-encino de la comunidad de Durango, en el Parque Nacional Los Mármoles, municipio de Zimapán, Hidalgo, el parque se ubica en la Faja Volcánica Transversal Mexicana y la Sierra Madre Oriental. El clima de la zona es templado semiárido con una precipitación anual de 450 mm, lluvias de junio a agosto y temporadas de sequía entre octubre y abril. El estrato arbóreo se compone de Pinus pinceana, Gordón y Glen, P. montezumae Lamb., P. cembroides Zucc., P. greggii Engelm. ex Parl. 1868, P. teocote Schltdl. & Cham. 1830, P. patula Seem. 1856, P. pseudostrobus Lindl. 1858 asociados con Quercus castanea Née. 1801, Q. crassifolia Benth. 1840 y Q. mexicana Benth. 1840.
Establecimiento del experimento: El muestreo se estableció en enero 2015 mediante un sistema de recolecta a lo largo de siete sitios de muestreo en un rango altitudinal de 1 654 a 2 117 m.s.n.m. (100 m altitudinales entre cada uno). El diseño experimental utilizado fue de parcelas apareadas con dos tratamientos (feromona y testigo). En cada sitio se instalaron dos trampas tipo Lindgren de ocho unidades (Synergy Semiochemicals Corp®) una testigo y otra control a una altura aproximada de 1.5-2 m del nivel del suelo, para ello se eligieron dos árboles diferentes a las especies huésped con una separación aproximada de 50 m entre sí, a la trampa testigo se le colocó un atrayente comercial para D. frontalis compuesto por frontalina (1,5-dimetil-6-8-dioxabiciclo [3,2,1,] octano) + endobrevicomina (endo-7-etil-5-metil-6-8-dioxabiciclo [3,2,1.] octano) + alfa-pineno (2, 6, 6-trimetibiciclo [3,1,1.] hept-2-eno) y en la otra trampa control (sin feromona), no se colocó ningún tipo de atrayente. Los atrayentes fueron reemplazados cada dos meses, para la recolecta y preservación de los insectos se colocó en el vaso colector una mezcla de anticongelante y alcohol en una proporción de 1:1. Las catorce trampas colocadas fueron georreferenciadas con la ayuda de un GPS Garmin® Montana 600 obteniendo de esta manera las coordenadas geográficas y elevación (Tabla 1).
Tabla 1 Table 1 Sitios de trampeo de Dendroctonus frontalis y promedios climáticos estimados (1960-1990) con promedios climáticos proyectados al 2030 Dendroctonus frontalis trapping sites and estimated climatic averages (1960-1990) with projected climatic averages to 2030
| Sitio | Periodo (1960-1990)† | 2030¶ | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Longitud N | Latitud W | Altitud (m.s.n.m.) | TMA§ (°C) | TMAXÞ (°C) | PMA¤ (mm) | SMRPB†† | TMA§ (°C) | TMAXÞ (°C) | PM¤ (mm) | SMRPB†† | |
| 1 | 99º21`77’’ | 20º93’81’’ | 1 654 | 19.1 | 30.2 | 696 | 2.46 | 20.7 | 31.8 | 610 | 15.8 |
| 2 | 99º21’94’’ | 20º93’76’’ | 1 722 | 18.9 | 30.1 | 703 | 2.45 | 20.4 | 31.6 | 614 | 15.7 |
| 3 | 99º2’21’’ | 20º93’74’’ | 1 812 | 18.6 | 29.8 | 714 | 2.50 | 20.1 | 31.4 | 627 | 16.0 |
| 4 | 99º22`21’’ | 20º93’7’’ | 1 880 | 18.4 | 29.6 | 724 | 2.56 | 19.9 | 31.1 | 633 | 16.4 |
| 5 | 99º22`49’’ | 20º93’44’’ | 1 998 | 17.9 | 29.1 | 732 | 2.66 | 19.5 | 30.7 | 637 | 1.72 |
| 6 | 99º22`73’’ | 20º93’05’’ | 2 098 | 17.6 | 28.8 | 724 | 2.8 | 19.2 | 30.4 | 630 | 1.8 |
| 7 | 99º23’27’’ | 20º92’14’’ | 2 117 | 17.6 | 28.7 | 714 | 2.85 | 19.2 | 30.3 | 619 | 17.8 |
†Variables climáticas promedio 1960-1990. ¶Variables climáticas predichas para el 2030. Se utilizó el escenario A1B para obtener: §Temperatura promedio anual, Þ= Precipitación promedio anual. ††Balance de la precipitación primavera/verano.
Recolecta y procesamiento del material entomológico: La recolecta del material biológico se realizó cada quince días durante el periodo comprendido entre enero-diciembre 2015. El material se depositó en bolsas de sellado hermético, fueron etiquetadas y se trasladaron al Laboratorio de la Facultad de Ciencias Naturales en la Universidad Autónoma de Querétaro, México. La separación e identificación del material capturado se llevó a cabo en laboratorio de la colección entomológica, con base en características morfológicas diagnósticas. La identificación de las especies del género Dendroctonus se realizó con la ayuda de las claves taxonómicas de Wood (1982) y Cibrian, Mendez, Campos-Bolaños, Harry, & Flores-Lara (1995)
Modelación climática: Los valores estimados para la modelación climática fueron: temperatura media anual (TMA), temperatura media anual máxima (TMAX), precipitación media anual (PMA), balance de precipitación primavera/verano (SMRPB (precipitación de julio + agosto / precipitación de abril y mayo) e índice anual de aridez (Tabla 1).
Adicionalmente a las variables climáticas, se estimó el índice anual de aridez IAA (IAA = (DD50.5)/ PMA; DD5 = grados día > 5 °C), temperaturas altas, bajas y disponibilidad de agua, tanto para promedios climáticos estimados (1960-1990), los cuales se obtuvieron mediante el modelo climático “thin plate spline” desarrollado para México (Crookston, 2010) el cual se basa en la transposición de superficies de datos climáticos mensuales normalizados de temperatura (mínima, media y máxima) y precipitación en el software ANUSPLIN 4.4 (Hutchinson & Xu, 2013) Los valores proyectados para el 2030 se calcularon modificando estos valores según estimaciones del Panel Intergubernamental de Cambio Climático (IPCC) y posteriormente ajustando el software en ANUSPLIN, de esta manera se obtuvieron valores estimados del clima futuro en un escenario intermedio de emisiones de gases de efecto invernadero (A1B, A altas emisiones y B bajas emisiones de carbono escenario con un panorama intermedio muy probable) (Crookston, 2010).
Se realizó un análisis de varianza para determinar posibles diferencias significativas entre la abundancia de D. frontalis en distintas altitudes y una prueba de Tukey para estimar como son dichas diferencias entre sitios. Para evaluar la relación entre las características de cada sitio de muestreo (altitud sobre el nivel del mar o variables climáticas) respecto a la abundancia (número de individuos por trampa), se realizó un análisis de regresión lineal y cuadrática con el siguiente modelo (Tabla 2). Todos los análisis se realizaron con el paquete estadístico SAS Versión 9.3 (SAS institute, 2004).
TABLA 2 Tabla 2 Modelos de análisis de regresión de abundancia de Dendroctonus frontalis, altitud, grado de significancia y coeficiente de regresión Regression analysis models of abundance regression of Dendroctonus frontalis, altitude, degree of significance and regression coefficient
| Modelo de regresión | Desarrollo | Grado de significancia p≤ 0.05 | Coeficiente de regresión R² |
| Y ij = β0 + β 1 X 1 + e ij | β0 = intercepto, β1= pendiente, X1= altitud (m sobre el nivel del mar) otra variable climática estimada del i-ésimo sitio de muestreo, e ij = error. | 0.0518 | 0.6738 |
| Y ij = β0 + β 1 X 1 2 + e ij | β0 = intercepto, β1= pendiente, X1= altitud (m sobre el nivel del mar)2 u otra variable climática estimada del i-ésimo sitio de muestreo, e ij = error. | 0.0575 | 0.599 |
Donde Y ij ( media de la abundancia (individuos por trampa), ( 0 (intercepto, ( 1 (pendiente, X i (altitud (m sobre el nivel del mar) variable climática (temperatura y/o precipitación) estimada del i-ésimo sitio, e ij (error.
Resultados
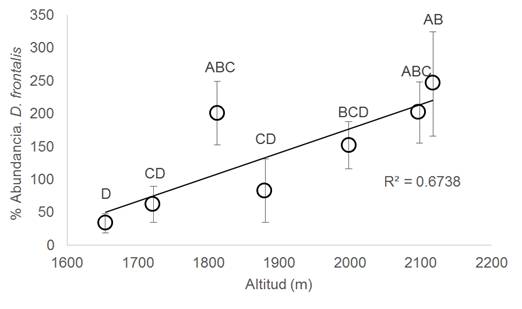
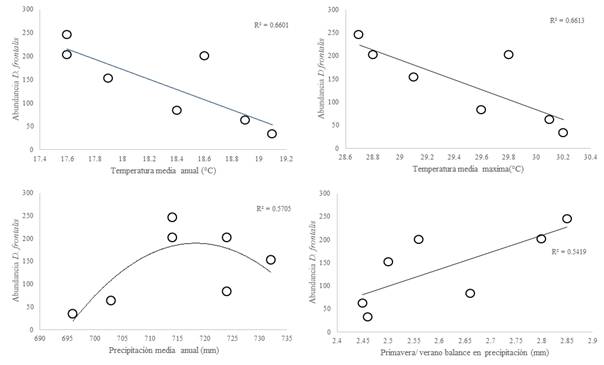
La abundancia de D. frontalis mostró escasa relación lineal positiva con la altitud (P = 0.0518, R2 = 0.6738) en el rango altitudinal de muestreo (1 654-2 117 m.s.n.m.) donde se observó que la mayor abundancia promedio de D. frontalis se presentó a mayor altitud (2 117 m.s.n.m.) y una menor abundancia promedio a menor altitud (1 654 m.s.n.m.; Fig. 1). Otro resultado que se observó es que el escarabajo descortezador D. frontalis en la Sierra de Zimapán, Hidalgo no mostró una relación muy marcada entre su abundancia y temperatura media anual (R2 = 0.6601, P = 0.064, Fig. 2A), sin embargo la tendencia es que en sitios de menor altitud donde la temperatura media anual (TMA) es cercana a los 19 °C la abundancia es menor, que en sitios de mayor altitud donde la TMA es sobre los 17 °C donde D. frontalis es más abundante (Fig. 2A). Al analizar la precipitación media anual en estos sitios se determinó que no hay una correlación directa con la abundancia (R2 = 0.5705, P = 0.845) (Fig. 2B). Por otro lado, se encontró una relación entre la abundancia de D. frontalis y temperatura media máxima (TMAX) donde el valor más alto se presentó en sitios donde la TMAX fue cercana a los 28 °C la cual ocurre en los sitios de mayor altitud, la frecuencia de D. frontalis fue menor en sitios donde la TMAX fue superior a 30 °C en sitios de menor altitud (R2 = 0.6613, P = 0.0261) (Fig. 2C). Por otra parte, se evidenció una relación con el balance de precipitación primavera-verano (R2= 0.5419, P = 0.0359) (Fig. 2D) lo anterior es indicador que la afluencia de estos insectos disminuyó en relación a una mayor precipitación durante julio y agosto con respecto a la que precedió en abril y mayo, donde se observó una tendencia en el incremento poblacional de D. frontalis en relación al aumento de la variabilidad de precipitación (SMRPB).
Durante el muestreo, se observó que el promedio más alto de abundancia en D. frontalis fue en marzo y disminuyó en los meses siguientes hasta octubre donde se observó la menor cantidad de individuos. La mayor frecuencia de D. frontalis se presentó en marzo y se asocia al inicio de las temperaturas elevadas y poca precipitación de marzo y abril, como se observa en el presente experimento teniendo como resultado un incremento en la afluencia de estos insectos con el incremento del índice de aridez anual (IAA) y decremento en la abundancia conforme disminuye la aridez en septiembre y octubre. Por otra parte existe una relación entre la temperatura media máxima (promedio de 30 años ocurrida) en los sitios de muestreo (R2 = 0.9918, P < 0.0001) y una relación entre la temperatura media máxima predicha para el 2030 (R2 = 0.995, P < 0.0001), con la altitud.
Discusión
La mayor abundancia promedio de D. frontalis a mayor elevación se puede explicar debido a que la altitud máxima de muestreo en este estudio fue de 2 117 m, dicha altitud es intermedia en el rango de distribución de especies de pinos que habitan en el Estado de Hidalgo y los cuales son hospederos de D. frontalis. Históricamente se ha registrado la distribución altitudinal de D. frontalis un en rango de distribución de 700 a 2 000 m de altitud (Salinas-Moreno et al., 2009). También se ha reportado dicha distribución hasta los 2 651 m.s.n.m. en EE.UU. En Arizona, donde se observó mayor abundancia de este descortezador en los sitios bajos (1 600-1 736 m.s.n.m.) y sitios medios (2 058-2 230 m.s.n.m.) y poco abundante en sitios altos (2 505-2 651 m.s.n.m.) (Williams, McMillin, DeGomez, Clancy, & Miller, 2008). Dentro del presente estudio se reportó la mayor cantidad de insectos descortezadores (D. frontalis) a una altitud de 2 117 m.s.n.m., también reportada como promedio de la distribución altitudinal natural de esta especie (Williams et al., 2008). De acuerdo a la distribución altitudinal promedio, en el presente estudio se determinó que D. frontalis en el sitio de 2 117 m.s.n.m. presenta mayor abundancia esto es posible porque encuentra condiciones climáticas óptimas para su desarrollo. En otros estudios, se ha observado que la mayor abundancia se presenta en altitudes promedio (1 750 m.s.n.m.) dentro del rango de distribución natural con otros insectos descortezadores como D. ponderosae, esta altitud es considerada como un óptimo con base a su crecimiento poblacional en dicha distribución altitudinal (Bentz et al., 2016; Salinas-Moreno et al., 2009).
Por otra parte, la altitud engloba un conjunto de variables climáticas como la temperatura y precipitación que influyen en la fenología de muchos insectos descortezadores como D. mexicanus y D. adjunctus (Berg et al., 2006; Salinas-Moreno et al., 2009; Six & Bracewell, 2014; Tran, Ylioja, Billings, Regniere, et al., 2007) se ha considerado a la temperatura como la principal variable que determina la abundancia de los descortezadores en latitudes del norte a nivel global (Chen et al., 2015). La relación entre el tamaño poblacional de D. frontalis y la temperatura media máxima (TMAX) presentó indicadores, como mayor número de individuos en sitios donde la TMAX fue cercana a los 28 °C la cual ocurre en los sitios de mayor altitud, por otro lado la abundancia fue menor en sitios donde la TMAX fue superior a 30 °C en sitios con menor altitud, lo anterior crea evidencia que la TMAX en las zonas elevadas son las más bajas que en sitios de menor altitud y por lo cual en conjunto con la temperatura las altitudes de mayor elevación son las más adecuadas para que se presente una mayor abundancia de estos descortezadores, otros autores mencionan que las infestaciones de escarabajos son influenciadas por variables como las temperaturas extremas (Sambaraju et al., 2012), precipitación (Chapman, Veblen, & Schoennagel, 2012; Six & Bracewell, 2014), y la disponibilidad de huésped susceptible (Creeden, Hicke, & Buotte, 2014).
Respecto a la relación del balance de precipitación primavera-verano y la abundancia se observó una tendencia en el incremento del número de escarabajos con relación al aumento de la variabilidad de precipitación (SMRPB). Cabe señalar que en los bosques de Pino de la localidad de Zimapán, la temporada de estiaje es entre octubre y abril con leve precipitación en las zonas de mayor elevación (2 117 m.s.n.m.) en invierno-primavera, mientras que la temporada de lluvias se distribuye de junio a agosto. Si consideramos que en otros estudios se ha observado que valores mayores en el SMRPB se han relacionado con un incremento en la estimulación de producción de biomasa en las plantas, lo cual puede ser asociado a una mayor disponibilidad de alimento para los insectos (Hovenden, Newton, & Wills, 2014).
La mayor abundancia promedio de D. frontalis ocurrió en marzo y disminuyó en los meses siguientes hasta octubre, los resultados de esta sección son similares a los reportados en Estado de Arizona (EE.UU.) donde la actividad de vuelo de D. frontalis ocurrió de marzo-abril y hasta finales de noviembre, aunque también se ha presentado mayor abundancia de D. frontalis en agosto como un evento que ocurrió en el 2002 (Gaylord, Kolb, Wallin, & Wagner, 2006; Williams et al., 2008). Dentro del periodo normal de lluvias en México se registra un fenómeno denominado canícula, el cual se presenta una etapa de ausencia de lluvia, evento que se caracteriza por un aumento de temperatura y disminución de la precipitación dicha condición puede favorecer la presencia de los descortezadores. La temperatura y la distribución espacio temporal de la precipitación responden al gradiente altitudinal, de manera que es posible que en los sitios más bajos la TMA es mayor que en los de mayor altitud y el SMRPB es menor en sitios bajos y mayor en aquellos elevados como en el presente estudio, durante la canícula, los puntos de monitoreo bajos que ya presentaban temperaturas elevadas se agudizaron ocasionándose condiciones desfavorables para el desarrollo de los descortezadores, por el contrario en los sitios altos el efecto de la canícula se amortiguo debido a que la temperatura media máxima es menor y hay una mayor precipitación en junio y julio, lo cual constituyen condiciones menos más favorables para el desarrollo de los insectos.
Sin embargo la mayor abundancia de D. frontalis se asocia al inicio de las temperaturas elevadas en marzo y abril, como se observó en este experimento, es posible que el estrés provocado por el IAA ocasione la susceptibilidad de los árboles al ataque de estos insectos (McDowell et al., 2008).
En el futuro en un contexto de cambio climático se espera un aumento en las temperaturas (IPPCC, 2000) para estas localidades se espera el aumento en las temperaturas medias máximas de 1.6 °C para el 2030 en la Sierra de Zimapán (Crookston, 2010). Si consideramos lo mencionado por el Panel Interamericano de Cambio Climático refiere que el incremento de 1 °C grado en la temperatura global, corresponde con un aumento potencial de aproximadamente 170 metros de altitud hacia arriba en el rango distribución de las especies (Sutherts et al., 2007). Por ejemplo, en el 2030 los sitios de elevaciones entre los 2 100 m, donde hoy en día ocurren TMAX cercanas a los 28 °C asociadas a mayores abundancias promedio de D. frontalis aumentará a casi 30 °C en su TMAX (+2 ºC), esperándose una disminución en la abundancia de D. frontalis a 2 100 m.s.n.m., pero podemos sugerir que la temperatura que hoy ocurre sobre los 2 100 m.s.n.m. se desplazará de entre 170 a 300 m.s.n.m. aproximadamente hacia arriba, ocasionando un ambiente propicio para el aumento de las poblaciones de D. frontalis a esta altitud de igual manera se espera la ausencia del insecto en altitudes bajas por el aumento en la ocurrencia de TMAX superiores a su umbral de desarrollo. El desplazamiento altitudinal en abundancia en insectos se ha predicho en otras especies como D. ponderosae donde las condición óptima para su desarrollo será a altitudes más elevada (Bentz et al., 2016). Este desplazamiento en altitud es muy probable que suceda D. frontalis, sin embargo, por otra parte, se desconoce la capacidad de adaptación de estos insectos a las nuevas temperaturas más elevadas. De acuerdo a nuestros resultados podemos enunciar que las temperaturas altas limitarán las poblaciones a altitudes bajas y se presenta mayor abundancia a altitudes más elevadas en climas más frescos, como se ha evidenciado en Sureste de Estados Unidos, donde D. frontalis se incrementó su supervivencia en climas más frescos (Tran, Ylioja, Billings, Régnière, & Ayres, 2007). En el estado de Hidalgo los Bosques de Pino se encuentran en sitios con un límite altitudinal alto cercanos a los 3 000 m.s.n.m., que en el futuro serán ambientes frescos y no tan fríos idóneos para presencia de D. frontalis. Si en un futuro el aumento en la TMAX que ocurre a altitudes bajas, estas funcionarán como control de la abundancia de D. frontalis, pero ello no es garantía de la conservación del bosque, los descortezadores se desplazarían a zonas de mayor altitud, donde ocurran TMAX apropiadas para su desarrollo y existan los hospederos. El bosque de Pino en el Estado de Hidalgo en el caso de que resista a las infestaciones de los descortezadores también puede verse afectado por no ser resistente al aumento de las TMAX que puedan ocurrir en el futuro (Allen & Breshears, 2007)
Se determinó una relación entre la cantidad de D. frontalis y la altitud donde elevaciones cercanas a los 1 700 m.s.n.m. reducirá el número de insectos descortezadores y altitudes de 2 000 m.s.n.m., aumenta la abundancia.
Finalmente, en el presente estudio se determinó que existe una relación entre las variables climáticas asociadas a la altitud como la temperatura e índice de aridez que influyen en la abundancia de escarabajos descortezadores de D. frontalis en los bosques de pino-encino en la Sierra de Zimapán en el Estado de Hidalgo, México.
Además que las temperaturas que ocurren en los 2 000 m.s.n.m. son las más favorables para las poblaciones de D. frontalis, debido a que se observó el mayor número de individuos de insectos.












 uBio
uBio