La diversidad de especies en los bosques tropicales es fundamental para su funcionamiento, resiliencia y capacidad de proporcionar bienes y servicios (Cardinale et al., 2011, 2012; Hooper et al., 2012; Gamfeldt et al., 2013). En la Amazonía, la diversidad florística está siendo afectada por la degradación y conversión de bosques naturales en agroecosistemas simples como pastos o monocultivos agrícolas y forestales (Davidson et al., 2012), esta situación es objeto de atención, porque conlleva no solo a la pérdida de biodiversidad, sino también de servicios ecosistémicos esenciales, como el almacenamiento de carbono (Fauset et al., 2015; Poorter et al., 2015). En efecto, los bosques naturales complejos poseen una diversidad de especies de plantas con rasgos funcionales y patrones diferentes de crecimiento y tamaño, esto conduce a una estratificación del ecosistema (Poorter et al., 2016), ofreciendo de esta manera mayores oportunidades a las especies para un mejor aprovechamiento de los recursos (luz, agua y nutrientes), debido a la complementariedad de nichos (Loreau, 2000; Dı́az & Cabido, 2001; Coomes et al., 2009). Esta característica, promueve la producción de biomasa en los ecosistemas naturales (Wang et al., 2011; Poorter et al., 2015; Zhang & Chen, 2015).
Los agroecosistemas biodiversos, que combinan especies leñosas perennes (árboles, palmeras) y cultivos agrícolas como los sistemas agroforestales (SAF) (Nair, 1993; Young, 1997), han ganado gran importancia en los últimos años, porque promueven la biodiversidad y servicios ecosistémicos, además de producir alimentos, generan ingresos económicos y mayor satisfacción a los agricultores (Matocha, Schroth, Hills, & Hole, 2012; Cardozo et al., 2015; Zomer et al., 2016), también reducen la presión sobre los bosques naturales (Schroth et al., 2015). Existen diferentes prácticas agroforestales (Atangana, Khasa, Chang, & Degrande, 2014; Nair, 2014), que se practican en más de 1 023 millones de hectáreas en todo el mundo (Nair, Kumar, & Nair, 2009), y en comparación a las prácticas convencionales de ganadería extensiva y agricultura de corte y quema, son una alternativa más sostenible (Yamada & Gholz, 2002; Leite et al., 2016).
Las prácticas agroforestales tienen el potencial para contribuir a la mitigación del cambio climático, mediante el secuestro del carbono en la vegetación y en el suelo (IPCC, 2000). El potencial de almacenamiento de carbono depende del tipo de práctica agroforestal, composición florística y manejo (Albrecht & Kandji, 2003; Kumar, 2006; Zomer et al., 2016). La diversidad en la composición florística de los SAF es clave para su funcionamiento y la generación de beneficios (Pinho, Miller, & Alfaia, 2012). Ali & Mattsson (2017a) identificaron una relación positiva de la diversidad florística sobre la biomasa en huertos caseros en regiones secas. Sin embargo, existe escasa información sobre esas relaciones para las regiones tropicales. El objetivo de este estudio fue evaluar el efecto de la riqueza de especies y la estructura de la vegetación sobre el almacenamiento de carbono en la biomasa en diferentes sistemas agroforestales en la Amazonía Boliviana. Ese conocimiento es muy relevante para entender el funcionamiento de los sistemas agroforestales, así como para promover políticas públicas para la adopción de sistemas que optimicen la diversidad y el almacenamiento de carbono.
Materiales y métodos
Área de estudio: El estudio se realizó en la Amazonía sur de Bolivia, en ocho municipios, en los departamentos de Beni (San Ignacio de Moxos, San Andrés y San Javier) y Santa Cruz (Yapacaní, San Carlos, Buena Vista, Ascensión de Guarayos y Urubichá) (Fig. 1). La clasificación climática de acuerdo con Köppen es tropical Am y Aw (Peel, Finlayson, & McMahon, 2007), la precipitación anual varía de 1 800 mm en Ascensión de Guarayos y Urubichá a 2 800 mm en Yapacaní, Buena Vista y San Carlos, con cinco a seis meses de estación seca y una temperatura promedio de 25 oC. Los suelos predominantes son de origen aluvial, clasificados como cambisol (Inceptsol), pluvisol (Entisol-Fluvent) y ferrasol (Oxisol) (Quesada et al., 2011, 2012). La vegetación de la región corresponde al bosque amazónico siempre verde, donde los sistemas de uso de suelo predominantes son pastos extensivos, agricultura mecanizada y agricultura de pequeña escala (Müller, Müller, Schierhorn, Gerold, & Pacheco, 2012).

Fig. 1 Áreas de estudio en la Amazonía Sur, Bolivia. / Fig. 1. Study areas in the Southern Amazon, Bolivia.
Sistemas de uso del suelo: En este estudio se evaluaron los sistemas agroforestales (SAF) más representativos de la región. El sistema “Cacao agroforestal” (CA), donde el cacao (Theobroma cacao) es el principal cultivo, y está asociado con otros frutales como los cítricos (Citrus spp.) y bananos (Musa spp.), también incluyen especies maderables como mara (Swietenia macrophylla) y serebo (Schizolobium parahyba). La mayoría de las especies tienen espacios definidos. El sistema “Café sombreado” (CS), donde el principal cultivo es el café (Coffea arabica), plantado en áreas de bosques secundarios, donde las especies de interés como leguminosas o maderables son seleccionadas y manejadas por el agricultor, ejemplo pacay (Inga sp.), jorori (Swartizia jorori), y las demás especies son cortadas para reducir la sombra. En estos sistemas, una vez al año se realiza la poda para regular la sombra, algunos sistemas han sido enriquecido con especies frutales, achachairu (Garcinia humilis), ocoro (Garcinia madruno) y maderas de valor comercial como almendrillo (Dipteryx odorata), jichituriqui (Aspidosperma macrocarpon).
El sistema “Huerto casero” (HC), uno de los más practicados en los trópicos (Kumar & Nair, 2004), es caracterizado por estar cerca de la casa, poseen una gran diversidad de frutales, árboles maderables y palmeras, no predomina una especie en particular, es fuente de alimentos y un espacio de descanso para las familias. Además de los sistemas mencionados, “Bosques Secundarios Avanzados” (BS) fueron incluidos en el estudio como ecosistemas de referencia, esos bosques son áreas de regeneración natural en sitios previamente utilizados para la agricultura de corte y quema.
Diseño experimental: Fueron muestreados 25 SAF con diferentes edades (10 sistemas CA de 7 a 40 años, 7 sistemas CS de 8 a 30 años, 8 HC de 14 a 40 años) y 4 BS de 40 a 60 años (Apéndice 1). Las edades de los SAF y BS fueron informadas por los agricultores y la recolecta de los datos fue realizada entre agosto 2015 y diciembre 2016. En cada uno de los 25 SAF y 4 BS estudiados, fue instalada una parcela circular de 50 m de diámetro (1 963 m2), donde se evaluó la biomasa en los diferentes compartimientos: árboles (diámetro a la altura del pecho ≥ 10 cm), arbustos (diámetro altura base de 1 a 9 cm a 30 cm del suelo y con una altura ≥ 1.5 m), necromasa fina (ramas finas de 2 a 5 cm de diámetro), hojarasca (hojas, flores, frutos y ramas < 2 cm de diámetro), y necromasa gruesa (ramas y árboles caídos > 5 cm de diámetro).
Método de muestreo de campo: La metodología de recolecta y análisis de la biomasa fue basada en estudios realizados en los trópicos húmedos (Brown, 2002; Chave et al., 2005, 2014; Poorter et al., 2016). Todos los árboles fueron identificados y medidos (diámetro y altura) en las parcelas de 50 m de diámetro. Para la medición fueron utilizados cinta diamétrica y clinómetro. Los cítricos y el cacao fueron medidos a 30 cm de la base de suelo (Schroth, D’Angelo, Teixeira, Haag, & Lieberei, 2002; Andrade, Segura, Somarriba, & Villalobos, 2008). La identificación de las especies se realizó en campo, con la ayuda del agricultor y de guías dendrológicas (Justiniano et al., 2004; Vargas, Mostacedo, & Jordán, 2005).
Los arbustos fueron muestreados en cinco sub parcelas de 5 x 5 m (25 m2) instaladas dentro de las parcelas circulares, donde se midió el diámetro de todas las especies con un calibrador. Al centro de cada una de estas sub parcelas, se instaló un cuadrante de 1 x 1 m, donde las especies herbáceas fueron muestreadas de forma destructiva y pesadas en campo. En esos cuadrantes también se muestreo la necromasa fina y la hojarasca que fueron pesadas en el campo para obtener el peso fresco. Finalmente, se recorrió dos transectos de 50 m en la parcela principal (sentido este - oeste y norte - sur) donde mediante interceptación fue medido el diámetro y estado de descomposición de la necromasa gruesa (Coomes, Allen, Scott, Goulding, & Beets, 2002; Van Wagner, 1968).
Cálculo de la diversidad, biomasa y carbono: Como medida de diversidad, se consideró el índice de diversidad de Shannon y la riqueza de especies (número total de especies arbóreas por parcela), este último es de fácil interpretación y también relevante para estudiar los mecanismos de complementariedad de nichos (Loreau et al., 2001; Flombaum & Sala, 2008; Chisholm et al., 2013)
La biomasa en las especies arbóreas y arbustivas fue calculada con fórmulas alométricas específicas y multiespecíficas, utilizadas en los trópicos húmedos (Cuadro 1). Para las especies arbóreas identificadas fue utilizada la densidad específica de la madera (g cm3), obtenida de la base de datos global (Zanne et al., 2009), para las especies que no están presentes en la lista, se utilizó una densidad media de 0.58 g cm3 (Brown, 1997; Nogueira, Fearnside, & Nelson, 2008). Para la determinación de la biomasa de la vegetación herbácea, necromasa fina y hojarasca, 500 g de muestras homogenizadas fueron secadas a 65 oC hasta obtener peso constate para determinar la humedad y luego el porcentaje de masa seca. La biomasa de la necromasa gruesa fue estimada a partir del diámetro y la densidad de la madera (Van Wagner, 1968), que fue clasificada en solida (0.60 g cm3), intermedia (0.42 g m3) y descompuesta (0.23 g m3) (IPCC, 2007).
Cuadro 1 Ecuaciones alométricas utilizadas para la estimación de la biomasa en los sistemas agroforestales y bosques secundarios en la Amazonía Sur, Bolivia
| - | Fórmula | R2 | Fuente |
|---|---|---|---|
| Theobroma cacao | BA=10(-1.625+2.63*log(D30)) | 0.98 | (Andrade et al., 2008) |
| Coffea arabica | BA=10(-0.779+2.338*Log10(H)) | 0.82 | (Segura, Kanninen, & Suárez, 2006) |
| Musa spp. | BA=0.030*Dap2.13 | 0.99 | (Pearson, Walker, & Brown, 2005) |
| Citrus sp. | BA=-6.64+0.279*AB+0.000514*AB2 | 0.94 | (Schroth et al., 2002) |
| Cecropia sp. | BA=exp(-2.5118+2.4257*ln(Dap)) | 0.98 | (Nelson et al., 1999) |
| Palmeras | BA=10.0+6.4*H | 0.96 | (Brown, 1997) |
| Arbustos <10 Dap Predicción Dap arbustivos | BA=exp(-1.9968 +2.4128 ln(Dap)) Dap = (-1,038-0,045) * DB² + 1,416 * DB | 0.98 0.98 | (Nelson et al., 1999) (Gehring, Park, & Denich, 2008) |
| Árboles de sombra | BA=0.0673*(ρD2H)0.976 | 0.98 | (Chave et al., 2014) |
BA = Biomasa aérea (kg); AB = Área basal (m2); Dap = Diámetro a la altura del pecho (cm); D = Diámetro (cm); H = Altura (m); DB = Diámetro basal (30 sobre el suelo en cm); ρ = Densidad de la madera (g/cm3).
BA = Aboveground biomass (kg); AB = Basal area (m2); Dap = Diameter at Breath Height (cm); D = Diameter (cm); H = Height (m); DB = Basal diameter (on the floor in 30 cm); ρ = Density of the wood (g/cm3).
Para el cálculo del carbono en cada compartimiento (árboles, arbustos, herbáceas, necromasa y hojarasca) la biomasa se multiplicó por el factor 0.5 (IPCC, 2003), luego fue sumada por parcela y extrapolada a Mg/ha.
Análisis de la información: Inicialmente, fueron evaluadas la normalidad y homogeneidad de la varianza de los datos para cumplir con los supuestos de la estadística paramétrica. Se utilizaron regresiones lineales y logarítmicas para evaluar el efecto de la diversidad, riqueza de especies, variación de la estructura (altura y Dap) y edad de los sistemas agroforestales sobre la acumulación del carbono.
Para determinar la variación de la estructura de la vegetación arbórea (altura y Dap), se calculó el coeficiente de variación (CV) de la altura y Dap, como la proporción de la desviación estándar de todas las mediciones de altura y Dap con la media de la altura y Dap, dentro de cada SAF (Ali & Mattsson, 2017b). La variación global de la altura y Dap representa el grado de diferenciación de nicho realizado a través de interacciones positivas planta-planta (Clark et al., 2007).
Para examinar como las variables de diversidad (Shannon, riqueza) y estructura (altura, Dap y CV) explican el carbono en la biomasa sobre el suelo (CBS), se utilizó la partición de la varianza. Este examen se basa en el análisis de redundancia (RDA), que examina cuanto de la variación es explicada por un conjunto de variables (Rousseau, Rioux, & Dostaler, 2006; Borcard, Gillet, Legendre, & Legendre, 2011). Las variables de diversidad y estructura fueron sometidas a una selección hacia adelante (Forward selection). Este procedimiento seleccionó variables significativas (riqueza, altura, Dap y CV) para construir un modelo que explique la variación del CBS, el índice de Shannon fue excluido del modelo (P = 0.06). Posteriormente la contribución de cada variable en el modelo fue evaluada por el test de Monte Carlo, con 999 permutaciones. Esto permitió especificar cuánto de la variación del modelo final fue explicado por el efecto puro de cada variable y que proporción fue compartida.
Todos los análisis estadísticos se realizaron con el software R 3.3.2. (R Core Team, 2016), la partición de la varianza y RDA utilizó la función varpart en el paquete vegan (Oksanen et al., 2015).
Resultados
Diversidad: En los 25 sistemas agroforestales (SAF) y 4 bosques secundarios (BS) estudiados fueron encontrados entre árboles, palmeras y bananos (especies arbóreas) un total de 2 911 individuos, donde se identificaron 78 especies, distribuidas en 64 géneros y 29 familias. La riqueza del sistema cacao agroforestal (CA) varío entre 4 a 15 especies arbóreas por parcela (promedio = 10.8 ± 2.9), café sombreado (CS) entre 10 a 18 (13.8 ± 3.4), huerto casero (HC) entre 13 a 17 (14.8 ± 1.6) y BS entre 18 a 22 (20.3 ± 2.1). El índice de diversidad de Shannon del CA varío entre 1.1 a 1.8 por parcela (Promedio = 1.5 ± 0.07), CS entre 1.7 a 2.3 (2.1 ± 0.08), HC entre 1.2 a 2.3 (1.9 ± 0.12) y BS entre 1.7 a 3.0 (2.2 ± 0.27). Las especies más abundantes fueron cacao (Theobroma cacao, N = 985) que representa el 33.8 % de las especies arbóreas, seguido por banano (Musa spp., N = 163, 5.6 %) y motacú (Attalea princeps, N = 126, 4.3 %). La taxonomía y uso de las 10 especies arbóreas más abundantes se presentan en el Apéndice 2.
Carbono: El carbono en la biomasa sobre el suelo (CBS) varió entre 14.93 a 68.88 Mg/ha (Promedio = 32.5 ± 17) en el CA, 14.43 a 78.58 (48.8 ± 22.5) en el CS, 30.66 a 55.53 (45.6 ± 8.9) en el HC, y 60.22 a 76.51 (67.4 ± 6.9) en el BS. Las relaciones bivariadas indicaron que el CBS aumentó significativamente con la riqueza de especies (r2 = 0.74; P < 0.001) (Fig. 2a), la edad (r2 = 0.61; P < 0.001) (Fig. 2b), la variación de la altura (r2 = 0.32; P < 0.001) (Fig. 2c) y variación Dap de las especies arbóreas (r2 = 0.31; P < 0.001) (Fig. 2d). La diversidad de Shannon presentó una relación significativa con el CBS pero menos fuerte que las demás variables (r2 = 0.20; P < 0.01).

Fig. 2 Relationship between the carbon of the aboveground biomass (AGB) and species richness (a), age (b), height variation (c) and DBH variation (d), in agroforestry systems (cocoa agroforestry/CA, shaded coffee/CS, homegarden/HC), and secondary forest (BS) in the Southern Amazon, Bolivia.
La relación del CBS con la edad de los sistemas (Fig. 2b) tiene la forma de una curva de saturación, lo que indica una acumulación de biomasa inicial muy rápida, seguida de una desaceleración más adelante en la sucesión. En todos los sistemas agroforestales evaluados, la acumulación de la biomasa se incrementa con la edad, debido al aumento de la abundancia de especies con mayor biomasa individual (Fig. 3) y mayor variación en altura y Dap (Fig. 4). El potencial de acumulación de biomasa en sistemas agroforestales como el café sombreado con 20 a 30 años de edad (69.9 ± 6.9 Mg/ha) es similar al bosque secundario de 40 a 60 años de edad (58.1 ± 7.6 Mg/ha; Fig. 2b).
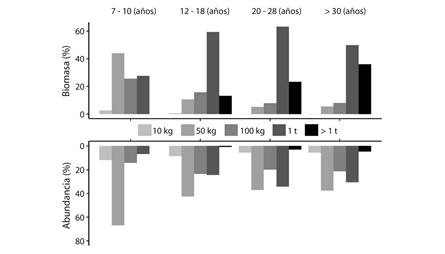
Fig. 3 Percentage distribution of biomass and abundance of trees with different individual biomass (kg) in agroforestry systems with different ages in the Southern Amazon, Bolivia.
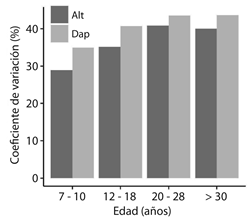
Fig. 4 Distribución del coeficiente de variación (%) de altura y Dap de especies arbóreas en sistemas agroforestales con diferentes edades en la Amazonía Sur, Bolivia. Fig. 4. Distribution of variation coefficient (%) of height and DBH of tree species in agroforestry systems with different ages in the Southern Amazon, Bolivia.
Partición de la varianza: La variación explicada para el CBS en su conjunto representó el 85.74 % (Fig. 5). La mayor proporción se debió al efecto compartido entre la riqueza y la estructura (42.69 %). Entretanto el mayor efecto puro sobre el CBS se relacionó con la riqueza (12.67 %), seguido por la estructura (8.76 %) y variación de la estructura (4.77 %). El efecto puro de las tres variables en el modelo fue significativo. Por su parte, el efecto compartido por las tres fracciones riqueza, estructura y variación de la estructura fue 13.18 %, y en menor proporción los efectos combinados riqueza y variación de la estructura (0 %), estructura y variación de la estructura (4.72 %).
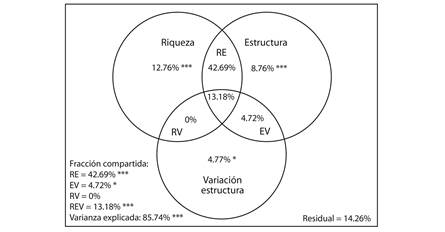
Fig. 5 Partition of variance for carbon of the biomass aboveground (AGB) in agroforestry systems with different ages, in the Southern Amazon, Bolivia. The variation is explained by the variables, pure effects: richness, structure and structure variation; Shared effects: richness and structure (RE), structure and structure variation (EV), richness and structure variation (RV), richness, structure and structure variation (REV). Residual is the unexplained fraction.
Discusión
El estudio evidenció relaciones significativas entre la riqueza de especies y el carbono de la biomasa aérea en sistemas agroforestales (SAF) tropicales, relación que también es encontrada en ecosistemas naturales (Poorter et al., 2015; Wang, Lei, Ma, Kneeshaw, & Peng, 2011; Zhang & Chen, 2015). Un estudio similar en huertos caseros de zonas secas, sugiere que la biomasa aérea es promovida por la riqueza de especies y la variación intraespecífica e interespecífica del tamaño de los árboles (Ali & Mattsson, 2017b).
En este estudio se observó diferentes sistemas agroforestales, con diferentes edades, riqueza y estructura en la vegetación, además de bosques secundarios avanzados como ecosistemas de referencia. Los sistemas agroforestales más antiguos presentaron una diversidad y riqueza de especies, próximo a los bosques secundarios (Fig. 2a). La diversidad es clave para el funcionamiento y estabilidad de los ecosistemas (Cardinale et al., 2012; Hooper et al., 2012), como también importante para la producción de biomasa (Reich et al., 2012), además la diversidad promueve mayor variedad de rasgos funcionales, patrones de crecimiento y tamaño de las especies (Poorter et al., 2016).
Los resultados resaltan, que los SAF, en particular el café sombreado con 20 a 30 años, pueden acumular cantidades similares de biomasa a los bosques secundarios de 40 a 60 años de edad (Fig. 2b). Una explicación para esa relación de biomasa entre estos sistemas es el manejo, en el sistema café sombreado, las especies arbóreas son seleccionadas, el sistema continúa siendo enriquecido con nuevas especies y con la poda mantienen una alta variación en la altura y Dap (Fig. 2c, Fig. 2d), permitiendo una utilización más eficiente de los recursos (Brassard et al., 2013), resultando en mayor producción de biomasa, considerando que en estos sistemas los agricultores no adicionan fertilizantes. Caso contrario, los bosques secundarios ricos en especies, continúan siendo perturbados por la extracción de madera, afectando la estructura de la vegetación y con esto su efecto negativo en las reservas de biomasa aérea.
Los resultados de esta investigación concuerdan con la idea de que la estratificación de la vegetación puede regular la diversidad de especies (Reich et al., 2012; Zhang, Chen, & Reich, 2012; Zhang & Chen, 2015), permitiendo una utilización más eficiente de los recursos luz, agua y nutrientes (Poorter et al., 2015; Ali, Yan, Chang, Cheng, & Liu, 2017), mejorando la producción de biomasa aérea debido al efecto de complementariedad de nichos (Loreau, 2000; Dı́az & Cabido, 2001; Coome, Kunstler, Canham, & Wright, 2009; Brassard et al., 2013). Por lo tanto, sistemas simples que no consideren el efecto positivo del espacio vertical y horizontal como factor regulador de la diversidad y aprovechamiento de los recursos, pueden disminuir su capacidad de producción de biomasa (Reich et al., 2012; Poorter et al., 2016). Esta relación fue encontrada en monocultivos de cacao y sistemas simples de café, con menor capacidad de producción de biomasa, comparados con sistemas multiestratos y biodiversos (Jacobi et al., 2014; De Beenhouwer et al., 2016; Rajab, Leuschner, Barus, Tjoa, & Hertel, 2016).
La descripción de acumulación de biomasa aérea a lo largo de los años en los sistemas agroforestales y su aproximación en las reservas de biomasa a los bosques secundarios puede ser empleada como una medida de resiliencia (Gunderson, 2000; Gehring, Denich, & Vlek, 2005) para estos agroecosistemas, considerando que los bosques secundarios reflejan la regeneración natural en la región. En ese contexto los SAF pueden desempeñar un rol importante, como reservorios de carbono, corredores biológicos y refugio para la biodiversidad (Faria, Paciencia, Dixo, Laps, & Baumgarten, 2007; Caudill, DeClerck, & Husband, 2015; Zomer et al., 2016).
La acumulación del carbono en la biomasa en el tiempo, tomó la forma de una curva de saturación con la edad de los sistemas (Fig. 2b). Esto sugiere que el carbono en la biomasa, está relacionada con el crecimiento de las especies arbóreas en el tiempo (Schroth et al., 2015), un incremento de biomasa inicial rápido y una desaceleración más adelante. Por eso, un análisis de partición de la varianza donde incluimos a la edad como variable explicativa, encontramos que la edad como factor puro no tiene un efecto directo sobre el carbono de la biomasa (Apéndice 3). Por otra parte, la biomasa aérea en los SAF es dinámico, sujeto a factores de manejo y perturbaciones (poda, selección de especies, sequias, entre otros) que afectan la producción, almacenamiento y perdida de biomasa.
La partición de la varianza (Fig. 5) sugiere que la riqueza, la estructura y variación de la estructura (altura y Dap) de las especies arbóreas son los principales mecanismos para causar efectos positivos sobre el carbono en la biomasa en los sistemas agroforestales. Estas relaciones probablemente resultaron por la distribución de la vegetación en los diferentes estratos, que se da a través del aumento en la desigualdad en la altura y Dap de las especies arbóreas en el tiempo (Fig. 4), lo que significa una ocupación más completa de los nichos por encima y por debajo del suelo, resultando en mayor capacidad de aprovechamiento de los recursos, luz, agua y nutrientes (Brassard et al., 2013; Ali & Mattsson, 2017b), para ser transformados en biomasa a través de la fotosíntesis (Mercado et al., 2011; Asner et al., 2014). Estos resultados agregan un nuevo valor en el entendimiento de los efectos de la riqueza sobre la biomasa aérea, y el funcionamiento en los sistemas agroforestales. En ese contexto los SAF tienen una participación importante en el potencial de almacenamiento de carbono, como también en la conservación de la biodiversidad y mayor capacidad de resiliencia.
Por lo tanto, la conversión de bosques naturales en paisajes de producción agrícola debe considerar la práctica de sistemas agroforestales, ricos en especies, sobre todo con especies de uso múltiple y con el mantenimiento de la estratificación del sistema, por ser más eficiente en el uso de los recursos, además de proporcionar mayores beneficios y servicios a los medios de vida de los agricultores, también pueden ser más resilientes a los impactos del cambio climático. Para eso, el desarrollo de políticas públicas para la promoción de los sistemas agroforestales y asistencia técnica son fundamentales.












 uBio
uBio 

