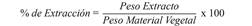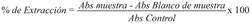La malaria es causada por un parásito de género Plasmodium, transmitido a los seres humanos por la picadura de la hembra del mosquito infectado de género Anopheles, que se reproduce en regiones que combinan calor, humedad y vegetación (OMS, 2017). Alrededor de 3 200 millones de personas están en riesgo de contraer la enfermedad en 97 países y se estima que ocurrieron en el mundo en el 2015, 198 millones de casos (intervalo: entre 124 millones y 283 millones) (OMS, 2016). Las principales especies de Plasmodium que afectan al hombre son P. vivax y P. falciparum, la más peligrosa es P. falciparum, dada su patogenicidad y resistencia a los principales antimaláricos que en muchas ocasiones puede llevar a la muerte del individuo. Existen otras dos especies de importancia, P. malariae y P. ovale, que causan formas benignas de la malaria (Chin, 2005; Gelb, 2007). En sangre, se diferencian cuatro formas parasitarias asexuadas: anillos o trofozoítos jóvenes, trofozoítos maduros, esquizontes que al romperse liberan, merozoítos que son las formas que invaden los eritrocitos. (Londoño, Carmona, & Blair, 2002; Olumese, 2006). La biología y bioquímica del Plasmodio son tópicos de interés científico en el diseño de nuevos fármacos antimaláricos (Liu et al., 2018). La mayoría de los medicamentos antimaláricos que están ahora en uso no son desarrollados sobre la base de blancos moleculares previamente identificados, sino productos del hallazgo de la actividad antimalárica de productos naturales utilizados tradicionalmente como tal (por ejemplo, quinina y la artemisinina). Recientemente, gracias a una mejor comprensión de la bioquímica de los parásitos de la malaria, se han podido identificar blancos potenciales para el diseño de nuevos medicamentos, los cuales han dado pautas sobre el modo de acción de muchos antimaláricos (Robert, Dechy-Cabaret, Cazelles, BenoitVical, & Meunier, 2002; Fidock, Rosenthal, Croft, Brun, & Nwaka, 2004).
Una de las vías y/o modos de acción de mayor relevancia en la literatura actual es la inhibición de biocristalización del grupo hemo generado principalmente por los derivados de la cloroquina (MacRaild, Pedersen, Anders, & Norton, 2012). En la mayoría de su ciclo de vida en humanos, el parásito de género Plasmodium habita en los glóbulos rojos. Dentro de los eritrocitos, el evento inicial es la endocitosis de la hemoglobina, que es transportada hacia una organela denominada la vacuola digestiva ácida (pH 5.2), donde los parásitos procesan entre un 60 y 80 % de la hemoglobina presente en el glóbulo rojo. Aquí es donde la parte proteica (globina) es degradada por una serie de enzimas proteolíticas incluyendo plasmepsinas I, II, y IV, proteasa histoaspártica (HAP), falcipaínas 2 y 3 y falcilisinas para generar péptidos. Éstos son degradados a aminoácidos debido a la limitada capacidad del parásito para sintetizarlos, generando como subproducto el hemo libre ferriprotoporfirina (ΙΧ) (Fe (III) PPIX) o (FP); (el FP en la vacuola digestiva representa sólo el 3-5 % del volumen total del parásito). Debido al medio ácido de la oxihemoglobina, el hierro se oxida de Fe2+ a Fe3+ con la consecuente producción de un 0.5 equivalente molar de H2O2 (Egan & Ncokazi, 2005; Egan, 2008). Tanto el FP y H2O2 son moléculas tóxicas que el parásito necesita destruir o neutralizar. El FP “libre” en eritrocitos infectados con P. falciparum ha sido cuantificado en 0.1-0.4 mM. Incluso se ha llegado a estimar que la concentración local puede ser mucho mayor (Kumar, Guha, Choubey, Maity, & Bandyopadhyay, 2007). Esto sugiere que el parásito vive en constante peligro, por lo que su mecanismo para la desintoxicación de FP debe ser preciso para evitar los efectos tóxicos de los residuos metabólicos de estos dos productos generados. Se estima que el parásito realiza una detoxificación mediante uniones coordinadas entre los grupos carboxilato y los Fe3+ presentes en la FP, propiciando un fenómeno de biocristalización entre estos grupos, generando así un producto de color carmelita oscuro denominado hemozoina o pigmento malárico, el cual no es tóxico debido a su insolubilidad en agua a pH fisiológico o ácido (Fitch, 2004). La inhibición de la desintoxicación FP, causa una acumulación de moléculas tóxicas de FP que eventualmente destruyen la integridad de las membranas del parásito de la malaria. La hemozoina se ha identificado químicamente mediante difracción de rayos X y espectroscopia mossbauer y la cual fue comparada con un compuesto de síntesis conocido como β-hematina. El entendimiento de este proceso de biocristalización de FP ha llevado a la identificación y búsqueda de una serie de posibles nuevos compuestos antimaláricos (Biamonte, Wanner, & Le Roch, 2013).
El género Piper perteneciente a la familia Piperaceae, se distribuye en todo el mundo con aproximadamente 2 300 especies. Este género tiene una gran importancia comercial y económica, para la industria de condimentos, farmacéutica, insecticida y se ha reportado una amplia gama de plantillas estructurales como lignanos, saponinas, fenoles flavonoides y alcaloides (Gupta, Arias, Correa, & Lamba, 1979; Benevides, Sartorelli, & Kato 1999; Prasad et al., 1995). Igualmente, Clusiaceae es una de las familias de plantas en la cual se han encontrado compuestos con actividad antimalárica, como xantonas y derivados del acilfloroglucinol. Se han reportado estos compuestos en plantas de los géneros Hypericum, Vismia y Garcinia. En la familia Clusiaceae, el género Calophyllum lo componen cerca de 200 especies, algunas de las cuales presentan reportes sobre compuestos de tipo cumarinas, xantonas y triterpenos con actividades antimalárica, analgésica, antiviral, antiulcerogénica, anticáncer, antibacteriana, y molusquicida (Noldin, Isaias & Filho, 2006). Es así como los géneros Piper y Calophyllum pudieran ser fuentes de metabolitos secundarios, sus especies han sido poco estudiadas en el campo de la malaria y en los mecanismos de acción conocidos de los principales antimaláricos. Este trabajo tiene como objetivo evaluar la potencialidad de los extractos de diferente polaridad de las especies Piper piedecuestanum, C. brasiliense, C. longifolium y Calophyllum sp. en la inhibición de la formación de β-hematina.
Materiales y métodos
Recolección del material vegetal: Se recolectaron tres tipos de muestras a partir del material vegetal: una muestra para espécimen de herbario, muestras como testigos de los especímenes recolectados y muestras de hojas y tallos para la obtención de los extractos. El espécimen para herbario fue procesado, depositado, caracterizado taxonómicamente en el herbario Universidad de Antioquia (HUA), y determinado como Piper piedecuestanum Trel. & Yunck. (Voucher 164502) recolectado en Piedecuesta, Santander- Colombia. Calophyllum brasiliense Cambess recolectado en el departamento de Antioquia- Angelópolis (Voucher 162467), Calophyllum longifolium Willd recolectado en el departamento de Caldas- Norcasia (Voucher 166377) y una morfoespecie Calophyllum sp. recolectada en el departamento de Risaralda- Belén Umbría (Voucher 167392).
Preparación de los extractos de diferente polaridad: El material vegetal se sometió a un proceso de desecación a temperatura ambiente con aireación y sin exposición a la luz solar durante 10 días, posteriormente se pulverizó el material en un molino industrial hasta un tamaño de partícula de 5 mm para iniciar el proceso de extracción. Se llevó inicialmente el material vegetal molido a un proceso de percolación hasta agotamiento (5 días/3 veces), utilizando etanol (E) destilado como solvente con cada una de las plantas Piper piedecuestanum (PP) (0.236 kg mezcla de hojas y tallos), C. brasiliense Cambess (CB) (0.015 kg de tallos), C. longifolium L (CI) (0.016 kg mezcla de hojas y tallos). Por otra parte, el material vegetal seco y molido de 0.36 kg de hojas y tallos de P. piedecuestanum (PPHT); 1.64 kg de hojas de C. brasiliense Cambess (CBH); 1.74 kg de tallos de C. brasiliense Cambess (CBT); 0.13 kg de mezcla de hojas y tallos de C. brasiliense Cambess (CBHT); 0.27 kg hojas de C. longifolium L. (CIH), 0,25 kg de tallos C. longifolium L. (CIT); 0.78 kg de mezcla hojas y tallos C. longifolium L. (CIHT); 0.51 kg de hojas Calophyllum sp. (CSH); 0.43 kg de tallos de Calophyllum sp. (CST); 0.75 kg de mezcla de hojas y tallos de Calophyllum sp. (CSHT), se extrajo sucesivamente por 10 días mediante percolación (3 x 4 L) hasta agotamiento con solventes de polaridad ascendente previamente destilados: éter de petróleo (H), diclorometano (D), acetato de etilo (AE), y metanol (M). Los extractos fueron codificados con las iniciales de cada planta, tipo de material vegetal y solvente empleado. Después de tres días se comenzó la concentración del extracto a presión reducida en un rotavapor y posteriormente pesados para obtener los porcentajes de extracción según la ecuación 1.
Inhibición de la biocristalización de β-hematina: Para la evaluación de la inhibición de la biocristalización de β-hematina por los extractos se utilizó el método colorimétrico según Parapini et al. 2000, 2004; con algunas modificaciones (Parapini, Nicoletta, & Erica, 2000, Parapini et al., 2004). Un total de 100 µl de una solución 1.562 mM de cloruro de hemina disuelto en NaOH 0.2 M, se distribuyó en microplacas de 96 pozos (0.4 µmol/ Pozo) con pipeta multicanal junto con 50 µl de diferentes concentraciones de extractos en un rango: 5.0-0.078 mg/ml disueltos en dimetilsulfóxido (DMSO) al 100 % y el control CQ se evaluó en un rango de 3.0-0.094 mg/ml. Se adicionó por triplicado cada concentración y se realizaron dos réplicas del ensayo. En los pozos control se adicionaron 50 µl de DMSO para pozos sin tratamiento y control de cloroquina como referencia. La formación de β-hematina se inició mediante la adición de 50 µl de ácido acético 2.175 M hasta un pH final de 2.8 y 50 µl de solución tampón de acetato de sodio (C 2 H 3 NaO 2 .3H 2O) 0.75 M. La placa se incubó a 37 °C durante 24 h y después se centrifugó a 4 500 G durante 1 h. La fracción soluble del material fue descartada. El resto se resuspendió con 200 µl de DMSO: H2O relación 1:1 para eliminar la hematina sin reaccionar. Las placas nuevamente se centrifugaron a 4 500 G durante 15 min por triplicado y el sobrenadante fue descartado. El precipitado, se disolvió en NaOH 0.2 M para la cuantificación espectrofotométrica. Una alícuota de 50 µl de cada pozo se transfirió a un nuevo plato con 150 µl de 0.2 NaOH. Un blanco de muestra a las mismas concentraciones disuelto en 150 µl de 0.2 NaOH fue empleado. Antes de las lecturas se verifico la formación de β-hematina en un Spectronic 20 UV-Vis en el rango de 250-800 nm. La cantidad de β-hematina inhibida por cada uno de los extractos se determinó midiendo la absorbancia (Abs) a 595 nm utilizando un lector de ELISA (BioRad) y se calculó el porcentaje de inhibición de β-hematina según la ecuación 2.
Análisis estadístico: Los resultados de los porcentajes de inhibición de los diferentes extractos y las concentraciones evaluadas son presentados como la media y su desviación estándar (Media ± DS). Se realizó un modelo de regresión logística no lineal y un análisis de varianza de dos vías (ANOVA) con un nivel de confianza de P < 0.05 empleando el programa GraphPad Prism 5.
Resultados
Los porcentajes de material obtenido de los extractos de las especies de Piper y Calophyllum con los diferentes solventes y las concentraciones inhibitorias medias sobre la producción de β-hematina se presentan en el Cuadro 1. Los mejores rendimientos de extracción lo tuvieron los extractos de diclorometano de la mezcla de tallos y hojas de las especies P. piedecuestanum (PPHTExtD) con 1.75 % y para las especies de Calophyllum se presentaron máximos de rendimientos de extracción en porcentaje en peso con respecto al material vegetal en los extractos metanólicos de la especie C. brasiliense de 6.209 % (CBHTExtM), de la especie C. longifolium fue 6.130 % (CIHExtM) y de la especie Calophyllum sp. fue de 8.138 % (CSHTExtM).
Cuadro 1 Inhibición de β-hematina por los extractos de diferente polaridad de P. piedecuestanum y Calophyllum
| Código | Especie | Extracto | % rendimiento de la extracción (g de extracto / g de material vegetal seco)** | CI 50 (mg/mL) X + DE*** |
|---|---|---|---|---|
| Inhibición de β-hematina**** | ||||
| PPHExtH | P. piedecuestanum | Éter de petróleo, percolación hojas y tallos 25 ºC ZP* :5mm 10 días | 0.668 | > 5.00 |
| PPHTExtD | P. piedecuestanum | Diclorometano, percolación hojas y tallos 25 ºC ZP* :5mm 10 días | 1.748 | > 5.00 |
| PPHTExtA | P. piedecuestanum | Acetato Etilo, percolación hojas y tallos 25 ºC ZP* :5mm 10 días | 1.116 | > 5.00 |
| PPHTExtM | P. piedecuestanum | Metanol, percolación hojas y tallos 25 ºC ZP* :5mm 10 días | 1.550 | > 5.00 |
| CBHTExtH | C. brasiliense | Éter de petróleo, percolación hojas y tallos 25 ºC ZP* :5mm 10 días | 1.791 | 2.610 ± 0.032 |
| Código | Especie | Extracto | % rendimiento de la extracción (g de extracto / g de material vegetal seco)** | CI50 (mg/mL) X + DE*** |
| Inhibición de β-hematina**** | ||||
| CBHTExtD | C. brasiliense | Diclorometano, percolación hojas y tallos 25 ºC ZP*: 5mm10 días | 1.696 | ND***** |
| CBHTExtA | C. brasiliense | Acetato Etilo, percolación hojas y tallos 25 ºC ZP*: 5mm 10 días | 1.700 | ND |
| CBHTExtM | C. brasiliense | Metanol, percolación hojas y tallos 25 ºC ZP*: 5mm 10 días | 6.209 | 1.260 ± 0.048 |
| CBTExtH | C. brasiliense | Éter de petróleo, percolación tallos 25 ºC ZP*: 5mm 10 días | 1.489 | 2.790 ± 0.037 |
| CBTExtD | C. brasiliense | Diclorometano, percolación tallos 25 ºC ZP*: 5mm 10 días | 1.051 | 0.212 ± 0.056 |
| CBTExtA | C. brasiliense | Acetato Etilo, percolación tallos 25 ºC ZP*: 5mm 10 días | 1.685 | 2.660 ± 0.028 |
| CBTExtM | C. brasiliense | Metanol, percolación tallos 25 ºC ZP*: 5mm 10 días | 2.608 | 2.020 ± 0.039 |
| CBHExtH | C. brasiliense | Éter de petróleo, percolación hojas 25 ºC ZP*: 5mm 10 días | 2.249 | ND |
| CBHExtD | C. brasiliense | Diclorometano, percolación hojas 25 ºC ZP*: 5mm 10 días | 2.902 | ND |
| CBHExtA | C. brasiliense | Acetato Etilo, percolación hojas 25 ºC ZP*: 5mm 10 días | 2.241 | 0.266 ± 0.046 |
| CBHExtM | C. brasiliense | Metanol, percolación hojas 25 ºC ZP*: 5mm 10 días | 3.719 | > 5.00 |
| CIHTExtH | C. longifolium | Éter de petróleo , percolación hojas y tallos 25 ºC ZP*: 5mm 10 días | 1.529 | 0.908 ± 0.068 |
| CIHTExtD | C. longifolium | Diclorometano, percolación hojas y tallos 25 ºC ZP*: 5mm 10 días | 1.889 | 4.490 ± 0.039 |
| CIHTExtA | C. longifolium | Acetato Etilo, percolación hojas y tallos 25 ºC ZP*: 5mm 10 días | 1.661 | 0.429 ± 0.028 |
| CIHTExtM | C. longifolium | Metanol, percolación hojas y tallos 25 ºC ZP*: 5mm 10 días | 3.598 | 1.080 ± 0.057 |
| CITExtH | C. longifolium | Éter de petróleo, percolación tallos 25 ºC ZP*: 5mm 10 días | 0.500 | 0.982 ± 0.079 |
| CITExtD | C. longifolium | Diclorometano, percolación tallos 25 ºC ZP*: 5mm 10 días | 0.564 | 4.490 ± 0.051 |
| CITExtA | C. longifolium | Acetato Etilo, percolación tallos 25 ºC ZP*: 5mm 10 días | 0.347 | ND |
| CITExtM | C. longifolium | Metanol, percolación tallos 25 ºC ZP*: 5mm 10 días | 0.931 | 1.080 ± 0.057 |
| CIHExtH | C. longifolium | Éter de petróleo, percolación hojas 25 ºC ZP*: 5mm 10 días | 2.868 | 0.233 ± 0.048 |
| CIHExtD | C. longifolium | Diclorometano, percolación hojas 25 ºC ZP*: 5mm 10 días | 2.026 | 0.299 ± 0.056 |
| CIHExtA | C. longifolium | Acetato Etilo, percolación hojas 25 ºC ZP*: 5mm 10 días | 1.298 | ND |
| CIHExtM | C. longifolium | Metanol, percolación hojas 25 ºC ZP*: 5mm 10 días | 6.130 | ND |
| CSHTExtH | Calophyllum sp. | Éter de petróleo, percolación hojas y tallos 25 ºC ZP*: 5mm 10 días | 2.114 | > 5.00 |
| Código | Especie | Extracto | % rendimiento de la extracción (g de extracto / g de material vegetal seco)** | CI50 (mg/mL) X + DE*** |
| Inhibición de β-hematina**** | ||||
| CSHTExtD | Calophyllum sp. | Diclorometano, percolación hojas y tallos 25 ºC ZP*: 5mm 10 días | 1.400 | 1.970 ± 0.260 |
| CSHTExtA | Calophyllum sp. | Acetato Etilo, percolación hojas y tallos 25 ºC ZP*: 5mm 10 días | 1.337 | ND |
| CSHTExtM | Calophyllum sp. | Metanol, percolación hojas y tallos 25 ºC ZP*: 5mm 10 días | 8.138 | 0.116 ± 0.029 |
| CSTExtH | Calophyllum sp. | éter de petróleo, percolación tallos 25 ºC ZP*: 5mm 10 días | 0.869 | > 5.00 |
| CSTExtD | Calophyllum sp. | Diclorometano, percolación tallos 25 ºC ZP*: 5mm 10 días | 0.526 | 1.970 ± 0.089 |
| CSTExtA | Calophyllum sp. | Acetato Etilo, percolación tallos 25 ºC ZP*: 5mm 10 días | 0.389 | ND |
| CSTExtM | Calophyllum sp. | Metanol, percolación tallos 25 ºC ZP*: 5mm 10 días | 1.145 | 0.115 ± 0.029 |
| CSHExtH | Calophyllum sp. | Éter de petróleo, percolación hojas 25 ºC ZP*: 5mm 10 días | 3.271 | 0.436 ± 0.037 |
| CSHExtD | Calophyllum sp. | Diclorometano, percolación hojas 25 ºC ZP*: 5mm 10 días | 0.886 | ND |
| CSHExtA | Calophyllum sp. | Acetato Etilo, percolación hojas 25 ºC ZP*: 5mm 10 días | 1.113 | 0.442 ± 0.023 |
| CSHExtM | Calophyllum sp. | Metanol, percolación hojas 25 ºC ZP*: 5mm 10 días | 5.197 | 0.685 ± 0.034 |
* ZP: Tamaño de partícula.
** Dato de una sola réplica.
*** X (Media) + DE (Desviación estándar).
**** Control positivo Cloroquina sobre inhibición de β-hematina a 595nm CI50 = 1.331 ± 0.038 mg/ml.
***** ND=No determinado.
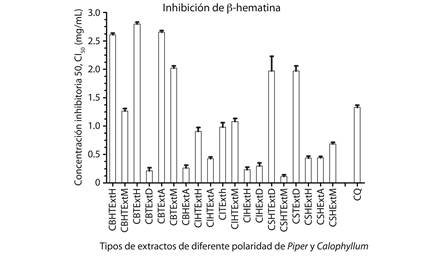
El ensayo colorimétrico de inhibición de β-hematina es simple, robusto y presenta un bajo costo-efectivo que puede ser empleado para un tamizaje de extractos a partir de plantas, con la finalidad de identificar sustancias promisorias como agentes antimaláricos (Vargas et al., 2011). La optimización de esta técnica permitió informar por primera vez la actividad inhibitoria de la β-hematina de 40 extractos obtenidos a partir de las especies P. piedecuestanum, C. brasiliense, C. longinforium, y Calophyllum sp. Para todos los extractos de las especies P. piedecuestanum, C. brasiliense, C. longifolium, Calophyllum sp. se encontró una adecuada relación concentración-respuesta con coeficientes de correlación cercanos a uno (R²) estadísticamente significativos para todas las muestras evaluadas y con un nivel de confianza de P. En la Figura 1 aparecen representados los extractos de diferente polaridad de las especies P. piedecuestanum y Calophyllum sp. que fueron capaces de inhibir la β-hematina con una CI50 < 3 mg/ ml. 19 extractos fueron seleccionados por su potencial capacidad de inhibir la formación de β-hematina. Es de resaltar que los extractos con más potencial de inhibir la β-hematina fueron los extractos en diclorometano y acetato de etilo de las especies de Calophyllum. Nótese que los extractos; de tallos en diclorometano; de hojas en acetato de etilo C. de brasiliense; tallos y hojas en acetato de etilo; hojas en éter de petróleo; hojas en diclorometano de C. longinforium; hoja y tallo en metanol; hojas en acetato de etilo y en metanol de Calophyllum sp. fueron los que presentaron mayor actividad, indicando que los componentes presentes en estos extractos interaccionan fuertemente con la β-hematina con valores inferiores al del fármaco de referencia que fue la Cloroquina, CQ con una CI50 < 1.33 mg/ml.
Discusión
Varios trabajos notifican la actividad inhibitoria por parte de extractos de plantas en la formación de la β-hematina. Osorio, Montoya, Muñoz, & Arango (2006) presentaron el reporte de extractos de acetato de etilo de los tallos de Rollinia pittieri y Pseudomalmea boyacana (Annonaceae) con un 98 % de inhibición de β-hematina. Igualmente, Osorio et al. (2005; 2006) reportaron 36 extractos de diferente polaridad de otras especies de la misma familia de Annonaceae (Annona muricata, Desmopsis panamensis, Rollinia exsucca, Rollinia pittieri) los cuales presentaron capacidad de inhibir la β-hematina con porcentajes de inhibición mayores al 85 % cuando fueron evaluados a una concentración de 2.5 mg/ml. Vargas et al., (2011) probaron un total de 40 moléculas y 219 extractos de plantas, encontrando buenas correlaciones con respecto a la especificidad (compuestos puros 85 %, extractos 93 %) y el valor predictivo (compuestos puros 72 %, extractos 50 %) que obtuvieron en comparación con la inhibición del crecimiento de Plasmodium en un modelo in vitro con una buena correlación. Por otra parte, se han reportado una serie de bisquinolinas, xantonas, una nueva clase de complejos metálicos de coordinación, 8-aminoquinolinas, medicamentos antimaláricos sintéticos como el azul de metileno, y derivados, que han demostrado tener actividades antimaláricas que están bien correlacionadas con sus capacidades para inhibir la polimerización del grupo hemo. Sin embargo, los detalles moleculares de esta inhibición son desconocidos (Asghari-Khiavi et al., 2011). La identificación de nuevas plantillas con mecanismos conocidos son necesarios para el desarrollo de tratamientos eficaces y seguros para la malaria, por lo que la evaluación de la inhibición de la formación de la β-hematina permite rastrear rutinariamente extractos de plantas con el objetivo final de identificar nuevas moléculas antimaláricas en una etapa inicial al descubrimiento de nuevos fármacos. Los positivos resultados obtenidos en este trabajo principalmente para los extractos de diclorometano y acetato de etilo de la especie C. brasiliense direccionan el estudio hacia la búsqueda de sustancias activas mediante la separación de sus principales componentes con el fin de encontrar sustancias con mecanismos similares a los antimaláricos convencionales.
En conclusión, este trabajo reporta la actividad inhibitoria de β-hematina de las especies P. piedecuestanum, Calophyllum brasiliense, Calophyllum longifolium y Calophyllum sp. Los extractos de la especie de P. piedecuestanum no presentaron capacidad de inhibición mientras que si se presentaron resultados promisorios en las especies de Calophyllum donde la especie más activa fue Calophyllum sp. con una CI50 = 0.115 mg/ml, seguido de C. brasiliense con una CI50 = 0.212 mg/ml y C. longifolium con una CI50 = 0.233 mg/ml, lo que permite continuar con los estudios de estas especies promisorias y explorar los metabolitos activos mediante un ensayo bioguiado.












 uBio
uBio