La obtención de información fisiológica a partir de poblaciones de animales silvestres en cautiverio es un recurso que puede ayudar a entender muchas de las características reproductivas de una especie en vida libre, esto en aras de su conservación, en especial para especies silvestres amenazadas (Paris, Whiteb, Reissb, Westa, & Schwarzenberger, 2002; Graham, 2004; Dias, dos-Santos, Lara, Righetto, Pinder, & Chiarello, 2007). Para ello, es imprescindible conocer los parámetros reproductivos básicos de cada especie, incluyendo las características del ciclo estral, la edad del inicio de la pubertad, y el tiempo de gestación entre otras variables (Graham, Schwarzenberger, Möstl, Galama, & Savage, 2001; Palme, 2005; Pereira, Barbanti, & Negrão, 2005; Touma & Palme, 2005; Dumonceaux, Bauman, & Carillo, 2006; Dias, et al., 2007; Schwarzenberger, 2007). Por lo tanto, es necesario conocer los patrones endocrinos de cada especie, información fundamental para entender su biología reproductiva (Graham, 2004).
Tradicionalmente, los perfiles endocrinos han sido determinados con base en las fluctuaciones hormonales en sangre (Goymann, 2012; Palme, 2005). Sin embargo, por las implicaciones de bienestar animal, complicaciones asociadas con la manipulación de los animales y la facilidad de incrementar el tamaño de la muestra, se ha buscado la implementación de métodos no invasivos para la determinación de los diferentes estados fisiológicos, reduciendo con ello, los efectos negativos de estas metodologías de tipo invasivas (Valdespino, Martínez-Mota, García-Feria, & Martínez-Romero, 2007; Goymann, 2012). Por esta razón, las técnicas no invasivas utilizadas para establecer los niveles de esteroides en heces han experimentado un mejora sustancial en las últimas décadas (Graham et al., 2001; Goymann, 2012; Keay, Singh, Gaunt, & Kaur, 2006; Schwarzenberger, 2007).
Dentro de las ventajas de las técnicas no invasivas, sobresale el hecho de estar menos influenciadas por factores como el estrés por la manipulación, se facilita la recolección de muestras seriadas por animal con una mínima interacción sobre el individuo, facilitando estudios paralelos del comportamiento reproductivo. Además, descarta el inconveniente de no obtener una cantidad adecuada de muestra, contrario a lo que ocurre por ejemplo con muestras de sangre (Chelini, Souza, Rocha, Felippe, & Oliveira, 2005; Goymann, 2005; Dumonceaux et al., 2006; Schwarzenberger, 2007).
El método de análisis de esteroides en heces se fundamenta en el principio de detección de compuestos hormonales de “desecho” producto de la metabolización. Los metabolitos conservan su estructura esteroidea, permitiendo su detección y cuantificación en heces, facilitando el establecimiento de relaciones entre las variaciones de esteroides en sangre y su eliminación en las heces (Touma & Palme, 2005).
Si bien, el perezoso de dos dedos (Choloepus hoffmanni) es uno de los mamíferos más abundantes en las zonas boscosas de Costa Rica (Wainwright, 2007), existen pocos estudios que contemplan aspectos reproductivos y endocrinos de esta u otras especies del super-orden Xenarthra (Gilmore, Da-Costa, & Duarte, 2000; Mühlbauer, Duarte, Gilmore, & Da-Costa, 2006; Troll et al., 2013). Snoek, Cruz, Catenacci y Cassano (2011), atribuyen esto al comportamiento críptico del C. hoffmanni, el cual los hace difíciles de estudiar en condiciones de vida libre. Además, la literatura reporta que las hembras de C. hoffmanni carecen de características sexuales secundarias o una clara evidencia de estro, siendo su manifestación muy sutil, con leve edematización de la vulva y escasa secreción vaginal (Gilmore et al., 2000). Esto hace que la determinación del celo por métodos observacionales en condiciones de campo, sea difícil o imposible.
Distintos reportes coinciden en que las hembras alcanzan su madurez sexual a la edad de dos años, mientras que los machos a los cuatro años (Taube, Keravec, Vié, & Duplantier, 2001; Wainwright, 2007). Se considera que la reproducción de C. hoffmanni en vida libre sigue un patrón de estacionalidad, siendo más comunes las gestaciones durante la época lluviosa y los partos durante los meses más secos (Taube et al., 2001). La preñez en esta especie tiene una duración que ronda los 11 meses, con un periodo de lactancia de un mes. Las crías acompañan a la madre hasta los cinco meses de edad.
En la literatura se hace referencia al uso de métodos tradicionales en otras especies para conocer el estado hormonal, tales como la citología vaginal, la colecta de orina y la toma de muestras sanguíneas, los cuales son logísticamente complicados y laboriosos, en especial para la especie C. hoffmanni dada su conducta agresiva (Snoeck et al., 2011; Troll et al., 2013). Por tanto, el análisis de metabolitos hormonales en heces representa un método de medición alternativo para el monitoreo reproductivo de esta especie a largo plazo.
El objetivo de este estudio fue realizar un seguimiento del ciclo reproductivo en C. hoffmanni en condiciones de cautiverio, como modelo para conocer la biología reproductiva de esta especie y de esa manera, valorar la utilidad de las extracciones de metabolitos hormonales fecales en nuestras condiciones.
Materiales y métodos
Selección del sitio de muestreo y de los animales: El muestreo se llevó a cabo en “Sloth Sanctuary” (9°47’57” - 9°47’58”N & 82°54’51” - 82°54’54”W) en Cahuita, Limón, Costa Rica, durante los meses de noviembre y diciembre de 2013 y enero de 2014. Fueron seleccionadas 19 hembras sexualmente maduras de C. hoffmanni, con edades estimadas entre cuatro y 12 años, peso promedio de 6.75 kg (5 kg - 8.47 kg) y aparentemente sanas, sin historia de padecimientos recientes acorde con los expedientes clínicos de cada animal. Estos individuos cumplieron con los siguientes criterios de inclusión: (i) los animales debían estar bajo las mismas condiciones de temperatura, ubicación y tamaño del recinto; (ii) tener el mismo manejo nutricional; y (iii) cada sujeto debía estar alojado en un recinto individual.
La dieta establecida para todos los individuos incluyó vainicas (Phaseollus vulgaris), chayote (Sechium edule), zanahoria (Daucus carota) y berros chinos (Nasturtium officinale).
Los recintos miden 2 m de ancho, 3 m de fondo y 2 m de alto. Se encuentran distribuidos uno junto al otro en un espacio de acceso limitado del refugio. Son de cemento y poseen paredes de malla, de manera que los animales están en constante contacto visual y olfatorio entre sí; dentro de los recintos hay una estructura metálica, así como una tarima y ramas para que se desplacen.
Todos los permisos de esta investigación fueron aprobados por el Comité de Bioética y Bienestar Animal de la Escuela de Medicina Veterinaria, Universidad Nacional (FCSA-EMV-CBAB-007-2014) y se contó con el consentimiento de la administración del Sloth Sanctuary.
Muestras de sangre: Fueron tomadas directamente de la vena cubital o de la vena subclavia en todas las hembras estudiadas, previa sedación de los animales con una combinación intramuscular de Ketamina-Medetomidina (2.5 mg/kg + 0.02 mg/kg respectivamente) (Domitor ® ; Zoetis Kalamazoo, MI 49007, USA.-Ketamine; Aveco Co., Fort Dodge, IA, USA). Luego de 45 minutos de anestesia se antagonizó la Medetomidina con una dosis de Atipamazole 0.1 mg/kg IM (Antisedan ® ; Zoetis, Kalamazoo, MI 49007) (Hanley, 2008).
Un volumen ~1.5 mL de sangre fue obtenido de cada animal usando una jeringa heparinizada (heparina de litio) y cada muestra fue divida en dos alícuotas, una se almacenó en un tubo con heparina (~500 µL) y la segunda muestra fue reservada para colectar plasma siguiendo el procedimiento estándar. Las alícuotas se transportaron a ~4 ºC en una hielera en menos de 24 horas para su posterior análisis hematológico y de química sanguínea, en el Laboratorio de Análisis Clínicos de la Escuela de Medicina Veterinaria de la Universidad Nacional (EMV), donde se mantuvieron a 4ºC hasta su procesamiento. Las muestras sanguíneas de cada perezoso seleccionado (Cuadro 1), se tomaron con una frecuencia de 15 días durante un período de tres meses (noviembre 2013 a enero de 2014).
Análisis hematológico, química sanguínea: Cada muestra de sangre completa y/o plasma, fue procesada en un periodo no mayor a las 24 a 48 horas posteriores a su recolección. Se evaluó el hemograma completo, y se determinó la concentración de proteínas en plasma (totales y albúmina). Adicionalmente, se analizaron los metabolitos de nitrógeno ureico, creatinina y las enzimas: Aspartato Aminotransferasa (AST) y Alanina Aminotransferasa (ALT). El análisis hematológico se llevó a cabo siguiendo el procedimiento estándar establecido por Meneses-Guevara y Bouza-Mora (2014), el cual básicamente consisten en un montaje manual del hematocrito, hemoglobina y conteo leucocitario, así como la realización del diferencial celular bajo la observación de personal capacitado y con amplia experiencia, esto con el fin de evitar errores de lectura en los equipos automatizados. La química sanguínea se cuantificó mediante el equipo automatizado Selectra Junior Spinlab100® (Vital Scientific, Van Rensselaerweg 4, AV Spankeren, NL 6956, USA) siguiendo las recomendaciones del fabricante (Meneses-Guevara & Bouza-Mora, 2014).
Material fecal: Muestras de heces de todas las hembras seleccionadas fueron recolectadas cada vez que defecaron, usando para ello un guante de látex estéril nuevo para cada muestra. La identificación de las muestras se garantizó al mantener una sola hembra por recinto. Las heces se almacenaron en bolsas estériles con la identificaron del individuo incluyendo la fecha de recolección. Todas las muestras fueron almacenadas inmediatamente a -20 °C y se procesaron en los tres meses posteriores a su colecta en el Laboratorio de Endocrinología y Biotecnología Reproductiva de la EMV. Se decidió incluir en esta parte del estudio a solo cinco hembras, las cuales poseyeron el mayor número de heces y mayor confiabilidad en la frecuencia cronológica de defecaciones; esto permitió una colecta de muestras de manera sistemática. En total, se analizaron 208 muestras: 42, 55, 33, 43 y 35 de cada uno de los individuos, respectivamente (Cuadro 1).
Cuadro 1: Edades, número total de muestras de heces analizadas para cuantificación hormonal y pesos de las hembras incluidas en el estudio hormonal.
| Identificación | Edad estimada (años) | n | Pesos por visita (kg) | |||||
| 2013 | 2014 | |||||||
| 14.11 | 28.11 | 12.12 | 28.12 | 13.01 | 28.01 | |||
| Hembra 1 | 5 | 42 | 5.6 | 5.7 | 5.9 | 6.0 | 5.8 | 6.1 |
| Hembra 2 | 11 | 55 | 7.2 | 7.3 | 7.7 | 8.1 | 7.9 | 8.3 |
| Hembra 3 | 11 | 33 | 7.9 | 7.4 | 7.5 | 7.3 | 7.7 | 7.3 |
| Hembra 4 | 4 | 46 | 5.2 | 5.5 | 5.3 | 5.4 | 5.6 | 5.7 |
| Hembra 5 | 12 | 35 | 5.1 | 5.0 | 4.9 | 4.8 | 5.2 | 5.2 |
Extracción de metabolitos hormonales en heces: Se fundamentó en el método de Brown, Walker y Steinman (2009) para muestras de heces húmedas. En el cual a partir de 0.5 g de heces se extrajeron metabolitos hormonales usando etanol al 90 %. Este material se colocó en un Thermomixer ® C (Eppendorf®, Hamburg, Germany) a 96 °C durante 20 minutos; seguidamente se centrifugó a 2 500 rpm durante 20 minutos, se recuperó el sobrenadante. Se conservó el sobrenadante y al precipitado remanente se le repitió el procedimiento anterior. Finalmente, se combinaron los dos sobrenadantes en una sola solución y se evaporó a 56 ºC por 60 minutos, bajo un flujo de aire comprimido. Posteriormente, se le agregó 1 mL de solución salina estéril y se homogenizó. A partir de esta solución, se realizaron diluciones seriadas (1:3) hasta llegar a una relación final de 1:81; esta última solución se empleó inmediatamente para la cuantificación de hormonas. Los remanentes de las diluciones fueron almacenados a -20 º C. Previo a las extracciones en las muestras de las hembras seleccionadas, se estableció la eficiencia del método de extracción y la repetitividad de las mediciones hormonales en heces (material suplementario S1), según lo establecido por Brown et al. (2009).
Cuantificación hormonal: Las mediciones hormonales en sangre de progesterona (P4) y estradiol (E2), al igual que los metabolitos hormonales en heces, se cuantificaron utilizando un equipo automatizado (Tosoh Bioscience, Inc. Modelo AIA-360 ® . 6000 Shoreline Court, Suite 101 South San Francisco, CA. USA) siguiendo las recomendaciones del fabricante para ambos casos. Brevemente, este equipo realiza una detección hormonal o de metabolitos hormonales por medio de un ensayo de tipo competitivo basado en la inmunoabsorción ligado a enzimas fluorescentes (ELFIA), mediante las copas comerciales ST AIA PACK PROG ® y ST AIA PACK E2 ® marca Tosoh Bioscience. Las copas empleadas contienen “perlas” magnetizadas impregnadas con anticuerpos para las hormonas o metabolitos específicos, y se usan enzimas marcadas con un antígeno de interés (hormonas o metabolitos específicos) para realizar la detección y cuantificación. La cuantificación se realizó con la medición de la cantidad de enzima que se une a las perlas, la cual es inversamente proporcional a la concentración de hormona en la muestra. Para este ensayo se usaron 75 μL de muestra de plasma o 5 μL de extracto de metabolitos de heces.
De acuerdo con los datos suministrados por el fabricante, ambos kits comerciales muestran un 100 % de especificidad con la hormona correspondiente (P4 o E2). Se reportan porcentajes de reacción cruzada con otros esteroides inferiores a 6.9 % para las copas ST AIA PACK PROG ® y 7.2 % para las copas ST AIA PACK E2 ® (material suplementario S1). Los rangos de detección son 0.1 a 40 ng/dL y 25 a 3 000 pg/mL, respectivamente.
Comportamiento del ciclo estral: Para estimar la duración del ciclo estral, por medio de la actividad ovárica en los animales seleccionados, se siguió la metodología de Troll et al. (2013), donde a partir de la concentración máxima y mínima de metabolitos de P4 en heces (P4H) durante el tiempo, se estimó la actividad ovárica y con ello la duración del ciclo estral. A partir de estos datos se definieron dos grupos de valores bajo los siguientes criterios: “altos” aquellos datos de P4H con valores > 1.5 veces a su desviación estándar (DS) del promedio del metabolito de P4 de cada animal; y “medios” aquellos valores < 1.5 a su DS. Se consideró que cada valor “alto” representó un pico de P4 en plasma y por tanto, el tiempo transcurrido entre picos, sugirió la duración del ciclo estral.
Para determinar las concentraciones hormonales por gramo de heces de P4 (ng/g) y de E2 (pg/g), se calcularon los valores mínimos y máximos, mediana, promedios y la diferencia promedio entre hembras. Estas diferencias se analizaron descriptivamente y se determinó su relevancia por criterios veterinarios.
Adicionalmente, se correlacionó la concentración hormonal entre plasma y sus metabolitos hormonales fecales mediante la prueba no paramétrica de Spearman. Para esto se consideraron las muestras de heces del mismo día del sangrado y los datos obtenidos en los cuatro días siguientes, al considerar la duración del tránsito intestinal.
Los análisis estadísticos se efectuaron con la plataforma R 3.1.2 (R Core Team, 2014) utilizando los paquetes “multicon” (Sherman, 2015), “descTools” (Signorell et al., 2017) y “ggplot2” (Wickham, 2009).
Resultados
Observaciones generales: Las hembras seleccionadas para el seguimiento hormonal presentaron un promedio de 3.5 deposiciones con un rango de una a cinco por semana, esto representó un elevado número de muestras de heces (n = 208) durante los meses del muestreo (Cuadro 1). Durante las visitas no se detectaron signos de celo y los cuidadores reportaron ausencia de cambios de comportamiento compatibles con estro. Se descartó la posibilidad de gestación durante el periodo de seguimiento, ya que las hembras se encontraban en recintos individuales. A lo largo del estudio las hembras mostaron variaciones leves en su peso (Cuadro 1, material suplementario S2); no se observaron otros hallazgos que indicaran alteraciones en el estado de salud que pudieran afectar los resultados obtenidos.
Hematología, química clínica y hormonas en plasma: Se analizaron un total de 56 muestras sanguíneas pertenecientes a 19 hembras C. hoffmanni, las cuales mostraron un elevado recuento plaquetario y un leucograma compuesto principalmente por linfocitos (Cuadro 2, material suplementario S2).
Cuadro 2: Promedio y su IC 95%, mediana, valores mínimos y máximos de los resultados de hematología y química sanguínea en 19 hembras C. hoffmanni
| Variable | n | Promedio ± IC95% | Mediana (Min-Max) |
|---|---|---|---|
| Hematocrito (%) | 52 | 35 ± 1 | 35.16 (29 - 40) |
| Hemoglobina (g/dl) | 56 | 10.95 ± 0.24 | 10.87 (9.4 - 13) |
| HCM* (g/dL) | 52 | 31 ± 1 | 31.69 (27 - 37) |
| Conteo de leucocitos (µL) | 56 | 12 502 ± 1242 | 12 577 (4 150 - 24 500) |
| N. ‡ en banda (µL) | 56 | 0 ± 0 | 0 (0 - 0) |
| N. ‡ segmentados (µL) | 56 | 3 123 ± 649 | 2 220 (124 - 14 740) |
| Eosinófilos (µL) | 56 | 491 ± 429 | 303 (0 - 5 975) |
| Basófilos (µL) | 56 | 115 ± 52 | 0 (0 - 882) |
| Linfocitos (µL) | 56 | 8 764 ± 1 065 | 8 335 (2 040 - 15 200) |
| Monocitos (µL) | 56 | 0 ± 0 | 0 (0 - 0) |
| Plaquetas (µL) | 52 | 173 130 ± 100 677 | 99 824 (25 690 - 2 003 382) |
| Proteínas totales (g/dL) | 54 | 8.30 ± 3.34 | 6.85 (3.9 - 66.6) |
| Albúmina (g/dL) | 55 | 3.82 ± 0.24 | 3.90 (2 - 4.9) |
| Nitrógeno uréico (mg/dL) | 55 | 18.63 ± 1.56 | 19 (9 - 28) |
| Creatinina (mg/dL) | 50 | 0.83 ± 0.08 | 0.90 (0.4 - 1.2) |
| AST† (U/L) | 56 | 94 ± 9 | 95 (52 - 149) |
| ALT§ (U/L) | 56 | 8 ± 2 | 8 (1 - 29) |
* Hemoglobina corpuscular media.
‡ Neutrófilos.
† Aspartato amino transferasa.
§ Alanina amino transferasa.
Las cinco hembras seleccionadas para el seguimiento reproductivo mostraron concentraciones de P4 plasmática con una mediana de 1.26 ng/mL, con un mínimo de 0.3 ng/mL y 12.84 ng/mL como valor máximo; los resultados de E2 se encontraron por debajo del límite de detección del equipo empleado (Cuadro 3, material suplementario S2).
Cuadro 3: Promedio y su IC95%, mediana, valores mínimos y máximos de los resultados de hormonas en heces y plasma de las cinco hembras seleccionadas para seguimiento reproductivo
| Variable | Promedio ± IC95% | Mediana (Min-Max) | ||
|---|---|---|---|---|
| P4 plasmática (ng/mL)+ | 3.11 ± 0.92 | 1.26 (0.32 - 12.84) | ||
| E2 plasmático (pg/mL)+ | < 25* | < 25* | ||
| P4 en heces (ng/g) | Hembra 1 | 188.19 ± 58.44 | 94.22 (50.74 - 838.85) | |
| Hembra 2 | 216.09 ± 62.86 | 90.79 (42.72 - 999.83) | ||
| Hembra 3 | 2 64.62 ± 85,60 | 196.46 (52.26 - 1 048.28) | ||
| Hembra 4 | 297.49 ± 99.24 | 177.38 (62.56 - 1 526.00) | ||
| Hembra 5 | 120.90 ± 53.49 | 62.18 (46.54 - 874.33) | ||
| Hembras 1 - 5+ | 217.46 ± ٨١.١٥ | 124.21 (50.96 -1 057.46) | ||
| E2 en heces (pg/g) | Hembra 1 | 1767.22 ± 52.31 | 1 756.48 (1 469.66 - 2 339.96) | |
| Hembra 2 | 1772.65 ± 50.85 | 1 733.02 (1 472.69 -2 211.30) | ||
| Hembra 3 | 1719.30 ± 72.20 | 1 787.51 (1 269.87 - 2 197.68) | ||
| Hembra 4 | 1560.44 ± 71.7 | 1 549.88 (239.14 - 1 902.54) | ||
| Hembra 5 | 1700.61 ± 46.09 | 1 717.88 (1 507.50 - 2 144.71) | ||
| Hembras 1 - 5+ | 1 704.04 ± 106.75 | 1 708.95 (1 191.77 - 2 159.24) | ||
+ Valores promedio considerando las 5 hembras a las que se realizó seguimiento reproductivo.
* Valores inferiores al límite inferior de detección del equipo AIA-360®.
Metabolitos hormonales en heces: El método de extracción en nuestras condiciones mostró un promedio de recuperación hormonal de 83 %, con una variación intra-ensayo de 13.8 % para la progesterona y 9.4 % para el estradiol (material suplementario S1). Las cinco hembras seleccionadas defecaron con una frecuencia de una a cinco deposiciones semanales, con un promedio general de 3.55 (IC 95 %: 3.36 - 3.74) veces por semana. El promedio de las concentraciones medianas en las heces de las cinco hembras fue de 124.21 ng/g para la P4 y 1 708.95 pg/g para E2. Las concentraciones promedio mínimas y máximas fueron 50.96 ng/g y 1 057.46 ng/g para P4 y para E2, 1 191.77 pg/g y 2 159.24 pg/g (Cuadro 3 y Figura 1). El detalle de los resultados por hembra se detalla en el material suplementario S3.
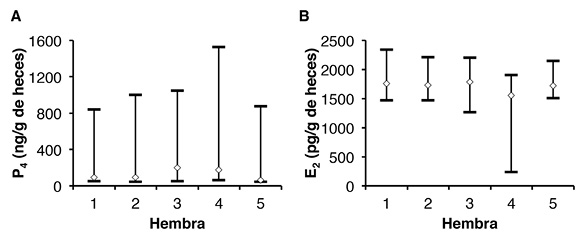
Figura 1 Mediana, valores mínimos y máximos de hormonas en heces de las cinco hembras estudiadas. A. Resultados de progesterona. B. Resultados de estradiol.
La “Hembra 5” presentó un promedio de P4H inferior al observado en el resto de los individuos. De igual manera la concentración promedio de E2 en heces (E2H) fue muy similar en cuatro de las hembras (Kruskal-Wallis = 0.932, P = 0.818), con excepción de la “Hembra 4”, quien presentó valores inferiores a 1 600 pg/g (Kruskal-Wallis = 34.709, P = 5.33 x 10-7).
Comportamiento del ciclo estral: El cambio de las concentraciones de los metabolitos de P4H y E2H de cinco hembras se siguió durante tres meses (Fig. 2). Se observó un pico de P4H en todas las hembras a inicios de noviembre, momento a partir del cual decayó progresivamente la actividad progestacional hasta alcanzar valores inferiores a 100 ng/g con leves variaciones (Figura 2). Asimismo, se detectó la presencia de fluctuaciones irregulares del metabolito de E2H durante todo el periodo de análisis. Solamente dos hembras (hembras uno y dos) presentaron alta regularidad en su ciclo durante el periodo de muestreo (Figura 3).
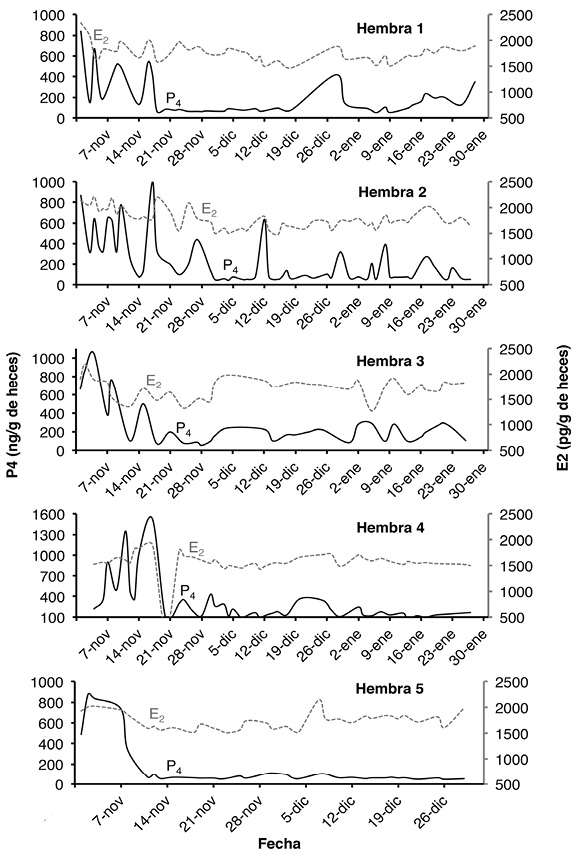
Figura 2 Concentración de P4 (ng/g de heces) y E2 (pg/g de heces) de cinco hembras durante tres meses (noviembre y diciembre de 2013 y enero de 2014). La línea sólida representa la P4, la línea punteada corresponde al E2.
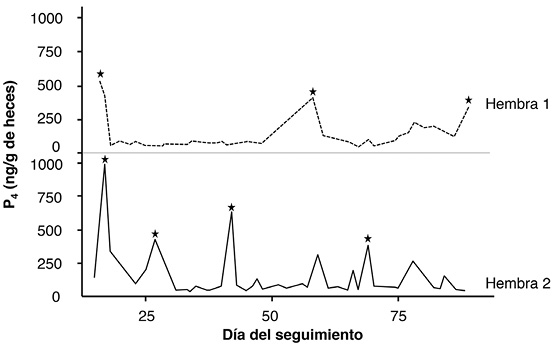
Figura 3 Estimación del ciclo estral en las hembras uno y dos durante noviembre y diciembre de 2013 y enero de 2014. Las estrellas negras indican los momentos en los que ocurrieron picos de P4H.
Correlación entre la concentración hormonal de progesterona en sangre y en heces: No se encontró una correlación estadísticamente significativa entre la progesterona plasmática y la P4H en ninguno de los días evaluados (Spearman, P > 0.05; Cuadro 4).
Cuadro 4: Correlación (r) y su IC 95 % entre las muestras de sangre y las heces del mismo día de la toma sanguínea (día 0) y los cuatro días posteriores TABLE 4: Correlation (r) and CI 95 % between blood samples and feces collected from the blood sampling day (day 0) and the four next days.
| Día | n | r | IC 95% |
| 0 | 10 | -0.29 | -0.78 - 0.42 |
| 1 | 6 | -0.024 | -0.82 - 0.80 |
| 2 | 8 | 0.81 | 0.24 - 0.96 |
| 3 | 10 | 0.21 | -0.48 - 0.74 |
| 4 | 5 | 0.34 | -0.77 - 0.94 |
Discusión
Los valores hematológicos y de química sanguínea encontrados en este estudio concuerdan con los rangos y proporciones reportados por otros autores para la especie C. hoffmanni (Durán, 2005; Hayssen, 2011; Kinney, Cole, Vaughan, & Sladky, 2013; Miller & Fowler, 2015); de igual manera, hay concordancia de los resultados hematológicos con lo reportado para las especies Choloepus didactylus (Vogel, Vie, Thoisy, & Moreau, 1999) y Bradypus variegatus (Araújo, 2006). Aunque C. didactylus no es la misma especie de este estudio, sí es del mismo género Choloepus, por lo que representa una especie simpátrica para el hemisferio sur y por tanto, los valores en nuestro estudio presentan comportamientos similares. Reportes de valores fisiológicos similares en vertebrados simpátricos están bien documentados y utilizados en la literatura (Gilmore et al., 2000; Miller & Fowler, 2015). Además, la ausencia de reportes previos de valores hormonales en sangre para el C. hoffmanni y otras especies de Choloepus sp., limita poder establecer comparaciones de estos valores para la especie de nuestro estudio.
El promedio de P4H obtenido en este estudio (217.46 ng/g, IC95 %: 132.31 - 302.61 ng/g) es levemente mayor al reportado por Troll et al. (2013), quienes en su estudio de esteroides fecales en C. didactylus reportaron datos promedio para dos individuos en cautiverio (98.0 ± 17.0 ng/g y 105.9 ± 30.0 ng/g), variaciones que podrían estar asociadas de alguna manera con el número de muestra, o con la especificidad de detección del metabolito en el procedimiento empleado en dicho estudio. Contrario a lo esperado, los promedios de E2H obtenidos por Troll et al. (2013), fueron considerablemente más altos (6 700 ± 900 pg/g y 7 500 ± 1 600 pg/g) en comparación con este estudio (1 704.04 pg/g, IC95 %: 1 597.29 - 1 810.79 pg/g).
Las variaciones entre las concentraciones hormonales en ambos estudios podrían deberse no sólo a las diferencias especie-específicas, sino también al número de deposiciones semanales, en especial por la diferencia en la recolección de heces que reporta Troll et al. (2013) en su estudio, lo cual podría ser una fuente para esta diferencia. En dicha investigación, las hembras defecaron 1.4 y 2.7 veces por semana en promedio, mientras que este estudio registró un promedio de 3.5 deposiciones por semana. Un lento tránsito intestinal podría explicar parcialmente la diferencia en los valores de E2H, dado que una mayor permanencia de las heces en intestino favorecería un aumento en la concentración del metabolito.
En otras especies se ha reportado que la cantidad de fibra ingerida modifica la concentración hormonal que se excreta, de forma que la fibra dietética se asocia proporcionalmente con el E2(Goldin, Adlercreutz, Dwyer, Swenson, Warram, & Gorbach, 1981; Adlercreutz et al., 1987) e inversamente con la P4 (Wasser et al., 1993). Esto sugiere que las hembras incluidas en nuestro estudio mantuvieron una dieta con menor contenido de fibra en comparación con las analizadas por Troll et al. (2013).
Asimismo, las diferencias encontradas reflejan la relevancia de evaluar las variaciones en el comportamiento hormonal a través de mediciones repetidas en un mediano plazo cuando se trabaja con muestras de heces, en vez de cuantificar un único valor (Dumonceaux et al., 2006; Schwarzenberger, 2007).
Para las cinco hembras analizadas, los valores elevados de P4H a inicios de noviembre, evidencian actividad ovárica importante, dado que los niveles de progesterona altos usualmente se asocian con la presencia de tejido luteal funcional (Reece, 2009). Sin embargo, conforme avanzó el mes de noviembre, la actividad progestacional disminuyó en frecuencia e intensidad en todas las hembras, hasta mantenerse en niveles basales en al menos tres de ellas. Esto revela una disminución de la actividad ovárica que podría estar asociada con un comportamiento reproductivo estacional, fenómeno normal relacionado con el ciclo estral reportado en otros mamíferos (Guimarães-Martins, Bonato, Queiroz-da-Silva, & Furtado-dos-Reis, 2006). Lo anterior podría tener relación con variaciones climáticas, pues la zona en la que se ubican los animales, conocida como Caribe Sur, se caracteriza por ser muy húmeda, con dos breves periodos ligeramente menos lluviosos a lo largo del año (precipitación promedio de 100 a 200 mm), y un importante incremento de las precipitaciones en noviembre y diciembre (MINAET & IMN, 2009), con valores históricos promedio entre 400 y 445 mm.
Si bien en el trópico, las variaciones anuales en el fotoperiodo y la temperatura ambiental son menores que en las zonas templadas, esta región presenta variaciones importantes en la precipitación y es factible que se presente cierta estacionalidad en la disponibilidad de algunos tipos de alimentos y/o el acogimiento de una estrategia reproductiva oportunista por parte de algunas especies de animales (Porras, Zarco, & Valencia, 2004). Esto último estaría asociado con la existencia de condiciones ambientales más favorables para la supervivencia de la progenie, característica que se observa en muchas especies silvestres con el fin de garantizar una mayor tasa de supervivencia de las crías, como se reporta para otras especies de mamíferos tropicales (Guimarães-Martins et al., 2006). En Costa Rica la variación de horas luz a lo largo del año es de una hora como máximo (Suárez-Esquivel & Castro-Ramírez, 2016); aunado a lo anterior, el periodo de estudio fue de tres meses, por lo que la modificación del fotoperiodo fue aún menor y por ende, es poco probable que la influencia de horas luz haya sido determinante. Sin embargo, el primer mes del muestreo (noviembre) corresponde a la transición al periodo de mayor actividad lluviosa en el Caribe Sur de Costa Rica (MINAET & IMN, 2009), lo cual puede ser un factor relevante en la actividad cíclica de estas hembras. De hecho, la teoría de que el ciclo reproductivo de C. hoffmanni ocurre con cierta estacionalidad ya ha sido propuesta (Taube et al., 2001), con un patrón de gestaciones durante la época lluviosa y partos al inicio de la época seca.
Asimismo, la presencia de fluctuaciones de E2H acompañadas de bajos niveles de P4H en las hembras (individuos tres, cuatro y cinco) podría deberse a ondas foliculares anovulatorias sin actividad luteal importante, fenómeno observado comúnmente en herbívoros domésticos como las yeguas (Equus caballus) (Mair, 2013) y en rumiantes domésticos (Bos sp.) en anestro posparto (Porras et al., 2004). Sin embargo, no se puede descartar la posibilidad de que esté asociado con el número de muestras o tiempo dedicado a este estudio, que pudo generar variaciones asociadas a un sesgo de muestreo.
Si bien es cierto que en todas las hembras se redujo la actividad a partir de la segunda mitad de noviembre, en las hembras uno y dos la actividad ovárica se mantuvo, aunque presentó menor intensidad
A pesar de que no se encontró una correlación estadísticamente significativa entre la P4 plasmática y la P4H, los valores obtenidos en las heces del segundo día posterior a la toma de muestras de sangre reflejaron las variaciones observadas en las hormonas plasmáticas. Esta tendencia podría ser más visible con un número mayor de muestras.
Nuestros resultados sugieren que la técnica de medición de metabolitos hormonales en heces usando métodos automatizados puede resultar útil para cuantificar la actividad ovárica de los perezosos de dos dedos en cautiverio, a partir de materia fecal de individuos, aunque esto aún debe ser comprobado a través de la comparación contra otros métodos previamente verificados. Este método se podría usar para establecer relaciones fisiológicas con mayor certeza mediante la comprobación con un mayor número de muestras e individuos, además de un seguimiento más riguroso y por un periodo más prolongado.












 uBio
uBio 

