La subfamilia Podonominae (Diptera: Chironomidae) representa un importante componente de las comunidades de macroinvertebrados en ríos y arroyos fríos de alta montaña en el hemisferio sur. Aunque esta subfamilia fue establecida originalmente a partir de especímenes recolectados de manera ocasional en ríos de la región Paleártica (Thienemann, 1937), posteriormente, con base en observaciones morfológicas detalladas de adultos, pupas, exuvias y larvas de Podonominae australes (Sudamérica, Sudáfrica, Australia y Nueva Zelanda), Brundin (1966) realizó un extenso estudio, en el que además de revelar una sorprendente diversidad de especies en comparación con la fauna boreal, puso de relieve importantes relaciones filogenéticas y conexiones biogeográficas transantárticas (Gondwánicas) entre sus componentes. De esta manera, este trabajo de Brundin se convirtió en la principal referencia para el conocimiento de los Podonominae en Sudamérica, particularmente en los Andes del Sur (Chile y Argentina). Posteriormente, Roback (1970) describió dos nuevas especies del géneroPodonomusde los Andes de Ecuador, y Roback y Coffmann (1983) describieron tres nuevos morfotipos pupales procedentes del altiplano de Perú y Bolivia. Más recientemente, Cranston, Hardy, Morse, Puslednik y McCluen (2010), y Cranston y Kosch (2015) incorporaron evidencias moleculares que respaldaron en gran medida la filogenia propuesta originalmente por Brundin y sugirieron la presencia de especies vicariantes entre las regiones biogeográficas australes.
Sin embargo, los resultados de estos estudios se han restringido principalmente a material biológico recolectado en los Andes del Sur (al sur de Bolivia, especialmente Chile y Argentina). Por el contrario, poco se conoce con respecto a la diversidad y biogeografía de los Podonominae de la zona altoandina tropical (Andes del Norte y Centro) (Spies & Reiss, 1996; Ashe & O’Connor, 2009). Recientemente, Prat, González-Trujillo y Ospina-Torres (2014) publicaron una clave para la distinción de géneros y algunos morfotipos de pupas de quironómidos presentes en los ríos tropicales altoandinos desde el norte de Colombia hasta el sur de Perú. En aquél trabajo, se incluyeron los tres géneros Podonominae de amplia distribución en la zona de estudio y sobre los cuales tratará el presente trabajo:PodonomopsisBrundin, 1966; PodonomusPhilippi, 1865 yParochlusEnderlein, 1912.
Podonomopsises un género de origen gondwánico descrito por Brundin (1966) desde los Andes de Argentina, que también cuenta con varias especies en Australia (Cranston & Krosch, 2015). En los Andes del Sur (Argentina y Chile) cuenta con cinco especies, sin embargo, en los ríos andinos tropicales solo se presenta una especie,P. illiesi, descrita originalmente desde el altiplano del Titicaca en Perú. AunquePodonomopsispuede ser localmente abundante, por lo general es poco frecuente; a diferencia deParochlusyPodonomus,que si están muy diversificados y en Sudamérica se distribuyen a lo largo de toda la cordillera de los Andes, siendo en ocasiones los elementos que dominan la fauna bentónica, especialmente en ríos de cabecera (Brundin, 1966; Acosta & Prat, 2010; Kuhn et al., 2011). El géneroParochluses de amplia distribución a nivel mundial y cuenta con más de 50 especies (Ashe & O’Connor, 2009) de las cuales 29 viven en ríos de montaña de los Andes, el archipiélago del Sur de Chile y las islas Juan Fernández (Brundin, 1966). Por su parte, el género Podonomusincluye en Sudamérica 40 especies válidas y nueve morfotipos no descritos formalmente (Ashe & O’Connor, 2009) principalmente desde los Andes de Bolivia hasta la Patagonia (Brundin, 1966). Aunque también se ha reportado una nueva especie (Roque & Trivhinho-Strixino, 2004), y dos poblaciones adicionales genéticamente diferentes (Trivinho-Strixino, Pepinelli, Siqueira, & Roque, 2012) en ríos del bosque lluvioso del Atlántico de Brasil entre los 1 300 y 2 700 msnm. Al parecer la diversidad específica de estos tres géneros de Podonominae en los ríos altoandinos tropicales, es menor a la encontrada en los Andes australes de Argentina y Chile. Por ejemplo, recientemente Cranston y Krosh (2015) revisaron morfológica y molecularmente el géneroPodonomopsis,e incluyeron especímenes recolectados por los autores de este artículo en la zona altoandina tropical. Los resultados mostraron que entre el sur del Perú y el norte de Colombia solo se encuentraPodonomopsisilliesi, y así se confirma lo que inicialmente sugirió Brundin (1966).
Los objetivos de este trabajo fueron: i) describir la diversidad de taxa de Podonominae en los ríos andinos tropicales entre el sur de Perú y el norte de Colombia, y por encima de los 2 000 msnm, usando las características morfológicas de las exuvias pupales; y ii) comprobar si existe una evidente disminución de especies y una simplificación filogenética hacia el norte de la Cordillera de los Andes. Así mismo, con los resultados obtenidos se propone una clave para distinguir los diferentes morfotipos de pupas de Podonominae en los ríos altoandinos tropicales. Esta clave representa un complemento a la clave de géneros de pupas de ríos altoandinos de Prat et al. (2014); aunque no se han podido identificar todas las especies de los morfotipos encontrados, la elaboración de este tipo de claves representa una estrategia adecuada, cuando se comienza a estudiar un área con poca información taxonómica de larvas y pupas a nivel de especie. Por ejemplo, Cranston (2000), elaboró una clave de géneros y morfotipos de larvas y pupas de Chironomidae para Australia, la cual revisó constantemente y a partir de la cual se han basado posteriores estudios morfológicos y moleculares sobre grupos específicos, que han permitido la confirmación de especies originalmente descritas como morfotipos, especialmente sobre componentes de fauna gondwánica (Cranston et al., 2010; Cranston & Sæther, 2010; Cranston & Krosch, 2015).
Materiales y métodos
El área de estudio se sitúa entre el norte de Colombia (5° Latitud Norte) y el sur del Perú (16° Latitud Sur) y a lo largo de un gradiente altitudinal entre los 2 000 y 4 600 msnm. Los especímenes de pupas y exuvias pupales provinieron de un total de 197 puntos (ríos o arroyos) distribuidos en 17 cuencas muestreadas en tres proyectos de investigación realizados entre los años 2004 a 2011 (detalles de los mismos pueden consultarse en http://www.ub.edu/riosandes/). El Cuadro 1 muestra el número de puntos de muestreo por cuenca y por país, e información adicional puede encontrarse en el Apéndice 1. Las muestras del proyecto CERA, fueron tomadas en la temporada seca entre octubre del 2007 y noviembre del 2008, y las del proyecto BIQURA, en la temporada seca entre julio a octubre del 2011.
Los especímenes recolectados en ambos proyectos fueron obtenidos a partir de un muestreo cuantitativo realizado en transectos de 50 m de largo. En cada uno de ellos, fueron tomadas 12 muestras de red Surber de 0.1023 m2y 250 micras de apertura, de las cuales ocho pertenecieron a hábitats dominantes (más del 5 % de cobertura en el transecto) y cuatro a hábitats marginales (menos del 5 % de cobertura en el transecto) según su representatividad y habitabilidad en el transecto (Villamarín, Rieradevall, Paul, Barbour, & Prat, 2013). Adicionalmente, en los puntos de muestreo del proyecto BIQURA, se realizó una separaciónin situde pupas provenientes de las muestras bentónicas y se instalaron dos a tres redes de deriva durante dos a tres horas de exposición con el objetivo de recuperar pupas y exuvias pupales transportadas por la corriente (Prat, Ribera, Rieradevall, Villamarín, & Acosta, 2013). Las muestras del río Cañete provinieron de un muestreo semicuantitativo con una red circular de mano de 250 micras de apertura, realizado durante dos ocasiones, en la temporada seca y final de la lluviosa en los años 2004 y 2005, respectivamente (Acosta & Prat, 2010).
Cuadro 1: Cuencas muestreadas para el estudio de pupas y exuvias pupales de Podonominae (Diptera: Chironomidae) en ríos altoandinos
| País | Cuenca | Código | Vertiente | Número de sitios | Proyecto |
|---|---|---|---|---|---|
| Colombia | Chinchiná | CHIN | Atlántico-Caribe | 6 | BIQURA |
| Colombia | Campoalegre-Cauca | CAMPO | Atlántico-Caribe | 2 | BIQURA |
| Colombia | Gualí-Magdalena | GUALI | Atlántico-Caribe | 2 | BIQURA |
| Colombia | San Juan | JUAN | Pacífico | 2 | BIQURA |
| Ecuador | Mira | MIR | Pacífico | 16 | CERA |
| Ecuador | Aguarico-Napo | AGU | Atlántico-Amazonas | 14 | CERA |
| Ecuador | Guayabamba-Esmeraldas | GUAY | Pacífico | 7 | BIQURA |
| Ecuador | Papallacta, Tambo-Napo | NAPO | Atlántico-Amazonas | 6 | BIQURA |
| Ecuador | Pastaza-Marañón | PAS | Atlántico-Amazonas | 16 | CERA |
| Ecuador | Guayas | GU | Pacífico | 15 | CERA |
| Perú | Santa | SAN | Pacífico | 16 | CERA,BIQURA |
| Perú | Mosna-Marañón | MOS | Atlántico-Amazonas | 16 | CERA,BIQURA |
| Perú | Cañete | CAÑ | Pacífico | 35 | Tesis* Ph. D. |
| Perú | Urubamba | URU | Atlántico-Amazonas | 15 | CERA |
| Perú | Ampay-Apurimac | AMP | Atlántico-Amazonas | 7 | BIQURA |
| Perú | Cotahuasi-Ocoña | COT | Pacífico | 7 | BIQURA |
| Perú | Colca-Camaná | COL | Pacífico | 15 | CERA |
BIQURA: Biodiversidad de Quironómidos en Ríos Altoandinos (2011), CERA: Calidad Ecológica de Ríos Altoandinos (2007). Tesis* Ph. D. R. Acosta (2009).
Las muestras bentónicas de los tres proyectos fueron conservadas en formol al 10 %, mientras que las muestras de deriva y los especímenes de la recolecta manual del proyecto BIQURA, se conservaron en alcohol al 96 %. Posteriormente, las pupas y exuvias pupales fueron separadas en el laboratorio, y montadas en láminas portaobjetos con Euparal®como medio de conservación permanente y siguiendo los protocolos descritos por Pinder y Reiss (1986) y Epler (2001), tal como se detalla en Prat et al. (2014).
La nomenclatura morfológica y la ubicación de las diferentes partes de la pupa y exuvias utilizadas en esta clave siguieron a Prat et al. (2014) (véase la Figura 1 de dicha publicación), pero se utilizó por ejemplo “Órgano Respiratorio” (OR) en lugar de “Cuerno Torácico”. Para distinguir los diferentes morfotipos pupales hemos utilizado: i) el nombre científico específico (en tres casos en los que ha sido posible identificarlos a este nivel); ii) el grupo taxonómico al que pertenecen, los cuales fueron establecidos por Brundin (1966), o iii) nombrándolos como sp. 1, sp. 2 y así sucesivamente. Cuando el espécimen examinado fue muy semejante a alguna especie previamente descrita, pero la zona de recolección original era muy distante a nuestra área de estudio (por ejemplo, la región patagónica), se ha preferido designar el morfotipo como cercano o próximo a dicha especie (“nr”).
Resultados
De las 197 muestras tomadas se encontraron pupas o exuvias pupales de Podonominae en 73 muestras en un rango altitudinal entre los 2 300 y 4 800 msnm. Para todo el material examinado se observaron un total de 24 morfotipos diferentes en tres géneros (Figura 1), cada uno de los cuales podría corresponder a una especie.
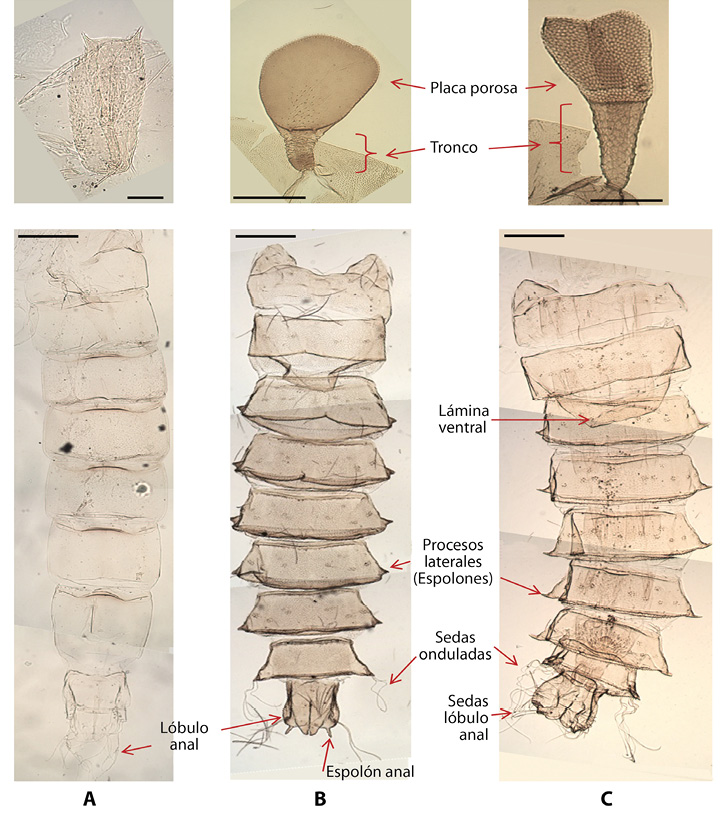
Figura 1.Características morfológicas usadas en la clave para distinguir los géneros, grupos de especies y morfotipos de Podonominae (pupas y exuvias pupales) en ríos altoandinos. Los órganos respiratorios (OR) y el abdomen son mostrados en la parte superior e inferior, respectivamente, A) Podonomopsis B) Parochlusy C) Podonomus. Líneas de escala: OR (A: 25 µm, B y C: 50 µm); Abdomen (A, B y C: 100 µm).
Un total de 23 individuos dePodonomopsisfueron recolectados en toda la zona de muestreo, todos pertenecientes a la especieP. illiesi(Brundin, 1966), y exclusivamente en las cuencas andinas de Perú por encima de los 3 500 msnm. La mayor cantidad de pupas fueron recuperadas de la cuenca del río Cañete (16), pero también en los ríos Cotahuasi (5) y Santa (4).
Del géneroParochlus, se examinaron 64 individuos e identificaron nueve morfotipos (Cuadro 2, Figura 2 y Figura 3). Todos los especímenes recolectados (exceptoParochlusnigrinus peruvianus) tienen sedas largas y onduladas en el segmento anal (dos sedas) y en el segmento abdominal VIII (cinco sedas). Las espuelas anales (AS) nunca son muy grandes (máximo de 67 micras) y todos tienen el abdomen con una microescultura poco desarrollada, con lo cual se descarta la presencia de especies del grupopatagonicus,que sí presentan una microescultura evidente. Por otra parte, las AS nunca están en ángulo recto hacia fuera, ni tienen fuertes dentículos, por lo tanto, los grupossquamipalpisysteinenitampoco parecen encontrarse en la zona altoandina tropical. Por lo que todas las especies encontradas en nuestro estudio se sitúan dentro de los gruposnigrinusyaraucanus.
Cuadro 2: Riqueza y abundancia de especies y morfotipos de pupas y exuvias pupales deParochlusrecolectados en ríos altoandinos
| CHIN1 | MIR2 | NAP2 | GUAY2 | SAN3 | MOS3 | CAÑ3 | COL3 | URU3 | Total | ||
| Grupoaraucanus | |||||||||||
| Sub-grupoaraucanus | P. nr.araucanus | 1 | 1 | ||||||||
| Parochlussp. 1 | 2 | 6 | 6 | 3 | 17 | ||||||
| Parochlussp. 3 | 1 | 1 | |||||||||
| P. nr.maorii | 1 | 1 | |||||||||
| Sub-grupotrigonocerus | P. nr.ohakunensis | 6 | 2 | 1 | 9 | ||||||
| P.incaicus | 5 | 3 | 6 | 2 | 16 | ||||||
| Parochlussp. 2 | 9 | 3 | 5 | 17 | |||||||
| Parochlussp. 4 | 1 | 1 | |||||||||
| Gruponigrinus | |||||||||||
| P.nigrinusperuvianus | 1 | 1 | |||||||||
| Total* | 16 (3) | 5 (2) | 7 (2) | 13 (4) | 10 (3) | 3 (1) | 7 (2) | 1 (1) | 2 (1) | 64 | |
1: Colombia, 2: Ecuador, 3: Perú.
*Entre paréntesis se indica el número total de morfotipos recolectados por cuenca.
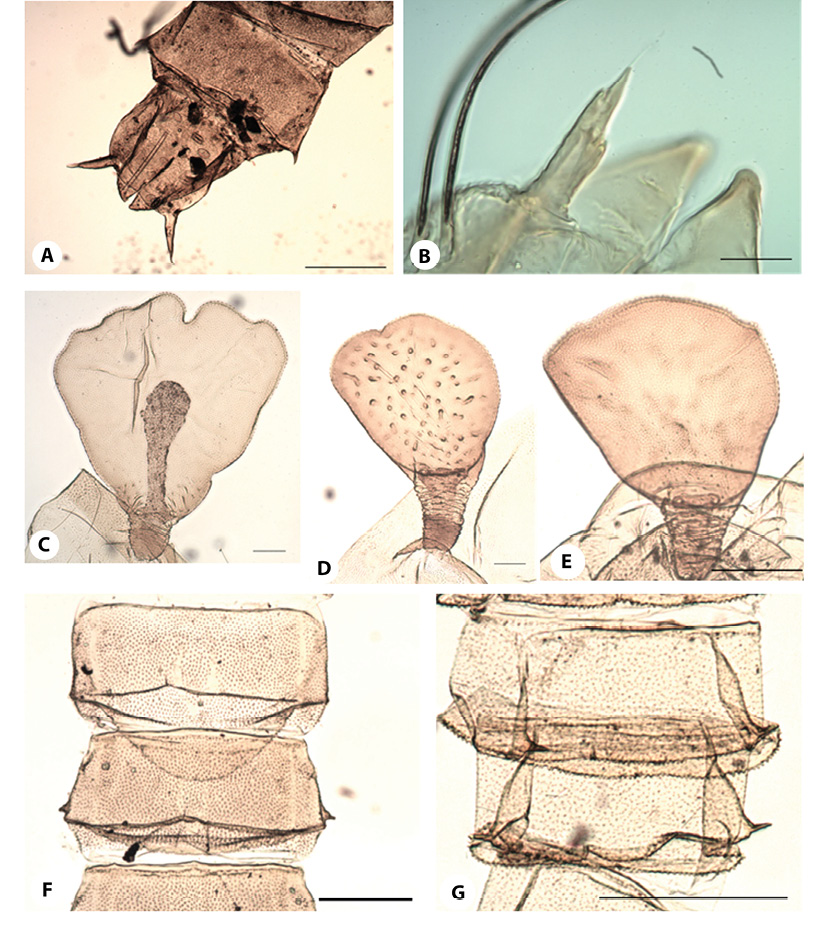
Figura 2 Parochlus.Segmento Anal y AS:A) P. nigrinus peruvianus;B) P. sp. 4. OR:C) P. nr.ohakunensis; D) P. sp.2;E) P. incaicus. Microescultura:F) P. incaicus;G) P. sp4. Líneas de escala: 2A (250 µm); 2B-2G (50 µm).
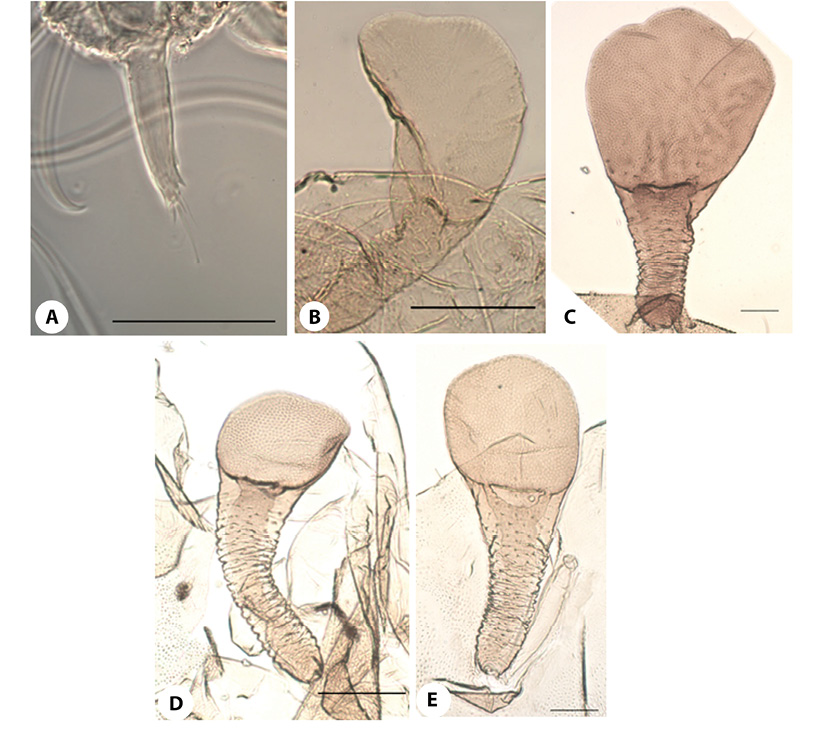
Figura 3 Parochlus.AS:A) P. nr.araucanus. TH:B) P. nr.araucanus;C) P. sp. 1;D) P. sp. 3;E) P. nr.maorii.Líneas de escala: 3A (25 µm); 3B-3E (50 µm).
Dentro del primer grupo, destacaP.nigrinuscon la subespecieperuvianusdescrita previamente por Brundin (1966) (Figura 2A). Las especies de este grupo se distinguen por la ausencia de sedas onduladas largas tanto en el segmento anal como en el segmento abdominal VIII; en nuestros muestreos fue recolectado un solo individuo en la cuenca del río Colca. Los otros ocho morfotipos pertenecieron al grupoaraucanus, que por la forma del órgano respiratorio (OR) se presentaron dos subgrupos:araucanus, con la longitud de la placa porosa (PP) relativamente pequeña con respecto al tronco (T) (Relación LT/LPP > 0.5), ytrigonoceruscon la PP relativamente grande con respecto al T (Relación LT/LPP < 0.5). Dentro de este último subgrupo, tantoParochlussp. 2 (Figura 2D) comoP.incaicus(Figura 2E) fueron muy frecuentes en nuestras muestras (17 y 16 ejemplares respectivamente). MientrasP. incaicusfue descrita previamente por Brundin (1966) en el altiplano de Bolivia y Perú, ninguna descripción previa se parece aParochlussp. 2. Asimismo, cabe destacar a una especie cercana aP.ohakunensis(Freeman) (Figura 2C) (nueve ejemplares recolectados) cuyo borde anterior ondulado del OR es muy característico. Sin embargo, como esta especie solo se ha reportado previamente en Nueva Zelanda (Brundin, 1966), no nos atrevemos a validarla como tal hasta que se pueda confirmar su identidad con posteriores estudios moleculares o con la descripción de los adultos correspondientes.
Dentro del subgrupoaraucanus(aquellos con el Tronco del OR alargado) encontramos aParochlussp. 1. (Figura 3C), con un OR muy característico y muy frecuente en nuestros muestreos (17 ejemplares recolectados); mientras que los otros taxones encontrados fueron poco abundantes, incluyendoP.nr.maorii(Figura 3E) que Roback (1970) describió desde Ecuador. Un caso particular es la posible presencia deP.kiefferi(Garrett) en la zona, especie de distribución Holártica. Sólo dos ejemplares examinados procedentes de Colombia y Ecuador se podrían situar como pertenecientes a esta especie, por tener la AS larga, pero con una sola seda y no con dos, como enP. araucanus(Figura 3A) especie que es muy similar. Sin embargo, las sedas de la AS son muy difíciles de distinguir, presentándose una gran variabilidad en su número y posición dentro de una misma especie. Por esta razón además de su baja representatividad, no hemos incluido los especímenes de este morfotipo. Antes de considerar queP.kiefferiestá presente en nuestra área de estudio, será necesario recolectar más especímenes y probablemente también hacer uso de herramientas moleculares, que permitan confirmar la diagnosis inicial.
Con respecto al géneroPodonomus,de los 194 individuos examinados, hemos podido distinguir 14 morfotipos en cuatro grupos:decarthrus,nudipennis,albinervisymaculatus(Cuadro 3, Figura 4, Figura 5, Figura 6 y Figura 7). De éstos,albinervisfue el que presentó más morfotipos (seis), mientras el grupomaculatussolo estuvo representado porP.nr.reticulatus(Figura 6C y 6D). La separación de los grupos de especies dePodonomuses relativamente fácil, primero la mayor o menor extensión de la lámina ventral del segmento abdominal II separa al grupodecarthrus; seguidamente, la forma de los espolones del segmento abdominal VII separa el gruponudippenisdelalbinervis. Caso particular es el deP. caranqui, que aunque pertenece al grupoalbinervis, por motivos prácticos en la clave, se incluye separado de los otros miembros de este grupo, debido a la particular forma de su OR. Hay que tener precaución con la forma de los espolones, tanto los abdominales como el anal, debido a que en algunas ocasiones pueden estar rotos en el extremo y conducir a identificaciones erróneas.
| CHIN1 | MIR2 | NAP2 | GUAY2 | PAS2 | SAN3 | MOS3 | CAÑ3 | COL3 | COT3 | URU3 | Total | |
| Grupodecarthrus | ||||||||||||
| P. nr.Illiesi | 1 | 1 | 2 | |||||||||
| P. gr.decarthrussp. 1 | 1 | 1 | 2 | |||||||||
| P. gr.decarthrussp. 2 | 1 | 2 | 3 | |||||||||
| P. fittkaui | 8 | 21 | 1 | 3 | 1 | 34 | ||||||
| Gruponudipennis | ||||||||||||
| P. gr.nudipennissp. 1 | 12 | 4 | 16 | |||||||||
| P. gr.nudipennissp. 2 | 1 | 8 | 1 | 5 | 4 | 1 | 2 | 1 | 23 | |||
| P. fastigians | 3 | 1 | 22 | 1 | 27 | |||||||
| Grupoalbinervis | ||||||||||||
| P. nr.regalissp. 1 | 2 | 1 | 1 | 3 | 7 | |||||||
| P. nr.regalissp. 2 | 5 | 5 | ||||||||||
| P. caranqui | 8 | 2 | 20 | 1 | 4 | 4 | 2 | 1 | 42 | |||
| P. nr.inermis | 12 | 4 | 16 | |||||||||
| P. nr.Quito | 2 | 11 | 1 | 14 | ||||||||
| Podonomussp. 1 | 2 | 2 | ||||||||||
| Grupomaculatus | ||||||||||||
| P. nr.reticulatus | 1 | 1 | ||||||||||
| Total | 10 (3) | 3 (2) | 9 (2) | 23 (4) | 1 (1) | 37 (8) | 5 (2) | 45 (8) | 38 (5) | 21 (9) | 2 (2) | 194 |
1: Colombia, 2: Ecuador, 3: Perú.
*Entre paréntesis se indica el número total de morfotipos recolectados por cuenca.
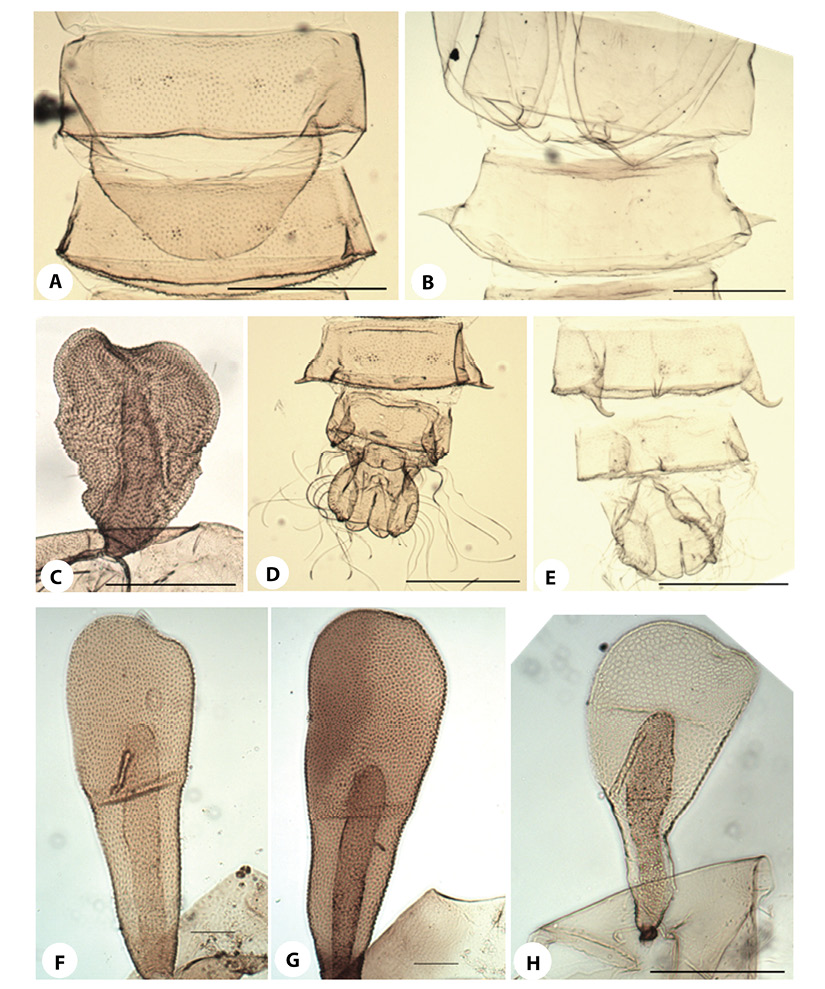
Figura 4 Podonomus. OR:C) P.caranqui;F) Pgrnudipennissp1;G) P.fastigians;H) P.grnudipennissp. 2; Lámina ventral: A)Presente (P.nr.regalissp. 1);B)Ausente (P. gr. decarthrussp. 2). Espolones del segmento abdominal VII: D)No recurvados (P. gr.nudipennissp. 1);E)Recurvados (P. nr.regalissp. 1). Líneas de escala: 4A-4E, 4H (250 µm); 4F-4G (50 µm).

Figura 5.Podonomus Tergitos abdominales:A) P. fastigians;B) P. gr.nudipennissp. 1. OR:C) P. nr.regalissp. 1;D) P. nr.regalissp. 2;E) P.nr.inermis. Sedas onduladas:F)Más de 20 (P. nr.inermis);G)Menos de 15 (P. nr.quito). Líneas de escala: 5A-5D, 5G (50 µm); 5E-5F (250 µm).
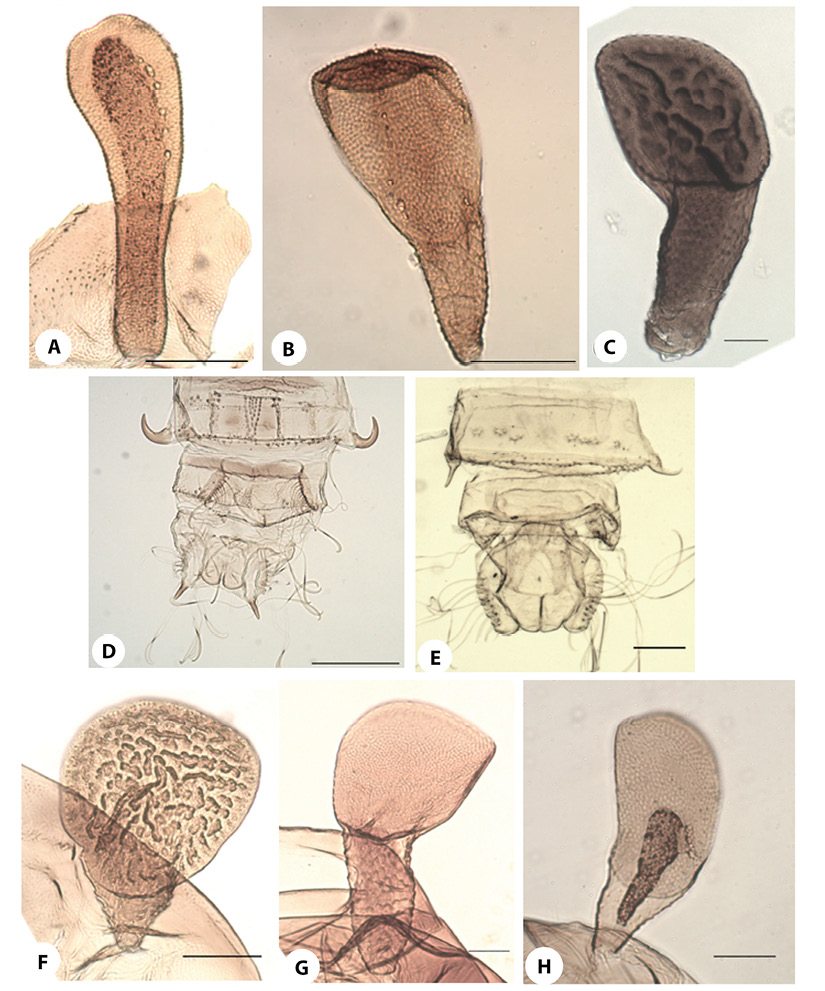
Figura 6.Podonomus. OR:A) P sp. 1;B) P. nrquito;C) P. nr.reticulatus; F) P. fittkaui;G) P. nr. illiesi;H) P.gr.decarthrussp. 1. AS:D)Presente (P. nr.reticulatus);E)Ausente (P. fittkaui). Líneas de escala: 6A-6C, 6E-6H (50 µm); 6D (250 µm).
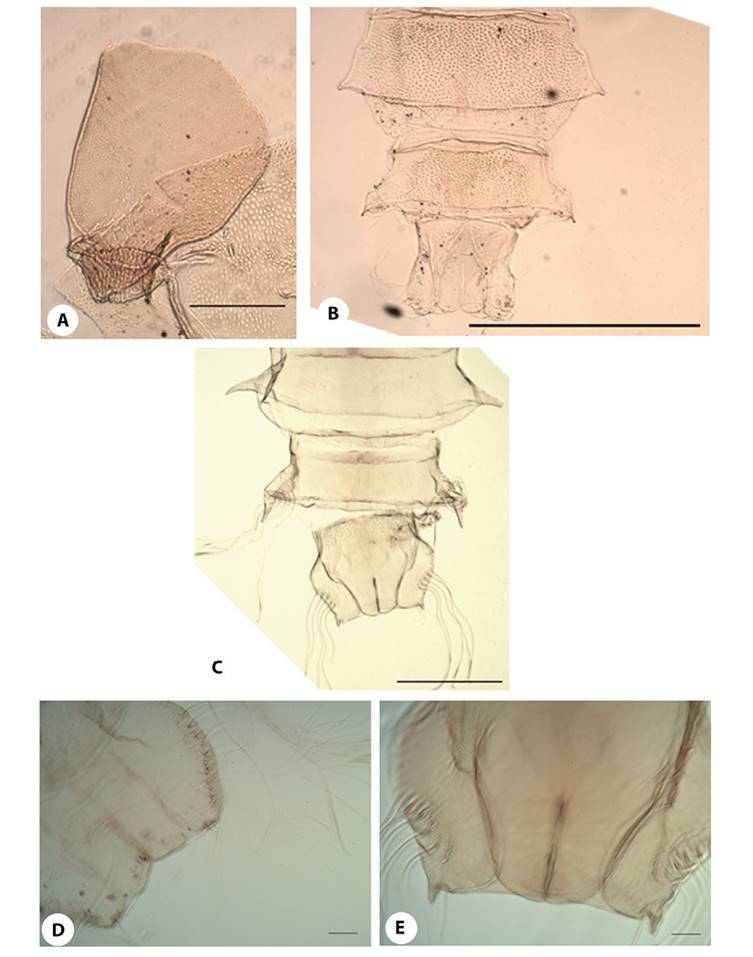
Figura 7. Podonomus OR:A) P.gr.decarthrussp. 2;Espolones del segmento abdominal VIII:B)Cortos (P. nr.illiesi);C)Largos (P. gr.decarthrussp. 2). AS:D)No evidentes (P. gr.decarthrussp. 1);E)Cortos (P. gr.decarthrussp. 2). Líneas de escala: 7A, 7D-7E (50 µm); 7B-7C (250 µm).
De los 14 morfotipos dePodonomusencontrados en nuestra zona de muestreo, cuatro fueron reportados previamente,P. fittkaui(Figura 6F) (grupodecarthrus) yP. fastigians(Figura 4G y 5A) (gruponudipennis) fueron descritas por Brundin (1966) en Bolivia y Perú. Así mismo, del grupoalbinervis,P.nr.regalisfue descrita por Roback y Coffman (1983) en el altiplano de Perú y Bolivia, y de ella hemos distinguido dos formas diferentes según la relación entre la longitud del T respecto a la PP del OR, ambas recolectadas en Perú. La otra especie previamente descrita, también del grupoalbinervis, fue el morfotipoP. “La Paz”(Brundin, 1966) que posteriormente Roback (1970) la nombró comoP. caranqui(Figura 4C) a partir de especímenes de Ecuador. Así mismo, encontramos morfotipos similares a las especies originalmente descritas comoP. illiesiyP. reticulatuspor Brundin (1966) en la Patagonia chilena, pero debido a su lejanía con nuestra zona de estudio, los hemos nombrado comoP.nr.illiesi(Figura 6G) y P. nr.reticulatus(Figura 6C y 6D),respectivamente.Especímenes similares a P. quito,especie originalmente descrita en Ecuador por Roback (1970), fueron encontrados en este estudio en las cuencas de Perú, pero debido a algunas diferencias encontradas, preferimos nombrarlos comoP. nr.quito(Figura 6B).En cuanto a su frecuencia de ocurrencia,P. caranqui,P. fittkauiyP. fastigiansfueron los morfotipos más frecuentes en nuestros muestreos, con 42, 34 y 27 ejemplares recolectados, respectivamente. También fueron relativamente frecuentes Podonomus del grupo nudipennis con dos morfotipos diferentes (P.gr.nudipennissp. 1 y P. grnudipennissp. 2); hemos encontrado cierta variabilidad en la forma de la PP de estos dos morfotipos. En cuanto a P. fastigians,la particular forma de los márgenes posteriores de los tergitos abdominales lo hace inconfundible con otros morfotipos de este grupo. Por el contrario, el único individuo del grupo maculatus, fue encontrado en la cuenca del río Cotahuasi, ypresentó la característica ornamentación que describió Brundin (1966) paraP. reticulatus, pero en la Patagonia de Chile, debido a esto, decidimos nombrar el morfotipo como P. nr. reticulatus.
La mayor abundancia de pupas y exuvias de Parochlus, se recolectaron en las cuencas de los ríos Chinchiná (Colombia) y Guayas (Ecuador), con 16 y 13 individuos, respectivamente (Cuadro 2), pero la mayor diversidad de morfotipos se presentó en la cuenca del río Guayas (4 morfotipos). Con respecto aPodonomus,la mayor abundancia se presentó en los ríos de la vertiente del Pacífico de los Andes (Cuadro 3), principalmente en las cuencas peruanas de Santa (37 individuos), Cañete (45 individuos) y Colca (38 individuos). Sin embargo, fue la cuenca del río Cotahuasi (también de la vertiente del Pacífico), la que presentó la mayor cantidad de morfotipos diferentes recolectados (nueve), seguida de las cuencas de los ríos Santa y Cañete (ocho).
A partir de todos los especímenes examinados, la observación de su morfología y las medidas realizadas, se ha formalizado la siguiente clave, adaptada a partir de Brundin (1966) con la que se pueden distinguir los morfotipos más frecuentes en la zona de estudio. Los acrónimos que se utilizan en la clave son los siguientes: Órgano respiratorio (OR), Longitud del tronco (LT), Longitud de la Placa Porosa (LPP), Anchura de la Placa Porosa (APP), Lámina ventral (LV) y Espolón Anal (AS) (Figura 1). El Cuadro 4 muestra las principales medidas y relaciones morfométricas (en µm) para cada morfotipo deParochlusyPodonomus.
Cuadro 4: Características morfométricas (medias y rangos) de pupas y exuvias pupales de Parochlus y Podonomusen ríos altoandinos. Table 4: Morphometrics characteristics (mean and range) of pupae and pupal exuviae ofParochlusandPodonomus at Andean high altitude rivers
| LT | LPP | APP | LT/LPP | LPP/APP | |
| ParochlusEnderlein,1912 | |||||
| Grupoaraucanus | |||||
| P. nr.araucanus | 136.78 | 159.58 | 129.51 | 0.86 | 1.23 |
| Parochlussp1 | 183.06 (151-202) | 224.25 (179-259) | 211.06 (178-249) | 0.82 (0.68-0.94) | 1.07 (0.95-1.24) |
| Parochlussp3 | 119 | 49 | 6 | 2.43 | 8.17 |
| P. nr.maorii | 197 | 141 | 139 | 1.4 | 1.01 |
| P. nr.ohakunensis | 69.92 (55-91.8) | 322.64 (302-340) | 323.08 (294-342.55) | 0.22 (0.18-0.30) | 0.99 (0.94-1.06) |
| P. incaicus | 83.44 (68.02-110) | 254.91 (221-274.78) | 248.27 (220.83-289) | 0.33 (0.25-0.50) | 1.03 (0.91-1.18) |
| Parochlussp2 | 114.92 (89-127.5) | 261.29 (221-307) | 270.5 (221-329) | 0.44 (0.35-0.56) | 0.97 (0.75-1.08) |
| Parochlussp4 | 67.66 | 248.26 | 204.11 | 0.27 | 1.22 |
| Gruponigrinus | |||||
| P. nigrinus peruvianus | 159.67 | 236.57 | 149.43 | 0.67 | 1.58 |
| PodonomusPhilippi, 1865 | |||||
| Grupodecarthrus | |||||
| P.nr.Illiesi | 120.31 (118-122.62) | 163.63 (99.26-228) | 159.79 (111.58-208) | 0.88 (0.52-1.23) | 0.99 (0.89-1.10) |
| P. gr.decarthrussp1 | 61.33 (45-84) | 183.67 (145-229) | 111.33 (88-137) | 0.33 (0.25-0.37) | 1.65 (1.62-1.67) |
| P. gr.decarthrussp2 | 179.87 (171.60-187) | 188 (178-207) | 168.67 (140-198) | 0.96 (0.9-1.01) | 1.13 (1.04-1.27) |
| P. fittkaui | 71.02 (49.15-108.8) | 228.489 (171.88-393.56) | 230.266 (175.69-317.46) | 0.32 (0.12-0.55) | 0.99 (0.88-1.39) |
| Gruponudipennis | |||||
| P. gr. nudipennissp1 | 63.79 (30.52-85) | 349.32 (234-452.3) | 154.4 (97.8-232.7) | 0.19 (0.07-0.30) | 2.32 (1.45-2.68) |
| P. gr. nudipennissp2 | 84.5 (41.36-109.79) | 243.52 (160.59-224.60) | 184.71 (120-282.16) | 0.37 (0.14-0.67) | 1.35 (1.06-1.67) |
| P. fastigians | 51.48 (27.69-71.1) | 456.56 (390.84-523.24) | 208.14 (155.25-263.44) | 0.11 (0.05-0.16) | 2.21 (1.98-2.75) |
| Grupoalbinervis | |||||
| P.nr.regalissp1 | 156.78 (124.93-187.24) | 151.29 (110.88-194.90) | 154.4 (140-180) | 1.09 (0.64-1.69) | 0.97 (0.79-1.08) |
| P.nr.regalissp2 | 195.3 (192.19-212.81) | 115.25 (103.11-127.91) | 79.76 (64.35-94.06) | 1.71 (1.53-1.93) | 1.47 (1.10-1.74) |
| P. caranqui | 47.07 (29.22-78) | 348.09 (233.07-416) | 271.67 (225-343.6) | 0.14 (0.08-0.29) | 1.29 (0.73-1.52) |
| P. nr.inermis | 118.7 (94.9-150.41) | 259.57 (202.30-323) | 180.8 (107.4-237.9) | 0.46 (0.38-0.62) | 1.46 (1.23-188) |
| P. nr.quito | 114.16 (97.76-138.21) | 216.04 (153.73-272.51) | 165.81 (102-28-207.09) | 0.55 (0.4-0.82) | 1.31 (1.1-1.67) |
| Podonomussp1 | 138.5 (126-151) | 221 (182-260) | 106.31 (106.2-106.42) | 0.66 (0.48-0.83) | 2.08 (1.71-2.45) |
| Grupomaculatus | |||||
| P.nr.reticulatus | 204.9 | 183.6 | 172.2 | 1.12 | 1.07 |
LT: Longitud del Tronco del Organo Respiratorio, LPP: Longitud de la Placa Porosa del Organo Respiratorio (OR), APP: Ancho de la Placa Porosa del OR.
Clave para géneros de pupas de la subfamilia Podonominae de los ríos altoandinos
(Adaptada a partir deBrundin, 1966)
1 - Segmentos abdominales III-VII prolongados en procesos laterales en el margen posterior (Figura 1B y 1C) 2- Sin estos procesos laterales (Figura 1A) Podonomopsis illiesiBrundin, 1966
2 - Lóbulos anales como máximo con dos sedas onduladas en cada lado, el mismo segmento tiene dos espuelas anales más o menos desarrolladas que tienen 1-3 sedas muy pequeñas (Figura 1B). ParochlusEnderlein, 1912- Lóbulos anales como mínimo con cinco sedas a cada lado. Si hay espuelas, normalmente están poco desarrolladas y sin sedas (Figura 1C). Podonomus Philippi, 1865
Clave de morfotipos de pupas deParochlusde los ríos altoandinos
(Adaptado a partir deBrundin, 1966)
1- Sin sedas onduladas en los segmentos abdominales. Espolones anales (AS) presentes y largos, acabados en una seda fuertemente esclerotizada. Sin dentículos en su superficie (Figura 2A) Parochlus nigrinus peruvianusBrundin, 1966- Con sedas onduladas. Los AS de otra forma con una o dos sedas terminales. 2
2- Relación entre la longitud del tronco (LT) del órgano respiratorio (OR) y la longitud de su placa porosa (LPP) inferior a 0.5 (e.g. Figura 2C, 2D y 2E) (Parochlus subgrupo trigonocerus) 3- Relación LT/LPP superior a 0.5 (e.g. Figura 3C, 3D y 3E) (Parochlus subgrupo araucanus) 6
3- PP grande y con el borde superior ondulado. LT/LPP media = 0.29 (max = 0.5) (Figura 2C).
Parochlus cf. ohakunensis (Freeman) 1959- PP diferente, sin la ondulación 4
4- Los poros de la PP son muy grandes y distribuidos regularmente por su superficie. Lámina ventral corta (Figura 2D). La relación LT/LPP media es de 0.44 (rango: 0.35 - 0.56) (Figura 2D) Parochlussp. 2- Los poros de la PP son todos iguales y pequeños. Lámina ventral del segundo segmento abdominal larga (Figura 2E) 5
5- AS cortos con dos sedas cortas. Microescultura del abdomen densa y fuerte (Figura 2F). Segmento abdominal VIII con sedas laterales largas. OR como en Figura 2E. ParochlusincaicusBrundin, 1966-AS largos (Figura 2B). Microescultura del abdomen menos densa (Figura 2G). Segmento abdominal VIII con sedas laterales cortas. Parochlussp. 4
6- AS muy largos, cinco o más veces más largas que anchas (Figura 3A). LT ligeramente inferior a la LPP (Figura 3B) Parochlusnr.araucanusBrundin 1966- AS más cortos 7
7- Relación LT/LPP inferior a 1, media = 0.82 (rango: 0.68 - 0.94). Borde de la PP normalmente con tres pequeñas ondulaciones (Figura 3C). Parochlussp. 1- Relación LT/LPP superior a 1 8
8- LT/LPP superior a 2 (Figura 3D). Parochlussp. 3- LT/LPP nunca es superior a 2 (Figura 3E). AS con dos sedas, la apical más larga que la central Parochlusnr.maoriiBrundin, 1966
Clave de morfotipos de pupas dePodonomusde los ríos altoandinos
(Adaptado a partir deBrundin, 1966)
1- Lámina ventral (LV) del segmento abdominal II grande, alcanzando más allá de la mitad del tercer segmento abdominal (Figura 4A) 2- Lámina ventral más pequeña no sobrepasando la mitad del tercer segmento abdominal (Figura 4B) 10
2- Órgano respiratorio (OR) con el Tronco muy corto y la Placa Porosa (PP) muy ancha. Relación LT/LPP = 0.14 (0.08 - 0.29) y con una escotadura en la parte media de la zona distal muy característica (Figura 4C). P. caranquiRoback, 1970 - OR diferente 3
3- Espolones del segmento abdominal VII, dirigidos lateralmente y nunca curvados en la punta (Figura 4D). El tronco de la PP es siempre más corto que esta. P.gr. nudipennis 4- Espolones del segmento abdominal VII recurvados en la punta (Figura 4E) 6
4- Tronco del OR extremadamente corto, PP alargada (LT/LPP = 0.14; rango: 0.05 - 0.30) (Figura 4F y 4G) 5- Tronco del OR no tan corto (LT/LPP = 0.38; rango: 0.24 - 0.67) (Figura 4H) P.gr.nudipennissp. 2
5- Margen posterior de los tergitos abdominales con dentículos irregulares y ramificados (Figura 5A) P. fastigiansBrundin, 1966 Margen posterior de los tergitos abdominales con dentículos cortos no ramificados (Figura 5B)P.gr. nudipennissp. 1
6- Tronco del OR más largo o igual que la PP (LT/LPP = 1.35; rango: 0.64 - 1.93) (Figura 5C y 5D) P.nr. regalis 7- Tronco del OR más corto que la PP (LT/LPP = 0.53; rango: 0.38 - 0.83) (Figura 5E) 8
7-LT/LPP inferior a 1.5 (Figura 5C) P.nr. regalissp. 1- LT/LPP superior a 1.5 (Figura 5D) P.nr. regalissp. 2
8-Más de 20 sedas onduladas en el segmento anal (Figura 5F) Pnr.inermis- Número de sedas onduladas del segmento anal inferior a 15 (Figura 5G) 9
9- Placa porosa tubular, LT similar a LPP, LPP > 3 APP. (Figura 6A) Podonomussp. 1- OR diferente, no tubular LT < LPP, LPP como mucho el doble de APP (Figura 6B) P.nr.quitoRoback, 1970
10- Espolones anales (AS) relativamente largos. La ornamentación de los tergitos está formada por una serie de tubérculos dispuestos en filas con un dibujo característico (Figura 6D) P.nr.reticulatusBrundin, 1966- Espolones anales cortos. Sin este retículo (Figura 6E) 11
11- Placa porosa de forma redondeada y con poros agrupados en callosidades (LPP/APP = 0.99) (Figura 6F) P. fittkauiBrundin, 1966 - Placa porosa alargada (LPP/APP = 1.65) o cuadrada (1.07) (Figura 6H y 6G) 12
12- Espolones del segmento abdominal VIII cortos y no recurvados (Figura 7B)
P.nr. illiesiBrundin, 1966 - Espolones del segmento abdominal VIII largos (Figura 7C). P.gr.decarthrus13
13- OR con el tronco mucho más corto que la PP (LT/LPP = 0.33) (Figura 6H). OR más tubular. AS no conspicuos (7D). Pgr.decarthrussp. 1 - OR con el tronco más largo, igual o solo algo menor que la PP (LT/LPP = 0.96) (Figura 7A). OR más ancho en la parte superior. AS cortos, pero evidentes (7E) P.gr.decarthrussp. 2
Discusión
La biodiversidad de las pupas de Podonominae de los ríos altoandinos se ha concretado en la elaboración de una clave taxonómica que permite distinguir los diferentes morfotipos de los tres géneros encontrados, así como dos cuadros que resumen su distribución y frecuencia de ocurrencia. Se encontraron un total de 24 morfotipos de Podonominae, con una sola especie dePodonomopsis(P. illiesi), nueve morfotipos deParochlusy 14 dePodonomus. Algunos de los morfotipos deParochlusyPodonomusfueron claramente identificados como especies previamente descritas, tales comoParochlus incaicus,P. nigrinus peruvianusy Podonomus fittkaui, P. fastigiansyP. caranqui; sin embargo, para el resto de morfotipos, estudios posteriores en los que se combine la identificación de pupas, adultos y análisis moleculares, confirmarán si realmente corresponden a especies diferentes.
La distribución geográfica actual de la fauna de Chironomidae en los Andes parece haber sido el resultado conjunto de casos de aislamiento geográfico por el efecto de barreras naturales y severas fluctuaciones climatológicas ocurridas durante el Pleistoceno (Donato & Posadas, 2010; Prat et al., 2013). En cuanto a la distribución biogeográfica de los Podonominae en los ríos de los Andes, a partir de nuestros muestreos encontramos que, aunque en general tanto Parochlus como Podonomus tienen una buena representación en número de morfotipos en la zona altoandina tropical, esta es menor a la encontrada en los Andes del Sur de Chile y Argentina, con algunos grupos de especies totalmente ausentes en los Andes del Norte y Centro, tales como conjungens, chiloensis, squamipalpis y steineni de Parochlus, por lo que se comprueba la disminución de especies y la simplificación filogenética hacia el norte de la cordillera de los Andes. Sin embargo, este gradiente de menor diversidad hacia el norte, no solo es evidente entre los Andes del Centro y del Sur. Más al norte, otros dos patrones de distribución latitudinal son reconocibles. Por una parte, tenemos el caso del género Podonomopsis,cuya única especie en los Andes tropicales (P. illiesi) fue recolectada únicamente en las cabeceras de ríos altoandinos de Perú (preferentemente sobre los 3 500 msnm) y siempre al sur de la Depresión de Huancabamba. Esta depresión geográfica ubicada al norte de Perú en los 6° de latitud Sur, representa una importante disrupción fisiográfica y estructural en la continuidad de la cordillera de los Andes constituyendo el punto más bajo (2 145 msnm) entre Colombia y el sur de Chile (Duellman & Pramuk, 1999). Las actuales elevaciones y patrones de drenaje en la Depresión de Huancabamba fueron establecidas durante el Pleistoceno periodo durante el cual se sucedieron períodos más fríos y secos durante las fases glaciales intercalados con otros más cálidos y húmedos durante las fases interglaciares (Gansser, 1973). Estas fuertes fluctuaciones climáticas junto con la compleja topografía, presumiblemente resultaron en una barrera natural para la dispersión de diversos grupos taxonómicos y en un área de aislamiento que favoreció altos niveles de endemismos (Duellman & Pramuk, 1999; Cosacov, Sérsic, Sosa, De-Nova, Nylinder, & Cocucci, 2009; Weigend, Gottschling, Hilgeri, & Nürk, 2010). Distribuciones similares se han reportado para otros géneros de Chironomidae como Barbadocladius (Orthocladiinae) con el cual frecuentemente comparte hábitat (Prat et al., 2013). Tanto Barbadocladius como Podonomopsisson géneros de origen gondwánico que en su dispersión hacia el norte no lograron sobrepasar la barrera natural que representa Huancabamba, por lo que están ausentes en los ríos altoandinos de Ecuador y Colombia. Así mismo, las especies dePodonomus,P. fittkaui y P. fastigians, muy frecuentes en nuestros muestreos en las cuencas altoandinas de las vertientes del Pacífico de Perú, tampoco fueron encontradas al norte de Huancabamba. En general, se observó tanto una mayor frecuencia de ocurrencia como una mayor diversidad de morfotipos dePodonomusal sur de esta zona.
Por otro lado, tenemos especies de Podonominae que sí han logrado dispersarse al norte de Huancabamba tales como P. caranqui y P. gr. Nudipenniss p. 2 que se han recolectado en todo el gradiente latitudinal estudiado. Otras especies de Chironomidae de origen godwánico también han mostrado dicho patrón, como Stictocladius (Orthocladiinae) (Sæther & Cranston, 2012; Krosch & Cranston, 2013). Una posible explicación de porqué algunas especies de Chironomidae consiguieron dispersarse al norte de Huancabamba y otras no, puede estar relacionada con los diferentes requerimientos térmicos a los que algunas especies están adaptadas. Aquellas que lograron dispersarse más al norte, además de sobrellevar la barrera física de Huancabamba, probablemente consiguieron tolerar temperaturas más cálidas, a diferencia de P. illiesi, P. fittkaui y P. fastigians, especies de requerimientos fríos estenotermos, que quedaron confinadas en las cabeceras de ríos más altos y más fríos, al sur de Huancabamba. Futuros estudios morfológicos y moleculares de larvas y adultos correspondientes a las pupas aquí reconocidas ayudarán a discernir la identidad taxonómica real de los morfotipos descritos en este estudio. Así mismo, es necesaria una mayor recolección de especímenes de Podonominae en otros sectores de los Andes relativamente menos muestreados como en los ríos altoandinos de Bolivia.












 uBio
uBio 

