Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.61 n.1 San José Mar. 2013
Variación estacional de la composición proximal en tres especies de importancia comercial del Golfo de Nicoya, Puntarenas, Costa Rica
Seasonal variation of proximate composition in three commercially important species in the Gulf of Nicoya, Puntarenas, Costa Rica
Seasonal variation of proximate composition in three commercially important species in the Gulf of Nicoya, Puntarenas, Costa Rica
*Dirección para correspondencia:
Abstract
Nutritional value of seafood for human consumption is worldwide recognized. Some information have been generated in other countries, nevertheless, there is limited information describing the chemical composition of some fishery important species caught in the Gulf of Nicoya. For this reason, we studied the levels of proximal components of the edible parts (fresh) of three commercially important species. The meat samples of snook Centropomus unionesis, the shrimp Trachypenaeus byrdi and the bivalve Polymesoda radiata, were collected from the Puntarenas local fish market during the fishing season of February 2009 to January 2010. Proximate composition analysis was determined according to AOAC methodology, and evaluated the moisture content, and protein and lipid composition of shellfish meats. The results indicated that the moisture content ranged from 74.6-80.6g/100g for snook 76.9-80.0g/100g for shrimp and 77.9-89.5g/100g for green mussel. After the moisture, the protein was the most abundant chemical fraction (6.8 to 21g/100g) showing the highest values in February for the shrimp and green mussel, and December for snook. The largest fluctuations in the lipid content were found in the snook, ranging from 0.7g/100g to 5.6g/100g; the highest values in this fraction were found in shrimp, green mussel and snook, for July, February and April samples respectively. Considering these results, we concluded that fish and shrimp species studied are a good alternative for human consumption as a source of protein and low lipid content.
Key words: Polymesoda radiata, Trachypenaeus byrdi, Centropomus unionesis, proximate composition, Gulf of Nicoya, Costa Rica.
Resumen
La información disponible sobre la composición química de algunos recursos pesqueros que se capturan en el Golfo de Nicoya es muy limitada. Por tal razón se determinaron los niveles de los componentes proximales de las partes comestibles (fresco) de tres especies de importancia comercial. Las muestras fueron adquiridas en el Mercado de Puntarenas entre febrero 2009 y enero 2001 durante la temporada de pesca. Los análisis de la composición proximal se determinaron según la metodología de AOAC. Los resultados indicaron que el contenido de humedad varió entre 74.6-80.6g/100g en robalo (Centropomus unionesis), 76.9-80.0g/100g en camarón (Trachypenaeus byrdi) y 77.9-89.5g/100g en almeja verde (Poymesoda radiata). Después de la humedad la fracción química más abundante fue la proteína presentando los valores más altos en diciembre para el robalo y febrero para el camarón y la almeja verde. Las mayores fluctuaciones en el contenido de lípidos se presentaron en el robalo, variando desde 0.7g/100g hasta 5.6g/100g. Los valores más altos en esta fracción fueron encontrados en julio, febrero y abril en camarones, almeja y robalo respectivamente. Se concluye que la especie de pescado y camarón estudiados son una buena alternativa para el consumo humano por ser una fuente importante de proteínas y por su bajo contenido en lípidos.
Palabras clave: Poymesoda radiata, Trachypenaeus byrdi, Centropomus unionesis, composición proximal, Golfo de Nicoya, Costa Rica.
El pescado y los mariscos constituyen recursos alimenticios importantes para la mayoría de las sociedades por su valioso aporte de nutrientes en la dieta humana a lo largo del mundo (Chukwu & Mohammed 2009). Se sabe que constituyen una fuente alta en proteína, minerales y vitaminas esenciales de valioso valor biológico (Karakoltsidis et al. 1995, Astorga et al. 2007, Fuentes et al. 2009, Özden 2010a). Más aun, por su bajo contenido en grasas y calidad de ácidos grasos, muchas investigaciones reportan los efectos benéficos del consumo de estos organismos para una buena salud (Shahidi & Botta 1994, Wykes 1995, Daviglus et al. 1997, Tanakol et al. 1999, Izquierdo et al. 2000, Castro-González et al. 2007, Özden 2010b).
La carne de pescado contiene como ingredientes básicos, en proporción variable, agua, proteínas, grasas, carbohidratos, ceniza y otros nutrientes importantes y sustancias como minerales y vitaminas (Stansby 1962). La FAO (1991) ha informado que normalmente los peces contienen 72% de agua, 19% de proteínas y 8% de grasa. Sin embargo, estos valores no son estáticos y por el contrario experimentan variaciones de acuerdo a los cambios ambientales y en relación con su edad, sexo, hábitat y estaciones (Nazrul & Razzaq 2005), por lo que el aporte nutricional de estos recursos, dependerá de los factores ambientales y biológicos imperantes al momento de su captura, de ahí la importancia de conocer la variación estacional de estos componentes bioquímicos.
Muchos trabajos han determinado los contenidos sobre composición proximal del pescado a nivel mundial y los resultados no solo proporcionan información que ayuda a entender el balance energético y ecológico de las especies (Giese & Pearse 1974), sino que además permiten determinar el valor alimenticio de su carne. El conocimiento del aporte nutricional de las especies marinas ha sido motivo de extensos estudios en varios países, entre los que destaca las hechas en México (Castro-González et al. 1998, López et al. 2006, Badillo-Zapata et al. 2010), Venezuela (Izquierdo et al. 2000, Izquierdo et al. 2001, Cabrera et al. 2005), Chile (Romero et al. 2000) y otras latitudes, que informan la composición proximal de algunas especies marinas del Océano Pacífico (Krzynowek & Murphy 1987, Vlieg 1988, Dignam et al. 1995). No obstante, la información acerca de los valores nutricionales y composición química de las especies que se consumen en el Costa Rica es escasa y entre los trabajos efectuados a la fecha se encuentran los realizados en moluscos por Báez (1985) en Polymesoda inflata; Blanco & Montero (1992) en Strombus galeatus; Cruz & Villalobos (1993) en Mytella guyanensis; Jiménez-Arce (1993) en Strombus gracilior; Ruiz et al. (1998) en Polymesoda radiata y Fonseca et al. (2011) en Tagelus peruvianus.
En Costa Rica el robalo (Centropomus unionesis Bocourt 1868), la almeja verde (Poymesoda radiata Hamley 1844) y el camarón conchudo (Trachypenaeus byrdi Burkenroad 1934) se encuentran dentro de los alimentos marinos de consumo cotidiano (Ruiz 1995), en su mayoría por las poblaciones humanas aledañas a la zona costera, por lo que estos recursos representan una fuente importante de alimento y de recursos económicos (Piedra 1999). Sin embargo, la falta de una organizada estadística pesquera no permite evaluar su potencial, por lo que estas especies han sido poco estudiadas. Por lo tanto, teniendo en cuenta que hay interés en los efectos beneficiosos sobre la salud humana relacionados con el consumo de alimentos marinos, la necesidad de desarrollar investigaciones que sirvan de soporte para establecer la importancia que desde el punto de vista nutricional tienen las especies marinas de Costa Rica y que son escasos los estudios respecto a la composición química nutricional de este tipo de alimentos, el objetivo de esta investigación fue brindar información sobre la variación estacional en la composición proximal de la carne de C. unionesis, P. radiata y T. byrdi capturados en el Golfo de Nicoya.
Materiales y Métodos
Obtención de muestras: Mensualmente, entre febrero 2009 y enero 2010, fueron obtenidos cinco especímenes de C. unionesis, 30 de P. radiata y 30 de T. byrdi procedentes del Mercado de Puntarenas y de pescadores artesanales. Las muestras fueron colocadas en una hielera con hielo y trasladadas inmediatamente al laboratorio donde a cada pescado le fue determinado las medidas biométricas (longitud total y peso total) para posteriormente ser eviscerados, lavados y cortados, obteniéndose filetes de 1cm de espesor aproximadamente. Las almejas fueron medidas (longitud total) utilizando un vernier Fowler (±0.05mm de precisión) y pesadas en una balanza electrónica AND GX-2000 (±0.01g de precisión). Luego el tejido blando de los individuos fue removido y drenado por 10min, registrando su peso fresco. Los camarones fueron medidos (vernier Fowler±0.05mm de precisión) y pesados (balanza electrónica AND GX-2000±0.01g de precisión), posteriormente se separó la cabeza y se extrajo la concha. Finalmente, todo el material fresco de las tres especies fue deshidratado en horno a 100ºC por 24hr obteniéndose la humedad según la metodología de AOAC (1984). El material seco fue molido y homogeneizado para realizar los análisis químicos correspondientes.
Análisis químicos: A cada una de las muestras le fue realizado el análisis proximal por triplicado según los métodos recomendados por la AOAC (1984): el contenido de proteína bruta (Nx6.25) utilizando el método de Kjeldhal en un equipo LABCONCO, el extracto etéreo fue determinado utilizando un equipo extractor continuo Soxhlet (Lab-Line Instruments, Inc., ILL, USA) con éter de petróleo (J.T. Baker, USA). Las cenizas se obtuvieron por calcinación lenta, incrementando la temperatura hasta 500ºC por 12hr.
El tratamiento estadístico de los datos se realizó utilizando el paquete estadístico Statgraphics Centurion XV, mediante el cual se determinó la estadística descriptiva (media y desviación estándar). El supuesto de normalidad de los datos fue probado mediante la prueba de Shapiro-Wilks y la homogeneidad de la varianza fue evaluada usando la prueba de Levene. Se realizaron correlaciones de Pearson entre los compuestos químicos y para cada parámetro evaluado se realizó un ANOVA de una vía, seguida de comparaciones múltiples de Tukey, para determinar si existe diferencia significativa entre la composición bioquímica durante los meses de muestreos a un nivel de significancia del 5%. Los datos son reportados como promedio±desviación estándar.
Resultados
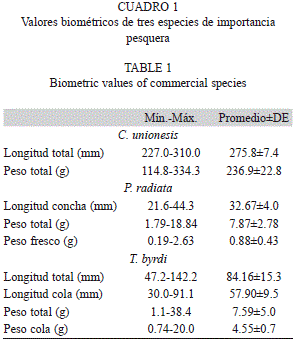
En el cuadro 1 se muestran los valores biométricos de las tres especies estudiadas. Los individuos de robalo mostraron una longitud total promedio de 275.8±7.4mm y un peso total promedio de 236.9±22.8g. La almeja presentó una longitud de la concha promedio de 32.67±4.0mm, un peso total promedio de 7.87±2.78g y un peso fresco promedio de 0.88±0.43g. El camarón conchudo presentó una longitud total promedio de 84.16±15.3mm, longitud promedio de la cola 57.90±9.5mm, peso total promedio 7.59±5.0g y peso cola promedio de 4.55±0.7g.
La composición proximal en base húmeda obtenida para T. byrdi, P. radiata y C. unionesis se presenta en el cuadro 2.
El contenido mínimo y máximo de humedad detectado para el camarón conchudo (T. byrdi) fue 76.9 y 80.0g por 100g (febrero-noviembre) con un promedio de 78.47g por 100g. El contenido de cenizas en esta especie varió de 1.4 a 2.0g por 100g a través del año (promedio de 1.62g por 100g) y mostraron un aumento significativo desde enero hasta junio. Las proteínas varían de 16.7 a 21.0g por 100g con un promedio de 19.08g por 100g e incrementando significativamente (p<0.05) de diciembre a febrero. El mínimo del extracto etéreo encontrado fue en noviembre (0.09g por 100g) y el máximo en diciembre 1.09g por 100g (p<0.05). Se encontró una correlación inversa entre la variación de humedad y cenizas (Pearson, r=-0.69, p<0.05), humedad y proteínas (Pearson, r=-0.89, p<0.05) y una correlación positiva entre las cenizas y las proteínas (Pearson, r=0.66, p<0.05).
La almeja verde (P. radiata) presentó un promedio en el contenido de humedad de 83.32g por 100g, variando durante todo el año entre 77.9g por 100g (febrero) y 89.5g por 100g (octubre), encontrándose una correlación significativa (p<0.05) con el extracto etéreo y las proteínas Pearson, r=-0.85 y r=-0.86 respectivamente y ligeramente con las cenizas (Pearson, r=-0.61, p<0.05). La ceniza varia de 1.1 a 2.6g por 100g (septiembre-febrero) con un promedio de 1.62g por 100g y una diferencia significativa (p<0.05) entre el mínimo y máximo valor. El contenido de proteínas de esta especie presentó un máximo en febrero (13.5g por 100g), un mínimo en octubre (6.8g por 100g) (p<0.05) y un promedio de 10.89g por 100g. La fracción lipídica varió significativamente (p<0.05) de 1.0 a 3.5g por 100g (agosto-febrero) y un promedio de 2.07g por 100g.
La humedad detectada para el robalo (C. unionesis) varió entre 74.6 a 80.6g por 100g (abril-septiembre), con un promedio de 77.38g por 100g. La variación de la humedad del tejido blando en las muestras de robalo manifiestan una correlación inversa con las cenizas (Pearson, r=-0.71, p<0.05) y con el extracto etéreo (Pearson, r=-0.83, p<0.05). El contenido de ceniza fue el más bajo de las tres especies estudiadas, variando de 0.8 a 1.2g por 100g donde el valor más bajo encontrado (p<0.05) fue en septiembre. El contenido de proteína estuvo en un rango de 17.6 a 20.9g por 100g (septiembre-diciembre) con un promedio de 19.25. La proteína en esta especie incrementó significativamente (p<0.05) de septiembre a diciembre. El extracto etéreo varió de 0.7 a 5.6g por 100g y un promedio de 2.51g por 100g. El mínimo valor obtenido fue en agosto y el máximo en abril (p<0.05).
Discusión
La composición química constituye un criterio importante al seleccionar los alimentos sobre todo en aquellos países donde el nivel de cultura alimentaria es elevada, ya que los alimentos proporcionan la energía y los nutrimentos necesarios para el desarrollo, el mantenimiento y la realización de las actividades fisiológicas en el hombre (Guerra 2003).
Andrade (2000) recalca la calidad nutricional de los camarones, aduciendo que éstos son ricos en proteínas e igual a cualquier otra proteína de origen animal, así como también bajos en calorías y grasas (con un rango cercano a 0.5 a 1.0%) lo cual queda demostrado con los resultados obtenidos en esta investigación. Se encontraron valores promedio de humedad, ceniza, lípidos y proteínas para el camarón T. byrdi de 78.47, 1.62, 1.29, 19.08g por 100g, respectivamente. Similares resultados han sido obtenidos por Rivas (2000) en camarón azul silvestre Litopenaeus stylirostris (humedad 75.85 %, ceniza 1.92%, lípidos 1.82 % y proteínas 21.30), Wong (2004) citado por Tamarit (2008) en el camarón marino Litopenaus vannamei (76.1% humedad, 20.3% proteínas, 0.9% lípidos, 1.3% cenizas y 1.4% carbohidratos), INCAP (2007) y para otras especies de camarón en diferentes latitudes como lo informan Heu et al. (2003) para Pandalus borealis y Trachypena curvirostris en Korea, Yanar & Çelik (2006) para Penaeus semisulcatus y Metapenaeus monoceros del Mediterráneo Oriental, Turquía y Özden (2010a) para Parapenaus longirostris en Turquía.
La composición proximal de C. unionesis en el presente estudio fue muy similar a la reportada para otra especie del mismo género (C. undecimalis) en Brasil por Menezes et al. (2008) (79.62, 1.09, 2.5 y 18.29g/100g de humedad, ceniza, lípidos y proteínas respectivamente), en Venezuela por Izquierdo et al. (2000) (77.12, 1.60, 1.66, y 21.61g/100g de humedad, ceniza, lípidos y proteínas, respectivamente) y similar a otras de especies reportadas para el Pacífico americano (Castro-González et al. 1998, Romero et al. 2000, López et al. 2006, Badillo-Zapata et al. 2010).
De acuerdo con Varlik et al. (2004) citado por Özden et al. (2010), los peces son usualmente clasificados como grasos (>8g/100g), moderadamente grasos (4-8g/100g) y magros (<4g/100g). Por esto, considerando los resultados, la especie estudiada en este trabajo es considerada una especie magra, lo cual puede ser más atractivo para los consumidores que prefieren carnes blancas. Similares resultados han sido reportados por Özden et al. (2010) para Solea solea y Merlangius merlangus, Izquierdo et al. (2001) para el robalo C. undecimalis y Romero et al. (2000).
El análisis de la composición proximal de la almeja verde en esta investigación presentó valores promedios de humedad, ceniza, extracto etéreo y proteínas de 83.32, 1.81, 2.07 y 10.89g/100g, respectivamente. Ruiz et al. (1998) reportaron para almejas con longitud total y peso de carne promedio (32.29±7.63mm y 1.36±3.75g) porcentajes de humedad, ceniza, lípidos y proteínas de 90.1, 0.6, 0.9 y 7.8%, valores que a excepción de la humedad, son inferiores a los reportados en este trabajo. Estas diferencias pueden ser atribuidas a factores como la alimentación, ubicación geográfica, época, edad y sexo (Caballero et al. 1997, Özden et al. 2010). Se observó además, que existe una relación inversa entre el contenido de humedad y de materia grasa en las muestras de almeja verde y robalo, lo cual está descrito en la literatura (Gruger et al. 1964, Romero et al. 1996).
Por otra parte, se ha observado que la frecuencia de los cambios en la composición de los constituyentes bioquímicos de cualquier organismo oscila con la variación de los cambios ambientales, entre ellos la dieta, época de captura y la temperatura del agua, además de algunas diferencias biológicas tales como la edad, sexo y tamaño de las especies (Love 1957, Shearer 1994, Lie 2001, Rasmussen 2001, Nazrul & Razzaq 2005). Love (1957) indicó que la disponibilidad de alimento en diferentes épocas del año tiene un efecto considerable sobre los componentes del tejido, particularmente las grasas. Las especies estudiadas presentaron variaciones de los compuestos nutricionales a lo largo del periodo de estudio lo cual evidencia que la composición proximal del músculo en organismos marinos puede cambiar estacionalmente de acuerdo a diferentes factores, entre ellos la especie y de un individuo a otro dependiendo de la edad, el sexo, el ambiente, estación del año, la dieta y origen geográfico coincidiendo con lo expresado por Love 1957, Shearer 1994, Andrade 2000, Lie 2001, Rasmussen 2001, Nazrul & Razzaq 2005, Erkan et al. 2007 y Özden et al. 2010.
El pescado y los mariscos son una valiosa fuente de proteínas de alta calidad y de otros productos orgánicos, siendo esta proteína la única que contiene todos los aminoácidos esenciales en la proporción adecuada, y por lo tanto, llamada proteína completa, comparable solo con la proteína presente en la leche y el huevo (Nazrul & Razzaq 2005).
Bajo esta primicia, el contenido de proteínas promedio determinado en este estudio para C. unionesis y T. byrdi (19.08g/100g y 19.25g/100g, respectivamente) fueron similares a los reportados en la carne de bovino (20 a 22%), pollo (20%) y cerdo (19 a 20%) que satisfacen los requerimientos mínimos diarios en la dieta del hombre (Stansby 1963, Bourgeois & Le Roux 1986). Por lo tanto, estos resultados permiten concluir que las especies estudiadas son una buena alternativa para el consumo humano, por su bajo contenido en grasas, ricas en ácidos grasos n-3 (no determinados en este estudio) (Luzia et al. 2003, Castro-González et al. 2007, Tawfik 2009) y por el aporte proteico, principalmente durante los meses de diciembre, enero y febrero para C. unionesis y P. radiata y durante febrero, mayo y septiembre para T. byrdi.
Se recomienda continuar estudios sobre el valor nutricional de otras especies de pescado y mariscos en Costa Rica.
Agradecimientos
Este trabajo es una contribución de la Universidad Nacional (Escuela de Ciencias Biológicas), por medio del proyecto 053451, “Estrategia de Manejo Participativa de las Pesquerías del Golfo de Nicoya, Costa Rica”. Se le agradece a Rosa Soto por su colaboración en la revisión del documento.
Referencias
Andrade, G. 2000. Los camarones y su importancia en la alimentación. Fondo Nacional de Investigaciones Agropecuarias, Maracay, Venezuela. (Consultado el 14 junio de 2011, http://sian.inia.gob.ve/repositorio/ revistas_tec/FonaiapDivulga/fd65/texto/camarones.htm). [ Links ]
AOAC. 1984. Official methods of analysis. Association of Official Analytical Chemists. Washington D.C., EE.UU. [ Links ]
Astorga, M., E. Rodríguez & C. Díaz. 2007. Comparison of minerals and trace element concentration in two mollusks from the Strait of Magellan (Chile). J. Food Comp. Anal. 20: 273-279. [ Links ]
Badillo-Zapata, D., G. Correa-Reyes, L. D’Abramo, J. Lazo, J. Toro-Vázquez & M. Viana. 2010. Effect of replacing dietary fish oil with vegetable oils on the fatty acid composition of muscle tissue of juvenile California halibut (Paralichthys californicus). Cienc. Mar. 36: 121-133. [ Links ]
Báez, R. 1985. Evaluación de algunos aspectos de la biología del molusco Polymesoda inflata (Philipp, 1851) (Bivalvia: Corbiculidae), en el manglar de Pochote, Puntarenas, Costa Rica. Tesis de Licenciatura, Universidad de Costa Rica, San José, Costa Rica. [ Links ]
Blanco, A. & M. Montero. 1992. Composición químiconutricional de la carne de cambute, Strombus galeatus (Mesogastropoda: Strombidae). Rev. Biol. Trop. 40: 89-93. [ Links ]
Bourgeois, C. & P. Le Roux. 1986. Proteínas animales. El Manual Moderno, México D.F., México. [ Links ]
Caballero, A., J. Cabrera & Y. Solano. 1997. Descripción del crecimiento y madurez sexual de una población de Crassostrea columbensis (Mollusca: Bivalvia). Rev. Biol. Trop. 44-45: 335-339. [ Links ]
Cabrera, T., G. Cabrera, J. Rosas, A. Velásquez & M. Silva. 2005. Variación de lípidos y ácidos grasos en camarones marinos consumidos en Venezuela. ALAN 55: 194-200. [ Links ]
Castro-González, M., J. Silencio, M. Juárez, S. Montaño & F. Pérez-Gil. 1998. Composición química de la fauna de acompañamiento del camarón de Veracruz (Golfo de México). Rev. Biol. Trop. 46: 249-256. [ Links ]
Castro-González, M., V.A. Ojeda, B.S. Montaño, C.E. Ledesma & R.F. Pérez-Gil. 2007. Evaluación de los ácidos grasos n-3 de 18 especies de pescados marinos mexicanos como alimentos funcionales. ALAN 57: 85-93. [ Links ]
Chukwu, O. & I. Mohammed. 2009. Effects of Drying Methods on Proximate Compositions of Catfish (Clarias gariepinus). World J. Agric. Sci. 5: 114-116. [ Links ]
Cruz, R.A. & C.R. Villalobos. 1993. Monthly changes in tissue weight and biochemical composition of the mussel Mytella guyanensis (Bivalvia: Mytillidae) in Costa Rica. Rev. Biol. Trop. 41: 93-96. [ Links ]
Daviglus, M.L., J. Stamler, A.J. Orencia, A.R. Dyer, K. Liu, P. Greenland, M.K. Walsh, D. Morris & R.B. Shekelle. 1997. Fish consumption and the 30-year risk of fatal myocardial infarction. N. Engl. J. Med. 336: 1046-1053. [ Links ]
Dignam, C.A., B.A. Burlingame, J.M. Arthur, R.J. Quigley & G.C. Milligan. 1995. The pacific Islands food composition tables. South Pacific Commission, New Zealand Institute for Crop & Food Research, Christchurch, Nueva Zealanda. [ Links ]
Erkan, N., Ö. Özden, D. Üçok-Alakavuk, S.Y. Tosun, C. Varlık & T. Baygar. 2007. Istanbul’ da satılan karideslerin sodyum metabisülfit düzeyinin tespiti. J. Fish. Sci. 1: 26-33. [ Links ]
FAO, 1991. Fish for Food and Development. Food and Agriculture Organization of the United Nations, Rome, Italy. [ Links ]
Fonseca, C., C. Marín-Vindas, F. Chavarría-Solera, R.A. Cruz & P. Toledo. 2011. Variación estacional de la composición proximal del mejillón Tagelus peruvianus (Bivalvia: Solecurtidae) del Golfo de Nicoya, Puntarenas, Costa Rica. Rev. Biol. Trop. 54: 1517-1523. [ Links ]
Fuentes, A., I. Fernández-Segovia, I. Escriche & J. Serra. 2009. Comparison of physicochemical parameters and composition of mussels (Mytilus alloprovincialis Lmk.) from different Spanish origins. Food Chem. 112: 295-302. [ Links ]
Giese, A. & J. Pearse. 1974. Introduction general principles, p 1-41. In A.C. Giese & J.S. Pearse (eds.). Reproduction of marine invertebrates. Academic, New York, EEUU. [ Links ]
Gruger, H., R. Nelson & M. Stansby. 1964. Fatty acid composition of oils from 21 species of marine fish, freshwater fish and shellfish. J. Am. Oils Chem. Soc. 41: 662-667. [ Links ]
Guerra, M. 2003. Evaluación de la calidad del camarón blanco Litopenaeus schmitti cultivado. Tesis de Licenciatura, Universidad de la Habana, La Habana, Cuba. [ Links ]
Heu, M.S., J.S. Kim & F. Shahidi. 2003. Components and nutritional quality of shrimp processing byproducts. Food Chem. 82: 235-242. [ Links ]
INCAP. 2007. Tabla de Composición de Alimentos de Centroamérica. INCAP, OPS, Guatemala. [ Links ]
Izquierdo, P., G. Torres, Y. Barboza, S. Márquez & M. Allara. 2000. Análisis proximal, perfil de ácidos grasos, aminoácidos esenciales y contenido de minerales en doce especies de pescado de importancia comercial en Venezuela. ALAN 50: 187-194. [ Links ]
Izquierdo, P., G. Torres, M. Allara, E. Marquez, Y. Barboza & E. Sanchez. 2001. Análisis proximal, contenido de aminoácidos esenciales y relación calcio/fosforo en algunas especies de pescado. FCV-LUZ 2: 95-100. [ Links ]
Jiménez-Arce, G. 1993. Composición químico-nutricional en diferentes tallas y sexos del cambute Strombus gracilior (Mesogastropoda: Strombidae) de Playa Panamá, Costa Rica. Rev. Biol. Trop. 41: 345-349. [ Links ]
Karakoltsidis, P., A. Zotos & S. Constantinides. 1995. Composition of the commercially important mediterranean finfish, crustaceans and mollusks. J. Food Comp. Anal. 8: 258-273. [ Links ]
Krzynowek, J. & J. Murphy. 1987. Proximate Composition, Energy, Fatty Acid, Sodium, and Cholesterol Content of Finfish, Shellfish, and their Products. NOAA Tech. Rep NMFS 55, Washington D.C., EE.UU. [ Links ]
Lie, Ø. 2001. Fish qualitythe role of nutrition. Aquac. Res. 32: 341-348. [ Links ]
López, L., E. Durazo, A. Rodríguez-Gómez, C. True & M. Viana. 2006. Composición proximal y perfil de ácidos grasos de juveniles silvestres y cultivados de Totoaba macdonaldi. Cienc. Mar. 32: 303-309. [ Links ]
Love, R.M. 1957. The biochemical composition of fish, p. 401-418. In M.E. Brown (ed.). The Physiology of Fish. Academic, New York, EE.UU. [ Links ]
Luzia, L.A., G.R. Sampaio, C.M. Castellucci & E.A. Torres. 2003. The influence of season on the lipid profiles of five commercially important species of Brazilian fish. Food Chem. 83: 93-97. [ Links ]
Menezes, M.E., G. Macema, C.M. Bazílio de Omena, J. Duarte de Freitas & A.E. Goulart. 2008. Composição centesimal, colesterol e perfil de ácidos graxos dos peixes tainha (Mugil cephalus) e camurim (Centropomus undecimalis) da Lagoa Mundaú, AL/Brasil. Rev. Inst. Adolfo Lutz 67: 89-95. [ Links ]
Nazrul, I. & A. Razzaq. 2005. Seasonal variation of the proximate composition of freshwater gobi, Glossogius giuris (Hamilton) from the River Padma. Pak. J. Biol. Sci. 8:532-536. [ Links ]
Özden, Ö. 2010a. Seasonal differences in the trace metal and macrominerals in shrimp (Parapenaus longirostris) from Marmara Sea. Environ. Monit. Assess. 162: 191-199. [ Links ]
Özden, Ö. 2010b. Micro, macro mineral and proximate composition of Atlantic bonito and horse mackerel: a monthly differentiation. Int. J. Food Sci. Technol. 45: 578-586. [ Links ]
Özden, Ö., N. Erkan & S. Ulusoy. 2010. Determination of mineral composition in three commercial fish species (Solea solea, Mullus surmuletus and Merlangius merlangus). Environ. Monit. Assess. 170: 353-363. [ Links ]
Piedra, C.L. 1999. La pesquería de la almeja verde (Polymesoda radiata): implicaciones para su manejo. Programa Regional en Manejo y conservación de Vida Silvestre para Mesoamérica y el Caribe. Informe técnico. UNA, Heredia, Costa Rica. [ Links ]
Rasmussen, R.S. 2001. Quality of farmed salmonids with emphasis on proximate composition, yield and sensory characteristics. Aquac. Res. 32: 767-786. [ Links ]
Rivas, M.E. 2000. Efecto del contenido de proteína en el alimento de camarón azul (Litopenaeus stylirostris) cultivado sobre la actividad proteolítica y parámetros calorimétricos y su relación con la pérdida de textura durante su almacenamiento en congelación. Tesis de Maestría, Universidad de Sonora, Sonora, México. [ Links ]
Romero, N., P. Robert, L. Masson, C. Luck & L. Buschmann. 1996. Composición en ácidos grasos y aporte de colesterol de conservas de jurel, sardina, salmón y atún al natural. ALAN 46: 75-77. [ Links ]
Romero, N., P. Robert, L. Mansson & R. Pined. 2000. Composición de ácidos grasos y proximal de siete especies de pescado de Isla de Pascua. ALAN 50: 304-308. [ Links ]
Ruiz, E. 1995. Ciclo reproductivo, Estructura poblacional y Composición bioquímica (Proximal) de la almeja verde Polymesoda radiata (Hanley, 1844) (Bivalvia: Corbiculidae), en la desembocadura del Río Bebedero, Guanacaste, Costa Rica. Tesis de Licenciatura, Universidad Nacional, Heredia, Costa Rica. [ Links ]
Ruiz, E., J. Cabrera, R.A. Cruz & J. Palacios. 1998. Crecimiento y ciclo reproductivo de Polymesoda radiata (Bivalvia:Corbiculidae) en Costa Rica. Rev. Biol. Trop. 46: 643-648. [ Links ]
Shahidi, F. & J.R. Botta. 1994. Seafoods: Chemistry, Processing Technology and quality. Chapman & Hall, Londres, Inglaterra. [ Links ]
Shearer, D.K. 1994. Factors affecting the proximate composition of cultured fishes with emphasis on salmonids. Aquaculture 119: 63-88. [ Links ]
Stansby, M. 1962. Analytical Methods, Industrial Fishery Technology. Chapman & Hall, Londres, Inglaterra. [ Links ]
Stansby, M. 1963. Industrial Fishery Technology. Chapman & Hall, Londres, Inglaterra. [ Links ]
Tamarit, Y. 2008. Caracterización de la textura sensorial e instrumental del camarón de cultivo Litopenaeus vannamei en la camaronera de Tunas de Zaza. Tesis de Maestría, Universidad de la Habana, La Habana, Cuba. [ Links ]
Tanakol, R., Z. Yazici, E. Sener & E. Sencer. 1999. Fatty acid composition of 19 species of fish from the Black Sea and Marmara Sea. Lipids 34: 291-297. [ Links ]
Tawfik, M.S. 2009. Proximate composition and fatty acids profiles in most common available fish species in Saudi Martket. Asian J. Clin. Nutr. 1: 50-57. [ Links ]
Vlieg, P. 1988. Proximate composition of New Zealand Marine Finfish and Shellfish. Biotechnology Division Dpt. Scientific and Industrial Research, Roodeplaat, New Zealand. [ Links ]
Wykes, A. 1995. Effects of fish oils and polyunsatured omega-3 fatty acids in health and disease, Bibliography-A. National Institutes of Health NIH, Maryland, EE.UU. [ Links ]
Yanar, Y. & M. Çelik. 2006. Seasonal amino acid profiles and mineral contents of green tiger shrimp (Penaeus semisulcatus De Haan, 1844) and speckled shrimp (Metapenaeus monoceros Fabricus, 1789) from the Eastern Mediterranean. Food Chem. 94: 33-36. [ Links ]
*Correspondencia a:
Cristian Fonseca Rodríguez. Estación de Biología Marina, Escuela de Ciencias Biológicas, Universidad Nacional. Puntarenas, Costa Rica; cfonseca@una.ac.cr
Fabián Chavarría Solera. Estación de Biología Marina, Escuela de Ciencias Biológicas, Universidad Nacional. Puntarenas, Costa Rica; fbnchs@gmail.com
Fernando Mejía-Arana. Estación de Biología Marina, Escuela de Ciencias Biológicas, Universidad Nacional. Puntarenas, Costa Rica; yonando30@gmail.com.
1. Estación de Biología Marina, Escuela de Ciencias Biológicas, Universidad Nacional. Puntarenas, Costa Rica; cfonseca@una.ac.cr, fbnchs@gmail.com, yonando30@gmail.com
Recibido 21-X-2011. Corregido 21-VII-2012. Aceptado 20-VIII-2012