Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.60 n.3 San José Sep. 2012
Distribución, densidad y estructura de talla Oreaster reticulatus y Luidia senegalensis (Echinodermata: Asteroidea) en isla de Cubagua, Venezuela
*Dirección para correspondencia
Abstract
Distribution, density an size structure of Oreaster reticulatus and Luidia senegalensis (Echinodermata: Asteroidea) in Cubagua Island, Venezuela. There is limited biological information about the starfish Oreaster reticulatus and the nine-armed starfish Luidia senegalensis in Venezuelan waters. These species are currently considered threatened in many localities of the Caribbean, Brazil and Colombia. Therefore, the aim of this study was to describe their population density, size distribution and population structure in Cubagua Island. During 2008, 52 stations located around the island were evaluated using band transects of 50m2. Each organism was counted and measured (maximum radius), and its size was compared to the maturity length reported in the literature. The results for O. reticulatus include: 167.3ind./ha; 33% juveniles and 67% adults; average size of 10.7±5cm (range: 2.2-21cm); a wide distribution around the island, with higher densities in the Eastern and Southwest areas. The 50% of the specimens were found in seagrass beds, 25% in sand, 16% in areas covered by decomposed seaweeds, 9% in oyster beds and 1% coralline patches. The densities of O. reticulatus were higher than those reported in the Caribbean, Panama and Puerto Rico, but lower than Venezuelan National Parks: Mochima and Morrocoy; as well as in the Virgin Islands and Belize. For L. senegalensis we found an average density of 40ind./ha; 95% exceeded the reported size at maturity, with mean length of 12cm±3.5cm (range: 3.5-22.3cm); they were found only in 15% of the stations of which 92.5% were sandy bottoms and the other 7.5% oyster beds. The degree of aggregation of L. senegalensis was greater than O. reticulatus, with an estimated k of 0.06. However, it was not possible to compare the densities of L. senegalensis with any other study. For both species is recommended to carry out reproductive studies and to monitor their population densities to infer temporal variations.
Key words: equinoderm, asteroidea, sea stars, nine-armed sea star, cushion sea star.
Resumen
Las estrellas de mar: Oreaster reticulatus y Luidia senegalensis, han sido objeto de escasos estudios en aguas venezolanas. Actualmente son consideradas especies amenazadas en diversas zonas del Caribe, Brasil y Colombia. Por esto, se planteó como objetivo generar información sobre su densidad poblacional, distribución y estructura de talla en los alrededores de la isla de Cubagua. Para ello, durante el año 2008, se realizaron cuatro transectas bandas de 50m2 cada una, en 52 estaciones ubicadas alrededor de la isla. Entre los resultados obtenidos para O. reticulatus destacan: 167.3ind/ha, un 33% inmaduros y 67% adultos con un promedio de tallas de 10.7±5cm (rango: 2.2-21cm); una amplia distribución en los alrededores de la isla, con mayores densidades en la zona este y suroeste. Luidia senegalensis mostró una densidad promedio de 40ind/ha, 95% superaba la talla de madurez reportada, con talla promedio de 12cm±3.5cm (rango: 3.5-22.3cm). Se recomienda realizar estudios de reproducción, así como monitoreos de sus densidades poblacionales que permitan inferir sus variaciones temporales.
Palabras clave: equinodermos, asteroidea, estrella de mar, estrella de nueve brazos.
Distribution, density an size structure of Oreaster reticulatus and Luidia senegalensis (Echinodermata: Asteroidea) in Cubagua Island, Venezuela. There is limited biological information about the starfish Oreaster reticulatus and the nine-armed starfish Luidia senegalensis in Venezuelan waters. These species are currently considered threatened in many localities of the Caribbean, Brazil and Colombia. Therefore, the aim of this study was to describe their population density, size distribution and population structure in Cubagua Island. During 2008, 52 stations located around the island were evaluated using band transects of 50m2. Each organism was counted and measured (maximum radius), and its size was compared to the maturity length reported in the literature. The results for O. reticulatus include: 167.3ind./ha; 33% juveniles and 67% adults; average size of 10.7±5cm (range: 2.2-21cm); a wide distribution around the island, with higher densities in the Eastern and Southwest areas. The 50% of the specimens were found in seagrass beds, 25% in sand, 16% in areas covered by decomposed seaweeds, 9% in oyster beds and 1% coralline patches. The densities of O. reticulatus were higher than those reported in the Caribbean, Panama and Puerto Rico, but lower than Venezuelan National Parks: Mochima and Morrocoy; as well as in the Virgin Islands and Belize. For L. senegalensis we found an average density of 40ind./ha; 95% exceeded the reported size at maturity, with mean length of 12cm±3.5cm (range: 3.5-22.3cm); they were found only in 15% of the stations of which 92.5% were sandy bottoms and the other 7.5% oyster beds. The degree of aggregation of L. senegalensis was greater than O. reticulatus, with an estimated k of 0.06. However, it was not possible to compare the densities of L. senegalensis with any other study. For both species is recommended to carry out reproductive studies and to monitor their population densities to infer temporal variations.
Key words: equinoderm, asteroidea, sea stars, nine-armed sea star, cushion sea star.
Resumen
Las estrellas de mar: Oreaster reticulatus y Luidia senegalensis, han sido objeto de escasos estudios en aguas venezolanas. Actualmente son consideradas especies amenazadas en diversas zonas del Caribe, Brasil y Colombia. Por esto, se planteó como objetivo generar información sobre su densidad poblacional, distribución y estructura de talla en los alrededores de la isla de Cubagua. Para ello, durante el año 2008, se realizaron cuatro transectas bandas de 50m2 cada una, en 52 estaciones ubicadas alrededor de la isla. Entre los resultados obtenidos para O. reticulatus destacan: 167.3ind/ha, un 33% inmaduros y 67% adultos con un promedio de tallas de 10.7±5cm (rango: 2.2-21cm); una amplia distribución en los alrededores de la isla, con mayores densidades en la zona este y suroeste. Luidia senegalensis mostró una densidad promedio de 40ind/ha, 95% superaba la talla de madurez reportada, con talla promedio de 12cm±3.5cm (rango: 3.5-22.3cm). Se recomienda realizar estudios de reproducción, así como monitoreos de sus densidades poblacionales que permitan inferir sus variaciones temporales.
Palabras clave: equinodermos, asteroidea, estrella de mar, estrella de nueve brazos.
Hace unos 50 años Oreaster reticulatus (Linneaus 1758) era común en el Caribe (Myers & Ottensmeyer 2005), sin embargo, en la actualidad sólo se encuentra en áreas con escasos asentamientos humanos y poco turismo (Metaxas et al. 2002). Sus poblaciones en aguas de poca profundidad han disminuido drásticamente y son consideradas extintas en zonas muy desarrolladas, sin existir signos de recuperación (Myers & Ottensmeyer 2005). La venta de estas estrellas como adornos para turistas, acuarios e inclusive escuelas, por parte de empresas suplidoras de artículos biológicos, son las causas principales de su declive (Hendler et al. 1995, Myers & Ottensmeyer 2005). En países vecinos, como Colombia y Brasil ha sido incluida en libros de fauna amenazada (Ardilla et al. 2002, Benavides-Serrato et al. 2005, Amaral et al. 2008, Machado et al. 2008). En México, se calcula que el comercio de estrellas de mar incluye unos 40 000 ejemplares al año, con una media de 200 ejemplares por punto de venta, siendo Oreaster uno de los principales componentes de estas estadísticas (Lunn et al. 2008). En Venezuela sólo se ha estudiado su taxonomía (Zoppi 1967), hábitos alimenticios y densidades poblacionales en los Parques Nacionales Mochima y Morrocoy (Martín et al. 2001, Zuliani et al. 2007). Es una especie comercializada como adorno, pero se desconoce por completo el número de ejemplares que son vendidos al año o las zonas de extracción. Sumado a esto, no existe ningún control sobre sus capturas, ni legislación que la proteja.
Luidia senegalensis (Lamarck 1816), ha sido objeto de pocos estudios, a pesar de ser común en muchas áreas del Atlántico tropical occidental (Halpern 1970). Se encuentra esporádicamente desde el sur de Florida hasta el sur de Brasil (Miller & Lawrence 1999), generalmente asociada a zonas costeras tropicales (Setubal 1992). En Venezuela sólo se ha estudiado su taxonomía (Zoppi 1967) y sus hábitos alimenticios, los cuales demuestran que es una especie carnívora con preferencia por los moluscos bivalvos (Penchaszadeh & Lera 1983). Está incluida en el libro rojo de la fauna brasilera amenazada de extinción por la reducción gradual de sus poblaciones (Amaral et al. 2008, Machado et al. 2008).
Por la poca información existente para ambos equinodermos en aguas venezolanas y por las amenazas señaladas anteriormente, el presente estudio plantea como objetivos evaluar la distribución y abundancia de O. reticulatus y L. senegalensis en los alrededores de la isla de Cubagua, así como generar información respecto a los tipos de fondo donde se distribuyen y sus estructuras poblacionales, con la finalidad de contribuir al conocimiento sobre estas especies y poder elaborar recomendaciones que contribuyan a su manejo y conservación.
Materiales y métodos
Área de Estudio: El estado Nueva Esparta se encuentra ubicado sobre la plataforma continental de la región nororiental de Venezuela y está conformado por las islas de Margarita, Coche y Cubagua. Esta última, posee una longitud de costa de unos 25km (10º47’ - 10º51’ N y 64º8’ - 64º14’ W); a una distancia aproximada de 8km al sur de la Isla de Margarita (Pta. Piedras) y a unos 20km al norte de la Península de Araya (Cervigón 1997, Ancieta 2005).
Trabajo de campo: La zona costera de la isla de Cubagua fue dividida en 52 celdas imaginarias de 1km2, hasta una profundidad máxima de 18m. Durante enero-diciembre 2008, se eligieron al azar, y sin reposición, un mínimo de cuatro y un máximo de cinco celdas por mes, hasta cubrir todos los alrededores de la isla. Cada una de las celdas o estaciones de muestreo fue reconocida ubicando el punto central, mediante el uso de un Sistema de Posicionamiento Global (GPS). Dentro de cada celda una pareja de buzos con equipo autónomo, trazó un total de cuatro réplicas al azar de transectas bandas de 10x5m (50m2 cada una), totalizando un área de muestreo de 200m2 por celda. Se realizaron 208 transectas, para un total de 10 400m2 de sustrato evaluado alrededor de toda la isla de Cubagua. Se contaron cada uno de los ejemplares de O. reticulatus y L. senegalensis observados; cada individuo fue medido in situ con un vernier de 1mm de precisión, la longitud mayor del radio estaba comprendida entre la parte centro dorsal del disco y el brazo más largo (Guzmán & Guevara 2002). Los animales encontrados fuera del área de las transectas fueron medidos para reforzar el análisis de estructura de tallas, pero no fueron incluidos en los cálculos de densidad poblacional.
Para examinar la relación entre la densidad de ambas estrellas (ind./m2) y el tipo de fondo, estos fueron categorizados cualitativamente en función del tipo de sustrato dominante observado en cada transecta, entre los que destacan: arena, ostrales (bancos de bivalvos: Pinctada imbricata y Arca zebra), parches coralinos, parches de octocoral, praderas de fanerógamas (Thalassia testudinum) y algas en descomposición.
Para determinar el tipo de distribución de los organismos en el área de estudio, se estimó en primer lugar el cociente entre la varianza y la media de la densidad de organismos observados en campo, para cada especie por separado. Una vez descartado el patrón de distribución uniforme (cociente entre la varianza y la media de la densidad >1), se determinaron las frecuencias de aparición de organismos por transectas, y las frecuencias esperadas para una distribución binomial negativa (asociada a distribuciones agregadas), mediante el uso de un estimado preliminar de k (parámetro que describe la medida de agregación de los organismos) mediante la siguiente fórmula:
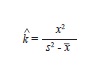
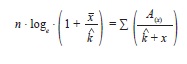
donde, A(x) es la suma de las frecuencias observadas superiores a x, donde x corresponde al número de organismos encontrados en cada celda de muestreo (Elliot 1977).
Individuos inmaduros de O. reticulatus fueron reconocidos tomando como referencia la talla mínima de madurez (<7cm) indicada por Guzmán & Guevara (2002), además del color característico (suelen ser verdes, mientras que los adultos son amarillos, naranjas y/o color canela) (Kaplan 1988). Para L. senegalensis fue considerada la talla de madurez señalada por Halpern (1970) de unos 7.5cm de radio mayor. Las zonas con elevadas proporciones de individuos inmaduros fueron identificadas cuando el porcentaje de individuos menores a la talla de madurez superó el 65% de los ejemplares encontrados por celda (en zonas con más de 2 individuos). Finalmente con el programa ArcView, fueron realizados mapas de distribución y densidad de ambas especies, clasificando los rangos de dichos mapas por cuartiles.
Resultados
Área de estudio: Las 52 celdas de muestreo, presentaron sustratos predominantes en el siguiente orden: arena (n=26), praderas de fanerógamas (n=10), bancos de moluscos (n=8), parches de coral y zonas cubiertas de algas en descomposición (n=3 cada uno), y parches de octocoral (n=2) (Fig. 1). El rango de profundidades varió entre 1.6-18m, con un promedio de 8±4.1m (±desv. estándar, DE).
Oreaster reticulatus: Se contabilizó un total de 174 ejemplares, 33% inmaduros y 67% adultos, con una densidad promedio de 0.017±0.003ind./m2 DE (intervalo de confianza, C.I.95%=0.007-0.025) (Fig. 1). La estructura de tallas mostró individuos entre 2.2-21cm respectivamente (Fig. 2). La longitud promedio quedó establecida en 10.7±5cm DE. No se detectó ningún individuo muerto.
La especie fue observada en un 63.5% de las estaciones analizadas, con amplia distribución en los alrededores de la isla, principalmente en las zonas este y suroeste, y en menor grado en la parte norte. El 50% de los individuos se ubicó en fondos de pastos marinos, un 25% en arenales, 16% en zonas cubiertas por algas en descomposición, 9% en ostrales, 1% en parches de coral, y no fueron encontrados en sustratos donde dominaban los octocorales. Con respecto al patrón de distribución espacial, la especie mostró una disposición agregada, con un estimado del parámetro de agregación k de 0.4 (mientras menor es el valor de k, hay mayor grado de agregación de los organismos en el espacio).
Un 35% de los ejemplares analizados eran adultos solitarios, de los cuales 67% se encontró en arenales, seguido de 17% en ostrales y 8% en praderas de Thalassia y parche de coral. Por el contrario, sólo fue encontrado un individuo inmaduro solitario ubicado en un arenal. Un 36% de los inmaduros se ubicaron en praderas de Thalassia, seguidos de ostrales y arena con 27% cada uno.
Las densidades promedio en las estaciones con pastos marinos y algas en descomposición tuvieron grandes varianzas, no así en el resto de los sustratos analizados (Fig. 3). Fueron identificadas cinco zonas con proporciones elevadas de juveniles (más de 65% de ejemplares con tallas menores a la de madurez sexual), que en su mayoría fueron fondos de Thalassia (40%), ostrales (40%) y arenales (20%).
Luidia senegalensis: Se encontró un total de 40 individuos, con una densidad promedio de 0.004±0.018ind./m2 DE (C.I.95%=-0.001- 0.009) (Fig. 1). El 95% de los organismos encontrados superaban la talla de madurez sexual reportada, y se encontraron sólo dos ejemplares inmaduros en áreas separadas. Se determinó una talla promedio de 12±3.5cm DE; con una longitud mínima de 3.5cm y una máxima 22.3cm (Fig. 2).
La especie fue observada en un 15% de las estaciones, ubicadas en la zona sur y suroeste de la isla, de las cuales el 92.5% eran arenales y el otro 7.5% bancos de bivalvos (Fig. 3). El grado de agregación de esta especie fue mayor que para O.reticulatus, con un k de 0.06.
Discusión
Oreaster reticulatus: En comparación con otras localidades venezolanas, la densidad encontrada para la isla de Cubagua (167.3ind./ ha) es inferior a las de Caño León (720ind./ ha) en el Parque Nacional Morrocoy y a las del Parque Nacional Mochima (2 000ind./ha) (Martín et al. 2001). Sin embargo, para la localidad de Las Luisas también del P. N. Morrocoy, Martín et al. (2001) indican una densidad de 75ind./ha y años más tarde en la misma zona se encontraron unos 200ind./ha (Zuliani et al. 2007), y se desconoce si estas variaciones son naturales o producto de su extracción, puesto que no existe información sobre las zonas de pesca y niveles de captura.
Las densidades observadas para Cubagua con respecto a otros países son superiores al Caribe panameño (150ind./ha) (Guzmán & Guevara 2002) y a Puerto Rico (27.5ind./ ha) (Le Gore et al. 2008). Sin embargo, son inferiores a las de islas Vírgenes (entre 200 y 900ind./ha), donde incluso encuentran hasta 1 400 individuos en un área de 100m2 cubierta de Syringodium filiforme (Scheibling 1980a). De igual forma, en Belice han sido reportadas densidades superiores, de entre 170-1 830ind./ ha (Scheibling & Metaxas 2010) y de 890ind./ ha (Wulff 2008).
En Cubagua, los ejemplares fueron en su mayoría adultos; resultados similares han sido encontrados en Puerto Rico, donde la población está compuesta por individuos de gran tamaño, que a pesar de ubicarse en zonas poco profundas y de fácil acceso, no son recolectados con fines ornamentales por no ser adecuados para pequeños acuarios caseros (Le Gore et al. 2008). Por el contrario, en Panamá se ha detectado una estructura poblacional compuesta por un 83% de juveniles y 17% adultos (Guzmán & Guevara (2002).
Las tallas medias encontradas son superiores a las reportadas para el P.N. Morrocoy (6.15cm) (Zuliani et al. 2007) y las de Bocas del Toro, Panamá (9.5cm) (Guzmán & Guevara (2002); aunque en otras localidades panameñas (Islas San Blas), se encontró una talla promedio superior, de 11.8cm (6-19cm) (Wulff 1995). De igual forma para Belice se ha detectado una talla media de 12cm (Wulff 2008) y un rango promedio entre 9.7-13.7cm entre los distintos hábitats (Scheibling & Metaxas 2010); mientras que en Saint Croix (Islas Vírgenes) osciló entre 8.4-19.6cm (Scheibling 1981b). Las diferencias en la estructura de tallas entre las poblaciones de O. reticulatus pueden ser atribuidas a diferencias en la calidad y disponibilidad de fuentes de alimentos entre los sustratos que habitan (Scheibling 1980b).
Oreaster reticulatus habita prácticamente en todos los alrededores de la isla de Cubagua (con menor distribución en la zona norte) y en casi todos los tipos de sustratos observados (excepto parches de octocoral). Esta gran cobertura de área en los alrededores de la isla, se debe posiblemente a que se alimentan mayoritariamente de materia orgánica de los sedimentos, por lo que tienden a ocupar grandes áreas para obtener suficiente alimento (Scheibling 1980a, 1980c, 1981a, 1982a). Sin embargo, las zonas este y suroeste de la isla, son las que presentan mayor heterogeneidad de sustratos y mayores densidades de la especie. Ha sido señalado que la distribución espacial de una población de estas estrellas de mar es producto de dos fuerzas contrarias: la competencia por alimentación (que tiende a disminuir la densidad poblacional), y la concentración ideal de organismos para asegurar el éxito reproductivo (que tiende a aumentar su densidad poblacional) (Metaxas et al. 2002, Scheibling 2001).
Una marcada distribución en arenales y praderas de Thalassia coincide con lo reportado por Scheibling & Metaxas (2010), quienes encuentran zonas con densos pastos marinos que pueden proporcionar un entorno de protección para el reclutamiento y el cambio ontogénico, mientras que los adultos suelen ser característicos de fondos arenosos, donde, por lo general los ejemplares alcanzan la madurez sexual. Esta condición fue corroborada para la isla de Cubagua, ya que de 43 individuos encontrados en arenales sólo dos presentaban la condición de inmaduros.
Para la isla de Cubagua destaca una talla mínima de 2.2cm y una estación en el suroeste (con sustrato predominante Thalassia), donde se capturaron 36 ejemplares de los cuales 34 tenían tallas inferiores a los 7cm, sugiriendo cierta agregación de reclutas, los cuales presentaron la respectiva coloración críptica de los juveniles. Encontrar un 90% de individuos inmaduros en compañía de adultos podría sugerir cierta tendencia al asentamiento en zonas con presencia de individuos maduros de la misma especie. En general, los huevos de O. reticulatus presentan una flotabilidad negativa que les da la capacidad de desplazarse al menos unos 20m antes de hundirse, lo que aumenta la probabilidad de fertilización (Metaxas et al. 2008) y podría colaborar con estas agregaciones de adultos y juveniles.
Los ostrales o bancos de bivalvos, demostraron ser un hábitat importante para la especie y su reclutamiento. Estas agregaciones incrementan la heterogeneidad espacial del ambiente béntico, y proveen hábitat y comida para gran diversidad de organismos (Jacobi 1987, Seed 1996). Experimentos de laboratorio, han revelado que las larvas tienen preferencia por microhábitats crípticos (Metaxas et al. 2008), condición característica de los bancos de moluscos bivalvos. Sin embargo, existe una pesquería artesanal dirigida a estos moluscos, que soporta volúmenes de captura de entre 35 000-40 000tm/año (Jiménez et al. 1996) lo que podría afectar en cierta medida la sobrevivencia de los reclutas de las estrellas, a causas de daños mecánicos ocasionados con el arte de pesca (rastra artesanal). Así, un incremento en su explotación puede provocar una reducción del tamaño poblacional por debajo del nivel crítico requerido para una producción de cigotos y reclutamiento exitoso, lo que podría llevar a la especie a su extinción local e incluso global (Metaxas et al. 2002).
La alteración del litoral, contaminación y prácticas pesqueras destructivas e insostenibles convierten a las zonas costeras en espacios amenazados, que podrían considerarse factores de riesgo adicionales para O. reticulatus (Scheibling & Metaxas 2010). Sumado a esto, entre los aspectos de la historia de vida de esta estrella destacan una baja tasa de recuperación poblacional por su crecimiento lento, madurez sexual tardía y baja tasa de reclutamiento; características que la hacen particularmente vulnerable (Scheibling 1982b).
Luidia senegalensis: el promedio de tallas observado coincide con el espectro de tallas del suroeste de Florida, el cual varió entre 11.7±1.2cm-13.2±1.1cm, hasta una talla máxima de 14cm (Miller & Lawrence 1999). La talla máxima encontrada en Cubagua, es superior a todas las reportadas previamente. Halpern (1970) indica que la especie crece a una tasa de 1.2cm al mes, y el crecimiento es mayor en organismos de pequeño tamaño, para luego reducirse drásticamente.
La especie alcanza la madurez sexual aproximadamente a los 7.5cm de longitud del radio mayor (Halpern 1970). Pocos organismos presentaron tamaños inferiores a esta talla, sin embargo, individuos de pequeño tamaño podrían ser difíciles de encontrar, si se entierran por completo sin dejar silueta sobre la arena. Humann & Deloach (2006) indican que la especie rara vez se puede ver libremente, puesto que suele permanecer enterrada para alimentarse.
L. senegalensis ha sido reportada principalmente en arenales (Zoppi 1967), lo que coincide con los resultados de este trabajo, aunque también fue encontrada en fondos de moluscos, lo que podría atribuirse a que la especie consume mayoritariamente al bivalvo Abra aequalis, además de otras especies de bivalvos, poliquetos, briozoos, gasterópodos y ofiuros (Halpern 1970).
Resulta imposible realizar algún tipo de comparación con respecto a las densidades encontradas, puesto que no ha sido llevada a cabo ninguna investigación que aporte datos al respecto. No obstante, para el sureste Brasilero, Setubal (1992, 2001) afirma que la especie es frecuente y abundante entre los invertebrados bentónicos.
Implicaciones de manejo: Antiguamente, O. reticulatus era abundante, y actualmente es rara en muchos lugares del Caribe (Hendler et al. 1995); además, está amenazada en países vecinos como Colombia y Brasil (Benavides- Serrato et al. 2005, Amaral et al. 2008, Machado et al. 2008); y siendo el comercio de sus ejemplares la causa principal de la disminución de sus poblacionales; es prioridad prohibir actividades para su extracción y comercialización en Venezuela.
Para ambas especies, se recomienda realizar periódicamente censos poblacionales, a fin de detectar variaciones de sus densidades en el tiempo. Es importante llevar a cabo estudios que permitan identificar posibles picos repro- ductivos para reforzar la vigilancia y control en la época correspondiente.
Cubagua es una isla con alto valor histórico (Otte 1977, Cervigón 1997, 1998) y paleontológico (Ancieta 2005, Landau et al. 2007, 2008), sometida a tres épocas de sobreexplotación de perlas (Cervigón 1998, Romero et al. 1999), con gran diversidad biológica (Gómez 1987, Cervigón 2005, Parra et al. 2007, Ramírez 2001, Hernández-Ávila et al. 2007, Hernández-Ávila 2010), y donde existen numerosas evidencias de que su ecosistema marino es afectado continuamente por actividades humanas (Rodríguez 2004, Alvizu 2006, Pascual 2007, Uriarte 2007, Barrios et al. 2007, Tagliafico et al. 2011). Así, la presencia de estas estrellas amenazadas suman una razón más para considerar la protección de la isla de Cubagua, ya que la implementación de un área marina protegida es la medida de conservación más efectiva que existe (Hixon et al. 2001).
Agradecimientos
Alexander Marcano y Alexis Marcano por toda la ayuda brindada en campo. A Jesús Rosas y todo el personal que labora en la estación científica “Fernando Cervigón” de la Universidad de Oriente en la Isla de Cubagua, por todo el apoyo logístico. Régulo López (padre e hijo) por valiosa colaboración. José Silva por su ayuda en la realización de los mapas. Sebastián Rodríguez, Gabriela Pérez y Edlin Guerra por su asesoría. Denise Debrot por la revisión del abstract. Provita y fondo IEA por cofinanciar indirectamente el proyecto. Revisores anónimos por sus acertadas sugerencias.
Referencias
Alvizu, A. 2006. Estructura comunitaria de esponjas asociadas a dos parches coralinos en la Isla de Cubagua, Venezuela. Trabajo de grado,Universidad de Oriente, Isla de Margarita, Venezuela. [ Links ]
Amaral, A., C. Volkmer-Ribero, M. Mansur, S. Santos, W. Avelar, H. Mattews-Cascon, F. Leite, G. Melo, P. Coelho, G. Buckup, L. Buckup, C. Ventura & C. Tiago. 2008. A situação de ameaça dos invertebrados aquáticos no Brasil, p. 156-165. In A. Machado, G. Drummond & A. Paglia (eds.). Livro Vermelho da fauna brasileira ameaçada de extinção. Brasilia, Brasil. [ Links ]
Ancieta, H. 2005. El mensaje de las rocas de Cubagua. Naoma Ediciones, Porlamar, Nueva Esparta, Venezuela. [ Links ]
Ardila, N., G. Navas & J. Reyes. 2002. Libro rojo de invertebrados marinos de Colombia. Invemar. La serie Libros rojos de especies amenazadas de Colombia. Ministerio de Medio Ambiente, Bogotá, Colombia. [ Links ]
Barrios, J., J. Bolaños & R. López. 2007. Blanqueamiento de arrecifes coralinos por la invasión de Kappaphycus alvarezii (Rhodophyta) en isla Cubagua, Estado Nueva Esparta, Venezuela. Bol. Inst. Oceanogr. Venezuela 46: 147-152. [ Links ]
Benavides, M., G. Borrero, O. Solano & G. Navas. 2005. Listado taxonómico de los asteroideos (Echinodermata: Asteroidea) de la plataforma y el talud superior del Caribe colombiano. Rev. Biol. Trop. 53: 171-194. [ Links ]
Cervigón, F. 1997. Cubagua 500 años. Fundación Museo del Mar, Boca de Río, Nueva Esparta, Venezuela. [ Links ]
Cervigón, F. 1998. Las perlas en la historia de Venezuela. Fundación Museo del Mar, Boca de Río, Nueva Esparta, Venezuela. [ Links ]
Cervigón, F. 2005. La ictiofauna marina de Venezuela, una aproximación ecológica. Bol. Inst. Oceanogr. Venezuela 44: 9-27. [ Links ]
Elliot, J.M. 1977. Some Methods for the Statistical Analysis of Samples of Benthic Invertebrates. Fresh. Biol. Ass. U.K. [ Links ]
Gómez, A. 1987. Estructura de la taxocenosis de peces en praderas de Thalassia testudinum de la bahía de Charagato, isla de Cubagua, Venezuela. Bol. Inst. Oceanogr. Venezuela 26: 125-146. [ Links ]
Guzmán, H. & C. Guevara. 2002. Annual reproductive cycle, spatial distribution, abundance, and size structure of Oreaster reticulatus (Echinodermata: Asteroidea) in Bocas del Toro, Panamá. Mar. Biol. 141: 1077-1084. [ Links ]
Halpern, J. 1970. Growth rate of the tropical sea star Luidia senegalensis (Lamarck). Bull. Mar. Sc. 20: 626-633. [ Links ]
Hendler, G., J.E. Miller, D.L. Pawson & P.M. Kier. 1995. Sea Stars, Sea Urchins, and Allies: Echinoderms of Florida and the Caribbean. Smithsonian Institution, Washington, D.C., U.S.A. [ Links ]
Hernández, I., A. Gómez, C. Lira & L. Galindo. 2007. Benthic decapod crustaceans (Crustacea: Decapoda A.) of Cubagua Island, Venezuela.. Zootaxa 1557: 33-45. [ Links ]
Hernández, I. 2010. Ofiuroideos (Echinodermata: Ophiuroidea) de la isla de Cubagua, Venezuela. Tesis de maestría, Instituto Oceanográfico de Venezuela, Universidad de Oriente, Cumaná, Sucre, Venezuela. [ Links ]
Hixon, M., P. Dee Boersma, M. Hunter Jr., F. Micheli, E. Norse, H. Possingham & P. Snelgrove. 2001. Oceans at risk: research priorities in marine conservation biology, p. 125-154. In M. Soulé & G. Orians (ed.). Conservation biology: Research priorities for the next decade. Island, Washington, D.C., U.S.A. [ Links ]
Humann, P. & N. Deloach. 2006. Reef creature identification, Florida, Caribbean, Bahamas. New World, Florida, U.S.A. [ Links ]
Jacobi, C.M. 1987. The invertebrate fauna associated with intertidal beds of the brown mussel Perna perna (L.) from Santos, Brazil. Stud. Neotrop. Fauna Environ. 22: 37-72. [ Links ]
Jiménez, R., T.D´Lacoste & T. Lunar. 1996. La pesquería de la pepitona Arca zebra en el banco de Chacopata, Estado Sucre. Acta Cient. Venez. 47: 41-42. [ Links ]
Kaplan, E. 1988. The Peterson Field Guide Series: A Field Guide to Southeastern and Caribbean Seashores: Cape Hatteras to the Gulf Coast, Florida, and the Caribbean. Houghton Mifflin, Boston, U.S.A. [ Links ]
Landau, B., J. Capelo & C. Marques. 2007. Patterns of extinction and local disappearance of tropical marine gastropods; contrasting examples from across the north atlantic. AÇoreana: 50-58. [ Links ]
Landau, B., V. Geerat & C. Marques. 2008. Southern Caribbean Neocene palaeobiogeography revisited. New data from the Pliocene of Cubagua, Venezuela. Palaeogeogr. Palaeocl. 257: 445-461. [ Links ]
Le Gore, R., M. Hardin, J. García & J. Brice. 2008. Marine ornamental trade in Puerto Rico: rapid population assessment of primary target species. Rev. Biol. Trop. 56: 65-88. [ Links ]
Lunn, K., M. Villanueva & A. Vincent. 2008. Souvenir from the sea, an investigation into the curio trade in echinoderms from Mexico. Traffic Bull. 22: 17-32. [ Links ]
Machado, A., G. Drummond & A. Paglia. 2008. Livro Vermelho da fauna brasileira ameaçada de extinção. Vol. 2. Fundação Biodiversitas, Brasília, Brasil. [ Links ]
Martín, A., P. Penchaszadeh & D. Atienza. 2001. Densidad y hábitos alimentarios de Oreaster reticulatus (Linnaeus, 1758) (Echinodermata, Asteroidea) en praderas de fanerógamas marinas de Venezuela. Bol. Inst. Esp. Oceanogr. 17: 203-208. [ Links ]
Metaxas, A., R. Scheibling & C. Young. 2002. Estimating fertilization success in marine benthic invertebrates: a case study with the tropical sea star Oreaster reticulatus. Mar. Ecol. Prog. Ser. 226: 87-101. [ Links ]
Metaxas, A., R. Scheibling, M. Robinson & C. Young. 2008. Larval development, settlement, and early postsettlement behavior of the tropical sea star Oreaster reticulates. Bull. Mar. Sc. 83: 471-480. [ Links ]
Miller, S. & J. Lawrence. 1999. Gonad and pyloric caeca production in the nine-armed starfish Luidia senegalensis off the southwest Florida Gulf coast during the annual reproductive cycle. Bull. Mar. Sc. 65: 175-184. [ Links ]
Myers, R. & A. Ottensmeyer. 2005. Extinction risk in marine species, p. 58-79. In E. Norse & L. Crowder (eds.). Marine conservation Biology, the science of maintaining the sea´s biodiversity. Marine Conservation Biology Institute, Island, Washington, U.S.A. [ Links ]
Otte, E. 1977. La perla del Caribe. Nueva Cádiz de Cubagua. Fundación Boulton, Caracas, Venezuela. [ Links ]
Pascual, L. 2007. Evaluación de la Estructura Comunitaria de Peces Asociados a Parches Coralinos en Dos Localidades de la Isla de Cubagua, Estado Nueva Esparta entre junio 2005 y mayo 2006. Tesis de Licenciatura, Universidad de Oriente, Boca del Rio, Nueva Esparta, Venezuela. [ Links ]
Parra, B., L. Ruiz & A. Prieto. 2007. Índices ecológicos y parámetros biométricos de Haemulidae (Pisces: Perciformes) en la zona costera de la Isla de Cubagua, Venezuela. Zootecnia Trop. 25: 51-61. [ Links ]
Penchaszadeh, P. & M. Lera. 1983. Alimentación de tres especies tropicales de Luidia (Echinodermata, Asteroidea) en Golfo Triste, Venezuela. Caribb. J. Sc. 19: 1-6. [ Links ]
Ramírez, P. 2001. Corales de Venezuela. Consejo de Investigación de la Universidad de Oriente, Guatamare, Nueva Esparta, Venezuela. [ Links ]
Rodríguez, S. 2004. Aspectos ecológicos (estructura, incremento poblacional y daños) de tres parches coralinos en Cubagua. Tesis de Licenciatura, Universidad de Oriente, Boca de Río, Nueva Esparta, Venezuela. [ Links ]
Romero, A., S. Chilbert & M. Eisenhart. 1999. Cubagua’s Pearl-Oyster Beds: The First Depletion of a Natural Resource Caused by Europeans in the American Continent. J. Polit. Ecol. 6: 57-78. [ Links ]
Scheibling, R.E. 1980a. Abundance, spatial distribution and size structure of populations of Oreaster reticulatus (L.) (Ehinodermata: Asteroidea) on sand bottoms. Mar. Biol. 57: 95-105. [ Links ]
Scheibling, R.E. 1980b. Dynamics and feeding activity of high-density aggregations of Oreaster reticulatus (L.) (Ehinodermata: Asteroidea) in a sand patch habitat. Mar. Ecol. Prog. Ser. 2: 321-327. [ Links ]
Scheibling, R.E. 1980c. The microphagous feeding behavior of Oreaster reticulatus (Echinodermata: Asteroidea). Mar. Behav. Physiol. 7: 225-231. [ Links ]
Scheibling, R.E. 1981a. Growth and respiration rate of juvenile Oreaster reticulatus (L.) (Ehinodermata: Asteroidea) on fish and algal diets. Comp. Biochem. Physiol. 69: 175-176. [ Links ]
Scheibling, R.E. 1981b. Optimal foraging movements of Oreaster reticulatus (L.) Echinodermata: Asteroidea). J. Exp. Mar. Bio. Ecol. 51: 173-185. [ Links ]
Scheibling, R.E. 1982a. Feeding habits of Oreaster reticulatus (L.) (Ehinodermata: Asteroidea). Bull. Mar. Sci. 32: 504-510. [ Links ]
Scheibling, R.E. 1982b. The annual reproductive cycle of Oreaster reticulatus (L.) (Echinodermata: Asteroidea) and interpopulation comparisons of reproductive capacity. J. Exp. Mar. Biol. Ecol. 54: 39-54. [ Links ]
Scheibling, R.E. 2001. Of size and space: an evolutionary trade-off in fertilization strategy among oreasterid sea stars, p. 207-208. In M. Barker (ed.). Proceedings of the 10th International Echinoderms Conference. AA Balkema, Rotterdam, Holanda. [ Links ]
Scheibling, R. & A. Metaxas. 2010. Mangroves and fringing reefs as nursery habitats for the endangered Caribbean sea star Oreaster reticulatus. Bull. Mar. Sc. 86: 133-148. [ Links ]
Seed, R. 1996. Patterns of biodiversity in the macroinvertebrate fauna associated with mussel patches on rocky shores. J. Mar. Biol. Assoc. U.K. 76: 203-210. [ Links ]
Setubal, A.M. 1992. Structure and dynamics of benthic megafauna on the continental shelf offshore of Ubatuba, southeastern Brazil. Mar. Ecol. Prog. Ser. 86: 63-76. [ Links ]
Setubal, A.M. 2001. Identifyng the components of ecological variation in a marine benthic megafauna. Rev. Brs. Oceanogr. 49: 29-38. [ Links ]
Tagliafico, A., M.S. Rangel & N. Rago. 2011. Distribución y densidad de dos especies de holoturoideos en la isla de Cubagua, Venezuela. Rev. Biol. Trop. 59: 843-852. [ Links ]
Uriarte, A. 2007. Condición Actual de las Formaciones Coralinas de Acroporidos en la Isla de Cubagua- Venezuela. Tesis de Licenciatura, Universidad de Oriente, Boca de Rio, Nueva Esparta, Venezuela. [ Links ]
Wulff, J. 1995. Sponge-feeding by the Caribbean starfish Oreaster reticulatus. Mar. Biol. 123: 313-325. [ Links ]
Wulff, J. 2008. Collaboration among sponge species increases sponge diversity and abundance in a seagrass meadow. Mar. Ecol. 29: 193-204. [ Links ]
Zoppi, E. 1967. Contribución al estudio de los equinodermos de Venezuela. Acta Biol. Ven. 5: 266-333. [ Links ]
Zuliani, L., J. DeVeer, C. Antich & S. Marín. 2007. Estudio de la densidad de Oreaster reticulatus (Echinodermata: Asteroridea) en la localidad de Las Luisas (Parque Nacional Morrocoy, Estado Falcón). VII Congreso Venezolano de Ecología, Guayana, Venezuela. [ Links ]
*Correspondencia:
Alejandro Tagliafico: Escuela de Ciencias Aplicadas del Mar, Universidad de Oriente, Núcleo Nueva Esparta, Isla de Margarita, Boca de Río, Venezuela. tagliaficoa@gmail.com.
María Salomé Rangel: Escuela de Ciencias Aplicadas del Mar, Universidad de Oriente, Núcleo Nueva Esparta, Isla de Margarita, Boca de Río, Venezuela. Departamento de Ciencias, Unidad de Cursos Básicos, Universidad de Oriente, Núcleo de Nueva Esparta, Isla de Margarita, Guatamare, Venezuela. salome453@gmail.com.
Néstor Rago: Oceanografía y Pesca, Fundación de Ciencias Naturales la Salle. nstorago@gmail.com.
1. Escuela de Ciencias Aplicadas del Mar, Universidad de Oriente, Núcleo Nueva Esparta, Isla de Margarita, Boca de Río, Venezuela; tagliaficoa@gmail.com
2. Departamento de Ciencias, Unidad de Cursos Básicos, Universidad de Oriente, Núcleo de Nueva Esparta, Isla de Margarita, Guatamare, Venezuela; salome453@gmail.com
3. Oceanografía y Pesca, Fundación de Ciencias Naturales la Salle; nstorago@gmail.com
Recibido 21-VI-2011. Corregido 20-I-2012. Aceptado 20-II-2012.














