Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.60 n.1 San José Mar. 2012
Evidencia morfológica de hibridación entre las subespecies de Ramphocelus flammigerus (Passeriformes: Thraupidae) en Colombia
*Dirección para correspondencia
Abstract
Morphological evidence of hybridization between Ramphocelus flammigerus subspecies (Passeriformes: Thraupidae) in Colombia. Habitat modifications such as deforestation and the increase of agricultural activities, have led to uncommon faunal interactions. In Colombia, this condition have caused the secondary contact of subspecies of Ramphocelus flammigerus populations from Cauca valley and the Pacific coast; and some specimens with rumps of intermediate colors of the subspecies have been found and are thought as hybrids. The objective of this study was to assess the presence of morphological evidence that may suggest hybridization and may explain the origin of individuals with intermediate coloration. We predict that if subspecies hybridize, they will be more similar in morphology when coexisting than when separated. Alternatively, coexisting subspecies might diverge in sympatry, because of selection to reduce competition for resources (character displacement). For this, a survey in 15 localities was undertaken: 10 allopatric areas (five for each subspecies), and five sympatric areas. Mist nets were used to capture individuals and a total of seven morphological characters were measured. To identify the patterns of morphological variation, we compared morphology of subspecies, sympatric and allopatric populations and individuals of intermediate colors. Consequently, we performed discriminant analysis and test for differences between groups by using 95% confidence intervals for log-ratio tests. A total of 112 individuals were captured (46 intermediate-colored individuals, 20 R. f. flammigerus, and 46 R. f. icteronotus. Discriminant analyses showed that subspecies were well differentiated, and intermediate individuals overlapped with them. Log-ratio test, based on Mahalanobis distances, showed that intermediate individuals were morphologically more similar to both subspecies than subspecies themselves. In addition, log-ratio tests showed that subspecies sympatric populations were similar but allopatric ones were different, and that individuals of intermediate colors were more similar to sympatric than to allopatric populations of the two subspecies. Therefore, morphological evidence supports the predictions of a hybridization hypothesis among the subspecies of R. flammigerus. In conclusion, the analysis of morphological variation in R. flammigerus suggests that hybridization between subspecies is occurring and that a process of genetic introgression is probably in progress.
Key words: hybridization, morphology, introgression, sympatric, allopatric, character displacement, Ramphocelus.
Resumen
Las modificaciones de los hábitats naturales, tales como la deforestación y el incremento de las actividades agrícolas, han conducido a interacciones faunísticas inusuales. En Colombia, esta situación ha generado el contacto secundario entre las poblaciones de las subespecies de Ramphocelus flammigerus del Valle del Cauca y de la costa Pacífica; y se han encontrado individuos con rabadillas de colores intermedios entre las subespecies que se han catalogado como híbridos. El objetivo del presente estudio fue evaluar si existe evidencia morfológica que sugiera hibridación y que pueda explicar el origen de los individuos de coloración intermedia. Con este fin, se obtuvieron muestras de 15 localidades; 10 zonas alopátricas (cinco por cada subespecie) y cinco zonas simpátricas. Para la captura de individuos se utilizaron redes de niebla y fueron tomados siete caracteres morfológicos. Asimismo, se predijo que si las subespecies están hibridando, las mismas, podrían ser morfológicamente más similares cuando coexisten que cuando se encuentran separadas. Alternativamente, cuando las subespecies coexisten, éstas pueden divergir en simpatría debido a presiones selectivas para reducir la competencia por recursos (desplazamiento de caracteres). Para identificar los patrones de variación morfológica, se comparó la morfología de las subespecies, de poblaciones simpátricas y alopátricas de ambas subespecies y de los individuos de cloración intermedia. Consecuentemente, se realizó un análisis discriminante y se evaluaron las diferencias entre los grupos con la utilización de intervalos de confianza del 95% para las relaciones logarítmicas. Y se capturaron un total de 112 individuos (46 de coloraciones intermedias, 20 R. f. flammigerus y 46 R. f. icteronotus). Los análisis discriminantes mostraron que las subespecies se diferencian entre ellas y que los individuos de coloraciones intermedias se traslapan con estas. Las relaciones logarítmicas, basadas en las distancias cuadradas de Mahalanobis, mostraron que los individuos intermedios fueron más similares morfológicamente a ambas subespecies que las subespecies entre ellas. Adicionalmente, se encontró que las poblaciones simpátricas de ambas subespecies son similares pero las poblaciones alopátricas son diferentes, y que los individuos de coloraciones intermedias son más similares a las poblaciones simpátricas de las dos subespecies que a las alopátricas. Por lo tanto, la evidencia morfológica evidencia las predicciones derivadas de la hipótesis de hibridación entre las subespecies de R. flammigerus. En conclusión, el análisis morfológico de la variación en R. flammigerus sugiere que se presenta hibridación entre las subespecies y que probablemente está en progreso un proceso de introgresión genética.
Palabras clave: hibridación, introgresión, morfología, Ramphocelus, subespecies, alopatría, simpatría, desplazamiento de caracteres
Morphological evidence of hybridization between Ramphocelus flammigerus subspecies (Passeriformes: Thraupidae) in Colombia. Habitat modifications such as deforestation and the increase of agricultural activities, have led to uncommon faunal interactions. In Colombia, this condition have caused the secondary contact of subspecies of Ramphocelus flammigerus populations from Cauca valley and the Pacific coast; and some specimens with rumps of intermediate colors of the subspecies have been found and are thought as hybrids. The objective of this study was to assess the presence of morphological evidence that may suggest hybridization and may explain the origin of individuals with intermediate coloration. We predict that if subspecies hybridize, they will be more similar in morphology when coexisting than when separated. Alternatively, coexisting subspecies might diverge in sympatry, because of selection to reduce competition for resources (character displacement). For this, a survey in 15 localities was undertaken: 10 allopatric areas (five for each subspecies), and five sympatric areas. Mist nets were used to capture individuals and a total of seven morphological characters were measured. To identify the patterns of morphological variation, we compared morphology of subspecies, sympatric and allopatric populations and individuals of intermediate colors. Consequently, we performed discriminant analysis and test for differences between groups by using 95% confidence intervals for log-ratio tests. A total of 112 individuals were captured (46 intermediate-colored individuals, 20 R. f. flammigerus, and 46 R. f. icteronotus. Discriminant analyses showed that subspecies were well differentiated, and intermediate individuals overlapped with them. Log-ratio test, based on Mahalanobis distances, showed that intermediate individuals were morphologically more similar to both subspecies than subspecies themselves. In addition, log-ratio tests showed that subspecies sympatric populations were similar but allopatric ones were different, and that individuals of intermediate colors were more similar to sympatric than to allopatric populations of the two subspecies. Therefore, morphological evidence supports the predictions of a hybridization hypothesis among the subspecies of R. flammigerus. In conclusion, the analysis of morphological variation in R. flammigerus suggests that hybridization between subspecies is occurring and that a process of genetic introgression is probably in progress.
Key words: hybridization, morphology, introgression, sympatric, allopatric, character displacement, Ramphocelus.
Resumen
Las modificaciones de los hábitats naturales, tales como la deforestación y el incremento de las actividades agrícolas, han conducido a interacciones faunísticas inusuales. En Colombia, esta situación ha generado el contacto secundario entre las poblaciones de las subespecies de Ramphocelus flammigerus del Valle del Cauca y de la costa Pacífica; y se han encontrado individuos con rabadillas de colores intermedios entre las subespecies que se han catalogado como híbridos. El objetivo del presente estudio fue evaluar si existe evidencia morfológica que sugiera hibridación y que pueda explicar el origen de los individuos de coloración intermedia. Con este fin, se obtuvieron muestras de 15 localidades; 10 zonas alopátricas (cinco por cada subespecie) y cinco zonas simpátricas. Para la captura de individuos se utilizaron redes de niebla y fueron tomados siete caracteres morfológicos. Asimismo, se predijo que si las subespecies están hibridando, las mismas, podrían ser morfológicamente más similares cuando coexisten que cuando se encuentran separadas. Alternativamente, cuando las subespecies coexisten, éstas pueden divergir en simpatría debido a presiones selectivas para reducir la competencia por recursos (desplazamiento de caracteres). Para identificar los patrones de variación morfológica, se comparó la morfología de las subespecies, de poblaciones simpátricas y alopátricas de ambas subespecies y de los individuos de cloración intermedia. Consecuentemente, se realizó un análisis discriminante y se evaluaron las diferencias entre los grupos con la utilización de intervalos de confianza del 95% para las relaciones logarítmicas. Y se capturaron un total de 112 individuos (46 de coloraciones intermedias, 20 R. f. flammigerus y 46 R. f. icteronotus). Los análisis discriminantes mostraron que las subespecies se diferencian entre ellas y que los individuos de coloraciones intermedias se traslapan con estas. Las relaciones logarítmicas, basadas en las distancias cuadradas de Mahalanobis, mostraron que los individuos intermedios fueron más similares morfológicamente a ambas subespecies que las subespecies entre ellas. Adicionalmente, se encontró que las poblaciones simpátricas de ambas subespecies son similares pero las poblaciones alopátricas son diferentes, y que los individuos de coloraciones intermedias son más similares a las poblaciones simpátricas de las dos subespecies que a las alopátricas. Por lo tanto, la evidencia morfológica evidencia las predicciones derivadas de la hipótesis de hibridación entre las subespecies de R. flammigerus. En conclusión, el análisis morfológico de la variación en R. flammigerus sugiere que se presenta hibridación entre las subespecies y que probablemente está en progreso un proceso de introgresión genética.
Palabras clave: hibridación, introgresión, morfología, Ramphocelus, subespecies, alopatría, simpatría, desplazamiento de caracteres
La modificación de los hábitats por las actividades humanas puede generar: el contacto secundario entre poblaciones, la mezcla de los acervos génicos y la pérdida del potencial genético de las mismas (Neuffer et al. 1999, Bleeker & Hurka 2001). En el caso de la especie Ramphocelus flammigerus (Jardine & Selby 1833) en Colombia, los individuos de la población del valle geográfico del río Cauca son de mayor tamaño y presentan rabadilla roja (R. f. flammigerus), mientras que, los de la costa pacífica (R. f. icteronotus) son más pequeños y la rabadilla es amarilla brillante (Sibley 1958). Los modelos de distribución potencial actual e histórica (en el Pleistoceno) indican que probablemente, estas diferencias morfológicas y de distribución, se deben a un evento de vicarianza que las mantuvo separadas en el pasado (A. Morales 2007 com. pers.). Sin embargo, en el Valle del Cauca, la destrucción de los bosques y el establecimiento de cultivos, han permitido que las dos subespecies extiendan sus rangos de distribución y entren en contacto secundario (Sibley 1958). En esta zona de contacto, sobre la vertiente pacífica de la cordillera Occidental de Colombia, se observan especímenes con rabadillas de colores intermedios (anaranjadas). Lafresnaye (1853) consideró a estos individuos como una especie diferente (R. chrysonotus). Por otra parte, Plath (1945) reportó que los machos juveniles presentan una coloración más clara en la rabadilla y propuso que la variación en coloración en esta especie se debe a diferencias en edad entre los individuos. Posteriormente, Sibley (1958) concluyó que las dos formas de R. flammigerus hibridan, por lo tanto, los individuos de coloraciones intermedias corresponden a híbridos entre éstas. Recientemente, se ha encontrado que las subespecies de R. flammigerus presentan alelos compartidos y una alta similitud en la secuencia del ADN mitocondrial, lo cual puede deberse a una hibridación o a tiempo de divergencia reciente (González 2009, Ocampo 2009). En vista de que la información sobre la interacción de estos dos taxones ha sido principalmente anecdótica e insuficiente, la afirmación de la hibridación entre estas dos especies no es conclusiva.
Cuando dos taxones, ecológica o filogenéticamente similares, coexisten; estos pueden diferir solo cuando coexisten (en simpatría) o diferir tanto cuando coexisten como cuando están separados (en alopatría). El primer patrón sugiere que la competencia podría generar una selección para la evolución de fenotipos divergentes en simpatría, lo cual se conoce como desplazamiento de caracteres (Brown & Wilson 1956, Grant & Grant 2006). El segundo patrón sugiere que la divergencia se originó en alopatría, antes que los taxones coexistieran, como resultado de condiciones ambientales diferentes y que esta divergencia facilitó la coexistencia en simpatría (Grant 1972, Thompson 1994). Alternativamente, si los taxones no difieren en simpatría pero sí en alopatría, este patrón puede sugerir que se presenta hibridación o convergencia debido a la similitud en condiciones ambientales. Por otra parte, si existe hibridación se espera que se presenten individuos intermedios entre los dos taxones. Sin embargo, los individuos intermedios pueden deberse a hibridación entre los parentales o a variación intraespecífica de uno de los taxa (Parkinson 1979).
De acuerdo con las características del contacto entre las subespecies de Ramphocelus, si están hibridando, podría estar en progreso un proceso de introgresión genética (Sibley 1958); flujo de genes entre dos poblaciones diferenciadas, como producto de repetidos eventos de hibridación y retro-cruzamiento (Allendorf et al. 2001). Por lo tanto, gracias al proceso de introgresión genética, la variabilidad mostrada por estas subespecies podría disminuir gradualmente. En este contexto, la subespecie R. f. flammigerus podría verse más afectada por tener una distribución más reducida y ser menos abundante localmente que la población de R. f. icteronotus (Sibley 1958). A largo plazo este proceso podría llevar a la pérdida de laintegridad genética de R. f. flammigerus, el cual es un taxón endémico para Colombia.
El objetivo del presente estudio fue evaluar si existe evidencia morfológica que sugiera hibridación entre las subespecies de R. flammigerus y que pueda explicar el origen de los individuos de coloración intermedia. Para lo cual se identificó el patrón de variación fenotípica, en donde se comparó la morfología de las subespecies, de las poblaciones alopátricas y simpátricas y de los individuos de coloraciones intermedias. Por lo tanto, si las subespecies de R. flammigerus están hibridando se espera que: 1) los individuos de coloraciones intermedias sean intermedios, en cuanto a su morfología, con respecto a las subespecies parentales; 2) los individuos de coloración intermedia sean más similares a las poblaciones simpátricas de las dos subespecies que a las poblaciones alopátricas y 3) que las poblaciones simpátricas de las subespecies sean más similares entre sí
que las poblaciones alopátricas.
Materiales y Métodos
Toma de datos: Desde el 2006 hasta el 2011 se capturaron individuos de Ramphocelus flammigerus, con redes de niebla, en distintas localidades de los Departamentos del Valle del Cauca y Cauca en Colombia. Asimismo, fueron realizados muestreos en 15 localidades: cinco alopátricas para R. f. flammigerus, cinco alopátricas para R. f. icteronotus y cinco zonas simpátricas (Fig. 1). Los individuos capturados fueron clasificados por los autores, en uno de los tres morfos, con base en el patrón de coloración. Por lo tanto, la clasificación fue consistente y basada en el conocimiento de la variación en coloración que se presenta en la zona de estudio.
Por medio de un calibrador digital (Mitutoyo®) se midieron los siguientes caracteres morfológicos en milímetros: longitud del ala, longitud del tarso, longitud del pico (culmen total), alto del pico, comisura (ancho del pico), longitud total y longitud de la cola, estas medidas fueron tomadas siguiendo Baldwin et al. (1931). Algunas de las localidades fueron visitadas en más de una ocasión (Zelandia: siete, Atuncela: cinco, Bitaco: cinco, Caloto: dos, La Elvira: dos, Isla Palma: dos) por lo tanto, todos los individuos capturados fueron marcados con anillos de colores para evitar considerar datos de recapturas en los análisis.
Para determinar si los individuos de coloraciones intermedias son intermedios en morfología con respecto a las poblaciones parentales, se realizó un análisis discriminante, en donde se consideran tres grupos (R. f. flammigerus, R. f. icteronotus e individuos intermedios). Adicionalmente, se realizó un análisis discriminante con los individuos clasificados en cinco grupos de acuerdo con el morfo y la distribución (R f. flammigerus alopátricos, R. f. flammigerus simpátricos, individuos de coloraciones intermedias, R. f. icterontus simpátricos y R. f. icteronotus alopátricos). Con base en el resultado de este análisis se determinó: 1) si se presenta una mayor similitud entre las poblaciones simpátricas y los individuos de coloraciones intermedias con respecto a las poblaciones parentales y 2) si se presenta una mayor similitud entre las poblaciones simpátricas de ambas subespecies que entre sus poblaciones alopátricas. En los análisis discriminantes se consideraron todas las medidas morfológicas y se realizaron validaciones cruzadas, y se dejó un individuo por fuera al tiempo, para evaluar la confiabilidad de los resultados. Esta validación consiste en estimar la función discriminante en el cual se deja fuera una observación, y luego utilizar la regla para clasificar la observación. Posteriormente, se evaluó la diferenciación morfológica entre los grupos, para los dos análisis, y se tomó en consideración las dos primeras funciones discriminantes; se realizó la comparación de las distancias cuadradas de Mahalanobis entre los grupos, y se tomó como referencia los centroides de cada grupo para el cálculo de las distancias.
Las comparaciones entre los grupos se realizaron con base en la relación logarítmica (Log-ratio), la cual es una medida del efecto del tamaño “Effect size” (ES) y por lo tanto es independiente de los tamaños de muestra de los grupos que se están comparando. Esta medida relacionó las distancias intragrupo (entre los individuos de un grupo y su centroide) con las distancias entre grupos (entre los individuos de un grupo y los centroides de los otros grupos) de la siguiente forma (Hedges et al. 1999):
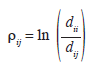
donde ρij es la relación logarítmica entre los grupos i y j medida desde el centroide del grupo i; ρii es la distancia cuadrada de Mahalanobis promedio desde el centroide i hasta los individuos del mismo grupo y dij es la distancia desde el centroide i hasta los individuos del grupo j. Por lo tanto, esta medida permite estimar la magnitud de la diferencia morfológica entre los dos grupos considerados, sin incluir el efecto de las diferencias en los tamaños de las muestras de los grupos comparados. La Varianza de la relación logaritmo fue obtenida a partir del método delta (Bolker 2008) como:
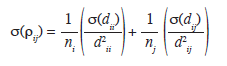
σ(ρij) es la varianza de la relación logarítmicaentre los grupos i y j medidos desde el centroide del grupo i: σ(dii) es la varianza de las distancia cuadradas de Mahalanobis de los individuos del grupo i hacia el centroide del grupo i; σ(dij) es la varianza de las distancias cuadradas de Mahalanobis de los individuos del grupo i hacia el centroide del grupo j, dii es la distancia cuadrada de Mahalanobis promedio desde el centroide i hasta los individuos del mismo grupo, dij es la distancia desde el centroide i hasta los individuos del grupo j, y ni es el número de individuos del grupo i. Para evaluar si las diferencias en morfología entre los grupos fueron significativas, se calcularon intervalos de confianza del 95% con base en los valores de la relación logarítmica y su varianza. En caso de no presentarse diferenciación morfológica significativa entre dos grupos, los intervalos de confianza para la relación logarítmica deben incluir el valor cero; pues ln(1)=0. Consecuentemente, se presenta una mayor diferencia morfológica a medida que el valor absoluto de la relación logarítmica se aleja de cero y su intervalo de confianza no incluye este valor. Los análisis discriminantes fueron realizados por medio del Software SPSS® 15.0 para Windows (SPSS 2006).
Resultados
Después de descartar los individuos juveniles, inusualmente pequeños, se analizaron un total de 112 individuos. De los cuales 20 correspondieron a R. f. flammigerus (12 de poblaciones simpátricas y ocho de poblaciones alopátricas), 46 correspondieron a los individuos de coloraciones intermedias y 46 a la subespecie R. f. icteronotus (27 de zonas alopátricas y 19 de zonas simpátricas).
Las dos primeras funciones del análisis discriminante contienen el 84% de la variación en las mediciones y diferencian morfológicamente a las dos subespecies entre sí, mientras que, los individuos intermedios presentan un amplio traslape con éstas (Fig. 2). El 65.2% de los individuos fueron correctamente clasificados de acuerdo con la clasificación a priori basada en el agrupamiento inicial; 14 de los 20 (70.0%) individuos de R. f. flammigerus, 27 de los 46 (58.7%) de coloraciones intermedias y 32 de los 46 (69.6%) de R. f. icteronotus. Por otra parte, con el test de validación cruzada fueron clasificados correctamente el 58.9 % de los individuos. El principal aporte en la diferenciación entre los tres grupos fue la longitud de la cola (Carga del factor=-0.097, Lambda de Wilks=0.363, F(14,206)=6.94, p<0.0014) y la comisura (Carga del factor=-0.76, Lambda de Wilks=0.597, F(14,206)=3.39, p<0.037) para la primera función discriminante, mientras que, para la segunda función discriminante fue la longitud total (Carga del factor=0.12, Lambda de Wilks=0.649, F(14,206)=8.21, p<0.0005). De acuerdo con esto, los individuos de R. f. icteronotus son de menor tamaño, los individuos de R. f. flammigerus presentan colas de mayor longitud y los individuos de coloraciones intermedias presentaron las comisuras de menor longitud (Cuadro 1). Adicionalmente, las poblaciones híbridas son similares a R. f. icteronotus en cuanto a la longitud de la cola y similares en tamaño con R. f. flammigerus.
Ahora bien, se presentan diferencias morfológicas significativas entre los tres grupos (individuos intermedios y las dos subespecies), pues los intervalos de confianza del 95% para las relaciones logarítmicas no incluyeron cero (Fig. 3). Además, existe una tendencia hacia un menor grado de diferenciación (relaciones logarítmicas más cercanas a cero) entre los individuos de coloraciones intermedias y ambas subespecies (ρII–ρRF=-0.24±0.15, ρII–ρRI=-0.19±0.09) que entre los individuos de las dos subespecies (ρRF–ρRI=-0.40±0.14).
Con base en las dos primeras funciones del análisis discriminante, que explican el 88% de la variación en las mediciones, se observa que las poblaciones alopátricas se diferencian morfológicamente entre sí, mientras que los individuos de las poblaciones simpátricas se mezclan con los individuos de coloraciones intermedias (Fig. 4). El 54.5% de los individuos fueron correctamente clasificados de acuerdo con la clasificación a priori basada en el agrupamiento de las medidas: cinco de los ocho (62.5%) individuos de las poblaciones simpátricas de R. f. flammigerus, cuatro de los 12 (33.3%) individuos de sus poblaciones alopátricas, 24 de los 46 (52.2%) individuos de las coloraciones intermedias, diez de los 19 (52.6%) individuos de poblaciones simpátricas de R. f. icteronotus y 18 de los 27 (66.7%) individuos de sus poblaciones alopátricas. Por otra parte, con el test de validación cruzada fueron clasificados correctamente el 42.9% de los individuos. El principal aporte en la diferenciación observada entre las poblaciones se debe a las variables longitud total (Carga del factor=0.62, Lambda de Wilks=0.505, F(28,365)=4.06, p>0.004) y comisura (Carga del factor=-0.56, Lambda de Wilks=0.51, F(28,365)= 4.73, p>0.002) para la primera función discriminante. Por otra parte, la longitud de la cola (Carga del factor=-0.61, Lambda de Wilks=0.52, F(28,365)= 4.73 y p>0.001) es la variable que más aporta a la diferenciación sobre la segunda función discriminante.
Con base en los intervalos de confianza de 95% para las relaciones logarítmicas se presenta una diferenciación entre los individuos intermedios y las poblaciones, alopátricas y simpátricas, de las dos subespecies (Fig. 5). Adicionalmente, hay una tendencia hacia una menor diferenciación morfológica entre las poblaciones simpátricas y los individuos de coloraciones intermedias (ρII–ρFS=-0.25±0.20, ρII–ρIS=-0.22±0.12) que entre los individuos de coloraciones intermedias y las poblaciones alopátricas (ρII–ρFA=-0.63±0.21, ρII–ρIA=- 0.38±0.07). Por otra parte, no se presentan diferencias morfológicas entre las poblaciones simpátricas (ρFS–ρIS=-0.14±0.22), mientras si se presentan diferencias entre las poblaciones alopátricas (ρFA–ρIA=-0.75±0.23).
Discusión
Los resultados indican que los individuos intermedios tienden a presentar una morfología intermedia entre las subespecies y a ser morfológicamente más similares a los individuos de las poblaciones simpátricas que a los de las poblaciones alopátricas; y que se presenta diferencia morfológica entre las poblaciones alopátricas pero no entre las poblaciones simpátricas de las subespecies. Por lo tanto, el análisis de la variación morfológica apoya la hipótesis de hibridación pues los resultados encontrados están de acuerdo con las predicciones derivadas de esta. Adicionalmente, la mayor similitud entre las poblaciones simpátricas de las subespecies podría indicar que se presenta un proceso de introgresión genética entre estas dos subespecies previamente aisladas.
Sibley en 1958, con base en la caracterización de la transición fenotípica a través de la zona de contacto y en la cuantificación de fenotipos, concluyó que aparentemente no hay barrera genética entre estas subespecies y que por lo tanto los individuos de coloración intermedia son híbridos. Sin embargo, Plath (1945) y Test (1942) observaron, en cautiverio, que la rabadilla de los machos de R. f. flammigerus antes de su primera muda post-nupcial era de color naranja-rojizo (como el de una hembra típica de flammigerus) y después adquieren una rabadilla con la coloración de un macho típico (escarlata brillante). Estos machos juveniles pueden ser más pequeños que los adultos de esta subespecie y más grandes que los adultos de R. f. icteronotus, y por tanto intermedios en tamaño entre las dos subespecies, como se esperaría en caso de hibridación. En las colecciones de la Universidad del Valle y del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, algunos de los individuos catalogados como híbridos corresponden a juveniles con plumaje en transición (especialmente machos) lo cual indica que existe la posibilidad de que los individuos catalogados como híbridos son juveniles de la subespecie R. f. flammigerus. Sin embargo, durante el muestreo realizado no se encontraron individuos, adultos o juveniles, de coloraciones intermedias en localidades por fuera de la zona de contacto; lo cual sugiere que la hipótesis de variación en color debido a la edad de los individuos no está soportada con base en la muestra obtenida en el presente estudio.
Alternativamente, en caso de no presentarse hibridación se esperaría que en las áreas donde coexisten las dos subespecies, éstas se diferencien más morfológicamente que cuando están separadas (Schluter 2000, Dayan & Simberloff 2005). Esto se debe a que cuando dos taxones muy similares coexisten, se espera que se acentúen las diferencias a nivel de su morfología, comportamiento y ecología para reducir la competencia y permitir la coexistencia (Brown & Wilson 1956, Grant & Grant 2006). A este patrón en el cual las poblaciones simpátricas de dos taxones relacionados muestran mayor diferenciación, en comparación con el grado de diferenciación que exhiben las poblaciones alopátricas, se ha denominado desplazamiento de caracteres (Brown & Wilson 1956). En el caso de R. f. flammigerus, los resultados demuestran que no se presenta el patrón característico del desplazamiento de caracteres, como se esperaría después del establecimiento del contacto secundario en respuesta a competencia.
Con base en las comparaciones morfológicas, los individuos intermedios presentaron distancias menores con respecto a cada subespecie en comparación con las distancias que se presentaron entre las dos subespecies. Por lo tanto, con estos resultados hay una evidente tendencia a que los individuos de coloraciones intermedias son morfológicamente intermedios con respecto a las subespecies, aunque se presente un traslape marcado de los individuos de coloraciones intermedias con las dos subespecies. Sin embargo, es importante tener en cuenta que en muchos casos la combinación de diferentes genomas proporciona una alta varianza en la población de híbridos, por lo cual se presentan individuos intermedios e individuos que se traslapan con los grupos parentales (West 1962, Anderson & Daugherty 1974, Bookstein et al. 1985). Las poblaciones de coloraciones intermedias fueron más similares a la subespecie R. f. icteronotus en cuanto a la longitud de la cola y la comisura y más similares en tamaño a R. f. flammigerus. Por lo tanto, esto sugiere que se podría presentar una expresión diferencial de los caracteres parentales en los individuos de coloraciones intermedias y lo cual puede explicar en parte el grado de variación morfológica exhibida. Es de destacar que a pesar de la variación, los resultados de las comparaciones demuestran que las tres poblaciones se diferencian morfológicamente entre ellas.
El mayor grado de similitud entre las poblaciones simpátricas de ambas subespecies, que entre sus correspondientes poblaciones alopátricas, y entre los individuos de coloraciones intermedias y las poblaciones simpátricas se pueden dar gracias al flujo de genes entre las dos formas como producto de repetidos eventos de hibridación y retrocruzamiento. Alternativamente, este patrón podría presentarse a causa de una convergencia morfológica, la cual se presenta como una respuesta similar a las condiciones ambientales de las zonas de simpatría. Sin embargo, la observación de parejas mixtas (M.J. Bedoya, en prep.) y de individuos intermedios solo en las localidades de simpatría, apoyan la hipótesis de hibridación. También, estudios moleculares previos, basados en la comparación de secuencias de ADN mitocondrial (González 2009) y microsatélites nucleares (Ocampo 2009), han demostrado que ambas subespecies presentan alelos compartidos y una alta similitud en las secuencias en la zona de estudio. Por lo tanto, existe evidencia morfológica y una aproximación molecular de un proceso de introgresión genética como ha sido planteado desde 1958 por Sibley.
Con base en los resultados obtenidos se observa una diferencia significativa en morfología entre las poblaciones alopátricas y simpátricas de R. f. Flammigerus, pero no entre las poblaciones de R. f. icteronotus. Por lo tanto, de acuerdo con lo esperado, hay evidencia para un mayor grado de introgresión en R. f. flammigerus. Sin embargo, para predecir el resultado de un proceso de hibridación hay que considerar que la tasa en la cual ocurre la introgresión, dependería tanto de la frecuencia de la hibridación, como del éxito de los híbridos y los retrocruces (Borge et al. 2005). Además, la extensión de este proceso depende de la zona en la cual ocurra el retrocruce y del tiempo de expansión de la zona híbrida (Borge et al. 2005). En la localidad de Zelandia se ha encontrado que la selección de pareja por parte de las hembras es proporcional a la abundancia de los machos de los tres morfos (M. J. Bedoya, en prep.). Por lo tanto, es probable que las frecuencias relativas de los fenotipos en las zonas de simpatría, al influenciar las frecuencias de retrocruces entre las poblaciones parentales con los híbridos, también sean un determinante del resultado del proceso de hibridación. De esta forma, la dirección del proceso de introgresión dependería de las condiciones locales de los sitios en los cuales interaccionan los individuos de las dos subespecies con los híbridos que forman.
En las zonas híbridas el potencial de selección en contra de la hibridación puede cambiar con el curso del tiempo. Así que en teoría el éxito reproductivo de los híbridos puede aumentar o disminuir con el tiempo y ello puede afectar las tasas de introgresión y el destino a largo plazo de la zona híbrida y los taxones que interaccionan. La hibridación extensiva y el retrocruce podrían resultar en una alta proporción de individuos de ancestría mezclada, lo que se conoce como enjambre híbrido (“Hybrid swarm”) (Rhymer & Simberloff 1996, Dukes & Mooney 1999, Allendorf et al. 2001). En algunas localidades de esta zona de hibridación la proporción de híbridos es mucho mayor a la de los parentales (M.J. Bedoya, en prep.), lo cual sugiere que se podría estar presentando esta situación. En estas condiciones, una gran proporción de individuos de ancestro mezclado pueden producir descendencias más exitosas que la F1 entre los parentales puros, de tal modo que facilita aún más la fusión de los genomas (Barton & Hewitt 1985, Butlin 1987, Kelly & Noor 1996).
En conclusión, los patrones morfológicos observados en el presente estudio, las observaciones de parejas mixtas (M.J. Bedoya, en prep.) y la evidencia molecular previa (Gonzáles 2009, Ocampo 2009) indican que se presenta un proceso de hibridación entre las subespecies de R. flammigerus. Adicionalmente, los resultados sugieren la existencia de un proceso de introgresión genética como resultado de la interacción entre individuos de las dos subespecies con los híbridos que forman. Este proceso puede amenazar la integridad de estas subespecies, una de las cuales es de distribución restringida y endémica para Colombia. La existencia de poblaciones distintas genéticamente, es uno de los principales componentes de la variación en una especie, y para proteger esta ariación se deben conservar diferentes poblaciones, ya sea que las diferencias entre ellas sean o no adaptativas (Rohwer & Wood 1998). Por lo tanto, el estudio de esta zona híbrida, como el de otras, es interesante desde el punto de vista de la biología de la conservación (Gill 1997) y provee oportunidades inusuales para examinar una variedad de procesos evolutivos que están relacionados con la variación geográfica y la evolución de caracteres (Hewitt 1988, Barton & Hewitt 1985, Harrison 1993).
Agradecimientos
Agradecemos al Programa de Jóvenes Investigadores e Innovadores “VIRGINIA GUTIÉRREZ DE PINEDA” de COLCIENCIAS por financiar parte del trabajo de campo. A Fernando Rondón, Fanny Lorena Gonzáles, Isabel Cristina Ocampo, Julio Cesar Osorio y Manuel Sánchez por su apoyo en el trabajo de campo. Al grupo de investigación en Ecología animal de la Universidad del Valle.
Cuando dos taxones, ecológica o filogenéticamente similares, coexisten; estos pueden diferir solo cuando coexisten (en simpatría) o diferir tanto cuando coexisten como cuando están separados (en alopatría). El primer patrón sugiere que la competencia podría generar una selección para la evolución de fenotipos divergentes en simpatría, lo cual se conoce como desplazamiento de caracteres (Brown & Wilson 1956, Grant & Grant 2006). El segundo patrón sugiere que la divergencia se originó en alopatría, antes que los taxones coexistieran, como resultado de condiciones ambientales diferentes y que esta divergencia facilitó la coexistencia en simpatría (Grant 1972, Thompson 1994). Alternativamente, si los taxones no difieren en simpatría pero sí en alopatría, este patrón puede sugerir que se presenta hibridación o convergencia debido a la similitud en condiciones ambientales. Por otra parte, si existe hibridación se espera que se presenten individuos intermedios entre los dos taxones. Sin embargo, los individuos intermedios pueden deberse a hibridación entre los parentales o a variación intraespecífica de uno de los taxa (Parkinson 1979).
De acuerdo con las características del contacto entre las subespecies de Ramphocelus, si están hibridando, podría estar en progreso un proceso de introgresión genética (Sibley 1958); flujo de genes entre dos poblaciones diferenciadas, como producto de repetidos eventos de hibridación y retro-cruzamiento (Allendorf et al. 2001). Por lo tanto, gracias al proceso de introgresión genética, la variabilidad mostrada por estas subespecies podría disminuir gradualmente. En este contexto, la subespecie R. f. flammigerus podría verse más afectada por tener una distribución más reducida y ser menos abundante localmente que la población de R. f. icteronotus (Sibley 1958). A largo plazo este proceso podría llevar a la pérdida de laintegridad genética de R. f. flammigerus, el cual es un taxón endémico para Colombia.
El objetivo del presente estudio fue evaluar si existe evidencia morfológica que sugiera hibridación entre las subespecies de R. flammigerus y que pueda explicar el origen de los individuos de coloración intermedia. Para lo cual se identificó el patrón de variación fenotípica, en donde se comparó la morfología de las subespecies, de las poblaciones alopátricas y simpátricas y de los individuos de coloraciones intermedias. Por lo tanto, si las subespecies de R. flammigerus están hibridando se espera que: 1) los individuos de coloraciones intermedias sean intermedios, en cuanto a su morfología, con respecto a las subespecies parentales; 2) los individuos de coloración intermedia sean más similares a las poblaciones simpátricas de las dos subespecies que a las poblaciones alopátricas y 3) que las poblaciones simpátricas de las subespecies sean más similares entre sí
que las poblaciones alopátricas.
Materiales y Métodos
Toma de datos: Desde el 2006 hasta el 2011 se capturaron individuos de Ramphocelus flammigerus, con redes de niebla, en distintas localidades de los Departamentos del Valle del Cauca y Cauca en Colombia. Asimismo, fueron realizados muestreos en 15 localidades: cinco alopátricas para R. f. flammigerus, cinco alopátricas para R. f. icteronotus y cinco zonas simpátricas (Fig. 1). Los individuos capturados fueron clasificados por los autores, en uno de los tres morfos, con base en el patrón de coloración. Por lo tanto, la clasificación fue consistente y basada en el conocimiento de la variación en coloración que se presenta en la zona de estudio.
Por medio de un calibrador digital (Mitutoyo®) se midieron los siguientes caracteres morfológicos en milímetros: longitud del ala, longitud del tarso, longitud del pico (culmen total), alto del pico, comisura (ancho del pico), longitud total y longitud de la cola, estas medidas fueron tomadas siguiendo Baldwin et al. (1931). Algunas de las localidades fueron visitadas en más de una ocasión (Zelandia: siete, Atuncela: cinco, Bitaco: cinco, Caloto: dos, La Elvira: dos, Isla Palma: dos) por lo tanto, todos los individuos capturados fueron marcados con anillos de colores para evitar considerar datos de recapturas en los análisis.
Para determinar si los individuos de coloraciones intermedias son intermedios en morfología con respecto a las poblaciones parentales, se realizó un análisis discriminante, en donde se consideran tres grupos (R. f. flammigerus, R. f. icteronotus e individuos intermedios). Adicionalmente, se realizó un análisis discriminante con los individuos clasificados en cinco grupos de acuerdo con el morfo y la distribución (R f. flammigerus alopátricos, R. f. flammigerus simpátricos, individuos de coloraciones intermedias, R. f. icterontus simpátricos y R. f. icteronotus alopátricos). Con base en el resultado de este análisis se determinó: 1) si se presenta una mayor similitud entre las poblaciones simpátricas y los individuos de coloraciones intermedias con respecto a las poblaciones parentales y 2) si se presenta una mayor similitud entre las poblaciones simpátricas de ambas subespecies que entre sus poblaciones alopátricas. En los análisis discriminantes se consideraron todas las medidas morfológicas y se realizaron validaciones cruzadas, y se dejó un individuo por fuera al tiempo, para evaluar la confiabilidad de los resultados. Esta validación consiste en estimar la función discriminante en el cual se deja fuera una observación, y luego utilizar la regla para clasificar la observación. Posteriormente, se evaluó la diferenciación morfológica entre los grupos, para los dos análisis, y se tomó en consideración las dos primeras funciones discriminantes; se realizó la comparación de las distancias cuadradas de Mahalanobis entre los grupos, y se tomó como referencia los centroides de cada grupo para el cálculo de las distancias.
Las comparaciones entre los grupos se realizaron con base en la relación logarítmica (Log-ratio), la cual es una medida del efecto del tamaño “Effect size” (ES) y por lo tanto es independiente de los tamaños de muestra de los grupos que se están comparando. Esta medida relacionó las distancias intragrupo (entre los individuos de un grupo y su centroide) con las distancias entre grupos (entre los individuos de un grupo y los centroides de los otros grupos) de la siguiente forma (Hedges et al. 1999):
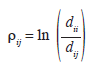
donde ρij es la relación logarítmica entre los grupos i y j medida desde el centroide del grupo i; ρii es la distancia cuadrada de Mahalanobis promedio desde el centroide i hasta los individuos del mismo grupo y dij es la distancia desde el centroide i hasta los individuos del grupo j. Por lo tanto, esta medida permite estimar la magnitud de la diferencia morfológica entre los dos grupos considerados, sin incluir el efecto de las diferencias en los tamaños de las muestras de los grupos comparados. La Varianza de la relación logaritmo fue obtenida a partir del método delta (Bolker 2008) como:
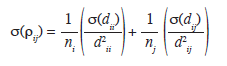
σ(ρij) es la varianza de la relación logarítmicaentre los grupos i y j medidos desde el centroide del grupo i: σ(dii) es la varianza de las distancia cuadradas de Mahalanobis de los individuos del grupo i hacia el centroide del grupo i; σ(dij) es la varianza de las distancias cuadradas de Mahalanobis de los individuos del grupo i hacia el centroide del grupo j, dii es la distancia cuadrada de Mahalanobis promedio desde el centroide i hasta los individuos del mismo grupo, dij es la distancia desde el centroide i hasta los individuos del grupo j, y ni es el número de individuos del grupo i. Para evaluar si las diferencias en morfología entre los grupos fueron significativas, se calcularon intervalos de confianza del 95% con base en los valores de la relación logarítmica y su varianza. En caso de no presentarse diferenciación morfológica significativa entre dos grupos, los intervalos de confianza para la relación logarítmica deben incluir el valor cero; pues ln(1)=0. Consecuentemente, se presenta una mayor diferencia morfológica a medida que el valor absoluto de la relación logarítmica se aleja de cero y su intervalo de confianza no incluye este valor. Los análisis discriminantes fueron realizados por medio del Software SPSS® 15.0 para Windows (SPSS 2006).
Resultados
Después de descartar los individuos juveniles, inusualmente pequeños, se analizaron un total de 112 individuos. De los cuales 20 correspondieron a R. f. flammigerus (12 de poblaciones simpátricas y ocho de poblaciones alopátricas), 46 correspondieron a los individuos de coloraciones intermedias y 46 a la subespecie R. f. icteronotus (27 de zonas alopátricas y 19 de zonas simpátricas).
Las dos primeras funciones del análisis discriminante contienen el 84% de la variación en las mediciones y diferencian morfológicamente a las dos subespecies entre sí, mientras que, los individuos intermedios presentan un amplio traslape con éstas (Fig. 2). El 65.2% de los individuos fueron correctamente clasificados de acuerdo con la clasificación a priori basada en el agrupamiento inicial; 14 de los 20 (70.0%) individuos de R. f. flammigerus, 27 de los 46 (58.7%) de coloraciones intermedias y 32 de los 46 (69.6%) de R. f. icteronotus. Por otra parte, con el test de validación cruzada fueron clasificados correctamente el 58.9 % de los individuos. El principal aporte en la diferenciación entre los tres grupos fue la longitud de la cola (Carga del factor=-0.097, Lambda de Wilks=0.363, F(14,206)=6.94, p<0.0014) y la comisura (Carga del factor=-0.76, Lambda de Wilks=0.597, F(14,206)=3.39, p<0.037) para la primera función discriminante, mientras que, para la segunda función discriminante fue la longitud total (Carga del factor=0.12, Lambda de Wilks=0.649, F(14,206)=8.21, p<0.0005). De acuerdo con esto, los individuos de R. f. icteronotus son de menor tamaño, los individuos de R. f. flammigerus presentan colas de mayor longitud y los individuos de coloraciones intermedias presentaron las comisuras de menor longitud (Cuadro 1). Adicionalmente, las poblaciones híbridas son similares a R. f. icteronotus en cuanto a la longitud de la cola y similares en tamaño con R. f. flammigerus.
Ahora bien, se presentan diferencias morfológicas significativas entre los tres grupos (individuos intermedios y las dos subespecies), pues los intervalos de confianza del 95% para las relaciones logarítmicas no incluyeron cero (Fig. 3). Además, existe una tendencia hacia un menor grado de diferenciación (relaciones logarítmicas más cercanas a cero) entre los individuos de coloraciones intermedias y ambas subespecies (ρII–ρRF=-0.24±0.15, ρII–ρRI=-0.19±0.09) que entre los individuos de las dos subespecies (ρRF–ρRI=-0.40±0.14).
Con base en las dos primeras funciones del análisis discriminante, que explican el 88% de la variación en las mediciones, se observa que las poblaciones alopátricas se diferencian morfológicamente entre sí, mientras que los individuos de las poblaciones simpátricas se mezclan con los individuos de coloraciones intermedias (Fig. 4). El 54.5% de los individuos fueron correctamente clasificados de acuerdo con la clasificación a priori basada en el agrupamiento de las medidas: cinco de los ocho (62.5%) individuos de las poblaciones simpátricas de R. f. flammigerus, cuatro de los 12 (33.3%) individuos de sus poblaciones alopátricas, 24 de los 46 (52.2%) individuos de las coloraciones intermedias, diez de los 19 (52.6%) individuos de poblaciones simpátricas de R. f. icteronotus y 18 de los 27 (66.7%) individuos de sus poblaciones alopátricas. Por otra parte, con el test de validación cruzada fueron clasificados correctamente el 42.9% de los individuos. El principal aporte en la diferenciación observada entre las poblaciones se debe a las variables longitud total (Carga del factor=0.62, Lambda de Wilks=0.505, F(28,365)=4.06, p>0.004) y comisura (Carga del factor=-0.56, Lambda de Wilks=0.51, F(28,365)= 4.73, p>0.002) para la primera función discriminante. Por otra parte, la longitud de la cola (Carga del factor=-0.61, Lambda de Wilks=0.52, F(28,365)= 4.73 y p>0.001) es la variable que más aporta a la diferenciación sobre la segunda función discriminante.
Con base en los intervalos de confianza de 95% para las relaciones logarítmicas se presenta una diferenciación entre los individuos intermedios y las poblaciones, alopátricas y simpátricas, de las dos subespecies (Fig. 5). Adicionalmente, hay una tendencia hacia una menor diferenciación morfológica entre las poblaciones simpátricas y los individuos de coloraciones intermedias (ρII–ρFS=-0.25±0.20, ρII–ρIS=-0.22±0.12) que entre los individuos de coloraciones intermedias y las poblaciones alopátricas (ρII–ρFA=-0.63±0.21, ρII–ρIA=- 0.38±0.07). Por otra parte, no se presentan diferencias morfológicas entre las poblaciones simpátricas (ρFS–ρIS=-0.14±0.22), mientras si se presentan diferencias entre las poblaciones alopátricas (ρFA–ρIA=-0.75±0.23).
Discusión
Los resultados indican que los individuos intermedios tienden a presentar una morfología intermedia entre las subespecies y a ser morfológicamente más similares a los individuos de las poblaciones simpátricas que a los de las poblaciones alopátricas; y que se presenta diferencia morfológica entre las poblaciones alopátricas pero no entre las poblaciones simpátricas de las subespecies. Por lo tanto, el análisis de la variación morfológica apoya la hipótesis de hibridación pues los resultados encontrados están de acuerdo con las predicciones derivadas de esta. Adicionalmente, la mayor similitud entre las poblaciones simpátricas de las subespecies podría indicar que se presenta un proceso de introgresión genética entre estas dos subespecies previamente aisladas.
Sibley en 1958, con base en la caracterización de la transición fenotípica a través de la zona de contacto y en la cuantificación de fenotipos, concluyó que aparentemente no hay barrera genética entre estas subespecies y que por lo tanto los individuos de coloración intermedia son híbridos. Sin embargo, Plath (1945) y Test (1942) observaron, en cautiverio, que la rabadilla de los machos de R. f. flammigerus antes de su primera muda post-nupcial era de color naranja-rojizo (como el de una hembra típica de flammigerus) y después adquieren una rabadilla con la coloración de un macho típico (escarlata brillante). Estos machos juveniles pueden ser más pequeños que los adultos de esta subespecie y más grandes que los adultos de R. f. icteronotus, y por tanto intermedios en tamaño entre las dos subespecies, como se esperaría en caso de hibridación. En las colecciones de la Universidad del Valle y del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia, algunos de los individuos catalogados como híbridos corresponden a juveniles con plumaje en transición (especialmente machos) lo cual indica que existe la posibilidad de que los individuos catalogados como híbridos son juveniles de la subespecie R. f. flammigerus. Sin embargo, durante el muestreo realizado no se encontraron individuos, adultos o juveniles, de coloraciones intermedias en localidades por fuera de la zona de contacto; lo cual sugiere que la hipótesis de variación en color debido a la edad de los individuos no está soportada con base en la muestra obtenida en el presente estudio.
Alternativamente, en caso de no presentarse hibridación se esperaría que en las áreas donde coexisten las dos subespecies, éstas se diferencien más morfológicamente que cuando están separadas (Schluter 2000, Dayan & Simberloff 2005). Esto se debe a que cuando dos taxones muy similares coexisten, se espera que se acentúen las diferencias a nivel de su morfología, comportamiento y ecología para reducir la competencia y permitir la coexistencia (Brown & Wilson 1956, Grant & Grant 2006). A este patrón en el cual las poblaciones simpátricas de dos taxones relacionados muestran mayor diferenciación, en comparación con el grado de diferenciación que exhiben las poblaciones alopátricas, se ha denominado desplazamiento de caracteres (Brown & Wilson 1956). En el caso de R. f. flammigerus, los resultados demuestran que no se presenta el patrón característico del desplazamiento de caracteres, como se esperaría después del establecimiento del contacto secundario en respuesta a competencia.
Con base en las comparaciones morfológicas, los individuos intermedios presentaron distancias menores con respecto a cada subespecie en comparación con las distancias que se presentaron entre las dos subespecies. Por lo tanto, con estos resultados hay una evidente tendencia a que los individuos de coloraciones intermedias son morfológicamente intermedios con respecto a las subespecies, aunque se presente un traslape marcado de los individuos de coloraciones intermedias con las dos subespecies. Sin embargo, es importante tener en cuenta que en muchos casos la combinación de diferentes genomas proporciona una alta varianza en la población de híbridos, por lo cual se presentan individuos intermedios e individuos que se traslapan con los grupos parentales (West 1962, Anderson & Daugherty 1974, Bookstein et al. 1985). Las poblaciones de coloraciones intermedias fueron más similares a la subespecie R. f. icteronotus en cuanto a la longitud de la cola y la comisura y más similares en tamaño a R. f. flammigerus. Por lo tanto, esto sugiere que se podría presentar una expresión diferencial de los caracteres parentales en los individuos de coloraciones intermedias y lo cual puede explicar en parte el grado de variación morfológica exhibida. Es de destacar que a pesar de la variación, los resultados de las comparaciones demuestran que las tres poblaciones se diferencian morfológicamente entre ellas.
El mayor grado de similitud entre las poblaciones simpátricas de ambas subespecies, que entre sus correspondientes poblaciones alopátricas, y entre los individuos de coloraciones intermedias y las poblaciones simpátricas se pueden dar gracias al flujo de genes entre las dos formas como producto de repetidos eventos de hibridación y retrocruzamiento. Alternativamente, este patrón podría presentarse a causa de una convergencia morfológica, la cual se presenta como una respuesta similar a las condiciones ambientales de las zonas de simpatría. Sin embargo, la observación de parejas mixtas (M.J. Bedoya, en prep.) y de individuos intermedios solo en las localidades de simpatría, apoyan la hipótesis de hibridación. También, estudios moleculares previos, basados en la comparación de secuencias de ADN mitocondrial (González 2009) y microsatélites nucleares (Ocampo 2009), han demostrado que ambas subespecies presentan alelos compartidos y una alta similitud en las secuencias en la zona de estudio. Por lo tanto, existe evidencia morfológica y una aproximación molecular de un proceso de introgresión genética como ha sido planteado desde 1958 por Sibley.
Con base en los resultados obtenidos se observa una diferencia significativa en morfología entre las poblaciones alopátricas y simpátricas de R. f. Flammigerus, pero no entre las poblaciones de R. f. icteronotus. Por lo tanto, de acuerdo con lo esperado, hay evidencia para un mayor grado de introgresión en R. f. flammigerus. Sin embargo, para predecir el resultado de un proceso de hibridación hay que considerar que la tasa en la cual ocurre la introgresión, dependería tanto de la frecuencia de la hibridación, como del éxito de los híbridos y los retrocruces (Borge et al. 2005). Además, la extensión de este proceso depende de la zona en la cual ocurra el retrocruce y del tiempo de expansión de la zona híbrida (Borge et al. 2005). En la localidad de Zelandia se ha encontrado que la selección de pareja por parte de las hembras es proporcional a la abundancia de los machos de los tres morfos (M. J. Bedoya, en prep.). Por lo tanto, es probable que las frecuencias relativas de los fenotipos en las zonas de simpatría, al influenciar las frecuencias de retrocruces entre las poblaciones parentales con los híbridos, también sean un determinante del resultado del proceso de hibridación. De esta forma, la dirección del proceso de introgresión dependería de las condiciones locales de los sitios en los cuales interaccionan los individuos de las dos subespecies con los híbridos que forman.
En las zonas híbridas el potencial de selección en contra de la hibridación puede cambiar con el curso del tiempo. Así que en teoría el éxito reproductivo de los híbridos puede aumentar o disminuir con el tiempo y ello puede afectar las tasas de introgresión y el destino a largo plazo de la zona híbrida y los taxones que interaccionan. La hibridación extensiva y el retrocruce podrían resultar en una alta proporción de individuos de ancestría mezclada, lo que se conoce como enjambre híbrido (“Hybrid swarm”) (Rhymer & Simberloff 1996, Dukes & Mooney 1999, Allendorf et al. 2001). En algunas localidades de esta zona de hibridación la proporción de híbridos es mucho mayor a la de los parentales (M.J. Bedoya, en prep.), lo cual sugiere que se podría estar presentando esta situación. En estas condiciones, una gran proporción de individuos de ancestro mezclado pueden producir descendencias más exitosas que la F1 entre los parentales puros, de tal modo que facilita aún más la fusión de los genomas (Barton & Hewitt 1985, Butlin 1987, Kelly & Noor 1996).
En conclusión, los patrones morfológicos observados en el presente estudio, las observaciones de parejas mixtas (M.J. Bedoya, en prep.) y la evidencia molecular previa (Gonzáles 2009, Ocampo 2009) indican que se presenta un proceso de hibridación entre las subespecies de R. flammigerus. Adicionalmente, los resultados sugieren la existencia de un proceso de introgresión genética como resultado de la interacción entre individuos de las dos subespecies con los híbridos que forman. Este proceso puede amenazar la integridad de estas subespecies, una de las cuales es de distribución restringida y endémica para Colombia. La existencia de poblaciones distintas genéticamente, es uno de los principales componentes de la variación en una especie, y para proteger esta ariación se deben conservar diferentes poblaciones, ya sea que las diferencias entre ellas sean o no adaptativas (Rohwer & Wood 1998). Por lo tanto, el estudio de esta zona híbrida, como el de otras, es interesante desde el punto de vista de la biología de la conservación (Gill 1997) y provee oportunidades inusuales para examinar una variedad de procesos evolutivos que están relacionados con la variación geográfica y la evolución de caracteres (Hewitt 1988, Barton & Hewitt 1985, Harrison 1993).
Agradecimientos
Agradecemos al Programa de Jóvenes Investigadores e Innovadores “VIRGINIA GUTIÉRREZ DE PINEDA” de COLCIENCIAS por financiar parte del trabajo de campo. A Fernando Rondón, Fanny Lorena Gonzáles, Isabel Cristina Ocampo, Julio Cesar Osorio y Manuel Sánchez por su apoyo en el trabajo de campo. Al grupo de investigación en Ecología animal de la Universidad del Valle.
Referencias
Allendorf, F.W., R.F. Leary, P. Spruell & J.K. Wenburg. 2001. The problems with hybrids: Setting conservation guidelines. Trends. Ecol. Evol. 16: 613-622. [ Links ]
Anderson, B.W. & R.J. Daugherty. 1974. Characteristics and reproductive biology of grosbeaks (Pheucticus) in the hybrid zone in South Dakota. Wilson. Bull. 86: 1-11. [ Links ]
Baldwin, S.P., H.C. Oberholser & L.G. Worley. 1931. Measurements of birds. Scientific Publication Cleveland Museum of Natural History II. Oxford, Mississipi, EEUU. [ Links ]
Barton, N.H. & G.M. Hewitt. 1985. Analysis of hybrid zones. Annu. Rev. Ecol. Systemat. 16: 113-148. [ Links ]
Bleeker, W. & H. Hurka. 2001. Introgressive hybridization in Rorippa (Brassicaceae): gene flow and its consequences in natural and anthropogenic habitats. Mol. Ecol. 10: 2013-2022. [ Links ]
Bolker, B.M. 2008. Ecological models and data in R. Princeton University, Princeton, Nueva Jersey, EEUU. [ Links ]
Bookstein, F.L., B. Chernoff, R.L. Elder, J.M. Humphries, G.R. Smith & R.E Strauss. 1985. Morphometrics in evolutionary biology: The geometry of size and Shape Change, with example from fishes. Natl. Acad. Sci. Phila. Spec. Publ. 15: 1-277. [ Links ]
Borge, T., K. Lindroos, P. Nadvornik, A.C. Syvanën & G.P. Saetre. 2005. Amount of introgression in flycatcher hybrid zones reflects regional differences in pre and post-zygotic barriers to gene exchange. J. Evol. Biol. 18: 1416-1424. [ Links ]
Brown, W.L. & E.O. Wilson. 1956. Character displacement. Syst. Zool. 5: 49-64. [ Links ]
Butlin, R. 1987. Speciation by reinforcement. Trends. Ecol. Evol. 2: 8-13. [ Links ]
Dayan, T. & D. Simberloff. 2005. Ecological and community- wide character displacement: The next generation. Ecol. Lett. 8: 875-894. [ Links ]
Dukes, J.S. & H.A. Mooney. 1999. Does global change increase the success of biological invaders? Trends. Ecol. Evol. 14: 135-139. [ Links ]
Gill, F.B. 1997. Local cytonuclear extinction in the goldenwinged warbler. Evolution 51: 519-523. [ Links ]
Grant, P.R. 1972. Convergent and divergent character displacement. Biol. J. Linn. Soc. 4: 39-68. [ Links ]
Grant, P.R. & B.R. Grant. 2006. Evolution of Character Displacement in Darwin’s Finches. Science 313: 224-224. [ Links ]
González, Z.F. 2009. Caracterización genética de las subespecies de Ramphocelus flammigerus (Aves:Thraupidae) en el Valle del Cauca y Cauca, basado en secuencias mitocondrilaes de ADN y marcadores moleculares microsatélites. Tesis de Bachillerato, Universidad del Valle, Cali, Colombia. [ Links ]
Harrison, R.G. 1993. Hybrid zones and the evolutionary process. Oxford University, Oxford, Nueva York, EEUU. [ Links ]
Hewitt, G. 1988. Hybrid zones: natural laboratories for evolution studies. Trends. Ecol. Evol. 3: 158-166. [ Links ]
Hedges, L.V., J. Gurevitch & P.S. Curtis. 1999. The metaanalysis of response ratios in experimental ecology. Ecology 80: 1150-1156. [ Links ]
Jardine, W. & D.J. Selby. 1833. Illustrations of ornithology 3: 9. [ Links ]
Kelly, J.K. & M.A.F. Noor. 1996. Speciation by reinforcement: A model derived from studies of Drosophila. Genetics 143: 1485-97. [ Links ]
Lafresnaye, F. 1853. Sur le genre Ramphocelus, Desm, et trois nouvelles especes qui lui appartiennent. Rev. et Jiagr. 5: 242-246. [ Links ]
Neuffer, B., A. Auge, H. Mesch, U. Amarell & R. Brandl. 1999. Spread of violets in polluted forest: morphological and molecular evidence for the ecological importance of interspecific hybridization. Mol. Ecol. 8: 365-377. [ Links ]
Ocampo, I. 2009. Caracterización de las subespecies de Ramphocelus flammigerus basados en marcadores moleculares microsatélites. Tesis de Bachillerato, Universidad del Valle, Cali, Colombia. [ Links ]
Parkinson, A. 1979. Morphologic variation and hybridization in Myotis yumanensis sociabilis and Myotis lucifugus carissima. J. Mammal. 60: 489-504. [ Links ]
Plath, K. 1945. Color Change in Ramphocelus flammigerus. Auk 62: 304. [ Links ]
Rhymer, J.M. & D. Simberloff. 1996. Extinction by hybridization and introgression. Annu. Rev. Ecol. Systemat. 27: 83-109. [ Links ]
Rohwer, S. & C. Wood. 1998. Three hybrid zones between Hermit and Townsend’s warblers in Washington and Oregon. Auk 115: 284-310. [ Links ]
Schluter, D. 2000. Ecological character displacement in adaptive radiation. Am. Nat. 156: S14-S16. [ Links ]
Sibley, C.G. 1958. Hybridization in some Colombian tanagers, avian genus Ramphocelus. Proc. Am. Phil. Soc.102: 448- 453. [ Links ]
SSS, I. 2006. SPSS para windows (Versión 15.0.1). Chicago: Copyright © SPSS Inc, EEUU. [ Links ]
Test, F.H. 1942. The nature of the red, yellow, and orange pigments in woodpeckers of the genus Colaptes. Univ. Calif. Publ. Zool. 46: 371-390. [ Links ]
Thompson, J.N. 1994. The coevolutionary process. Chicago University, Chicago, Illinois, EEUU. [ Links ]
West, D.A. 1962. Hybridization in grosbeaks (Pheucticus) of the great plains. Auk 79: 399-424. [ Links ]
*Correspondencia a: M. Juliana Bedoya; Grupo de Investigación en Ecología Animal. Departamento de Biología. A.A. 35260. Universidad del Valle, Cali, Colombia; julianabedoya85@yahoo.com
Oscar E. Murillo G.; Grupo de Investigación en Ecología Animal. Departamento de Biología. A.A. 35260. Universidad del Valle, Cali, Colombia; julianabedoya85@yahoo.com. School of Natural Resources and Environment & Wildlife Ecology and Conservation Department, University of Florida, Gainesville, United States; oscar.murillo@correounivalle.edu.co
1. Grupo de Investigación en Ecología Animal. Departamento de Biología. A.A. 35260. Universidad del Valle, Cali, Colombia; julianabedoya85@yahoo.com
2. School of Natural Resources and Environment & Wildlife Ecology and Conservation Department, University of Florida, Gainesville, United States; oscar.murillo@correounivalle.edu.co
Allendorf, F.W., R.F. Leary, P. Spruell & J.K. Wenburg. 2001. The problems with hybrids: Setting conservation guidelines. Trends. Ecol. Evol. 16: 613-622. [ Links ]
Anderson, B.W. & R.J. Daugherty. 1974. Characteristics and reproductive biology of grosbeaks (Pheucticus) in the hybrid zone in South Dakota. Wilson. Bull. 86: 1-11. [ Links ]
Baldwin, S.P., H.C. Oberholser & L.G. Worley. 1931. Measurements of birds. Scientific Publication Cleveland Museum of Natural History II. Oxford, Mississipi, EEUU. [ Links ]
Barton, N.H. & G.M. Hewitt. 1985. Analysis of hybrid zones. Annu. Rev. Ecol. Systemat. 16: 113-148. [ Links ]
Bleeker, W. & H. Hurka. 2001. Introgressive hybridization in Rorippa (Brassicaceae): gene flow and its consequences in natural and anthropogenic habitats. Mol. Ecol. 10: 2013-2022. [ Links ]
Bolker, B.M. 2008. Ecological models and data in R. Princeton University, Princeton, Nueva Jersey, EEUU. [ Links ]
Bookstein, F.L., B. Chernoff, R.L. Elder, J.M. Humphries, G.R. Smith & R.E Strauss. 1985. Morphometrics in evolutionary biology: The geometry of size and Shape Change, with example from fishes. Natl. Acad. Sci. Phila. Spec. Publ. 15: 1-277. [ Links ]
Borge, T., K. Lindroos, P. Nadvornik, A.C. Syvanën & G.P. Saetre. 2005. Amount of introgression in flycatcher hybrid zones reflects regional differences in pre and post-zygotic barriers to gene exchange. J. Evol. Biol. 18: 1416-1424. [ Links ]
Brown, W.L. & E.O. Wilson. 1956. Character displacement. Syst. Zool. 5: 49-64. [ Links ]
Butlin, R. 1987. Speciation by reinforcement. Trends. Ecol. Evol. 2: 8-13. [ Links ]
Dayan, T. & D. Simberloff. 2005. Ecological and community- wide character displacement: The next generation. Ecol. Lett. 8: 875-894. [ Links ]
Dukes, J.S. & H.A. Mooney. 1999. Does global change increase the success of biological invaders? Trends. Ecol. Evol. 14: 135-139. [ Links ]
Gill, F.B. 1997. Local cytonuclear extinction in the goldenwinged warbler. Evolution 51: 519-523. [ Links ]
Grant, P.R. 1972. Convergent and divergent character displacement. Biol. J. Linn. Soc. 4: 39-68. [ Links ]
Grant, P.R. & B.R. Grant. 2006. Evolution of Character Displacement in Darwin’s Finches. Science 313: 224-224. [ Links ]
González, Z.F. 2009. Caracterización genética de las subespecies de Ramphocelus flammigerus (Aves:Thraupidae) en el Valle del Cauca y Cauca, basado en secuencias mitocondrilaes de ADN y marcadores moleculares microsatélites. Tesis de Bachillerato, Universidad del Valle, Cali, Colombia. [ Links ]
Harrison, R.G. 1993. Hybrid zones and the evolutionary process. Oxford University, Oxford, Nueva York, EEUU. [ Links ]
Hewitt, G. 1988. Hybrid zones: natural laboratories for evolution studies. Trends. Ecol. Evol. 3: 158-166. [ Links ]
Hedges, L.V., J. Gurevitch & P.S. Curtis. 1999. The metaanalysis of response ratios in experimental ecology. Ecology 80: 1150-1156. [ Links ]
Jardine, W. & D.J. Selby. 1833. Illustrations of ornithology 3: 9. [ Links ]
Kelly, J.K. & M.A.F. Noor. 1996. Speciation by reinforcement: A model derived from studies of Drosophila. Genetics 143: 1485-97. [ Links ]
Lafresnaye, F. 1853. Sur le genre Ramphocelus, Desm, et trois nouvelles especes qui lui appartiennent. Rev. et Jiagr. 5: 242-246. [ Links ]
Neuffer, B., A. Auge, H. Mesch, U. Amarell & R. Brandl. 1999. Spread of violets in polluted forest: morphological and molecular evidence for the ecological importance of interspecific hybridization. Mol. Ecol. 8: 365-377. [ Links ]
Ocampo, I. 2009. Caracterización de las subespecies de Ramphocelus flammigerus basados en marcadores moleculares microsatélites. Tesis de Bachillerato, Universidad del Valle, Cali, Colombia. [ Links ]
Parkinson, A. 1979. Morphologic variation and hybridization in Myotis yumanensis sociabilis and Myotis lucifugus carissima. J. Mammal. 60: 489-504. [ Links ]
Plath, K. 1945. Color Change in Ramphocelus flammigerus. Auk 62: 304. [ Links ]
Rhymer, J.M. & D. Simberloff. 1996. Extinction by hybridization and introgression. Annu. Rev. Ecol. Systemat. 27: 83-109. [ Links ]
Rohwer, S. & C. Wood. 1998. Three hybrid zones between Hermit and Townsend’s warblers in Washington and Oregon. Auk 115: 284-310. [ Links ]
Schluter, D. 2000. Ecological character displacement in adaptive radiation. Am. Nat. 156: S14-S16. [ Links ]
Sibley, C.G. 1958. Hybridization in some Colombian tanagers, avian genus Ramphocelus. Proc. Am. Phil. Soc.102: 448- 453. [ Links ]
SSS, I. 2006. SPSS para windows (Versión 15.0.1). Chicago: Copyright © SPSS Inc, EEUU. [ Links ]
Test, F.H. 1942. The nature of the red, yellow, and orange pigments in woodpeckers of the genus Colaptes. Univ. Calif. Publ. Zool. 46: 371-390. [ Links ]
Thompson, J.N. 1994. The coevolutionary process. Chicago University, Chicago, Illinois, EEUU. [ Links ]
West, D.A. 1962. Hybridization in grosbeaks (Pheucticus) of the great plains. Auk 79: 399-424. [ Links ]
*Correspondencia a: M. Juliana Bedoya; Grupo de Investigación en Ecología Animal. Departamento de Biología. A.A. 35260. Universidad del Valle, Cali, Colombia; julianabedoya85@yahoo.com
Oscar E. Murillo G.; Grupo de Investigación en Ecología Animal. Departamento de Biología. A.A. 35260. Universidad del Valle, Cali, Colombia; julianabedoya85@yahoo.com. School of Natural Resources and Environment & Wildlife Ecology and Conservation Department, University of Florida, Gainesville, United States; oscar.murillo@correounivalle.edu.co
1. Grupo de Investigación en Ecología Animal. Departamento de Biología. A.A. 35260. Universidad del Valle, Cali, Colombia; julianabedoya85@yahoo.com
2. School of Natural Resources and Environment & Wildlife Ecology and Conservation Department, University of Florida, Gainesville, United States; oscar.murillo@correounivalle.edu.co
Recibido 01-III-2011. Corregido 26-VII-2011. Aceptado 23-VIII-2011.














