Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.59 n.1 San José Mar. 2011
Variación en la actividad microbiana por cambio de uso en suelos en sabanas, Llanos Orientales, Venezuela
1. Universidad de Oriente, Laboratorio de Investigaciones Biológicas, Apdo. 1231, Puerto La Cruz, Venezuela; irmagomez52@hotmail.com
2. Instituto Venezolano de Investigaciones Científicas Centro de Ecología, Apdo. 21827, Caracas 1020-A, Venezuela; jpaolini@ivic.ve
Dirección para correspondencia
Abstract
Soil microbial activity variation after land use changes in savannah, Llanos Orientales, Venezuela. In West plains of Venezuela, the traditional land use of the Trachypogon savannah, has been the extensive grazing. The pressure over these savannahs to obtain a major animal productivity has stimulated the introduction of exotic forage plants, such as Brachiaria brizantha and Andropogon gayanus. In spite that great savannah extensions have been subject to this land use change, information about the effect that pastures and grazing activity have on microbial activity in these soils is scarce. So the objective of this study was to determine the impact that the extensive grazing and cover substitution have on microbial activity. The soil sampling was carried out during the dry and rainy seasons. The employed parameters to determine changes in soil microbial activity were the substrate induced respiration (SIR), basal respiration (BR), the dehydrogenase activity (DHS), the fluorescein diacetate hydrolysis (FDA) and the arginene ammonification (AA). The similarity of the structural soil characteristics studied allows us to infer, that the differences in the microbiological parameters are determined by climatic conditions and soil management. The results show that there is a low microbial activity in these soils. The rainy season caused an increase in all the microbiological parameters determined. B. brizantha made a greater contribution to soil carbon and promoted a greater heterotrophic activity. The extensive grazing and the low stocking rate in the West plain savannas did not affect the microbial activity in these soils. Rev. Biol. Trop. 59 (1): 1-15. Epub 2011 March 01.
Key words: land use change, microbial activity, savannah, temporal variability.
Resumen
En los llanos orientales de Venezuela la forma tradicional de uso de las sabanas de Trachypogon ha sido el pastoreo extensivo. La presión sobre éstas para obtener una mayor productividad animal ha estimulado la introducción de plantas exóticas para forrajes, tales como: Brachiaria brizantha y Andropogon gayanus. A pesar de que grandes extensiones de sabanas están siendo sometidas a este cambio de uso de la tierra, es escasa la información acerca del efecto que estas pasturas y la actividad de pastoreo tienen sobre la actividad microbiana en el suelo; por lo que el objetivo del presente estudio fue determinar el impacto que el pastoreo extensivo y la substitución de la cobertura nativa tienen sobre la actividad microbiana en estos suelos. El muestreo fue llevado a cabo durante las temporadas de sequía y lluvias. Los parámetros empleados para determinar cambios en la actividad microbiana fueron la respiración inducida por sustrato (RIS), la respiración basal (RB), la actividad de la deshidrogenasa (DHS), la hidrólisis del diacetato de fluorisceína (DAF) y la amonificación de la arginina (AA). La similitud de las características estructurales de los suelos estudiados nos permite inferir, que las diferencias en los parámetros microbiológicos, están determinadas por las condiciones climáticas y el manejo del suelo. Los resultados muestran que en estos suelos existe una baja actividad microbiana. La temporada lluviosa provocó un incremento en todos los parámetros microbiológicos determinados. B. brizantha hizo un mayor aporte de carbono al suelo y promovió una mayor actividad heterotrófica. El pastoreo extensivo y la baja carga animal en las sabanas de los llanos orientales de Venezuela no afectaron la actividad microbiana del suelo.
Palabras clave: actividad microbiana, cambio de uso de la tierra, sabanas, variabilidad temporal.
La región de los Llanos Venezolanos cubre un área de 260 000km2. La vegetación es típicamente herbácea, dominada por especies de Trachypogon y algunas arbustivas como: Curatella americana, Bowdichia virgiloides y Byrsonima crassifolia (Albornoz et al. 1995). Estas sabanas se caracterizan por poseer suelos de baja fertilidad (Comerma & Chacón 2002) y bioproductividad (1.000g/m2/año), debido al estrés hídrico, físico y nutricional del suelo (San José & Montes 1989) y ocupan el 65% del estado Monagas (De Armas 2005).
Las actividades pecuarias representan el uso más común de la tierra y se utilizan principalmente las especies nativas que tienen baja capacidad de sustentación como fuente de alimentación. Ésta forma tradicional de uso ha estado basada en la ganadería extensiva (San José & Montes 1989) y continua (De Armas 2005) caracterizada por emplear grandes extensiones de pasto natural con una baja carga animal por hectárea (en promedio 0.42UA ha/año). Estas sabanas poseen un recurso forrajero comprometido por su reducida tasa de crecimiento, baja disponibilidad y palatibilidad del forraje (De Armas 2005). Sin embargo, la creciente presión antrópica sobre las mismas para obtener una mayor producción y productividad animal ha conducido a la introducción de gramíneas forrajeras adaptadas tales como Brachiaria brizantha y Andropogon gayanus (Silva et al. 1995). Ambas pasturas son originarias de África tropical y actualmente se encuentran ampliamente distribuidas en diferentes países tropicales. Específicamente, B. brizantha actualmente cubre más de 3 millones de hectáreas en Venezuela y al igual que A. gayanus se considera una forrajera importante en la producción de rumiantes en los Llanos Centrales y Orientales de Venezuela (Farías et al. 1987).
En la actualidad, la mayoría de los estudios realizados en las sabanas de los llanos orientales de Venezuela han estado dirigidos a la productividad animal y al efecto del pastoreo, y las coberturas sobre las características físicas y químicas del suelo, por lo que esta investigación tuvo como objetivo determinar, a través de los parámetros microbiológicos indicadores de cambios en la calidad del suelo, el impacto que estos usos de la tierra tienen sobre la actividad microbiana. Entre los atributos biológicos generalmente utilizados para la determinación de estos cambios destacan la respiración inducida por sustrato (RIS), ya que ésta es proporcional al tamaño de la biomasa microbiana (Anderson & Domsch 1985, Powlson 1994) y es referida como la porción de la biomasa microbiana activa (Hassik 1993), la respiración basal (RB) por ser considerada una medida de la actividad microbiana, la tasa de descomposición de la materia orgánica y de la calidad del carbono en el suelo (Saviozzi et al. 2001), las actividades de las deshidrogenasas (DHS) por ser indicadoras de la actividad microbiana del suelo (Burns 1978) y del estado de oxidación de la materia orgánica en éste (Makoi & Ndakidemi 2008), la hidrólisis del diacetato de fluorisceína (DAF) por constituir una buena estimación de la biomasa microbiana (Adams & Duncan 2001) y la amonificación de la arginina (AA) por ser empleada como un parámetro satisfactorio de la actividad microbiana (Lin & Brookes 1999, Bonde et al. 2001), parámetros que responden rápidamente a los cambios provocados por las condiciones ambientales y las prácticas del manejo del suelo (Brookes 1995).
Materiales y métodos
Sitio de estudio: Las parcelas objeto de estudio (100mx20m) están ubicadas en el estado Monagas, Venezuela y forman parte de los llanos orientales Venezolanos. En ésta se seleccionaron cuatro sitios: 1) una sabana nativa no intervenida ni sujeta a la acción del fuego, ubicada en la finca Sunsunes, Santa Barbara (9°33’ N - 63°39’ W), considerada como testigo, 2) una sabana nativa intervenida por ganado, con un sistema de pastoreo extensivo y continuo, en el cual los animales (en promedio 0.42UA ha/año) permanecen durante ambos períodos climáticos en la misma área. Ésta está localizada en la finca Chaparral, Aguasay (9°29’ N - 63°43’ W), 3), una parcela intervenida con B. brizantha y 4) otra con A. gayanus, ambas ubicadas en el Campo Experimental Santa Bárbara del Instituto Nacional de Investigaciones Agrícolas (INIA) (9°35’ N - 63°36’ W). Estas dos últimas, son parcelas experimentales donde se prueba la introducción y el comportamiento de ambas coberturas. No están sujetas a pastoreo.
El área seleccionada está caracterizada por la existencia de dos períodos climáticos bien definidos: uno de sequía (diciembre a mayo) y otro lluvioso (junio a noviembre), con fuertes lluvias de corta duración. La precipitación anual es de 1 028mm y la temperatura media anual de 27°C (promedio de 10 años).
El suelo de las áreas experimentales corresponde a un Ultisol caracterizado por su baja fertilidad, bien drenado y baja capacidad para retener nutrientes y humedad (Albornoz et al. 1995). En profundidad pueden llegar a tener texturas pesadas (más del 65% de arcilla).
La sabana natural de los sitios objeto de estudio está dominada por especies de Trachypogon con escasos parches de árboles llamados "matas", por lo que reciben el nombre de sabanas inarboladas. Éstas se consideraron como punto de referencia para determinar la existencia de variaciones en la calidad del suelo por efectos de la variabilidad temporal, el manejo del suelo y el pastoreo.
Para el momento de la selección de las áreas de estudio, éstas ya habían sido previamente sometidas, durante 5 años, a procesos de fertilización y encalado al inicio de cada período lluvioso (50kg/ha de P205 en forma de superfosfato triple, 30kg/ha de potasio en forma de K2O y 50kg/ha de urea: además de reabonos con urea (150kg/ha) y aplicación de un encalado anual de 150 a 350kg/ha de CaCO3).
Procedimiento de muestreo: El muestreo del suelo se realizó durante la temporada seca (marzo) y lluviosa (julio). En cada área experimental se establecieron parcelas de 100x20m, en las cuales se demarcaron 3 transectos, cada uno de ellos con 5 puntos de muestreo, de cuya superficie fueron eliminados los restos de vegetación, previo al muestreo. En éstos se tomaron muestras (0-10cm de profundidad) por triplicado con un barreno, las cuales se homogenizaron para formar cinco muestras compuestas por transecto, para un total de 15 por parcela. Éstas se tomaron a humedad de campo, se colocaron en bolsas plásticas para prevenir su secado y se trasladaron refrigeradas hasta el laboratorio. Las muestras fueron cernidas (<2mm) y almacenadas a 4°C hasta la determinación de las propiedades físicas, químicas y los parámetros indicadores de la actividad microbiana correspondiente.
Análisis físico y químico: La distribución del tamaño de las partículas del suelo se determinó por el método hidrométrico de Boyucos (Pla 1983). El carbono orgánico fue determinado por el método de oxidación del dicromato (Walkey & Black 1934) y el carbono hidrosoluble según Sims & Haby 1971). Las bases intercambiables (K, Ca y Mg) se extrajeron con NH4OAc IN, pH 7 (Pratt 1965), su cuantificación se realizó por espectrofotometría de absorción atómica. La escala de interpretación de los valores de los macroelementos fueron comparados con el manual de referencia de Chicco & Godoy (2002). La concentración de P en los extractos se realizó por el método colorimétrico del complejo azul de molibdenoácido ascórbico y el pH fue determinado en una relación suelo: agua (1:2.5).
Parámetros indicadores de actividad microbiana: La respiración inducida por sustrato (RIS) o biomasa microbiana activa se determinó por el método de absorción del CO2 en una trampa de álcali (Stozky 1965). El CO2 liberado en recipientes herméticamente sellados, contenían 50g de las muestras ajustadas con una solución de glucosa al 60% de su capacidad de retención hídrica e incubadas a 22°C, fue atrapado en una solución de NaOH 0.1M y el CO2 absorbido fue precipitado con BaCl2. El NaOH 0.1M remanente fue medido por titulación con HCl 0.1M. Los valores obtenidos fueron expresados en mg de C microbiano (Cmic)/ kg de suelo seco. La respiración basal (RB) se realizó al igual que la RIS, exceptuando la adición de glucosa a las muestras de suelo (Alef & Nannipieri 1995).
La actividad de la deshidrogenasa de los microorganismos del suelo (DHS) se determinó por el método descrito por Casida et al. (1964). El trifenil- tetrazolium cloruro (TTC) fue usado como aceptor artificial de electrones. Las muestras fueron incubadas a 37ºC por 24h en tubos sellados herméticamente y posteriormente extraídas con metanol. El contenido de trifenil formazan (TFF) fue determinado colorimétricamente a 485nm y los resultados se expresaron en μg de TFF/g/24h.
La hidrólisis del diacetato de fluoresceína (DAF) se determinó por el método descrito por Adams & Duncan (2001). Como sustrato se usó una solución de DAF (1 000μg/ml). La mezcla de reacción fue incubada a 30°C por 1h y la fluorisceína extraída fue determinada a 490nm. Los resultados fueron expresados en μg de fluorisceína/g/h.
La amonificación de la arginina (AA) fue determinada según el método descrito por Alef & Kleiner (1986). Una solución de arginina (0.2% en agua) fue empleada como sustrato. Las muestras fueron incubadas por 4h a 37°C y extraídas con KCl (2M). El amonio liberado fue determinado colorimétricamente a 600nm por el método del indofenol (Kandeler & Geber 1988). Los resultados fueron expresados en μg N-NH4+/g/h.
Los datos obtenidos de esta investigación están basados sobre condiciones preestablecidas de fertilización y uso en las áreas de muestreo, con el fin de determinar el impacto que ese manejo del suelo y la variabilidad temporal tienen sobre los parámetros microbiológicos. Para determinar el grado de significación de las diferencias observadas entre los tratamientos, los datos fueron analizados como un diseño completamente al azar con submuestras. Un análisis de varianza de dos vías (ANOVA) fue llevado a cabo para determinar las posibles diferencias provocadas por la variabilidad temporal (sequía/ lluvia) y el manejo del suelo (sabana nativa/ pasturas de B. brizantha y A. gayanus/pastoreo). Como test de comparaciones múltiples se realizó la prueba a posteriori del test de Tamhane (Vinacua 1997). El grado de las diferencias de las medias es significativo al nivel de p<0.05. El paquete estadístico SPSS para Windows fue usado para todos los análisis estadísticos.
Resultados
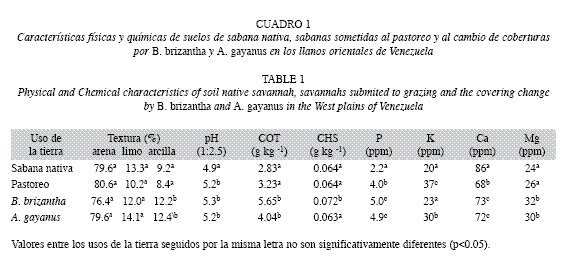
Propiedades físicas y químicas: Los suelos presentaron un elevado contenido de arena (76.4%-80.6%), bajos contenidos de limo (10%-14%) y arcilla (8.4%-12.4%). La sabana nativa presentó el valor más bajo de pH (4.9) y se diferenció significativamente (p<0.01) de aquel registrado en las parcelas sometidas al pastoreo (5.2) y a las coberturas de B. brizantha y A. gayanus (5.2 y 5.3, respectivamente). El P de la sabana nativa (2.2ppm), varió significativamente (p<0.001) del contenido de este elemento en los suelos sometidos a pastoreo (4.0ppm) y a las coberturas de B. brizantha y A. gayanus (5.0 y 4.9ppm, respectivamente). El contenido de las bases intercambiables también fue bajo. El K varió entre 20 y 37ppm, el Ca entre 68 y 173ppm y el Mg entre 24 y 32ppm. La sabana nativa presentó los menores valores de K (20ppm) y Mg (24ppm) (Cuadro 1).
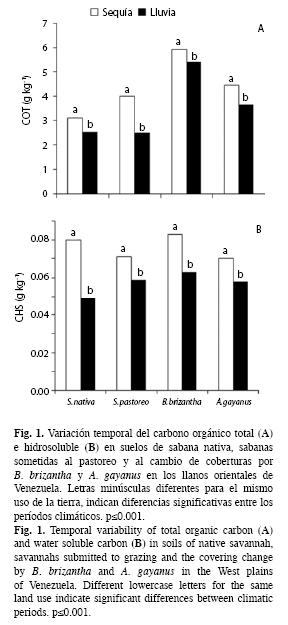
Carbono orgánico total e hidrosoluble: Los resultados reflejan que los suelos de las sabanas de los llanos orientales del Estado Monagas poseen un bajo contenido de carbono orgánico total (COT) e hidrosoluble (CHS). Ambos resultaron afectados en forma significativa (p<0.001) por la temporada climática (Figs. 1A y B). La variación del contenido de COT en la sabana nativa durante las temporadas de sequía y lluvias, respectivamente, fue de 3.09 a 2.52g/kg y en la sabana intervenida con pastoreo de 3.98 a 2.50g/kg; mientras que con la cobertura de B. brizantha la variación fue de 5.96 a 5.36g/kg y con A. gayanus ésta fue de 4.45 a 3.63g/kg (F=151.102, p=0.000).
El contenido de carbono hidrosoluble (CHS), al igual que el del COT, fue más bajo durante el período de lluvias. Éste varió en la sabana nativa de 0.080 a 0.049g/kg; mientras que en la sabana sometida a pastoreo ésta fue de 0.071 a 0.059g/kg durante los períodos de sequía y lluvias, respectivamente. En los suelos con la cobertura de B. brizantha la variación temporal del CHS fue de 0.083 a 0.063g/kg y de 0.070 a 0.058g/kg para la cobertura de A. gayanus para estas temporadas climáticas (F=233.922, p<0.001). (Fig. 1B).
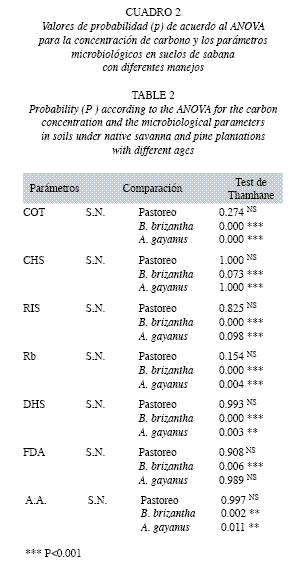
El cambio de coberturas, afectó significativamente el contenido de COT presente en el suelo de la sabana nativa (F=317.137, p<0.001). La interacción entre el manejo del suelo y la temporada climática para el COT y el CHS fue significativa (F=8.936, p<0.001; F=12.948, p<0.001, respectivamente). La prueba a posteriori mostró variación significativa del contenido de COT de la sabana nativa con relación a las coberturas de B. brizantha (Tamhane, p=0.000) y A. gayanus (Tamhane, p=0.000). El COT no varió con respecto a la sabana sometida a pastoreo (Tamhane, p=0.274); mientras que el CHS de la sabana nativa, sólo se diferenció de aquel presente bajo la cobertura de B. brizantha (Tamhane, p=0.073) (Cuadro 2).
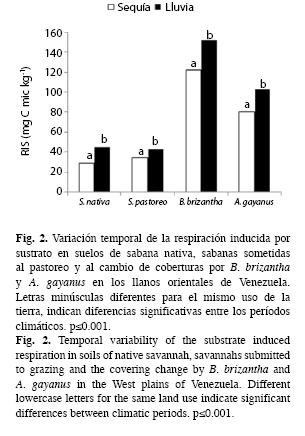
Respiración inducida por sustrato: La biomasa microbiana activa, determinada a través de la RIS, resultó afectada en forma significativa (F=116.667, p<0.001) por la variabilidad temporal (Fig. 2). Los valores obtenidos durante las temporadas de sequía y lluvia en la sabana nativa variaron de 28.66 a 44.68mgCmic/ kg, en la sabana intervenida por ganado de 34.69 a 43.38mg Cmic/kg; mientras que con las pastura de B. brizantha y A. gayanus la variaciones fueron de 122.51 a 151.97mg Cmic/kg y de 80.24 a 102.06mg Cmic/kg, respectivamente. El cambio de uso de la tierra afectó significativamente este parámetro (F=781.651, p<0.001). La interacción entre el manejo del suelo y la temporada climática fue significativa (F=6.266, p<0.001). El suelo de la sabana nativa varió con respecto al intervenido con las coberturas de B. brizanta (Tamhane, p=0.000) y A. gayanus (Tamhane, p=0.098). No se observó variación con respecto al pastoreo (Cuadro 2).
Respiración basal: Los resultados muestran que la variación de los valores de la respiración basal está determinada en gran medida por la variabilidad temporal (F=222.586, p<0.001) (Fig. 3A). Ésta varió en la sabana nativa, durante las temporadas de sequía y lluvias, respectivamente, de 5.87 a 6.95mg C-CO2/kg/24h, y en la sabana intervenida por ganado de 5.28 a 9.28mg C-CO2/kg/24h; mientras que su variación fue de 11.62 a 18.24 mg C- CO2/kg/24h en la parcela con la cobertura de B. brizantha, y de 10.94 a 14.5mg C-CO2/kg/24h, para aquella intervenida con A. gayanus. La interacción entre el manejo del suelo y la temporada climática resultó significativa (F=18.348, p<0.001).
La tasa de respiración basal, también resultó afectada por el cambio de cobertura, diferenciándose claramente la actividad de este parámetro presente en la sabana nativa de aquellas intervenidas con las pasturas de B. brizantha (Tamhane, p=0.000) y A. gayanus (Tamhane, p=0.004). No se observaron diferencias con respecto a la sabana sometida al pastoreo (Tamhane, p=0.154) (Cuadro 2).
Actividad de la deshidrogenasa: Los resultados muestran que la actividad de esta enzima también resultó afectada en forma significativa por la temporada climática (F=701 019, p<0.001). Los valores obtenidos durante las temporadas de sequía y lluvias, en la sabana nativa variaron de 9.97 a 12.31μg TFF7g/24h, y en la sabana intervenida por ganado la entre 9.07 y 14.30 μg TFF7g/24h; mientras que con la pastura de B. brizantha y A. gayanus la variaciones fueron de 20.07 a 42.50μg TFF7g/24h y de 11.70 a 39.53μg TFF7g/24h, respectivamente (Fig. 3B). La interacción entre el manejo del suelo y la temporada climática fue significativa (F=132.619, p<0.001).
El cambio de uso de la tierra, específicamente el cambio de cobertura, también afectó la actividad de la deshidrogenasa (F=342.920; p<0.001). Su actividad en la sabana nativa se diferenció claramente de aquella presente con las coberturas de B. brizanta (Tamhane, p=0.000) y A. gayanus (Tamhane, p=0.003) (Cuadro 2).
Hidrólisis del diacetato de fluorisceína: A excepción de la sabana nativa, la hidrólisis del DAF resultó afectada por la temporada climática (F= 54.126, p<0.001). Los valores de este parámetro variaron de 27.21 a 31.62μg de fluorisceína/g/h en la sabana nativa, de 23.73 a 31.18μg de fluorisceína/g/h en la sabana intervenida por ganado; mientras que la variación fue de 30.76 a 42.48μg de fluorisceνna/g/h con la cobertura de B. brizantha y de 27.17 a 33.91μg de fluorisceína/g/h con la pastura de A. gayanus durante los períodos de lluvias y sequía, respectivamente (Fig. 3C). La interacción entre el manejo del suelo y la temporada climática para la hidrólisis del DAF fue débilmente significativa (F=2.192, p<0.05). En cuanto al manejo del suelo, los valores de este parámetro en la sabana nativa sólo se diferenciaron de aquellos registrados con la cobertura de B. brizantha (Tamhane, p=0.006) (Cuadro 2).
Amonificación de arginina: A excepción de la sabana nativa, la variabilidad temporal afectó significativamente la amonificación de la arginina en las parcelas sometidas al sistema de pastoreo y al cambio de cobertura (F=282 124, p<0.001) (Fig. 3D). La variación de los valores de la AA en la sabana intervenida por ganado fue de 1.78 a 3.41μg de N-NH4/g/h;mientras que con la cobertura de B. brizantha ésta fue de 2.14 a 4.65μg de N-NH4/g/h y con la pastura de A. gayanus la variación fue de 1.90 a 4.56μg de N-NH4/g/h; durante los períodos de sequía y lluvias, respectivamente. La interacción entre el manejo del suelo y la temporada climática para la AA fue significativa (F=49313, p<0.001). La introducción de las pasturas de B. brizantha (Tamhane, p=0.002) y A. gayanus (Tamhane, p=0.011) promovieron un incremento significativo de la misma; mientras que el pastoreo no provocó variación de este parámetro con relación a la sabana nativa (Tamhane, p=0.997).
Discusión
Los suelos de las parcelas estudiadas, presentaron una composición granulométrica similar (franco arenoso). En promedio presentaron un 79% de arena en su horizonte superficial y muy bajos contenido de limo y arcilla (caoliníticas, consideradas como no expansibles), lo cual manifiesta la baja capacidad de éstos para retener humedad y nutrimentos. Los valores de pH están por debajo del rango de 5.0 a 5.5 (considerado como ácido) y la sabana nativa protegida presentó el mayor grado de acidez. Es probable, que el ligero incremento de pH observado en las áreas sujetas al pastoreo y al cambio de cobertura, este asociado en parte, al mayor contenido de bases intercambiables (Cuadro 1) y al efecto del encalado en el segundo caso.
En todas las áreas objeto de estudio los valores de P (2.2-5.0mg/kg) se encuentran por debajo del nivel crítico (10-15mg/kg) (Chicco & Godoy 2002). Bajos valores de P también han sido informados por Godoy & Chicco (1995) para sabanas del oriente Venezolano. Aunque los valores promedio de las bases intercambiables totales también están por debajo de los valores críticos descritos para estos suelos (Chicco &Godoy 2002), el mayor contenido de Ca y Mg se encontró en las parcelas sometidas al cambio de cobertura (Cuadro 1), efecto favorecido por la aplicación del encalado. Los valores del carbono orgánico (COT) e hidrosoluble (CHS) del suelo obtenidos en esta investigación están en concordancia con los informados por Gómez & Paolini (2006) y Gómez et al. (2008) en estudios realizados en las llanuras orientales del estado Anzoátegui, lo que confirma la gran fragilidad de los mismos. El bajo contenido de CHS, además de constituir un factor altamente limitante para la actividad microbiana (Wardle 1992, Sparling 1997), éste junto al carbono lábil proveniente de la biomasa microbiana, regula el ciclaje de la materia orgánica y representa una fuente primaria para los microorganismos del suelo.
La disminución que experimentó el COT y el CHS durante el período lluvioso tanto en la sabana nativa como en las parcelas sujetas al pastoreo y al cambio de cobertura (Figs. 1 A y B), podría estar relacionada en parte, con su pérdida por lavado a capas más profundas del suelo, lo cual está asociado a la textura franco arenosa de los mismos. Similar comportamiento del carbono en suelos bien drenados durante la temporada húmeda han sido señalados por Silva et al. (1995) y Eaton (2001). La dinámica de la precipitación y el flujo de agua son en gran parte responsables de los cambios temporales y el flujo de la materia orgánica disuelta en el suelo (Kalbitz et al. 2000). Otro factor puede ser atribuido al efecto beneficioso del re- humedecimiento del suelo sobre el metabolismo microbiano (Sugihara et al. 2005). El prolongado estrés hídrico característico de estas sabanas durante la temporada seca y el efecto de la presión de turgencia, a la que es sometida la biomasa sobreviviente durante la temporada húmeda, hacen que el carbono lábil contenido en la biomasa microbiana muerta, sea expuesto al ataque de la flora microbiana (Adu & Oades 1978); efecto que promueve un incremento de la mineralización de la materia orgánica (Fierer & Schimel 2003, Saetre & Stark 2005), lo cual es más marcado en los suelos arenosos donde ésta se encuentra menos protegida frente a la degradación microbiana (Brady & Weil 2002). Lundquist et al. (1999) señalaron que este proceso podía impactar significativamente la comunidad microbiana del suelo y la disponibilidad del carbono en el mismo.
El efecto causado por el cambio de cobertura sobre el COT y el CHS confirma las aseveraciones de Reeves (1997) quien señaló, que esta práctica de manejo modificaba la cantidad de materia orgánica total y su composición. En general, el efecto que provoca la introducción de plantas forrajeras como B. brizantha y A. gayanus en suelos de las sabanas de los llanos orientales de Venezuela sobre el contenido de carbono, corroboran los informes de Cerri et al. (1991) y Barrios et al. (1999) quienes observaron un incremento significativo del mismo en el suelo cuando las sabanas son reemplazadas por pasturas. Los valores del contenido de COT y CHS indican que B. brizantha hace un mayor aporte de carbono al suelo (Fig. 1A y B). Pérez-Silva et al. (1999), Tejos & Rodríguez (1995) informaron que B. brizantha producía un mayor porcentaje de cobertura y un mayor rendimiento de materia seca respecto a A. gayanus, especialmente en el período húmedo; asociado a ello, B. brizantha desarrolla un sistema de raíces muy densas en las capas superiores del suelo (Guenni et al. 2002), el cual es más prolífico horizontalmente que el de A. gayanus. Esta característica favorece la presencia de un mayor contenido de carbono en las capas superficiales del suelo bajo la cobertura de B. brizantha. El sistema de raíces de A. gayanus es más profundo con ramificaciones horizontales y verticales (Manrique & Mancilla 1997).
Nuestros resultados ratifican los informes de Kief (1994) y Shrestha et al. (2005), quienes no encontraron diferencias significativas entre el contenido de carbono de la sabana nativa y la intervenida por ganado. Es probable, que esta respuesta esté relacionada con la intensidad a la cual se realiza el pastoreo en la sabana nativa. Las sabanas orientales de Venezuela se caracterizan por estar sometidas a una baja carga animal (0.42UA ha/año), con un pastoreo extensivo, lo cual no parece afectar significativamente el contenido de carbono en el suelo (Cuadro 2). Contrariamente, se ha señalado que con la ganadería intensiva, la cobertura de gramíneas aérea resulta severamente afectada, lo que trae como consecuencia un incremento de la biomasa subterránea (Gao et al. 2007) como un mecanismo adaptativo de las plantas en respuesta al pastoreo, efecto que conduce a una mayor movilización del C hacia esta zona.
Otra de las explicaciones que podrían dar respuesta a la disminución de la concentración de carbono en el suelo durante la temporada húmeda, es la presencia de una mayor biomasa microbiana activa durante esta temporada. Efectivamente, en esta investigación ésta incrementó durante esta temporada climática (Fig. 2), lo cual está en concordancia con los informes de Fierer & Schimel (2003). Wardle & Parkinson (1990) señalaron que cambios en este parámetro estaban fuerte y positivamente correlacionados al contenido de humedad del suelo. Estas mejores condiciones de humedad promueven el cambio del estado latente de las células microbianas a un estado metabólicamente activo; así como el rápido crecimiento de la vegetación con sus efectos sobre la dinámica y actividad de las poblaciones microbianas. Tate (2000) informó, que las variaciones en el contenido de humedad del suelo, no sólo afectan la naturaleza de las poblaciones microbianas presentes en éste, sino que ésta puede alterar la cantidad de nutrientes y la estructura física del ambiente de los microorganismos.
La mayor biomasa microbiana activa en las áreas sometidas al cambio de cobertura puede estar relacionada en parte, con la fertilización mineral (Omay et al. 1997), al promover una mayor proliferación de raíces, exudados y acumulación de residuos orgánicos en el suelo. De igual manera, el encalado al incrementar el pH y precipitar el Al+3 característicos de estos suelos ácidos, promueve el incremento de la biomasa microbiana en ellos (Volkweiss & Tedesco 1984). Así mismo, la aplicación de la urea como fertilización nitrogenada también favorece el aumento de pH y la disponibilidad de fuente nitrogenada, factores que promueven la actividad microbiana (Alexander 1980).
Si consideramos que la respuesta de la RIS también está asociada con la disponibilidad y calidad de los sustratos añadidos al suelo (Colmes & Zak 1994), la mejor calidad de los residuos procedentes de B. brizantha, favorecen el incremento de la biomasa microbiana bajo esta cobertura (Cuadro 2). Pérez-Silva et al. (1999) señalaron que durante la época de mínima precipitación, B. brizantha poseía aproximadamente entre un 45.8% y un 75.3% de cobertura y que el porcentaje restante permanece en la superficie del suelo, producto de la defoliación característica de las gramíneas como consecuencia del estrés hídrico (Tejos & Rodríguez 1995), formando una capa protectora cuya descomposición durante las mejores condiciones de humedad del período lluvioso, favorece el desarrollo de la biomasa microbiana y sus actividades. Este incremento en suelos intervenidos con B. brizantha y A. gayanus está determinado no sólo por el contenido y calidad de los residuos orgánicos propios de cada una de ellas; sino también con el desarrollo y forma de crecimiento del sus sistemas radicales (Manrique & Mancilla 1997) sino también por la naturaleza y cantidad de los exudados propios de cada una de estas coberturas.
En esta investigación no se observaron diferencias significativas entre los valores de la RIS obtenidos en la sabana nativa no intervenida por ganado y aquella sometida al pastoreo. Lo cual permite inferir, que en éstas, la práctica de la ganadería extensiva no afecta la biomasa microbiana del suelo. Similares resultados han sido informados por Kief (1994).
Al evaluar el efecto de los diferentes manejos del suelo aquí señalados, sobre los parámetros indicadores de la actividad microbiana (Rb, DHS, FDA y AA), se puede inferir que en estos suelos existe una comunidad microbiana poco activa, aunque característica de estas sabanas (Gómez & Paolini 2006, Gómez et al. 2008, Gómez & Paolini 2009).
El incremento observado de la respiración basal durante la temporada lluviosa (Fig. 3A), es favorecido por el contenido de carbono lábil proveniente de las células microbianas muertas durante la temporada seca, producto del impacto de la presión osmótica (Tate 2000), la cual se convierte en una fuente potencial de nutrientes que se hace disponible para las plantas y microorganismos durante el período de lluvias. Fierer & Schimel (2003) indicaron que a corto plazo, el mayor flujo de CO2 medido durante el secado y re-humedecimiento del suelo, proviene principalmente de los solutos citoplasmáticos. Los resultados obtenidos en esta investigación son consistentes con los informados para otros ecosistemas de sabanas, en los cuales los eventos lluviosos incrementaron la tasa respiratoria (Hao et al. 1998). Esta variación temporal de la tasa respiratoria de los suelos de las sabanas orientales de Venezuela, ratifican los informes de Anderson (1994), quien señaló, que cualquier cambio de las condiciones medioambientales puede generar valores característicos de la actividad microbiana.
Las mejores condiciones de humedad no sólo incrementan la biomasa microbiana activa; sino que ésta puede estimular una mayor diversidad microbiana durante este período, lo cual va aparejado con una mayor actividad de uno o más procesos microbiológicos en el suelo (Kandeler et al. 1996). Así vemos como durante este período se observó un incremento de las actividades de la DHS, FDA y AA (Fig. 3B, C y D, respectivamente), lo cual sustenta los informes de Banerje et al. (2000) y Bonde et al. (2001). La menor actividad microbiana que se registró durante la sequía en todos los parámetros determinados, está asociada con el estrés hídrico característico de estas sabanas durante ésta temporada climática, en la cual gran parte de los microorganismos del suelo mueren o permanecen inactivos (Shing et al. 1989).
Como se desprende de esta investigación, el cambio de cobertura ejerció un efecto importante en la actividad microbiana (Cuadro 2). La actividad respiratoria, la DHS, FDA y AA determinadas en la sabana nativa se diferenciaron de estas actividades presentes en el suelo con las pasturas mejoradas, en especial B. brizantha. Esto podría explicarse debido a las diferencias en composición y calidad de los residuos de las coberturas de Trachypogon sp., B. brizantha y A. gayanus, los cuales pueden ser metabolizados a diferentes tasas dependiendo de su contenido de C, N, S y lignina (Janzen & Kucey 1988). La calidad química de los sustratos orgánicos añadidos al suelo juegan un papel muy importante en la respiración del mismo (Wan & Luo 2003) y constituyen la clave que determina la tasa de su descomposición (Bending et al. 2002). La fracción de los compuestos orgánicos presentes en los residuos de B. brizantha es de más fácil degradación que aquella presente en A. gayanus (Guenni et al. 2002, Ferreira & Sousa Costa 2003); mientras que Trachypogon sp., es una vegetación de forrajes duros, fibrosos, con alto contenido de pared celular, baja digestibilidad y, por ende, menor valor nutritivo (Sarmiento & Monasterio 1975), lo cual limita la capacidad de los microorganismos del suelo para degradar estos tejidos vegetales (Vogt et al. 1995, Geissen & Brümer 1999).
Otro factor que influye en la actividad microbiana son las diferencias en la densidad de las raíces de las coberturas, ya que esto incide en la biomasa microbiana y el contenido de carbono presente en su rizosfera (Ross et al. 1984), la composición química de los exudados (Adu-Gyamfi et al 2000) la cual afecta la estructura de la comunidad microbiana nativa (Grayston et al.1998) y el perfil del nivel fisiológico de la comunidad presente en el suelo (Degens 1998).
El estudio de la actividad microbiana a través de los diferentes parámetros microbiológicos confirma que una mayor actividad heterotrófica es llevada a cabo por los microorganismos presentes en suelos con la cobertura de B. brizantha, efecto asociado a la mejor calidad nutritiva de sus residuos (Pietrosemoli & Jauregui 1996) y al efecto beneficioso del desarrollo de su sistema radical.
La ausencia de diferencias significativas entre la actividad respiratoria, DHS, FDA y AA presentes en el suelo de la sabana nativa y en aquella intervenida por ganado, indica, que el pastoreo extensivo y la baja carga animal en estas sabanas no afectan la actividad biológica en estos suelos. Singh & Rai (2004) informaron que la intensidad del pastoreo determinaba la actividad microbiana del suelo.
Agradecimientos
Los autores desean expresar su agradecimiento al Consejo de Investigación de la Universidad de Oriente, Venezuela, por el financiamiento de esta investigación.
Referencias
Albornoz, A., A. González & O. Fuentes. 1995. Taller aspectos físicos de las sabanas Orientales y su efecto sobre la productividad. Fondo Nacional de Investigaciones Agropecuarias del Estado, Anzoátegui. Barcelona, España. [ Links ]
Adam, A. & H. Duncan. 2001. Development of a sensitive and rapid method for the measurement of total microbial activity using fluorescein diacetate (FDA) in a range of soils. Soil Biol. Biochem. 33: 943-951. [ Links ]
Adu, J. & J. Oades. 1978. Physical factors influencing decomposition of organic materials in soils aggregates. Soil Biol. Biochem. 10: 109-115. [ Links ]
Adu-Gyamfi, J.J, S. Ishikawa,T. Nakamura & H. Nakano. 2000. Genotypic variability and physiological characteristics of crop plants adapted to low- nutrient environments, p. 67-80. In J.J. Adu-Gyamafi (ed.). Food security in nutrient-stressed environments: exploiting plants’ genetic capabilities. Proceedings of an international workshop. Patancheru, Andhra Pradesh, India. [ Links ]
Alef, K. & D. Kleiner. 1986. Arginine ammonification a simple method to estimate microbial activity potentials in soils. Soil Biol. Biochem. 18: 233-235. [ Links ]
Alef, K. & P. Nannipieri. 1995. Methods in applied soil microbiology and biochemitry. Academic, Londres, Inglaterra. [ Links ]
Alexander, M. 1980. Introducción a la microbiología del suelo. Libros y editoriales, México, D.F., México. [ Links ]
Anderson, T.H. & K.H. Domsch. 1985. Determination of ecophysiological maintenance C requirements of soil microorganisms in a dormant state. Biol. Fertil. Soils 1: 81-89. [ Links ]
Anderson, T.H. 1994. Physiological analysis of microbial communities in soil: Applications and limitations, p. 67-76. In K. Ritz, J. Dighton & K.E Giller (eds.). Beyond the Biomass. Wiley, Chichester, Inglaterra. [ Links ]
Banerjee, M.R., D.L. Burton, W.P.P. McCaughey & C.A. Grant. 2000. Influence of pasture management on soil biological quality. J. Rang. Manage. 53: 127-133. [ Links ]
Barrios, E., I. Corrales, N. Asakawa, J.G. Cobo, R.J. Thomas & D.K. Friesen. 1999. Soil macroorganic matter and N mineralization in crop-rotations and lay farming systems for acid-soil savannas of Colombia, p. 108-112. In CIAT (ed.). Overcoming soil degradation through productivity enhancement and natural resource conservation. Cali, Valle del Cauca, Colombia. [ Links ]
Bending, G.D., M.K. Turner & J.E. Jones. 2002. Interactions between crop residue and soil organic matter quality and the functional diversity of soil microbial communities. Soil Biol. Biochem. 34: 1073-1082. [ Links ]
Bonde, A.T., T.H. Nielsen, M. Miller & J. Sørensen. 2001. Arginine ammonification assay as a rapid index of gross N mineralization in agricultural soils. Biol. Fertil. Soil. 34: 179-184. [ Links ]
Brady, N.C. & R.R. Weil. 2002. The nature and properties of soils. Pearson Education, Nueva Jersey, Middle Atlantic, EEUU. [ Links ]
Brookes, P.C. 1995. The use of microbial parameters in monitoring soil pollution by heavy metals. Biol. Fertil. Soils 19: 269-279. [ Links ]
Burns, R.G. 1978. Enzyme activity in soil: some theoretical and practical considerations, p. 295-396. In R.G. Burns (ed.). Soil Enzymes. Academic, Londres, Inglaterra. [ Links ]
Casida, L.E., D.A. Jr. Klein & T. Santoro. 1964. Soil dehydrogenase activity. Soil Sci. 98: 371-376. [ Links ]
Cerri, C.C., B. Volkoff & F. Andreux. 1991. Nature and behavior of organic matter in soils under natural forest and alter deforestation, burning and cultivation in the Amazonia. Forest Ecol. Manage. 38: 274-257. [ Links ]
Chicco, C. & S. Godoy. 2002. Nutrición mineral de los bovinos de carne en Venezuela, p. 135-155. In R. Romero, J. Arango & J. Salomón (eds.) XVIII Cursillo sobre Bovinos de Carne. Facultad de Ciencias Veterinarias, Maracay, Estado Aragua, Venezuela.
Colmes, E.E. & D.R. Zak. 1994. Soil microbial biomass dynamics and net nitrogen mineralization in Northem hardwood ecosystems. Soil Sci. Soc. Am. J. 58: 238-243. [ Links ]
Comerma, J.A. & E. Chacón. 2002. Aptitud de los llanos venezolanos para los principales usos ganaderos, p. 193-212. In R. Romero, J. Arango & J. Salomón (eds.). XVIII cursillo sobre bovinos de carne. Facultad de Ciencias Veterinarias, Maracay, Estado Aragua, Venezuela. [ Links ]
De Armas, L.R. 2005. Sistema de pastoreo en sabanas de Trachypogon en el estado Bolivar. IX Seminario de Pastos y Forrajes. Hato la Vergareña C.A, La Paragua, Estado Bolivar, Venezuela. [ Links ]
Degens, B. 1998. A novel approach for assessing the pattern of catabolic potential of soil microbial communities, p. 206-214. In H. Insam & A. Ranger (eds.). Microbial communities. Springer, Berlin, Heidelberg, Alemania. [ Links ]
Eaton, W.D. 2001. Microbial and nutrient activity in soils from three different subtropical forest habitats in Belize, Central America before and during the transition from dry to wet season. Appl. Soil Ecol. 16: 219-227. [ Links ]
Farias, J., I. Arriojas, E. Chacon, J. Berroteran & F. Chacon. 1987. Efecto del corte y de la aplicación de nitrógeno en el crecimiento de Andropogon gayanus. Biol. Pasturas Trop. 9: 2-8. [ Links ]
Ferreira, M.B. & N.M. Sousa Costa. 2003. Stylosantes macrocephala. FAO, (Consultado: Enero 2006, www.fao.org./ag/AGP/AGPC/doc/Gbase/DATA/Pf000495.HTM). [ Links ]
Fierer, N. & J.P. Schimel. 2003. A proposed mechanism for the pulse in carbon dioxide production commonly observed following the rapid rewetting of a dry soil. Soil Sci. Soc. Am. J. 67: 798-805. [ Links ]
Gao, Y.H., P. Luo, N. Wu, H. Chen & G.X. Wang. 2007. Grazing intensity impacts on carbon sequestration in an alpine meadow on the eastern Tibetan plateau. Res. J. Agric. Biol. Sci. 3: 642-647. [ Links ]
Geissen, V. & G.W. Brümer. 1999. Decomposition rates and feeding activities of soil fauna in deciduos forest soils in relation to soil chemical parameters following liming and fertilization. Biol. Fertil. Soils. 29: 335-342. [ Links ]
Godoy, S. & C. Chicco. 1995. Respuesta productiva a la suplementación mineral de los bovinos de pastoreo, p. 25-59. In D. Plasse, N. Peña de Borsotti & J. Arango (eds.). XI Cursillo sobre Bovinos de Carne. Facultad de Ciencias Veterinarias, Maracay, Estado Aragua, Venezuela. [ Links ]
Gómez, Y. & J. Paolini. 2009. Efecto de la variabilidad temporal y el manejo del suelo sobre los parámetros microbiológicos en sabanas de los Llanos Orientales de Venezuela. SABER 20: 18-28. [ Links ]
Gómez, Y. & J. Paolini. 2006. Actividad microbiana en suelos de sabanas de los Llanos Orientales de Venezuela convertidas pasturas. Rev. Biol. Trop. 54: 273-285. [ Links ]
Gómez, Y., J. Paolini & R.M. Hernández. 2008. Sustitución de la sabana nativa con plantaciones de Pinus caribaea (Pinaceae) en Venezuela: efecto sobre parámetros indicadores de cambios en el carbono del suelo. Rev. Biol. Trop. 56: 2041-2053. [ Links ]
Grayston, S.J., S. Wang, C.D. Campell & A.C. Edwards. 1998. Selective influence of plant species on microbial diversity in the rhizosphere. Soil Biol. Biochem. 30: 369-378. [ Links ]
Guenni, O., D. Marín & Z. Baruch. 2002. Responses to drought of five Brachiaria species. I. Biomass production, leaft growth, root distribution, water use and forage quality. Plant Soil. 243: 229-241. [ Links ]
Hao, W.M., D. Scharfee, P.J. Crutzen & E. Sanhueza. 1998. Production of N2O, CH4 and CO2 in the tropical savanna in the dry season. J. Atmos. Chem. 7: 93-105. [ Links ]
Hassik, J. 1993. Relationship between the amount and the activity of the microbial biomass in Dutch grassland soils: comparison of the fumigation and incubation method and the substrate-induced respiration method. Soil Biol. Biochem. 25: 533-538. [ Links ]
Janzen, H.H. & R.M.N. Kucey. 1988. C, N and S mineralization of crop residues as influenced by crops species and nutrient regime. Plant Soil. 106: 35- 41. [ Links ]
Kalbitz, K., S. Solinger, J.H. Park, B. Michalzik & E. Matzner. 2000. Controls on the dynamic of dissolved organic matter in soils: A review. Soil Sci. 165: 277-304. [ Links ]
Kandeler, E. & H. Gerber. 1988. Short-term assay of urease activity using colorimetric determination of ammonium. Biol. Fertil. Soils 6: 68-72. [ Links ]
Kandeler, E., C. Kampichler & O. Horak. 1996. Influence of heavy metals on the functional diversity of soil microbial communities. Biol. Fetil. Soils. 23: 299-306. [ Links ]
Kieft, T.L. 1994. Grazing and plant-canopy effects on semiarid soil microbial biomass and respiration. Biol. Fertil. Soils 18: 155-162. [ Links ]
Lin, Q. & P.C. Brookes. 1999. Arginine ammonification as a method to estimate soil microbial biomass and microbial community structure. Soil Biol. Biochem. 31: 1985-1997. [ Links ]
Lundquist, E., K. Scow, L. Jackson, S. Uesugi & C. Johnson. 1999. Rapid response of soil microbial communities from conventional low imput and organic farming systems to a wet/dry cycle. Soil Biol. Biochem. 31: 1661-1675. [ Links ]
Makoi, J.H.J.R. & P.A. Ndakidemi. 2008. Selected Soil enzymes: Examples of their potential roles in the ecosystems. African J. Biotech. 7: 181-191. [ Links ]
Manrique, A.J. & L.E. Mancilla. 1997. Efecto de las épocas de corte, dos fuentes nitrogenadas y tres niveles de nitrógeno en la producción y calidad de la semilla de andropogon gayanus kunth. Zoo. Trop. 15: 17-30. [ Links ]
Omay, A.B., C.W. Rice, L.D. Maddux & W.B.Gordon. 1997. Changes in soil microbial and chemical properties under long-term crop rotation and fertilization. Soil Sci. Soc. Am. J. 61: 1672-1678. [ Links ]
Pérez-Silva, G., J. Farias-Mármol & B. González. 1999. Evaluación agronómica de gramíneas forrajeras en Carora, estado Lara, Venezuela. Rev. Fac. Agron. 16: 621-636. [ Links ]
Pietrosemoli, S. & R. Jauregui. 1996. Contenido de lignina y digestibilidad in vitro del pasto Brachiaria brizantha fertilizado con nitrógeno. Rev. Fac. Agron. 13: 561-571. [ Links ]
Pla, I. 1983. Metodología para la caracterización física con fines de diagnóstico de problemas de manejo y conservación de suelos en condiciones tropicales. Alcance 33: 15-91. [ Links ]
Powlson, D.S. 1994. The soil microbial biomass: before, beyond and back, p. 3-20. In K. Ritz, J. Dighton & K.E. Giller (eds.). Beyond the Biomass. Wiley, Chichester, Inglaterra. [ Links ]
Pratt, P.F. 1965. Potassium, p.1022-1030. In A. Klute (ed.). Methods of soil analysis: Chemical and microbiological methods. Black, C.A. Madison, Wisconsin, EEUU. [ Links ]
Reeves, D.W. 1997. The role of soil organic matter in maintaining soil quality in continuous cropping systems. Soil Till. Res. 43: 131-167. [ Links ]
Ross, D.J., T.W. Speir, J.C. Cowling & K.N. Whale. 1984. Temporal fluctuations in biochemical properties of soil under pasture. II. Nitrogen mineralization and enzyme activities. Aust. J. Soil. Res. 32: 319-330. [ Links ]
Saetre, P. & J.M. Stark. 2005. Microbial dynamics and carbon nitrogen cycling following rewetting of soils beneath two semi-arid plant species. Oecologia 142: 247-260. [ Links ]
San José, J.J. & R. Montes. 1989. An assessment of regional productivity: The Trachypogon savannas at the Orinoco Llanos. Nature Res. 25: 15-18. [ Links ]
Sarmiento, M. & M. Monasterio. 1975. A critical consideration of the environmental conditions associated with occurrence of savanna ecosystems in Tropical America, p. 223-250. In F. Galley & E. Medina (eds.). Tropical ecological systems. Springer, Nueva York, Nueva York, EEUU. [ Links ]
Saviozzi, A., R. Levi-Minzi, R. Cardelli & R. Riffaldi. 2001. A comparison of soil quality in adjacent cultivated forest and native grassland soils. Plant Soil. 223: 251-259. [ Links ]
Silva, L.C., T. Rodríguez & M.S. Vielma. 1995. Sabanas orientales, características, ventajas y limitaciones para la producción agrícola, p. 1-55. In Fondo Nacional de Investigaciones agropecuarias (ed.). Aspectos físicos de los suelos de las sabanas Orientales y sus efectos sobre la productividad. FONAIAP. El Tigre, Anzoátegui, Venezuela. [ Links ]
Shrestha, G., P.D. Stahl, L.C. Munn, E.G. Pendall, G.F. Vance & R. Zhang. 2005. Soil carbon and microbial biomass carbon after 40 years of grazing exclusion in semiarid sagebrush steppe of Wyoming. Soil management for drylands. Aridlands N°58. Arizona, Tucson, EEUU. (Consultado: diciembre 2009, http://gyami.shrestha.googlepages.com/ALNNo.58_Shrestha_Soilcarbonandmicro.pdf). [ Links ]
Sims, J.R. & V.A. Haby. 1971. Simplified colorimetric determination of soil organic matter. Soil Sci. 112: 137-141. [ Links ]
Singh, J.S., A.S. Raghubanshi, R.S. Singh & S.C. Srivastava. 1989. Microbial biomass acts as a source of plant nutrients in dry tropical forest and savanna. Nature 338: 499-500. [ Links ]
Singh, S.K. & J.P. Rai. 2004. Soil microbial population and enzyme activity related to grazing pressure in alpine meadows of Nanda Devi Biosphere Reserve. Environ Biol. 25: 103-7. [ Links ]
Sparling, G.P. 1997. Soil microbial biomass, activity and nutrient cycling as indicators of soil health, p. 67-119. In C.E. Pankhurst, B.M. Doube & V.V.S.R. Gupta (eds.). Biological Indicators of Soil Heath. CAB International, Nueva York, Nueva York, EEUU. [ Links ]
Stotsky, G. 1965. Microbial respiration, p. 1550-1570. In C.A. Black, D.D. Evans, L.E. Esminger, J.L. White & F.E. Clark (eds.). Methods of Soil Analysis, Part 2. Chemical and Microbiological properties. Agronomy, Madison, Wisconsin, EEUU. [ Links ]
Sugihara, S., S. Funakawa, H. Shinjo & T. Kosaki. 2005. Short-term dynamics of soil organic matter and microbial biomass after simulated rainfall on tropical sandy soils. 18th World congress of Soil Science, Filadelfia, Pensilvania, EEUU. [ Links ]
Tate II, R.L. 2000. Soil microbiology. Wiley, Nueva York, Nueva York, EEUU. [ Links ]
Tejos, M.R. & C.M. Rodríguez. 1995. Adaptación de nuevas gramíneas al llano bajo venezolano. Rev. Fac. Agron. 15: 278-282. [ Links ]
Vinacua, B.V. 1997. Análisis estadístico con SPSS PARA Windows. Vol I. Estadística Básica. MacGrraw Hill, Madrid, España. [ Links ]
Vogt, C.A., D.J. Vogt, S. Brown, J.P. Tilley, R.L. Edmonds, W.L. Silver & T.G. Siccama. 1995. Dynamics of forest floor and soil organic matter accumulation in boreal, temperate, and tropical forestry, p. 159-178. In R. Lal, J. Kimble, B.A. Stewart (eds.). Soil management effect. Advances in Soil Science. CRC. Boca Raton, Florida, EEUU. [ Links ]
Volkweiss, S.J. & M.J. Tedesco .1984. A calagem dos solos ácidos, prática e beneficios. UFRGS, Porto Alegre, Rio Grande del sol, Brasilia, Brazil. [ Links ]
Walkley, A. & I.A. Black. 1934. An examination of Degtjareff method for determining soil organic matter, and a proposed modification of the chromic acid titration method. Soil Sci. 37: 29-38. [ Links ]
Wan, S. & Y. Luo. 2003. Substrate regulation of soil respiration in a tallgrass prairie: Results of a clipping and shading experiment. Global Biogeochem. Cy. 17: 1054. [ Links ]
Wardle, D.A. & D. Parkinson. 1990. Comparison of physiological techniques for estimating the response of the soil microbial biomass to soil moisture. Soil Biol. Biochem. 22: 817-823. [ Links ]
Wardle, D.A. 1992. A comparative assessment of the factors which influence microbial biomass carbon and nitrogen levels in soil. Biol. Rev. 67: 321-358. [ Links ]
Correspondencia a: Yrma Gómez. UniversidadJorge Paolini de Oriente, Laboratorio de Investigaciones Biológicas, Apdo. 1231, Puerto La Cruz, Venezuela; irmagomez52@hotmail.com
Jorge Paolini. Instituto Venezolano de Investigaciones Científicas Centro de Ecología, Apdo. 21827, Caracas 1020-A, Venezuela; jpaolini@ivic.ve