Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.58 suppl.3 San José Oct. 2010
Abundancia y riqueza de moluscos y crustáceos asociados a las raíces sumergidas del mangle rojo (Rhizophora mangle) en la laguna de Bocaripo, Sucre, Venezuela
Jennellis Cedeño1, Mayré Jiménez Prieto2, Luisana Pereda2 & Thays Allen2
1. Escuela de Ciencias, Departamento de Biología, Universidad de Oriente, Venezuela; jennellisccb@gmail.com
2. Instituto Oceanográfico de Venezuela, Universidad de Oriente; Mayrej@gmail.com
Key words: abundance, richness of species, mollusks, crustaceans, Rhizophora mangle, lagoon, Bocaripo, Venezuela.
Resumen
Las raíces de mangle son un importante hábitat para muchas especies. Se estudió la abundancia y riqueza de moluscos y crustáceos asociadas a las raíces sumergidas de Rhizophora mangle. Las muestras fueron recolectadas entre febrero 2005 y enero 2006, en la laguna de Bocaripo, costa norte del estado Sucre, Venezuela. Se establecieron cinco estaciones en la laguna; al azar en cada estación se escogieron dos raíces de mangle, fueron introducidas en bolsas plásticas; los organismos fueron obtenidos de la raíz raspando la superficie con un cuchillo, luego fueron separados y fijados en formalina al 10% para su posterior identificación. Se recolectaron 1 092 especimenes de moluscos, distribuidos en dos clases: Bivalvia y Gastropoda. La clase Bivalvia fue la más abundante con 943 individuos. La familia más representativa fue Mytilidae con 6 especies, siendo Musculus lateralis la especie dominante. Los crustáceos estuvieron representados por 372 organismos, pertenecientes a la clase Malacostraca, donde Panopeus herbstii (169 ind.) fue la especie más abundante. Las familias Panopeidae, Porcellanidae y Majidae presentaron el mayor número de especies. La máxima abundancia se encontró en febrero (224 ind.) con una riqueza de 25 especies y la mínima en noviembre (45 ind.) con 12. Las estaciones 1 y 5 presentaron la mayor abundancia y riqueza de organismos, lo cual pudiera estar relacionado con condiciones ambientales favorables, como la mayor disponibilidad de microhábitats y oferta alimenticia; por el contrario la estación 4, presentó un ambiente más inhóspito, debido a los altos valores en la salinidad y temperatura, lo cual contribuye con la menor abundancia y riqueza de las especies presentes.Palabras clave: abundancia, riqueza de especies, moluscos, crustáceos, Rhizophora mangle, laguna, Bocaripo, Venezuela.
Las lagunas costeras, son ecosistemas muy fluctuantes caracterizados fundamentalmente por la mezcla de aguas continentales y marinas. La intensidad y frecuencia de esta mezcla, determina en su mayor parte los cambios estaciónales de las características químicas del agua y de las poblaciones biológicas que las habitan; son ambientes sujetos a cambios rápidos en sus características tanto morfo-sedimentológicas como ambientales (Contreras et al. 1997, Contreras & Castañeda 2004, Medina & Barboza 2006). Dentro de estos ecosistemas lagunares, los manglares constituyen un importante recurso forestal, son árboles que sostienen la biodiversidad de los ecosistemas costeros tropicales, en los humedales forestales intermareales y áreas de influencia tierra adentro (Morao 1983, Reyes & Campos 1992, Yánez-Arancibia et al. 1998, Carballo 2000). Siendo, fundamentales en el mantenimiento de las cadenas tróficas marino-costeras, ya que muchas poblaciones animales dependen de ellos en alguna o varias etapas de su ciclo de vida, tales como crustáceos y moluscos (Dawes 1986, Kathiresan & Bingham 2001.
Las raíces sumergidas de algunas especies del manglar, principalmente Rhizophora mangle, constituyen un substrato adecuado parael establecimiento de numerosos organismos. Entre las raíces se protegen y se alimentan larvas, post-larvas y alevines de peces y crustáceos. Algunos moluscos, como el ostión de mangle (Crassostrea rhizophorae), utilizan las raíces para fijarse y desarrollarse hasta alcanzar su etapa adulta (Corredor 1984, Carballo 2000).
La laguna de Bocaripo se ubica en la costa norte del golfo de Cariaco que se caracteriza por su inmensa belleza natural, la cual está rodeada de una frondosa línea de manglares (Rhizophora mangle y Avicennia germinans) y es visitada con cierta frecuencia por turistas. Debido a estas características ha sido escogida para la realización de algunas investigaciones sobre comunidades de organismos marinos (Oliveros 1984, Valecillos 1993, Prieto et al. 2006), sin embargo sobre las comunidades de moluscos y crustáceos asociados a las raíces del mangle no existe ninguna investigación hasta la fecha.
Por la eminente importancia ecológicaturística que constituye la laguna de Bocaripo y a las escasas investigaciones de moluscos y crustáceos en las raíces de mangle se consideró relevante realizar un estudio de las comunidades para evaluar la abundancia y riqueza de estos grupos asociados a las raíces sumergidas del mangle rojo (Rhizophora mangle).
Materiales y métodos
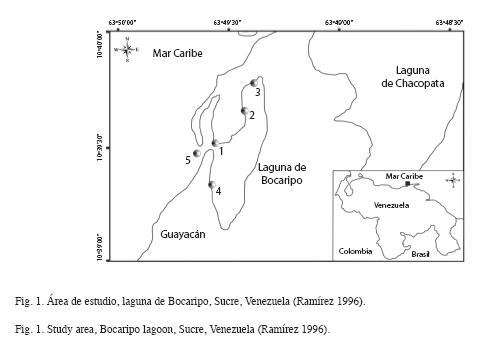
Área de muestreo: La laguna de Bocaripo está ubicada en la costa norte del Golfo de Cariaco, al noreste de la península de Araya, estado Sucre, entre los 10º34´ y 10º36´ N y 64º01´ y 64º04´ O. Presenta una longitud de 1 500m en dirección norte-sur y una anchura máxima de 450m en dirección este-oeste. El área total de la laguna es de 0.675km2 aproximadamente (Oliveros 1984).
El área no presenta afluentes fluviales y el único suministro de agua dulce la proviene de las precipitaciones. La laguna se encuentra rodeada casi en su totalidad por manglares; también pueden observarse en el fondo, de manera aislada, praderas de Thalassia testudinum.
Los muestreos se realizaron mensualmente desde febrero 2005 a enero 2006. Se establecieron 5 estaciones en el área de estudio. La estación 1 se ubicó en la garganta de la laguna bordeada por Rhizophora mangle, donde se pueden observar corrientes moderadas durante todo el día, con una profundidad promedio de 1.25m. Las estaciones 2 y 3 ubicadas hacia el norte de la laguna, dentro del saco de la misma, donde predomina R. mangle, este sitio presenta muy bajo hidrodinamismo y una profundidad promedio de 0.35m. La estación 4, se ubicó al sureste de la estación 3, donde se nota claramente una transición entre R. mangle y Avicennia germinans, con una profundidad promedio del agua de 0.20m. La estación 5 se encuentra fuera de la laguna, frente a la boca, donde hay formación de R. mangle, con corrientes moderadas durante todo el día y una profundidad promedio de 0.70m (Fig. 1).
En cada estación se escogieron dos raíces de mangle rojo al azar, fueron introducidas en bolsas de polietileno y se procedió a raspar la raíz con un cuchillo (Márquez & Jiménez 2002). Posteriormente se midió la temperatura y la salinidad del agua.
Se determinó la abundancia mensual y estacional de los organismos y la riqueza específica presentes en cada estación y mes (Krebs 1989).
Resultados
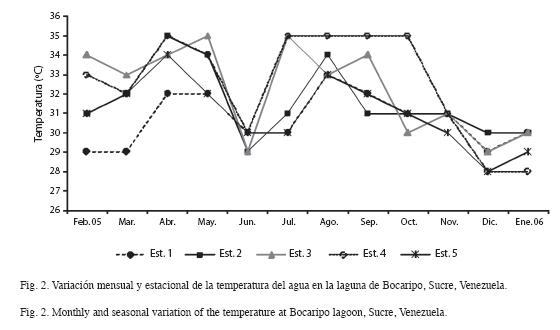
Ambientales: La temperatura mensual fluctuó entre 28-35ºC, observándose los valores más elevados en mayo, julio, agosto septiembre y octubre 2005 (31-35ºC), luego disminuyó en diciembre-2005 y enero 2006 (28-30ºC). Las temperaturas en las estaciones ubicadas dentro de la laguna (2, 3 y 4) se mantuvieron relativamente altas (31-35ºC), mientras que en las estaciones 1 y 5 fueron menores (28-30ºC) (Fig. 2).
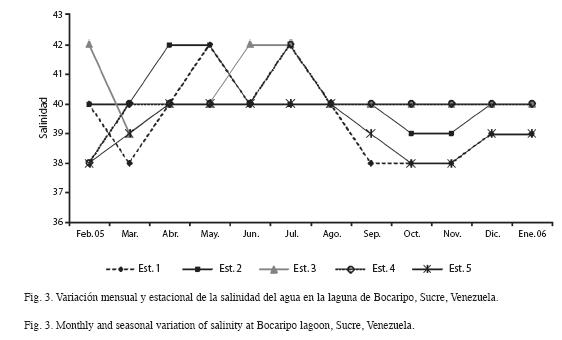
La salinidad se mantuvo casi constante, obteniéndose salinidades entre 38-42psu, los valores más altos fueron en abril, mayo, junio y julio (42psu), mientras que los valores más bajos en septiembre, octubre y noviembre (38psu). Las máximas salinidades se dieron dentro de la laguna (estaciones 2, 3 y 4), la cual estuvo entre 40-42psu, por su parte los mínimos valores se observaron en las estaciones ubicadas en la entrada de la laguna (1 y 5), donde la salinidad varió entre 38-40psu (Fig. 3).
Biológicos: Se procesaron un total de 120 raíces, recolectándose 1 465 organismos, pertenecientes a dos Phyla: Mollusca y Arthropoda, distribuidas en cuatro clases, 27 familias, 40 géneros, 61 especies. El Phylum Mollusca fue el mejor representado con dos clases (Bivalvia y Gastropoda), 17 familias, 25 géneros y 32 especies, cuantificándose un total de 1 093 organismos. La Clase Bivalvia presentó la mayor cantidad de especímenes (938), en 16 especies, 12 géneros y ocho familias. Las especies más abundantes fueron Musculus lateralis (279 ind.), Sphenia antillensis (182 ind.), Perna viridis (172 ind.) y Brachidontes exustus (140 ind.). La familia con el mayor número de especies (seis) y de individuos (629) fue Mytilidae, seguida familia Ostreidae con tres especies. La Clase Gastropoda, reporta 155 individuos contenidas en 11 familias, 12 géneros y 16 especies. Las familias Melongenidae y Buccinidae presentaron la mayor cantidad de especímenes y las especies Melongena melongena (56 ind.), Anachis sparsa (38 ind) y Crepidula glauca (24 ind.) fueron las más dominantes (Cuadro 1).
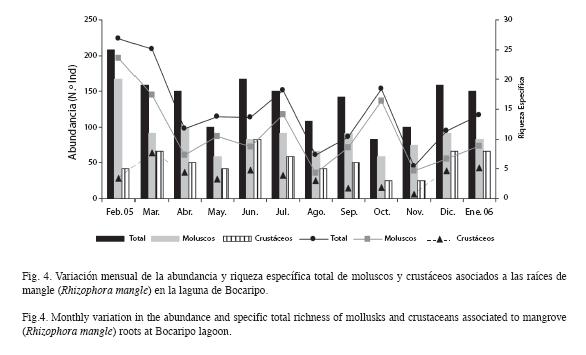
La mayor abundancia mensual total de organismos se obtuvo en febrero (224 ind.), seguido por marzo (209 ind.); y los valores más bajos correspondieron a noviembre (45 ind.) y agosto (61 ind.). La riqueza específica mensual total estuvo entre 10 y 25 especies, observándose máximos valores en febrero (25 spp.), seguido por marzo y diciembre (19 spp.) y los mínimos correspondieron a octubre (10 spp.) y noviembre (12 spp.).
Los moluscos tuvieron valores máximos en febrero (196 ind.) y marzo 2005 (145 ind.), mientras que agosto (36 ind.) y noviembre (39 ind.) presentaron los mínimos. La mayor riqueza de moluscos se presentó en febrero 2005 (20 spp.) y los mínimos se registraron en mayo y octubre 2005 (siete spp.) (Fig. 4).
Los crustáceos alcanzaron su mayor abundancia durante marzo 2005 (64 ind.) y enero 2006 (43 ind.), y la menor correspondió a noviembre (6 ind.) y septiembre (15 ind.). Los valores más altos de especies de crustáceos se encontraron durante junio (10 spp.) y los más bajos en octubre y noviembre (tres spp.) (Fig. 4).
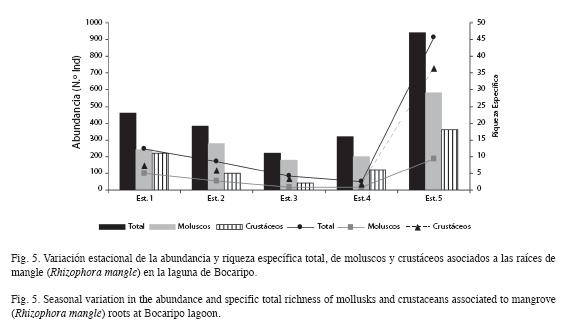
La abundancia por estación estuvo entre un máximo de 912 individuos, con el máximo valor en la estación 5 (912 ind.) y un mínimo en las estaciones 4 y 3 con 51 individuos. Se observó la misma tendencia para moluscos y crustáceos, altos valores en las estaciones 5 y 1, mientras que, los mínimos se presentaron en la estación 4 (35 ind. para moluscos y 16 ind. para los crustáceos). La riqueza fluctuó entre 11 (estación 3) y 47 especies (estación 5). La riqueza de moluscos y crustáceos mostraron el mismo comportamiento presentado para la riqueza total (Fig. 5).
El análisis estadístico detectó diferencias altamente significativas en la abundancia de epibiontes asociados a las raíces de mangle rojo con respectos a las estaciones (Fs=16.47; p<0.001); mientras que entre los meses no se encontraron diferencias (Fs=0.46; p>0.05). La prueba a posteriori Duncan mostró la formación de tres grupos; el primero formado por las estaciones más alejadas de la entrada (3 y 4), un segundo grupo formado por las estaciones ubicadas en la entrada (1 y 2) y el tercer grupo correspondió a la estación de la boca. Para las especies, el análisis estadístico mostró un comportamiento similar al de las abundancias, dando diferencias significativas entre estaciones (Fs=13.01; p<0.001), para los meses no se encontraron diferencias (Fs=1.18; p>0.05). La prueba a posteriori Duncan para las estaciones arrojó la formación de cuatro grupos, el primer grupo compuesto por las estaciones 3 y 4, el segundo grupo constituido por la estación 2, el tercer grupo estuvo representado por la estación 1 y el cuarto grupo lo constituyo la estación 5, con un comportamiento similar al registrado para la abundancia.
Discusión
Se encontró variación de la temperatura entre las estaciones, las máximas se registraron en las ubicadas en el interior de la laguna, pudiendo ser el resultado de la disminución de la profundidad, un menor efecto de las mareas o una combinación de ambos factores, ya que su ubicación no permite el intercambio de flujos de agua y están regidas por las épocas de lluvias. Las menores temperaturas se registraron en las estaciones 1 y 5, que están directamente comunicadas con el mar. Estas dos estaciones presentan mayor variabilidad en la temperatura y es allí donde se refleja principalmente la incidencia de la época de surgencias.
La laguna es un sistema de salinidad más o menos constante, ya que presentó poca fluctuación (entre 38-42psu). Las máximas salinidades coincidieron con los meses donde se registraron los valores más elevados de temperatura, durante este periodo se producen altos proceso de evaporación, lo que conlleva a un incremento de la temperatura y, como no hay afluentes fluviales, la salinidad sigue el mismo patrón de aumento. Los valores más bajos se presentaron en septiembre, octubre y noviembre 2005, donde se registraron fuertes precipitaciones alcanzando la salinidad valores de 38psu, provocando un descenso en la misma, esto se evidenció porque la abundancia de especies sufrió un drástico descenso en noviembre 2005.
En general, en los cuerpos lagunares con poca profundidad (<1.5m) se da una eficiente mezcla en la columna de agua provocada por los vientos, corrientes y flujos de mareas, en consecuentemente, no existe una estratificación salina ni de temperatura, aunque es posible observar un gradiente en el plano horizontal (Flores et al. 1992), coincidiendo esto con los resultados obtenidos en el presente estudio.
El número de especies (61 en total, 32 moluscos y 29 crustáceos) asociados a las raíces de mangle en la laguna de Bocaripo es similar al reportado por Ordosgoitti (1985) quien señala la presencia de 65 especies de la epifauna en la bahía de Mochima, de las cuales 31 fueron de moluscos y 34 crustáceos, coincidiendo 13 especies con este estudio. Sin embargo, es inferior al compararlo con el de Márquez (2000), la cual observó 100 especies en el golfo de Santa Fe, de las cuales 49 fueron oluscos y 51 crustáceos.
En estudios realizados en otras regiones de Venezuela, Morao (1983) reportó para la laguna de La Restinga, 22 especies de moluscos y 35 de crustáceos, Medina et al. (2005) estudiaron los invertebrados asociados a las raíces del mangle en Caño Neima, Alta Guajira venezolana, estado Zulia, encontrando que dichas raíces son capaces de soportar densidades muy altas de organismos, siendo los copépodos harpacticoides el grupo dominante en la localidad.
En el Caribe colombiano, Reyes & Campos (1992) estudiaron los macroinvertebrados colonizadores en raíces de R. mangle, en la bahía de Chengue, empleando estacas de mangle in situ como sustrato con el fin de comparar la composición de macroinvertebrados colonizadores. Encontraron que la mayoría de las especies colonizadoras de las estacas forman parte de la fauna habitual asociada a las raíces; registrando 15 especies de moluscos y 35 crustáceos, Moreno-Ríos (2007) analizó los moluscos y crustáceos, y su relación frente a la calidad del agua en dos áreas de la bahía de Cispatá, identificando16 especies, seis moluscos y 10 crustáceos. Valle (2007) caracterizó la comunidad de macrofauna recolectadas en Ciénaga de Cholón (Caribe colombiano), reportando un total de 49 especies, 14 pertenecen al Phylum Mollusca y 14 a Arthropoda. Lalana & Ortiz (1992) estudiaron la fauna asociada a manglares de la laguna Guanaroca (Cuba), encontrando 33 especies, donde el grupo dominante estuvo representado por los crustáceos. No obstante es necesario tener en cuenta que estos valores varían de acuerdo a la influencia de los parámetros abióticos existentes en la zona y al tamaño de la muestra, por lo que no es fácil hacer una comparación entre los diferentes estudios.
A pesar de que el número total de especies fue moderado; el número de individuos de la mayoría de las especies fue relativamente bajo, esto puede estar relacionado con la hidrografía de la zona. Esta laguna a diferencia de las otras localidades, no recibe aportes fluviales, sólo aguas de escorrentía en la época de lluvia, ocasionando una baja disponibilidad de nutrientes, como también, una alta competencia entre las especies por espacio y/o alimento, siendo generalmente las variaciones espaciales y temporales de la salinidad y la temperatura del agua los factores abióticos que en mayor medida condicionan la dinámica de las comunidades biológicas asociadas a las raíces del mangle en el sitio de estudio. Uno de los rasgos más comunes de estos ecosistemas es la abundancia relativa de nutrientes y materia particulada, la cual es aprovechada por diversos organismos (Perigó et al. 2006).
Por otro lado, hay que tener en consideración algunos factores ecológicos de la laguna. Generalmente ambientes lagunares cerrados, con poca profundidad en relación a su superficie, son propensos a que los fuertes y frecuentes vientos de la costa faciliten la mezcla de la columna de agua, alcanzando incluso el fondo yresuspendiendo sus sedimentos, comúnmente están turbias (Conde & Rodríguez-Gallego 2002). Algunos organismos no toleran estas condiciones, impidiendo su desarrollo. Lo anterior posiblemente estaría contribuyendo con el bajo número de individuos presentes en la laguna de Bocaripo y en mayor medida en las estaciones ubicadas en el interior.
Los ecosistemas lagunares están influenciados por factores abióticos como la temperatura, salinidad, disponibilidad de nutrientes y cambios de marea, los cuales pueden intervenir en la estructura y composición de la fauna asociada a las raíces sumergidas de mangle rojo. La distribución y abundancia de la fauna asociada, está determinada principalmente por la salinidad (Lopéz 1997). Victoria & Pérez (1979) encontraron en dos localidades del Caribe colombiano, especies de amplia tolerancia a los cambios de salinidad asociados a las raíces de R. mangle, entre los cuales se destacan B. exustus, Isognomon alatus y Pachygrapsus gracilis, además organismos de las especies Crassostrea rhizophorae, Eurypanopeus cf. depressus, P. armatus y Neanthes succinea, que concuerdan con algunas de las especies encontradas en este estudio.
Lalana et al. (1985), destacan la presencia de los pelecípodos Brachidontes citrinus y B exustus, como los más abundantes en las raíces de mangle en las lagunas costeras y de cayos de Cuba, Márquez (2000) señala que las especies más abundantes y mejor adaptadas a los hábitat suministrados por las raíces de R. mangle en el golfo de Santa Fe, fueron los moluscos C. rhizophorae, I. bicolor, I. alatus, B. exustus, Littorina meleagris, O. equestri y Lithophaga aristata; y los crustáceos P. armatus, Synalpheus apioceros, Pilumnus dasypodus, Periclimenes americanus, Mitrax forceps, M. hispidus, P. herbstii y A. pisonii, coincidiendo solamente cuatro con el presente estudio.
Aunque Musculus lateralis fue encontrada para este estudio como la especie más abundante, no es reportada en la mayoría de los estudios como especie típica de raíces de mangle rojo. Portocarrero (2004), cita su presencia en el Caribe colombiano, sin embargo, señala que fue una especie poco común, al igual que O. equestris, I. radiatus y Pinctada cf. imbricata; haciendo referencia a que M. lateralis es una especie que tiene una amplia distribución en el Caribe y que, no es usualmente considerada como parte de la fauna representativa de la biocenosis de las raíces de mangle. Por otro lado, Landa-Jaime (2003), indica que la especie vive comúnmente fijas a colonias de tunicados formando parte de la infauna. Villafranca & Jiménez (2004) reportan a M. lateralis asociada al mejillón verde Perna viridis y la señalan como una especie dominante en sustratos duros. Por lo que es considerada una especie facultativa o no característica de la comunidad de raíces sumergidas de R. mangle.
Los crustáceos cirrípedos también son un grupo estrechamente relacionado a las raíces de mangle (Valle 2007). En el presente estudio, se encontró que Balanus amphitrite, B. improvisus, B. eburneus, B. trigonus, Chthamalus fragilis, Megabalanus tintinnabulum formaban grandes conglomerados en las raíces de las estaciones del interior de la laguna, compitiendo por espacio y alimento con otras especies. Los cirripedios crecen mejor en aguas turbias que en claras, debido a que se alimentan de material en suspensión (Romero-Murillo & Polanía 2008); características que coinciden con estas estaciones en donde la presencia de materia orgánica en suspensión era mayor, en comparación con las estaciones ubicadas en la entrada de la laguna.
Lacerda et al. (2001) describen a los crustáceos como el taxón más representativo e importante dentro de los sistemas de manglar, debido a que intervienen en forma directa con muchos de los procesos de degradación y transformación de la materia orgánica generada por los árboles de mangle. Moreno-Ríos (2007) afirma que la especie más importante para la bahía de Cispatá, es el cirrípedio Balanus eburneus, con un porcentaje del 96.19% del total de los crustáceos contabilizados.
La fauna de epibiontes asociados a las raíces de mangle rojo varía en su estructura, dependiendo de la ubicación con respecto a los límites del sistema, su interacción con los hábitats adyacentes y las migraciones entre los diferentes ambientes presentes en la zona (Reyes & Campos 1992).
Agradecimientos
Los autores agradecen a Jorge Barrios y Ángel Antón por su colaboración en la recolección del material biológico. De igual forma desean agradecer al personal del laboratorio de Ecología Bentónica por su valiosa colaboración.
Abbott, R. 1974. American Seashells. Van Nostrand, Reinhold, Nueva York, EEUU. [ Links ]
Barreto, M. 2001. Análisis estructural de los manglares en el Refugio de Fauna Silvestre Cuare, Estado Falcón, Venezuela. Act. Biol. Vzla. 21: 43-51. [ Links ]
Barrios, J., M. Márquez & M. Jiménez. 2003. Macroalgas asociadas a Rhizophora mangle L. en el golfo de Santa Fe, Estado Sucre, Venezuela. Bol. Inst. Oceanogr. Univ. Oriente 42: 37-45. [ Links ]
Carballo, J. 2000. Distribución de Ecteinascidia turbinata (Ascidiacea: Perophoridae) en los manglares de la Península de Yucatán, México. Rev. Biol. Trop 48: 365-369. [ Links ]
Conde, D., R. Arocena & L. Rodríguez-Gallego. 2002. Recursos acuáticos superficiales de Uruguay: ambientes algunas problemáticas y desafíos para la gestión (I y II). AMBIOS 3: 5-9. [ Links ]
Contreras, F. & O. Castañeda. 2004. La biodiversidad de las lagunas costeras. Ciencias 76: 46-56. [ Links ]
Contreras, F., O. Castañeda & R. Torres. 1997. Hidrología, nutrientes y productividad primaria en las lagunas costeras del estado de Oaxaca, México. Hidrobiológica 7: 9-17. [ Links ]
Corredor, J. 1984. Identificación y análisis de los ecosistemas del Caribe. Interciencia 9: 145-151. [ Links ]
Dawes, C. 1986. Botánica marina. Limusa, México. [ Links ]
Díaz, J.M. & M. Puyana. 1994. Moluscos del Caribe colombiano. Un catálogo ilustrado. COLCIENCIAS, Fundación Natura e INVEMAR, Bogotá, Colombia. [ Links ]
Flores-Verdugo, F., F. González-Farías, D. Zamorano & P. Ramírez-García. 1992. Mangrove ecosystems of the Pacific coasr of Mexico: distribution, structure, litterfall and dstritus dynamics, p. 269-288. In U. Seeliger (ed.). Coastal Plant Communities of Latin America. Academic, Nueva York, EEUU. [ Links ]
Garmendia, M.A. 1992. Distribución y evolución espaciotemporal de elementos nutritivos y materia orgánica presente en aguas de la laguna de Píritu. Trabajo de postgrado, Universidad de Oriente, Cumaná, Venezuela. [ Links ]
Granadillo, L. & L. Urosa. 1984. La familia Balanidae (Cirripedia, Thoracica) en el oriente de Venezuela. Bol. Inst. Oceanogr. Univ. Oriente 23: 15-41. [ Links ]
Kathiresan, K. & L. Bingham. 2001. Biology of mangroves and mangrove ecosystems. Adv. Mar. Biol. 4: 81-251. [ Links ]
Krebs, C. 1989. Ecological Methodology. Harper & Row, Nueva York, EEUU. [ Links ]
Lacerda, L., J. Conde, B. Kjerfve, R. Álvarez-León, C. Alarcón & J. Polanía. 2001. American mangroves, p. 1-62. In L.D. Lacerda (ed.). Mangrove Ecosystem: Function and Management. Springer, Berlín, Alemania. [ Links ]
Lalana, R. & M. Ortiz. 1992. Fauna asociada a mangles de la Laguna Guanaroca, Provincia de Cienfuegos, Cuba. Rev. Invest. Mar. 13: 2-5-214. [ Links ]
Lalana, R., M. Álvarez, M. Ortíz, M. Pérez & T. Veledo. 1985. Organismos asociados a las raíces de mangle, Rhizophora mangle, en lagunas costeras y de cayos. Rev. Invest. Mar. 6: 59-71. [ Links ]
Landa-Jaime, V. 2003. Asociación de moluscos bentónicos del sistema lagunar estuarino Agua Dulce/El Ermitaño, Jalisco, México. Cien. Mar. 29: 169-184. [ Links ]
Lodeiros, C., B. Marín & A. Prieto. 1999. Catálogo de moluscos marinos de las costas nororientales de Venezuela: Clase Bivalvia. Apudons, Caracas, Venezuela. [ Links ]
Lopéz, A. 1997. Caracterización espacio temporal de la taxocenosis Mollusca-Crustacea-Equinodermata en la Ensenada de Pozos Colorados y sectores aledaños. Caribe Colombiano. Tesis de grado, Universidad de Bogotá Jorge Tadeo Lozano, Bogotá, Colombia. [ Links ]
Márquez, B. 2000. Comunidad de moluscos y crustáceos asociados a las raíces sumergidas del mangle rojo Rhizophora mangle (L.) en el golfo de Santa Fe, Estado Sucre, Venezuela. Trabajo de postgrado, Instituto Oceanográfico de Venezuela, Cumaná, Venezuela. [ Links ]
Márquez, B. & M. Jiménez. 2002. Moluscos asociados a las raíces sumergidas del mangle rojo Rhizophora mangle, en el golfo de Santa Fe, Estado Sucre, Venezuela. Rev. Biol. Trop. 50: 1101-1112. [ Links ]
Márquez-Rojas, B., J. Blanco-Rabla, M. Jiménez & T. Allen. 2006. Crustáceos asociados a las raíces del mangle rojo Rhizophora mangle (L.) en el golfo de Santa Fe, Estado Sucre, Venezuela. Ciencia 14: 12-27. [ Links ]
Medina, E. & F. Barboza. 2006. Lagunas costeras del Lago de Maracaibo: distribución, estatus y perspectivas de conservación. Ecotrópicos 19: 128-139. [ Links ]
Medina, P., C. Polo, M. Marín, J. Reyes & A. Godoy. 2005. Isópodos en raíces de mangle rojo (Rhizophora mangle), en Isla San Carlos, Estado Zulia, Venezuela. Bol. Cent. Invest. Biol. 39: 67-79. [ Links ]
Morao, A. 1983. Diversidad y fauna de moluscos y crustáceos asociados a las raíces sumergidas del mangle rojo, Rhizophora mangle en la Laguna de la Restinga. Tesis de grado, Universidad de Oriente, Cumaná, Venezuela. [ Links ]
Moreno-Ríos, C. 2007. Moluscos y crustáceos asociados a las raíces sumergidas de Rhizophora mangle (Linnaeus, 1753) y su relación frente a la calidad del agua en dos áreas de la bahía de Cispatá, "Ciénagas del Ostional y Navío y Ciénaga de la Soledad" (Córdoba), Caribe Colombiano. Trabajo de grado, Universidad de Bogotá Jorge Tadeo Lozano, Bogotá, Colombia. [ Links ]
Ocando, L. 1992. Distribución espacial y temporal de parámetros físico-químicos y materia orgánica en Laguna de Unare, Venezuela, noviembre 1988 - julio 1989. Trabajo de postgrado, Universidad de Oriente, Cumaná, Venezuela. [ Links ]
Okuda, T., J. Benítez, A. García & E. Fernández. 1968. Condiciones hidrográficas y químicas en la bahía de Mochima y la Laguna Grande del Obispo, desde 1964 a 1966. Bol. Inst. Oceanogr. Univ. Oriente 7: 7-37. [ Links ]
Oliveros, L. 1984. Evaluación de la ictiofauna presente en la Laguna de Bocaripo, Estado Sucre, Venezuela. Trabajo de grado, Universidad de Oriente, Cumaná,Venezuela. [ Links ]
Ordosgoitti, R. 1985. Estudio ecológico de la epifauna en raíces sumergidas del mangle Rhizophora mangle en la bahía de Mochima. Trabajo de grado, Universidad de Oriente, Cumaná, Venezuela. [ Links ]
Palazón-Fernández, J. 2000. Condiciones hidroquímicas del saco de la Isla de Coche, Venezuela, mayo 1989 mayo 1990. Bol. Inst. Oceanogr. Univ. Oriente 39:5 5-65 [ Links ]
Perigó, A., E. Perigó, J.F. Montalvo, E. Chang, M.E. Cesar & R. García. 2006. Evaluación de factores hidroquímicos indicadores de contaminación orgánica en la laguna costera El Doctor, Playa Baracoa. Cuba. Rev. Cubana Invest. Pesq. 36: 12-16. [ Links ]
Portocarrero, M. 2004. Estudio de la comunidad de moluscos epibiontes sobre raíces sumergidas del mangle rojo (Rhizophora mangle) en Isla Barú. Caribe Colombiano. Trabajo de grado, Universidad Nacional de Colombia, Bogotá, Colombia. [ Links ]
Prieto, A., C. Tineo; L. Ruiz & N. García. 2006. Moluscos asociados a sustratos someros en la Laguna de Bocaripo, Estado Sucre, Venezuela. Bol. Centro Invest. Biol. 40: 1-19. [ Links ]
Ramírez, P. 1996. Lagunas costeras venezolanas. Benavente y Martínez, Porlamar, Venezuela. [ Links ]
Reyes, R. & N. Campos. 1992. Macroinvertebrados colonizadores de raíces de Rhizophora mangle en la bahía de Chengue, Caribe Colombiano. An. Inst. Invest. Mar. Punta Betín 21: 101-116. [ Links ]
Romero-Murillo, P. & J. Polanía, 2008. Sucesión temprana de la taxocenosis Mollusca-Annelida-Crustacea en raíces sumergidas de mangle rojo en San Andrés Isla, Caribe colombiano. Rev. Biol. Mar. Oceanogr. 43: 63-74. [ Links ]
Sokal, R. & F. Rohlf. 1979. Biometría y principios y métodos estadísticos en la investigación biológica. Blum, Madrid, España. [ Links ]
Steel, R. & J. Torrie. 1960. Principles and Procedures in Statistics. McGraw-Hill, Nueva York, EEUU. [ Links ]
Sutherland, J. 1980. Dynamics of the epibenthic community on roots of the mangrove Rhizophora mangle, at bahía de Buche, Venezuela. Mar. Biol. 58: 75-84. [ Links ]
Valecillos, I. 1993. Estructura de la comunidad de peces del sistema costero Chacopata-Bocaripo, Península de Araya, Estado Sucre, Venezuela. Trabajo de grado,Universidad de Oriente, Cumaná, Venezuela. [ Links ]
Valle, A. 2007. Estructura del bosque de manglar y algunos aspectos sobre la fauna asociada a las raíces de Rhizophora mangle (L., 1773) en la Ciénaga de Cholón, Isla Barú, Municipio de Cartagena, Caribe Colombiano. Trabajo de grado, Universidad de Bogotá Jorge Tadeo Lozano, Bogotá, Colombia. [ Links ]
Victoria, C. & M. Pérez. 1977. Los taxa Annelida-Mollusca- Crustacea en las raíces sumergidas del mangle rojo en dos áreas costeras del Caribe colombiano. Inf. Mus. Mar. 21: 1-27. [ Links ]
Villafranca, S. 2007. Malacofauna en raíces sumergidas del mangle rojo Rhizophora mangle en la laguna hipersalina de la Restinga, Isla de Margarita, estado Nueva Esparta, Venezuela. Trabajo de Ascenso, Universidad de Oriente, Cumaná, Venezuela. [ Links ] Villafranca, S. & M. Jiménez. 2004. Abundancia y diversidad de moluscos asociados al mejillón verde Perna viridis (Bivalvia: Mytilidae) en Guayacán, Edo. Sucre, Venezuela. Bol. Inst. Oceanogr. Univ. Oriente 43: 65-76. [ Links ] Werding, B. 1977. Los porcelanidos (Crustacea: Anomura: Porcellanidae) de la región de Santa Marta, Colombia. An. Inst. Inv. Mar. Punta Betín 9: 173-214. [ Links ] Williams, A. 1984. Shrimps, Lobsters, and Crabs of the Atlantic Coast of the Eastern United State, Maine to Florida. Smithsonian, Washington, D.C., EEUU. [ Links ] Yáñez-Arancibia, A., R. Twilley & A. Lara-Domínguez. 1998. Los ecosistemas de manglar frente al cambio climático global. Madera y Bosques 4: 3-19. [ Links ]
Mayré Jiménez Prieto. Instituto Oceanográfico de Venezuela, Universidad de Oriente; Mayrej@gmail.com
Luisana Pereda2 & Thays Allen. Instituto Oceanográfico de Venezuela, Universidad de Oriente; Mayrej@gmail.com