Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.58 suppl.3 San José Oct. 2010
Distribución de esponjas (Porifera) a lo largo de un gradiente de profundidad en un arrecife coralino, Parque Nacional San Esteban, Carabobo, Venezuela
Mónica Núñez Flores1, José Gregorio Rodríguez-Quintal1 & María Cristina Díaz2
1. Departamento de Biología, Facultad de Ciencias y Tecnología, Apartado 2005, Universidad de Carabobo, Valencia, Venezuela. Tel: (058241) 990-63-88; nuez.monica@gmail.com; jgrodrigu@uc.edu.ve
2. Museo Marino de Margarita. Boca del Río, Venezuela. Tel: (058246); taxochica@gmail.com
Abstract
Sponges (Porifera) distribution along a depth gradient in a coral reef, Parque Nacional San Esteban, Carabobo, Venezuela. Sponges constitute one of the most diverse and abundant animal groups in the marine tropical benthos especially in coral reefs, though poorly studied to species level. The aim of this study is to characterize the sponge community along a depth gradient at Isla Larga (Parque Nacional San Esteban, Venezuela) fringe reef. Net and total sedimentation, roughness index, sponge species richness, density and proportion of the bottom covered by sponges, were evaluated at seven depths (1, 3, 6, 9, 12, 15, 18m), 17 species were identified grouped in 10 demosponges families. The highest densities and coverage corresponded to 6m of depth (6.03ind/m2; 11%), that coincides with the lowest net sedimentation and highest substrate heterogeneity. Most abundant species were Desmapsamma anchorata, Amphimedon erina and Scopalina rueztleri. Principal component analysis divided this community in three zones according to depth. The shallow zone of the reef (1 and 3m), where wave force and high irradiance exert a constant "stress sponges, shows the lowest density and coverage by sponges. In contrast, medium depth (6, 9 y 12m) and deep zone (15 y 18m) with lower light and sedimentation levels seem to enhance sponge growth and survival that are reflected on the higher densities and coverage of sponges. Rev. Biol. Trop. 58 (Suppl. 3): 175-187. Epub 2010 October 01.
Key words: coral reef, Porifera, distribution pattern, net sedimentation, Venezuela.
Resumen
Las esponjas son uno de los grupos de animales sésiles más abundantes y diversos de los fondos marinos tropicales, siendo un componente importante en los arrecifes coralinos, aunque poco estudiado a nivel de especies. El objetivo de este estudio fue caracterizar la comunidad de esponjas en el gradiente de profundidad de un arrecife coralino en Isla Larga, Parque Nacional San Esteban, Venezuela. Se trabajaron siete profundidades (1, 3, 6, 9, 12, 15 y 18m) donde se midió la sedimentación neta y bruta, el índice de rugosidad, y se evaluó la riqueza, densidad y cobertura de las esponjas. Se identificaron 17 especies en 10 familias. La mayor densidad y cobertura se encontró a los 6m (6.03ind/m2, 11%), coincidiendo con la mínima sedimentación neta y la máxima rugosidad del sustrato. Las especies más abundantes fueron Desmapsamma anchorata, Amphimedon erina y Scopalina rueztleri. El análisis de componentes principales arrojó una separación de esta comunidad en 3 zonas, la somera (1 y 3m), donde las esponjas están sometidas a una tensión producida por el oleaje y alta iluminación, y las zonas media (6, 9 y 12m) y profunda (15 y 18m), con características más favorables, dada una menor iluminación y sedimentación.Palabras clave: arrecife coralino, Porifera, patrón de distribución, sedimentación neta, Venezuela.
Por ser organismos de vida sésil, las esponjas han desarrollado estrategias como la capacidad de producir defensas químicas para evitar la depredación y competencia por espacio, así como inhibidores del asentamiento larvario. Estos compuestos determinan que muchas especies sean económicamente importantes, ya que los mismos son utilizados en la preparación de productos con valor farmacológico (Carballo 2001). Esto destaca la importancia de conocer su diversidad, donde si bien han sido descritas unas 15.000 especies, se estima que el valor real es mucho más alto (Hooper & Van Soest 2002).
En los arrecifes coralinos, los estudios tanto taxonómicos como de distribución y abundancia de las esponjas, son escasos en comparación con otros organismos (Rützler 1978), lo que se debe a las dificultades que implican su identificación y cuantificación en el campo (Díaz & Rützler 2001). Es por ello que la mayoría de los trabajos de caracterización arrecifal, las incluyen como una categoría bentónica y no se reportan las especies de esponjas presentes ni su estructura en el gradiente de profundidad, donde suelen presentar patrones de distribución verticales y horizontales, producto de la interacción con factores como el tipo de sustrato, disponibilidad de luz, profundidad y sedimentación (Sara & Vacelet 1973, Rogers 1990, Rützler 2004).
En Venezuela las comunidades de esponjas también han sido poco estudiadas, existiendo localidades donde la información es escasa o simplemente inexistente. Este es el caso de los arrecifes coralinos que se encuentran en la costa del estado Carabobo. El objetivo de este trabajo es estudiar la estructura de la comunidad de esponjas asociadas al arrecife coralino de Isla Larga, en el Parque Nacional San Esteban, determinando los factores que podrían estar contribuyendo a su presencia o ausencia en el arrecife.
Materiales y métodos
El presente estudio se llevo a cabo en Isla Larga (10°29´9.78" N-67°56´0.58" W), Parque Nacional San Esteban, el cual se encuentra ubicado en el tramo occidental de la Serranía del Litoral de la Cordillera de la Costa en el Estado Carabobo (Novo et al. 1997).
Se midió la tasa de sedimentación neta con trampas bajas (5cm de altura) y la bruta con trampas altas (15cm), Las trampas altas permiten medir la cantidad de sedimento bruto que se deposita en el área por unidad de tiempo, es decir, todo el material sedimentado que no es resuspendido y transportado por movimientos de aguas locales, ya que evita la pérdida del material depositado. Las trampas bajas son para estimar la cantidad de sedimento neto que es depositado en un área particular por unidad de tiempo y en las mismas si se da la resuspensión del sedimento, para ello se colocaron 3 repeticiones de cada par en los diferentes niveles de profundidad y se recambiaron cada 15 días. Cada muestra de sedimento fue lavada con el fin de eliminar las partículas de sal incineradas (24h; 560°C) para reducir la materia orgánica. Finalmente cada muestra fue pesada obteniéndose así la cantidad de sedimento (g/ m2/día) en los siete niveles de profundidad.
La identificación de las esponjas se realizó utilizando la guía de identificación de algunos invertebrados marinos de Bocas del Toro, Panamá (Collin et al. 2006). En campo se colectaron tres ejemplares por especie, que fueron preservados en etanol al 70% en agua de mar para su traslado al laboratorio. Posteriormente se determinó en cada ejemplar la presencia, distribución y tamaño de especializaciones morfológicas y funcionales del ectosoma, coanosoma y del esqueleto (tipos de espículas, naturaleza química, forma y tamaño de las mismas) utilizando claves taxonómicas y monografías (Wiedenmayer 1977, Van Soest 1978, 1980, 1984, Zea 1987, Díaz et al. 1993, Lenhnert & Van Soest 1998, Hooper & Van Soest 2002).
Se realizó un análisis de correlación de Spearman entre la rugosidad del sustrato y la riqueza de especies en cada una de las profundidades para corroborar si existe alguna relación directa entre ambos parámetros.
Se realizó un análisis de similitud entre las profundidades y la cobertura de cada una de las especies para lo cual se utilizo el coeficiente de Sorensen.
Finalmente se realizó un análisis de componentes principales sin rotación de ejes para analizar las diferencias de comunidades en relación con las características del medio, tomando en cuenta la identidad de las especies, a la matriz de coberturas de las diecisiete especies para observar gráficamente si existen relaciones entre la cobertura de las esponjas y los niveles de profundidad estudiados.
Resultados
Clase: Demospongiae
Orden: Halichondrida
Familia: Dictyonellidae
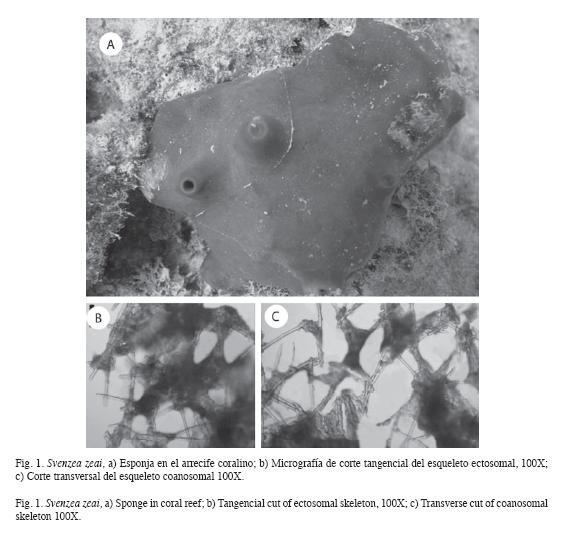
Forma: Masiva, incrustante gruesa, lobulada o ramosa (Fig. 1a).
Color: En vivo marrón rojizo externamente y beige internamente. En alcohol beige.
Consistencia: Compresible, fácil de rasgar.
Superficie: Muy lisa.
Ectosoma: Retículo multiespicular formando pequeñas mallas de diversas formas, con muy poca espongina (Fig. 1b).
Coanosoma: Presenta un patrón desorganizado. Gran cantidad de células granulosas pigmentadas que dificultan la observación de la arquitectura (Fig. 1c).
Espículas: Megascleras de tipo estilos y estilos curvados (estiloides) 110-240 (226.4)μm de altura x 6.6-11μm de ancho. Oxeas 109-220 (164.5)μm de altura x 5.0-11 (8)μm de ancho.
Ecología: Esta especie fue encontrada a 18 m de profundidad sobre coral muerto.
Referencias: Los especímenes estudiados coinciden con las descripciones realizadas por Álvarez, Van Soest & Rützler 1998.
Material: Depositado en el Museo de Biología de la UC, Colección Porífera, Universidad de Carabobo, Naguanagua Bárbula, Carabobo-Venezuela. Código: CPOR-016 (1p).
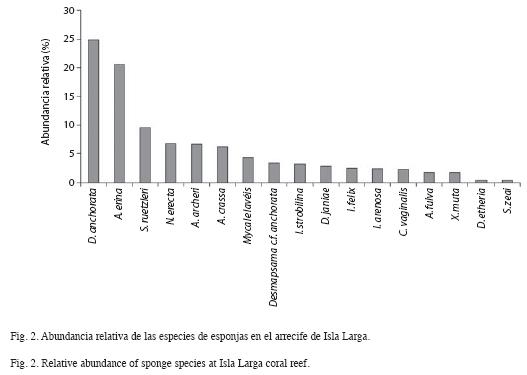
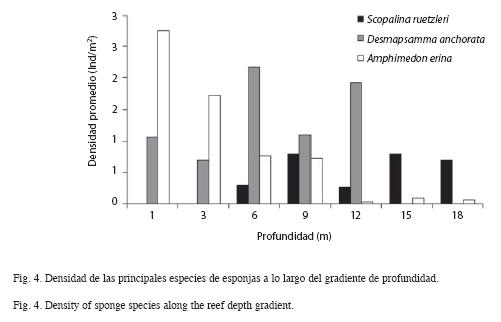
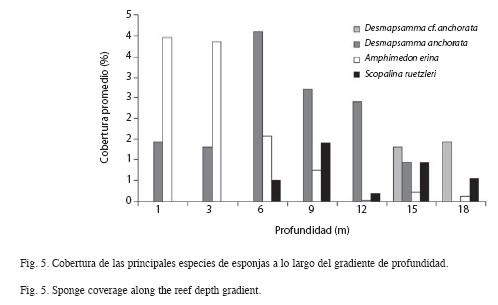
En cuanto al patrón de distribución de las especies a lo largo del gradiente de profundidad, se observó un primer grupo de esponjas conformado por Callyspongia vaginalis, Dysidea janiae e Ircinia strobilina. Estas especies están distribuidas homogéneamente a lo largo de todo el gradiente, pues no presentan variaciones en sus densidades (F=1.08; p>0.05). El segundo grupo de especies mostró también una distribución amplia, pero su abundancia varió significativamente a lo largo del gradiente. Entre estas especies destacan: A. erina, D. anchorata, S. ruetzleri, Aplysina archeri, Niphates erecta, Ircinia felix, Aiolochroia crassa, Iotrochota arenosa y Mycale laevis. Entre este grupo de esponjas D. anchorata fue una de las más abundantes, principalmente a los 6m de profundidad (2.17ind/m2) (Fig. 4). Otra especie fue A. erina, la cual presentó su mayor densidad a 1m (2.77ind/m2) y S. ruetzleri, cuya densidad fue mayor a los 15m (0.80ind/m2) (Fig. 4). El tercer grupo de mostró estar restringido a la zona media del arrecife, entre las que destacan Aplysina fulva, D. etheria, X. muta ,Desmapsamma cf. anchorata y S. zeai.
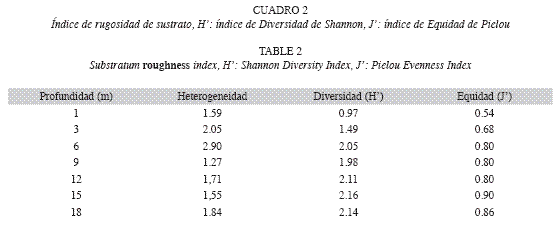
La mayor diversidad se registró a 18 m de profundidad, seguida de 15 y 12m (Cuadro 2). Según el diagrama de inferencia de severidad y pronosticabilidad ambiental, (Alcolado 1999) a grandes rasgos, se observa que a 1m la comunidad de esponjas se encuentra sometida a un ambiente muy severo y no pronosticable; a 3m como severo y no pronosticable; a 6m como algo severo y constante; a 9m como algo severo y casi constante y finalmente a 12, 15 y 18m como algo severo y constante.
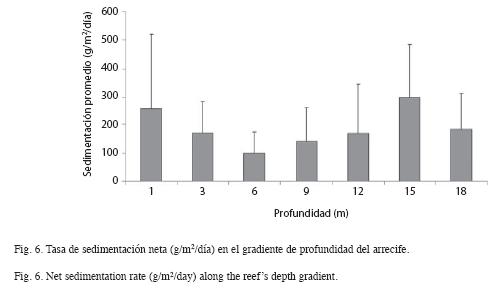
La tasa de sedimentación bruta no presentó diferencias a lo largo del gradiente de profundidad, mientras que la sedimentación neta varió con la profundidad (F=2.69, p<0.05), obteniéndose la mayor tasa a 15m (299g/m2/ día) y la menor a 6m (99g/m2/día) (Fig. 6).
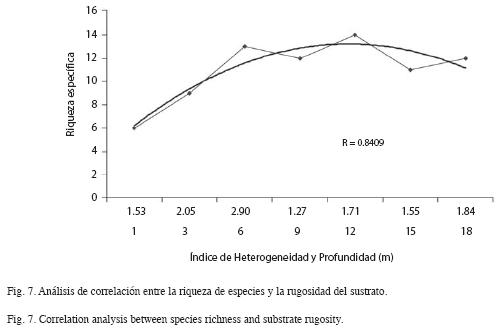
Esta disminución en la sedimentación neta coincide con un aumento en la riqueza de especies de esponjas (13 especies), así como con el máximo índice de rugosidad del sustrato (2.96) (Cuadro 2). Adicionalmente, se observó una correlación alta entre la rugosidad del sustrato y la riqueza de especies a lo largo del gradiente de profundidad (Spearman R=0.841). En este caso, ambos parámetros aumentan hacia las zonas de profundidad intermedia (6, 9 y 12m) y posteriormente disminuyen hacia las zonas más profundas (Fig. 7).
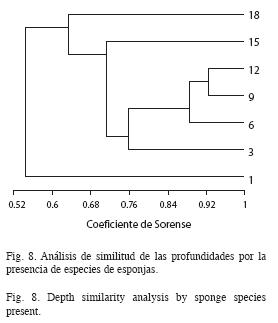
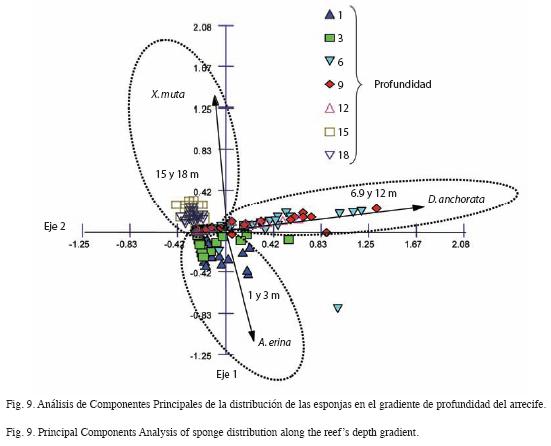
El dendograma del análisis de similitud con el coeficiente de Sorensen (Fig. 8), muestra una separación de las profundidades, de acuerdo a la presencia de especies, en tres grupos. El mayor valor de similitud se da entre las profundidades medias (3, 6, 9 y 12m), seguidas por las más profundas (15 y 18m), quedando finalmente el estrato somero, de 1m aislado. Un resultado similar se obtiene cuando se realiza un análisis de componentes principales (Fig. 9) con la abundancia de las especies de esponjas en los diferentes niveles de profundidad. Este análisis reveló una separación de las profundidades en tres zonas, presentándose un estrato somero (1 y 3m) representado por A. erina, un estrato medio (6, 9 y 12m), representado por D. anchorata y uno profundo (15 y 18m), representado por X. muta. A diferencia del análisis de similitud, aquí 3m se agrupa con el estrato somero de 1m, sin embargo se debe destacar que en el análisis de similitud, 3m es la profundidad más disímil del grupo de profundidades intermedias.
Discusión
La distribución de las esponjas en el gradiente de profundidad, así como su presencia en un tipo de hábitat varía de una especie a otra y según Sara & Vacelet (1973) y Rützler (2004), esta se pueden ver afectada por diversos factores físicos, entre los cuales la sedimentación y rugosidad del sustrato podrían ser determinantes. Durante este estudio, la sedimentación neta fue mayor en la zona somera (1 y 3m) y menor en la zona media (6, 9 y 12m), donde hay una mayor resuspensión de los sedimentos. Esto coincidió con un aumento en la abundancia y en la riqueza de especies de esponjas, así como con el mayor índice de rugosidad del sustrato.
La complejidad del sustrato es un factor importante en la abundancia de las esponjas (Sara & Vacelet 1973), dado que la presencia de relieves o cierta heterogeneidad, parece ser favorable para la fijación de las mismas. En la zona intermedia, la resuspensión del sedimento podría ser causada por la poca profundidad, la ausencia de una barrera física y el movimiento del agua; evitando el enterramiento de las esponjas esto junto con la heterogeneidad del arrecife, podrían favorecer la diversidad a esta profundidad.
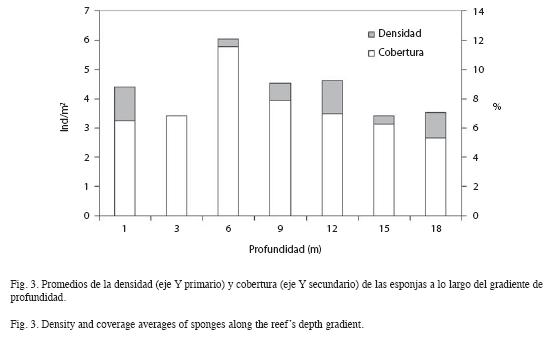
En general se observa el predominio de unas pocas especies en el intervalo de profundidad entre 1 y 3m. A profundidades cercanas a 1m, las esponjas se encuentran sometidas a una tensión constante producida por el oleaje y la iluminación, dado que a poca profundidad los rayos solares inciden con mayor intensidad. En esta zona suelen subsistir especies bien adaptadas, capaces de aprovechar al máximo los recursos disponibles (Díaz et al. 1985, Alcolado 1999). Esto podría explicar la predominancia de especies con forma de crecimiento incrustantes o rastreras (A. erina y D. anchorata), que soportan la acción mecánica de la corriente mejor que las formas de crecimiento masivas o tubulares de gran tamaño. A los 3m, las condiciones son muy similares a las anteriores, pero la intensidad de estos factores disminuye un poco. A partir de los 6m de profundidad, las condiciones ambientales parecen más favorables, pues se registró un mayor número de especies (13) y una mayor densidad y cobertura de esponjas (6.03ind/m2, 11%), lo cual coincide también con la mínima sedimentación neta y la máxima heterogeneidad del sustrato.
El estrato medio (6, 9 y 12m) es representado por D. anchorata y el profundo (15 y 18m) donde domina X. muta, definidos como ambientes menos severos y constantemente favorables. A estas profundidades las tensiones ambientales (luz, oleaje y sedimentación) disminuyen y son los factores bióticos mencionados por Reiswig (1973) tales como el ciclo vital de cada especie, la respuesta de cada estado de desarrollo a los retos ambientales, productividad de los huevos, tropismo y la longevidad de las larvas, los que sugieren una mayor probabilidad de colonización del sustrato y heterogeneidad del mismo, los mecanismos reguladores principales de esta zona. Se debe destacar que la separación de estos dos estratos con características ambientales similares, se debe a la presencia exclusiva de las especies S. zeai y Desmapsamma c.f anchorata en el estrato profundo, que si bien no son las más representativas determinan esta separación.
Referencias
Alcolado, P. 1979. Estructura ecológica de la comunidad de esponjas en un perfil costero de Cuba. Cienc. Biol. 3: 105-127. [ Links ]
Alcolado, P. 1990. General features of Cuban sponge communities, p. 351-357. In K. Rützler (ed.). New Perspective in Sponge Biology. Smithsonian, Washington D.C., EEUU. [ Links ]
Alcolado, P. 1999. Comunidades de esponjas de los arrecifes del archipiélago Sabana-Camagüey, Cuba. Bol. Invest. Mar Cost. 28: 95-124. [ Links ]
Álvarez, B. & M. Díaz. 1985. Las esponjas de un arrecife coralino en el Parque Nacional Archipiélago de los Roques: Taxonomía y Ecología. Trabajo Especial de Grado, Universidad Central de Venezuela, Caracas, Venezuela. [ Links ]
Álvarez, B., R.W.M. van Soest & K. Rützler. 1989. A revision of Axinellidae (Porifera: Demospongiae) of the Central West Atlantic region. Smithsonian Contr. Zool. 598: 47. [ Links ]
Amaro, M. & I. Liñero. 2002. Desmospongiae (Porifera) de Isla Larga, Bahía de Mochima, Venezuela. Trabajo de Ascenso a la categoría de Asistente. Universidad de Oriente. Bol. Inst. Ocean. Vzla. 41: 45-53. [ Links ]
Carballo, J. 2002. Los organismos marinos y las moléculas bioactivas. Perspectiva actual, p. 83-115. In A.J. Laborda (ed.). El mar como fuente de moléculas bioactivas. Secretariado de Publicaciones Universidad de León, León, España. [ Links ]
Collin, R., M. Diaz, J. Norenburg, R. Rocha, J. Sanchez, A. Schulze, M. Schwartz & A. Valdes. 2006. Photographic identification some common marine invertebrates of Bocas del Toro, Panamá. Carib. J. Sci. 41: 638-707. [ Links ]
Connell, J. 1978. Diversity in tropical rain forests and coral reef. Science 199: 1302-1310. [ Links ]
Díaz, H., M. Bevillacqua & D. Bone. 1985. Esponjas en mangles del Parque Nacional Morrocoy. Editorial Científica Venezolana, Coro, Venezuela. [ Links ]
Díaz, M., R.W.M. van Soest & S. Pomponi. 1993. A systematic revision of the Central Atlantic Halichondrids (Demospongiae, Porifera). Part. II . Description of valid species. Scien. Mar. 57: 283-306. [ Links ]
Díaz, M. & K. Rützler. 2001. Sponge: an essential component of Caribbean coral reefs. Bull. Mar. Sci. 69: 535-546. [ Links ]
Guzmán, H.M. & C. Guevara 1998. Arrecifes coralinos de Bocas del Toro, Panamá: II . Distribución, estructura y estado de conservación de los arrecifes de las Islas Bastimentos, Solarte Carenero y Colón. Rev. Biol. Trop. 46: 1-25. [ Links ]
Hooper, J. & R.W.M. van Soest. 2002. Systema Porifera. A Guide to the Classification of Sponges. Plenum, Nueva York, EEUU. [ Links ]
Lehnert, H. & R.W.M. van Soest. 1998 Shallow water sponges of Jamaica. Beufortia 48: 71-103. [ Links ]
Loya, Y. 1972. Community structure and species diversity of hermatipic corals. Mar. Biol. 13: 100-123. [ Links ]
Luckhurst, B. & K. Luckhurst. 1978. Analysis of the influence of substrate variables on coral reef fish communities. Mar. Biol. 49: 317-323. [ Links ]
Mclean, E. & P. Yoshioka. 2008. Substratum effects on the growth and survivorship of the sponge Desmapsamma anchorata. Carib. J. Sci. 44: 83-89. [ Links ]
Novo, I., L. Morales, C. Rodríguez, G. Martínez & I. de Hertelendy (eds.). 1997. Ciencia y conservación en el Sistema de Parques Nacionales de Venezuela. Una experiencia de cooperación institucional. Econaturas, Caracas, Venezuela. [ Links ]
Olivares, M. 1976. Estudio taxonómico de algunas Desmospongias (Porifera) de la Bahía de Mochima, Sucre, Venezuela. Trabajo de Ascenso, Universidad de Oriente, Margarita, Venezuela. [ Links ]
Pauls, S. 1998. Estudio sistemático y biodiversidad de Porifera y Cnidaria en la Bahía Ciénega de Ocumare de la Costa, Parque Nacional Henri Pittier. Trabajo de Ascenso, Universidad Central de Venezuela, Caracas, Venezuela. [ Links ]
Pauls, S. 2007. Abundancia y diversidad de esponjas de las comunidades coralinas de la Bahía de Turiamo, Litoral central. Libro de resúmenes VII Congreso Venezolano de Ecología, Ciudad Guayana 533: 367. [ Links ]
Porter, J. 1972. Patterns of species diversity in Caribbean reefs coral. Ecology 53: 745-748. [ Links ]
Reiswig, H. 1973. Population dynamics of three Jamaican Desmospongiae. Bull. Mar. Sci. 23: 191-226. [ Links ]
Rogers, C. 1990. Responses of coral reefs and reefs organisms to sedimentation. Mar. Ecol. Prog. Ser. 62: 185-202. [ Links ]
Romero, M. 2004. Evaluación de la condición de las comunidades de esponjas en tres localidades del Parque Nacional Morrocoy, haciendo énfasis en la prevalencia de síndromes/ enfermedades. Trabajo Especial de Grado, Universidad Central de Venezuela, Caracas, Venezuela. [ Links ]
Rützler, K. 1978. Sponges in coral reefs, p. 299-313. In D. Stoddard & R. Johannes (eds.). Coral Reefs: Research Methods. Monogr. Oceanogr. Method. 5. UNESCO, Paris, Francia. [ Links ]
Rützler, K. 2004. Sponges on coral reefs: A community shaped by competitive cooperation. Boll. Mus. Ist. Biol. Univ. Genova 68: 85-148. [ Links ]
Sara, M. 1970. Competition and co-operation in sponge populations, p. 273-284. In W. Fry (ed.). The Biology of the Porifera. Symp. Zool. Soc. London. Academic, London, Nueva York, EEUU. [ Links ]
Sara, M. & M. Vacelet. 1973. Ecologie des Demosponges, 462-576. In P.P. Grassé (ed.), Traite de Zoologie. Anatomie, Systematique, Biologie. Masson & Cie., Paris, Francia. [ Links ]
van Soest, R.W.M. 1978. Marine sponges from Curaçao and other Caribbean localities. Part I. Keratosa. Stud. Fauna Curaçao Carib. Isl. 56: 124. [ Links ]
van Soest, R.W.M. 1980. Marine sponges from Curaçao and other Caribbean localities. Part II . Haposclerida. Stud. Fauna Curaçao Carib. Isl. 62: 172. [ Links ]
van Soest, R.W.M. 1984. Marine sponges from Curaççao and other Caribbean localities. Part II . Poecilosclerida. Stud. Fauna Curaçao Carib. Isl. 66: 187. [ Links ]
Villamizar, E., J. Perez, H. Camisotti. 2008. Proyecto conservando arrecifes coralinos pristinos del Caribe: Investigación y educación ambiental en el Parque Nacional Archipiélago de los Roques. Informe final, CI-FCLR, Universidad Central de Venezuela, Caracas, Venezuela. [ Links ]
Wiedenmayer, F. 1977. Shallow-water sponges of the Western Bahamas. Birkhäuser, Basel, Stuttgart, Alemania. [ Links ]
Wilkinson, C. & J. Vacelet. 1979. Trasplatation of marine sponges to different conditions of light and current. J. Exp. Mar. Biol. Ecol. 37: 91-104. [ Links ]
Zea, S. 1987. Esponjas del Caribe colombiano. Dictyoceratida, Dendroceratida, Verongida, Haplosclerida, Poecilosclerida, Halichondrida, Axinellida, Desmophorida y Homosclerophorida. Editorial Catálogo Científico, Bogotá, Colombia. [ Links ]
Zea, S. 2001. Patterns of sponge (Porifera, Demospongiae) distribution in remote, oceanic reef complexes of the southwestern Caribbean. Rev. Acad. Col. Cien. 25: 579-592. [ Links ]
Correspondencia: Mónica Núñez Flores. Departamento de Biología, Facultad de Ciencias y Tecnología, Apartado 2005, Universidad de Carabobo, Valencia, Venezuela. Tel: (058241) 990-63-88; nuez.monica@gmail.com
José Gregorio Rodríguez-Quintal. Departamento de Biología, Facultad de Ciencias y Tecnología, Apartado 2005, Universidad de Carabobo, Valencia, Venezuela. Tel: (058241) 990-63-88; jgrodrigu@uc.edu.ve
María Cristina Díaz. Museo Marino de Margarita. Boca del Río, Venezuela. Tel: (058246); taxochica@gmail.com
Recibido 02-VII-2009. Corregido 22-I-2010. Aceptado 12-VII-2010.