Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.58 n.1 San José Mar. 2010
Histología gonadal y criterios fenotípicos de maduración en las tortugas marinas Chelonia mydas y Eretmochelys imbricata (Testudines: Chelonidae) de Cuba
Emir Pérez1, Ariel Ruiz2*, Georgina Espinosa3 & Idania Lee4
1. Departamento de Biología Animal y Humana, Facultad de Biología, Universidad de La Habana. Calle 25, No. 455, Vedado, La Habana, Cuba. CP 10400; emirbiocel@fbio.uh.cu
2. Centro de Investigaciones Marinas, Universidad de La Habana. Calle 16, No. 114, Miramar, Playa, La Habana, Cuba. CP 11300; ariel.urquiola@cim.uh.cu * Autor de correspondencia.
3. Departamento de Bioquímica, Facultad de Biología, Universidad de La Habana. Calle 25, No. 455, Vedado, La Habana, Cuba. CP 10400; georgina@fbio.uh.cu
4. Empresa Pesquera Industrial Camagüey, EPICAM. Albaisa # 191, Esq. Martí, Nuevitas, Camagüey, Cuba. CP 7510; idanialee@epicam.telemar.cu
Abstract: Gonadic histology and phenotypical maturation criteria in the marine turtles Chelonia mydas and Eretmochelys imbricata (Testudines: Chelonidae) from Cuba. Gonad maturity is usually evaluated through macroscopic analysis of the gonads. In sea turtles, the maturation stages are associated with body size, depending on the studied marine stock. Fishermen classify turtles bigger than 65.0cm as sexually mature. If they have secondary sex characters they are recorded as breeding males. We compared body size with macroscopic and microscopic gonad characteristics in two Cuban turtles. Eighteen individuals of C. mydas and twenty of E. imbricata was obtained from the legal fishery stock of Jardines del Rey Archipelago (Cuba), from October 2005 and 2006. In males, breeding condition (maximum spermiogenesis) was checked by histological analysis of the testes. In females, sexual maturity was identified by the presence of vitellogenic follicles or ovarian corpora. Most males were immature (C. mydas: 79.0cm; E. imbricata: 73.1±4.9cm, n=3) and lacked secondary sex characters. Some E. imbricata without a developed penis were in spermatogenic stages II to IV (i.e. pubescent). Most females were immature (C. mydas: 79.6±7.7cm, n=17; E. imbricata: 69.0±7.1cm, n=16; i.e.prepubescent and pubescent. The prepubescent females had ovaries with previtellogenic follicles near 1.0mm in a compact and yellowish stroma. The pubescent females had ovaries with previtellogenic follicles between 2.0 and 3.0mm. The stroma was more loosened and irrigated than in prepubescent turtles. The finding of spermatogenic activity in pubescent males indicates asynchrony between testicular and penial development in E. imbricata. The current phenotypical approach used by fishermen is not enough to determine sexual maturation in these turtles. The minimal size tentatively should be changed to: C. mydas: above 93.0cm and E. imbricata above 79.0cm. Rev. Biol. Trop. 58 (1): 287-298. Epub 2010 March 01.
Key words: sea turtles, straight carapace length, sexual maturity, breeding condition, previtellogenic follicle, spermatogenesis, fishing practice.
El estado de maduración y la talla, así como el dimorfismo sexual, constituyen variables claves para estudios ontogenéticos y para el manejo de recursos renovables. A menudo, la madurez sexual se reconoce como sinónimo de adultez (D’ Ancona 1960). Sin embargo, para el manejo de especies silvestres con estacionalidad reproductora resulta conveniente tratar por separado la madurez sexual de la reproductora. La madurez sexual, se define como el desarrollo orgánico alcanzado por el individuo que le permite reproducirse y generalmente marca su forma adulta (D’ Ancona 1960). En machos de tortugas marinas, los individuos maduros sexualmente pueden ser identificados fenotípicamente por la presencia de una cola con el segmento caudal precloacal alongado, el cual guarda en su seno el pene completamente desarrollado (Wibbels et al. 1990, Owens 1997, Wyneken 2004). Otro carácter importante en la identificación del sexo es la presencia de la uña del segundo dedo fuertemente curvada. En las hembras, los principales caracteres fenotípicos usados para determinar su madurez sexual, han sido la presencia de folículos vitelogénicos amarillos y vascularizados mayores de tres milímetros, huellas de ovulación, y la presencia de huevos en el oviducto (Hamann et al. 2003, Wyneken 2004).
Las tallas mínimas de madurez sexual informadas para tortugas marinas varían según el área, hábitat, el sexo y la especie. En Chelonia mydas (Linnaeus 1758) según Lee (2009) el largo recto del carapacho (LRC) mínimo estimado para un área marina de agregación cerca de las Islas de Hawai fue 81.0cm (Balazs 1995), mientras que en el sur de la Gran Barrera coralina australiana el largo curvo del carapacho (LCC) mínimo se estimó en 95.0cm (Limpus & Chaloupka 1997). En hembras adultas de Eretmochelys imbricata (Linnaeus 1766) han sido informados LRC mínimos entre 51.0 (Moncada et al. 1999) y 69.7cm (León & Diez 1999) para áreas marinas de agregación en Las Antillas, mientras que en machos el LRC mínimo registrado para la misma área fue de 67.0cm (Moncada et al. 1999).
Por otro lado, la madurez reproductora (breeding condition en inglés) es la condición fisiológica del individuo maduro sexualmente que le permite intercambiar gametos ipso facto, generalmente en los períodos reproductores para especies estacionales (D’ Ancona 1960). En machos de tortugas marinas, la madurez reproductora tiene lugar con la máxima espermiogénesis (estado espermatogénico VI, Wibbels et al. 1990) durante la migración hacia las áreas de apareamiento (Hamann et al. 2003). En las hembras, este estado coincide con la presencia de folículos preovulatorios y se asume que éstas ya han copulado (Hamann et al. op.cit.). En tortugas marinas es frecuente informar la talla de madurez reproductora como la talla de adultez, aunque no necesariamente coincidan (Limpus 1992). Generalmente, esta medida es registrada en las hembras mientras están anidando. También esta variable es registrada en áreas de agregación marinas para ambos sexos usando técnicas de laparoscopía. Esta técnica permite comprobar la madurez sexual a través del análisis macroscópico de las gónadas y sus conductos. En machos y hembras de C. mydas se han informado LCC mínimos de 81.9 y 86.0cm respectivamente, para áreas marinas de agregación de la Gran Barrera coralina australiana (Limpus et al. 2005). Para E. imbricata han sido registrados LRC mínimos de 50.5 (Pilcher 1999) y 58.5cm (Moncada et al. 1999) en áreas de anidación del Golfo Arábico y el Caribe respectivamente. Sin embargo, en áreas marinas de agregación de esta especie han sido informados LRC de 53.0cm (Moncada et al. 1999) y LCC de 80.2cm (Limpus & Miller 2008) para el Caribe y Australia respectivamente.
Nosotros evaluamos la correspondencia entre la talla (LRC), el dimorfismo sexual y las características de las gónadas a escalas macro y microscópica, para validar los estados de maduración en agregados marinos cubanos de C. mydas y E. imbricata.
Materiales y métodos
Área de estudio: Este estudio se localizó en la cayería norte de Camagüey (provincia de Cuba) conocida como Archipiélago Jardines del Rey (zona D de pesquería), particularmente en los pesqueros legales para tortugas marinas "El Mangle" (22º12’00" N, 77º48’26" W) y "Montañez" (21º06’56" N, 77º12’34" W). En el área de estudio, la zona entre los pesqueros y el lugar de pesquería es abundante en fondos arenosos bajos con una profundidad promedio de 3.0m (Baisre 2004). Los arrecifes que delimitan la plataforma insular del área son de tipo cresta (Alcolado et al. 1999). En estas crestas predominan corales del género Millepora, Diploria o Porites las cuales tienen bajo cubrimiento (González et al. 2007) y presentan un índice de integridad de las comunidades de peces de 1,3 y 1,9 para Cayo Romano y Cayo Guajaba respectivamente (González et al. 2007). El lugar del calado de las redes de profundidad constituye una ruta migratoria para Eretmochelys imbricata y el resto del área se comporta como una zona transitoria de forrajeo para C. mydas y Caretta caretta (Linnaeus 1758) según Lee (2009).
Obtención de los ejemplares: Se analizaron 18 individuos (un macho) de C. mydas y veinte de E. imbricata (cuatro machos) haciendo un muestreo en el agregado marino de Jardines del Rey, sometido a la pesquería legal de tortugas marinas durante los períodos de agosto a octubre de 2005 y 2006. En esta pesquería se usaron redes de profundidad de 250.0m de largo, 5.0m de peralto y un paso de malla de 0.40m. Estas artes fueron ubicadas perpendicularmente a la cresta de arrecife y por fuera de la plataforma. Fueron revisadas diariamente y los datos de los ejemplares capturados fueron registrados en una hoja de datos de pesquería.
Identificación fenotípica de los estados de maduración: Hemos de aclarar que las observaciones de los pescadores cubanos, ejecutores de la pesquería legal de tortugas marinas, constituyeron los datos primarios para hacer el manejo biológico de la explotación consuntiva de E. imbricata particularmente. Los pescadores inicialmente identificaron el sexo a partir de la talla y la presencia de caracteres sexuales secundarios. Para ellos, individuos con LRC mayor de 65.0cm y sin caracteres sexuales secundarios masculinos eran hembras siguiendo el criterio de adultez de Carrillo et al. (1999). Este criterio fue normalizado para la captura de tortugas marinas según el Reglamento 164 de Pesca del Ministerio de la Industria Pesquera (MIP). Los pescadores clasificaron como machos maduros sexuales y reproductores a los individuos con caracteres sexuales secundarios evidentes. Ellos también midieron el LRC con pie de rey de 1.0mm de precisión y colectaron una porción de ca. 16cm2 de cada gónada. Posteriormente, las porciones gonadales fueron enviadas al laboratorio en formol neutro al 10% y con la identificación correspondiente.
Siempre que fue posible, confirmamos in situ el sexo de cada individuo e identificamos el estado de maduración. Para esto analizamos macroscópicamente las gónadas y los conductos reproductores, clasificándolos como prepubescente, pubescente, maduro sexual y maduro reproductor (Miller & Limpus 2003). El estado de maduración fue corroborado por medio de cortes histológicos en el laboratorio.
En el caso de los machos, seguimos el criterio de madurez sexual de Owens (1997) y el de madurez reproductora de Hamann et al. (2003), comprobado mediante el análisis histológico de los testículos. En las hembras, aplicamos criterios de madurez sexual según Hamann et al. (2003), corroborado mediante cortes histológicos del ovario. En este caso, los folículos menores de 2.0cm de diámetro fueron examinados, y la presencia de plaquetas de vitelo fue asumida como una señal del inicio de la vitelogénesis. Nosotros aceptamos el criterio de Hamann et al. (2003) para identificar la madurez reproductora en hembras, el cual coincidió con el de los pescadores. En todos los casos, nosotros relacionamos cualitativamente los estados de maduración con las tallas y el dimorfismo sexual.
Procesamiento histológico de las gónadas: A partir de la porción gonadal de 16cm2, dos secciones de 1.0cm2 de cada gónada fueron analizadas histológicamente. Una sección fue incluida en parafina y cortada a 7 μm en un micrótomo de rotación manual Baird & Tatlock (London, LTD). La otra fue congelada y cortada en un criostato Leitz 1720 Digital entre 10 y 25μm. Los cortes fueron teñidos con hematoxilina-eosina (H-E) y Sudán III y negro B, siguiendo los protocolos de Ganter & Jollès (1970).
Resultados
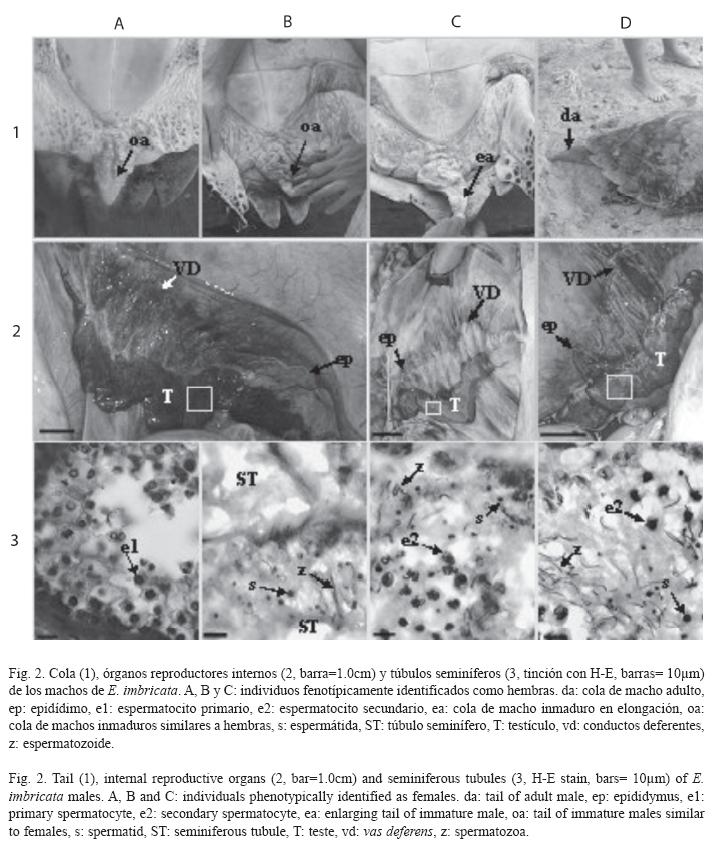
Estados de maduración en machos: En la muestra los pescadores identificaron un solo macho perteneciente a E. imbricata. Como este individuo presentó caracteres sexuales secundarios masculinos ellos lo consideraron maduro sexual y reproductor (Fig. 2: 1D). Sin embargo, el análisis histológico de sus testículos reveló que los túbulos seminíferos tenían espermatocitos secundarios y una cantidad discreta de espermatozoides (estado espermatogénico IV según Wibbels et al. (1990) (Fig. 2: 4D). Por lo que no había alcanzado su madurez reproductora.
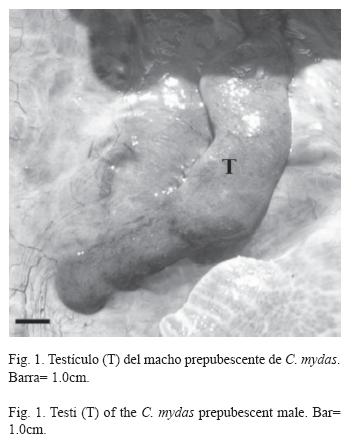
Otros cuatro individuos (C. mydas: 79.0cm, E. imbricata: 73.1±4.9cm) fueron clasificados por los pescadores como hembras al no presentar caracteres sexuales secundarios masculinos y tener LRC mayor de 65.0cm (Fig. 2: 1A, B y C). Sin embargo, cuando las gónadas fueron inspeccionadas a nivel macroscópico estos individuos resultaron ser machos inmaduros sexualmente. El macho de C. mydas presentó testículos alargados y muy compactos, con túbulos seminíferos no conspicuos a simple vista (Fig. 1), por lo que fue clasificado como prepubescente. Los tres machos restantes de E. imbricata presentaron gónadas alargadas, pero a diferencia de los anteriores individuos estaban más irrigadas y los conductos genitales (epidídimo y conductos deferentes) fueron más conspicuos (Fig. 2: 2A, B y C). El análisis histológico reveló actividad espermatogénica en estos tres machos, por lo que se clasificaron como pubescentes. Uno de éstos (67.0cm) presentó espermatogonias y espermatocitos primarios (estado espermatogénico II, Fig. 2: 4A); los otros dos (72.0cm y 78.5cm) tuvieron espermatocitos secundarios, espermátidas y escasos espermatozoides (estados espermatogénicos III y IV, Fig. 2: 4B y C, respectivamente). El de mayor talla presentó un segmento caudal precloacal con indicios de un proceso de elongación (Fig. 2: 1C).
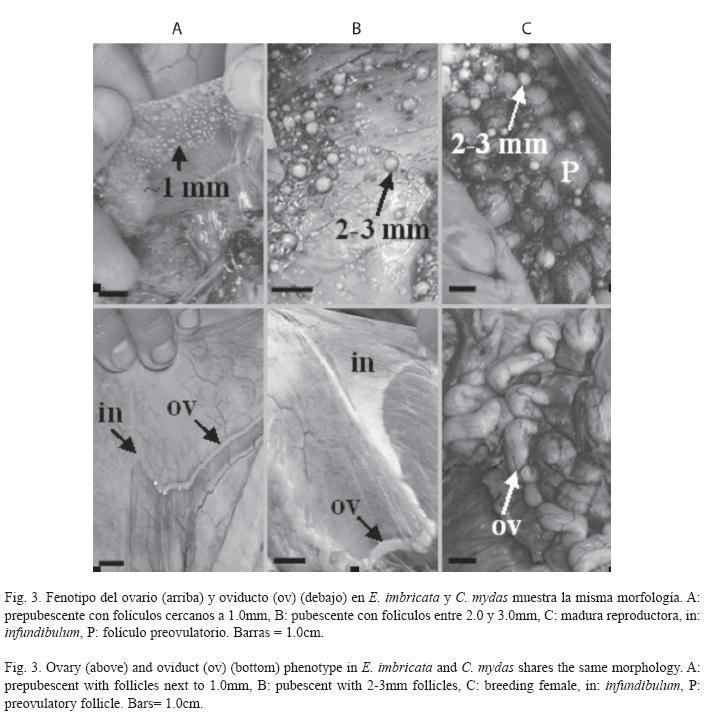
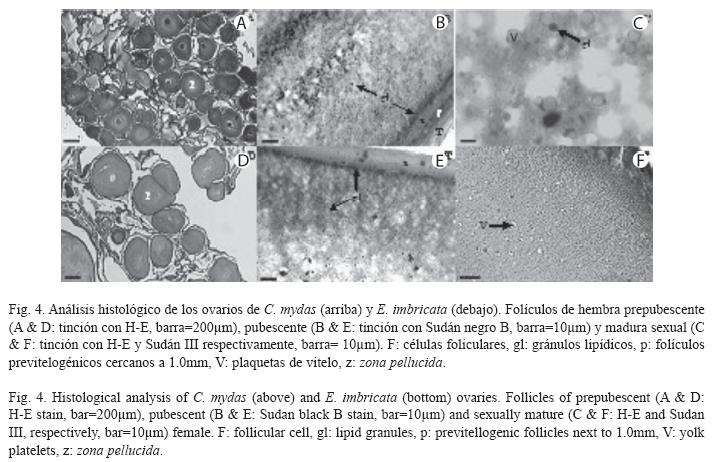
Estados de maduración en hembras: La generalidad de las hembras en la muestra fue inmadura sexual (C. mydas: 79.6±7.7cm, E. imbricata: 69.0±7.1cm), a pesar de tener LRC mayor de 65.0cm. La evaluación macroscópica de los órganos reproductores evidenció dos morfologías: prepubescente y pubescente (Fig. 3). El 70.6% y 78.6% de las hembras prepubescentes de C. mydas (79.0±8.9cm) y E. imbricata (67.0±4.5cm) respectivamente, mostraron ovarios con numerosos folículos cercanos al milímetro en un estroma compacto (Fig. 3A). Estos folículos fueron confirmados como previtelogénicos en los cortes histológicos (Fig. 4A y D). Los oviductos de estas hembras presentaron un diámetro menor de 2.0 mm de sección transversal a todo lo largo del conducto. Por otra parte, el 29.4% y 21.4% de las hembras pubescentes de C. mydas (81.2±5.0cm) y E. imbricata (76.5±2.0cm) respectivamente, mostraron ovarios con folículos entre 2.0 y 3.0mm en un estroma más distendido e irrigado que la condición prepubescente (Fig. 3B). Estos folículos también fueron confirmados como previtelogénicos (Fig. 4B y E), pero los de diámetro cercano al milímetro estuvieron más representados. Los oviductos de las hembras pubescentes presentaron un diámetro mayor de 2.0 mm de sección transversal a todo lo largo del conducto.
Sólo tres hembras fueron maduras sexuales (C. mydas: 101.1cm, E. imbricata: 71.0cm y 82.0cm). Una de éstas (82.0cm) presentó ovarios con folículos preovulatorios (Fig. 3C), siendo clasificada como madura reproductora. Las otras dos tuvieron folículos entre 3.0 y 4.0mm, en los cuales se visualizaron plaquetas de vitelo (Fig. 4C y F). Sus oviductos fueron más irrigados y plegados que la condición pubescente. Ninguna de estas hembras presentó corpora lutea ni albicantia.
Discusión
Aunque el tamaño de la muestra fue pequeño debido a una limitada infraestructura para la prospección de los agregados de pesquería y a restricciones de Regulaciones Pesqueras (Reglamento 164 de Pesca y Resolución 300 del MIP), nuestros resultados constituyen la referencia más reciente y última de un estudio fenotípico de la maduración gonadal a partir de métodos macro y microscópicos, para agregados cubanos de pesquería legal de tortugas marinas.
Nosotros consideramos la completa elongación del segmento caudal precloacal como carácter esencial de la madurez sexual en los machos de tortugas marinas. Esta característica morfológica confiere al macho la potencialidad de copular porque va aparejado al desarrollo completo del pene (Owens 1997). Aunque en muchas especies la madurez gonadal y sexual son sincrónicas, en el presente trabajo quedó demostrado que los testículos de E. imbricata pueden madurar antes que el pene se desarrolle completamente. Para la misma área de estudio y en E. imbricata, Moncada et al. (1999) consideraron como machos maduros sexualmente a individuos con presencia de caracteres sexuales secundarios masculinos y evidencias de espermatogénesis. Estos autores encontraron que los maduros sensus latus aparecían a partir del intervalo 65-67cm de LRC, aseverando que todos los ejemplares pescados con tallas mayores de 68.0cm eran maduros sexualmente. El macho con presencia de caracteres sexuales secundarios de E. imbricata encontrado en nuestro estudio también fue mayor de 68.0cm de LRC. Esta talla coincide con la cota mínima informada para aguas jurisdiccionales puertorriqueñas (Diez & van Dam 2002). Sin embargo, dos de los machos de E. imbricata superaron este valor y resultaron pubescentes. Uno de éstos fue mayor que el macho adulto registrado. Por consiguiente, la identificación de machos inmaduros de E. imbricata para áreas marinas de agregación de Jardines del Rey resulta imprecisa cuando éstos tienen LRC menores de 79.0cm. Adicionalmente, nuestros datos muestran superposición del LRC para ambas especies entre las clases sexuales y entre los individuos inmaduros y maduros sexualmente. Por lo tanto, la talla no resulta una variable adecuada para clasificar el sexo y la condición de madurez en estas especies. Esto está en concordancia con lo planteado por varios autores. Limpus (1992) demostró que en el sur de la Gran Barrera Coralina Australiana existía un gran número de individuos de E. imbricata, que no comenzaban a reproducirse hasta alcanzar tallas considerablemente superiores a la talla promedio de las hembras en áreas de anidación. Recientemente, este hecho fue corroborado por Limpus & Miller (2008) en Milmand Island (Australia). Estos autores encontraron hembras reproduciéndose por primera vez con un LCC promedio de 80.20±3.10cm, mientras que el LCC promedio de las hembras en anidación fue de 81.55±3.65cm. Para agregados marinos de C. mydas Limpus et al. (1994) ya habían registrado similar comportamiento en aguas australianas del estado de Queensland. En Bahía Shoalwater (Australia), Limpus et al. (2005) informaron superposición de LCC en hembras (96.55±5.15cm) y machos (90.78±4.11cm) pubescentes de C. mydas que fenotípicamente no eran discernibles (se identificaron por laparoscopía).
El hallazgo de un macho inmaduro de E. imbricata con el estado espermatogénico IV y en proceso de elongación del segmento caudal precloacal (ver Fig. 2: 1C), podría indicar que el inicio del alargamiento de este segmento está asociado con los niveles de testosterona presentes en este momento del ciclo espermatogénico. Si una vez iniciada la espermatogénesis los machos prosiguen hacia la máxima espermiogénesis (estado VI), entonces los individuos pubescentes con estado espermatogénico IV alcanzarían el estado VI (madurez reproductora) aproximadamente en dos meses, acorde con los datos informados para C. caretta por Wibbels et al. (1990). Simultáneamente a la máxima espermiogénesis, el segmento caudal precloacal culminaría la elongación y el pene completaría su desarrollo, y estos subadultos alcanzarían la condición de maduros sexuales.
El caso del macho inmaduro sexual de C. mydas que no estuvo en espermatogénesis pudo deberse a que esta especie comienza a madurar con tallas superiores a las de E. imbricata (van Burskirk & Crowder 1994). La variación interespecífica entre machos adquiere singular importancia para el manejo de tortugas marinas como un solo recurso. Si existe un manejo de tipo consuntivo los criterios de talla mínima de madurez sexual deben ser particularizados para cada especie.
Dentro de las hembras inmaduras sexuales los folículos de 2.0 a 3.0mm de diámetro pueden presentarse esporádicamente en ovarios prepubescentes. Sin embargo, suelen ser más numerosos en los pubescentes. En hembras pubescentes, estos folículos pueden ser erróneamente clasificados como vitelogénicos, ya que macroscópicamente presentan la misma coloración (amarilla) de un folículo vitelogénico. Histológicamente, los folículos de 2.0 a 3.0mm representan un estado folicular previtelogénico diferente al de los folículos cercanos a 1.0 mm. Este estado más avanzado está caracterizado por un engrosamiento de la zona pellucida, un citoplasma rico en vacuolas desde la periferia hacia el centro, sin plaquetas de vitelo en su interior, y una teca más engrosada e irrigada. Estas características demuestran que en estos folículos hay una entrada de lípidos hacia el citoplasma del ovocito (Fig. 4B y E). La presencia de estas biomoléculas en estados previtelogénicos previos a la entrada de vitelo proteico ha sido documentada en otros reptiles (Guraya 1989, Uribe et al. 1996). Como en las hembras pubescentes estuvieron poco representados los folículos de 2.0 a 3.0mm respecto a los cercanos al milímetro, éstas probablemente estarían comenzando la pubertad. Por lo tanto, estas hembras deberían experimentar el crecimiento previo a la vitelogénesis de un mayor número de folículos antes de iniciar este proceso.
El área marina de agregación de Jardines del Rey constituye un corredor migratorio para E. imbricata (Lee 2009), donde coexisten individuos prepubescentes, pubescentes y adultos. Otros agregados marinos de esta especie en el Caribe (Diez & van Dam 2002, Chacón 2004) y Australia (Limpus 1992, Limpus & Miller 2008) también presentan mezcla de estos estados ontogenéticos, los cuales tienden a ser genéticamente heterogéneos (Bass 1999, Bowen et al. 1996, Díaz-Fernández et al 1999). Si utilizamos las ecuaciones de regresión lineal entre el LRC y el LCC (C. mydas: LRC = (0.94 x LCC) + 0.5cm; E. imbricata: LRC = (0.84 x LCC) + 7.63cm) que Lee (2009) determinó para ambas especies en el agregado marino del Archipiélago Jardines del Rey, obtenemos para las hembras prepubescentes de C. mydas y E. imbricata intervalos de LCC de 68.6-98.4cm y 50.4-77.8cm respectivamente. Estos intervalos son semejantes a los informados para estas especies en otras áreas marinas de agregación. En C. mydas, la cota máxima supera la informada por Limpus et al. (2005) en Bahía Shoalwater (cota máxima de 90.0cm). Sin embargo, para E. imbricata nuestra cota máxima es inferior al intervalo informado por Limpus & Miller (2008) en el norte de la Gran Barrera Coralina australiana (cota máxima de 84.0cm). Cuando determinamos los intervalos de LCC en las hembras pubescentes con las mismas ecuaciones de regresión (C. mydas: 78.2-91.0cm, E. imbricata: 78.4-85.0cm), entonces nuestros valores se superponen o están comprendidos dentro de los intervalos obtenidos por estos autores para C. mydas (82.0- 99.6cm) y E. imbricata (65.0-94.0cm). Por consiguiente, en la medida que el estadio de maduración sexual está más próximo al estado adulto, hay menor variación de intervalos de talla para regiones geográficamente distantes como los agregados marinos cubanos y australianos. Adicionalmente, estos resultados corroboran el crecimiento no monotónico informado en estas especies. Para C. mydas (Chaloupka et al. 2004) y E. imbricata (Limpus & Miller 2008) en Australia ha sido demostrado que los individuos inmaduros recientemente reclutados en la plataforma, crecen lentamente. Sin embargo, mientras los individuos se acercan a LCC de 60cm el crecimiento se acelera y vuelve a mermar tendiendo a cero a medida que se aproximan a la adultez.
Las diferencias en las tasas de crecimiento de juveniles podrían estar ocasionadas por varios factores. Bjorndal et al. (2000) encontraron evidencias de una relación inversa entre la densidad del agregado marino y las tasas de crecimiento en juveniles de C. mydas del sur de Bahamas. Estos autores interpretaron esta relación como una limitación en la disponibilidad de alimentos para aquellas áreas densamente pobladas. También Seminoff et al. (2002) informaron que en juveniles de esta especie, las diferencias de tasas de crecimiento entre localidades de un área de forrajeo del centro del Golfo de California, pudieron estar relacionadas con el factor densidad poblacional. Contrariamente, Diez & van Dam (2002) analizando dos agregados marinos cercanos de E. imbricata en Isla Mona e Isla Monito, hallaron que las áreas marinas de mayor densidad poblacional tenían mayores tasas de crecimiento. Estos autores estimaron que la calidad del hábitat y la disponibilidad de presas de mayor preferencia explicaban las diferencias entre las tasas de crecimiento de estas áreas marinas de agregación. Como los individuos prepubescentes tienen mayor amplitud en el intervalo de tallas e intervalos de edad donde la tasa de crecimiento es mayor (Limpus & Chaloupka 1997, León & Diez 1999, Diez & van Dam 2002), la frecuencia de tallas dentro de este estado de maduración podría ser más dependiente de las condiciones del hábitat. Adicionalmente, los estadios juveniles de tortugas marinas no son filopátridos por lo que la heterogeneidad de tallas en áreas marinas de agregación podría ser también un reflejo de la dispersión particular de cohortes de origen diferente. Es decir, los miembros de una misma cohorte han estado al menos en un hábitat de forrajeo diferente.
Moncada et al. (1999) informan tallas mínimas para maduras reproductoras de E. imbricata en agregados marinos cubanos, a partir de los valores originales de LRC, menores incluso que las tallas registradas en el presente trabajo para prepubescente. Sin embargo, nuestro ejemplar reproductor presentó una talla (LCC=86.5) muy semejante a la registrada en la pesquería legal de esta especie durante los períodos de pesca de 2004 a 2006 en Jardines del Rey (LCC=86.88±2.66, Lee 2009), y algo superior a las informadas para las maduras reproductoras en Milmand Island (Australia) (Limpus & Miller 2008).
La ausencia de corpora lutea o albicantia en las hembras maduras sexuales indica que éstas por primera vez iniciaron su vitelogénesis. En el caso de la hembra de E. imbricata clasificada como madura reproductora, el proceso de vitelogénesis había culminado y probablemente estuviera en su primera migración hacia la zona de reproducción. Sin embargo, análisis laparoscópicos de la estructura gonadal combinados con datos de reproducción en Australia, han confirmado que la presencia de folículos agrandados no siempre constituye un indicio de anidación en la temporada reproductora más próxima. Según Limpus (1992), la anidación puede suceder varios años después. Nuestro diseño experimental no permitió confirmar si para el área de estudio la hembra con folículos preovulatorios era o no una nueva recluta de alguna población de anidación vecina. Para estos fines se requiere un programa de marcación en el área de agregación combinado con estudios laparoscópicos. No obstante, si tenemos en cuenta la ausencia de huellas de ovulación previas, la dirección noroeste-sureste de la hembra en la red de enmalle y que en septiembre ocurre el pico de anidación de E. imbricata en las poblaciones de Puerto Rico (Diez et al. 1998) e Islas Vírgenes norteamericanas (Meylan 1999), inferimos que la hembra madura reproductora de E. imbricata pudo ser un nuevo recluta de esas poblaciones de anidación.
Finalmente, consideramos que de reabrirse la pesquería legal de tortugas marinas en el Archipiélago Jardines del Rey, y en otras áreas, debería implementarse un manejo que permita capturar a los individuos vivos. De esta forma, los individuos podrían ser clasificados acorde con nuestros criterios de maduración con relación a la talla y según la especie, contribuyendo a disminuir el impacto del uso consuntivo sobre los agregados manejados. Aunque la generalidad de los países caribeños ha vedado permanentemente la pesquería de tortugas marinas, aún existe esta actividad de forma ilegal.
Agradecimientos
Nosotros agradecemos a los pescadores y a la dirección de EPICAM, en especial a Jorge Luis Fals Sifontes y Miguel Camps Roura, quienes apoyaron esta investigación en la logística y colecta de muestras con la debida información de campo. A Nilda Almaguer de la Facultad de Biología, a Xiomara González del Hospital Neurológico de La Habana y a Lysis Martínez del Centro Internacional de Restauración Neurológica, por su ayuda en el procesamiento histológico de las gónadas. Estos resultados formaron parte de la tesis de maestría de Emir Pérez Bermúdez defendida en la Facultad de Biología de la Universidad de La Habana.
Resumen
La madurez gonadal se suele evaluar a través del análisis macroscópico de las gónadas. En las tortugas marinas, las etapas de maduración están asociadas con el tamaño del cuerpo, dependiendo de la población estudiada. Los pescadores clasifican las tortugas que miden más de 65.0cm como maduras sexualmente. Si tienen los caracteres sexuales secundarios se registran como machos en edad reproductora. Nosotros comparáramos el tamaño del cuerpo con las características gonadales macroscópicas y microscópicas de dos tortugas de Cuba. Se obtuvieron dieciocho individuos de C. mydas y veinte de E. imbricata en la pesquería legal del Archipiélago Jardines del Rey (Cuba), entre octubre de 2005 y 2006. En los machos, el estado reproductivo (máxima espermiogénesis) se comprobó mediante el análisis histológico de los testículos. En las hembras, la madurez sexual fue identificada por la presencia de folículos vitelogénicos u ovarios corpora. La mayoría de los machos eran inmaduros (C. mydas: 79.0cm; E. imbricata: 73.1±4.9cm, n=3) y carecían de los caracteres sexuales secundarios. Algunos E. imbricata que no tenían un pene desarrollado se encontraban en fases espermatogénicas entre II y IV (p. ej. pubescentes). La mayoría de las hembras eran inmaduras (C. mydas: 79.6±7.7cm, n=17; E. imbricata: 69.0±7.1cm, n=16; p. ej. prepubescente y pubescente). Las hembras prepubescentes tenían ovarios con folículos previtelogénicos de cerca de 1.0mm en un estroma compacto y amarillento. Las hembras pubescentes tenían ovarios con folículos previtelogénicos entre 2.0 y 3.0mm. El estroma fue más distendido e irrigado que en las tortugas pubescentes. El hallazgo de actividad espermatogénica en machos pubescentes indica la asincronía entre el desarrollo de testículos y pene en E. imbricata. El criterio fenotípico actual utilizado por los pescadores no es suficiente para determinar la madurez sexual de estas tortugas. La talla mínima tentativa debe cambiar a: C. mydas: por encima de 93.0cm y E. imbricata por encima de 79.0cm.
Palabras claves: tortugas marinas, largo recto del carapacho, madurez sexual, madurez reproductora, folículo previtelogénico, espermatogénesis.
Referencias
Alcolado, P.M., E.E. García & N. Espinosa. 1999. Protección de la Biodiversidad y Desarrollo Sostenible en el Ecosistema Sabana- Camagüey. CESYTA S. L. Madrid, España. [ Links ]
Baisre, J.A. 2004. La pesca marítima en Cuba. Científico- Técnica. La Habana, Cuba. [ Links ]
Balazs, G. 1995. Growth rates of immature green turtles in the Hawaiian Archipelago, p. 117-126. In: K.A. Bjorndal (ed.). Biology and Conservation of Sea Turtles. Smithsonian Institution. Washington DC, EEUU. [ Links ]
Bass, A.L. 1999. Genetic analysis to elucidate the natural history and behavior of hawksbill turtles (Eretmo chelys imbricata) in the Wider Caribbean: a review and re-analysis. Chel. Cons. Biol. 3: 174-176. [ Links ]
Bjorndal, K.A., A. B. Bolten & M.Y. Chaloupka. 2000. Green turtle somatic growth model: evidence for density dependence. Ecol. Appl. 10: 269-282. [ Links ]
Bowen, B.W., A.L. Bass, A. García-Rodriguez, C.E. Diez, R. van Dam, A. Bolten, K.A. Bjorndal, M.M. Miyamoto & R.J. Ferl. 1996. Origin of hawksbill turtles in a Caribbean feeding area as indicated by genetic markers. Ecol. Appl. 6: 566-572. [ Links ]
Carrillo, E., G.J.W. Webb & S.C. Manolis. 1999. Hawksbill turtles (Eretmochelys imbricata) in Cuba: an assessment of the historical harvest and its impacts. Chel. Cons. Biol. 3: 264-280. [ Links ]
Chacón, D. 2004. Caribbean hawksbills – An introduction to their biology and conservation status. WWF-Regional Program for Latin America and the Caribbean. San José, Costa Rica. [ Links ]
Chaloupka, M.Y., C.J. Limpus & J.D. Miller, 2004. Green turtle somatic growth dynamics in a spatially disjunct Great Barrier Reef metapopulation. Coral Reefs. 23: 325-355. [ Links ]
D’ Ancona, H. 1960. Tratado de Zoología Tomo I: Zoología General. Labor. Barcelona, España. [ Links ]
Díaz-Fernández, R., T. Okayama, T. Uchiyama, E. Carrillo, G. Espinosa, R. Márquez, C. Diez & H. Koike. 1999. Genetic sourcing for the hawksbill turtle Eretmochelys imbricata in the Northern Caribbean region. Chel. Cons. Biol. 3: 296-300. [ Links ]
Diez, C.E. & R.P. van Dam. 2002. Habitat effect on hawksbill turtle growth rates on feeding grounds at Mona and Monito Islands, Puerto Rico. Mar. Ecol. Prog. Ser. 234: 301-309. [ Links ]
Diez, C.E., K.A. Marshall & R.P. van Dam. 1998. Assessment of hawksbill nesting activities and nest production on Mona Island, Puerto Rico, 1997. Final Report to US Fish and Wildlife Service, Cooperative Agreement #1448-0004-94-9115. San Juan, Puerto Rico. [ Links ]
Ganter, P. & G. Jollès. 1970. Histochimie Normale et Pathologique 2. Gauthier-Villars. París, Francia. [ Links ]
González, S., K. Cantelar, F. Pina, P.M. Alcolado, A. Jiménez, J. Espinosa, M. Hernández & J.L. Hernández. 2007. Estado de los ecosistemas marinos y costeros, y algunas características ambientales y tendencias, p. 38-50. In: Alcolado, P.M., E.E. García & M. Arellano- Acosta (eds.). Ecosistema Sabana Camagüey: Estado actual, avances y desafíos en la protección y uso sostenible de la biodiversidad. Academia. La Habana, Cuba. [ Links ]
Guraya, S.S. 1989. Ovarian follicles in reptiles and birds. Springer. Berlín, Alemania. [ Links ]
Hamann, M., C.J. Limpus & D.W. Owens. 2003. Reproductive Cycles of Males and Females, p. 135-161. In: Lutz, P.L., J.A. Musick & J. Wyneken (eds.). The Biology of Sea Turtles II. CRC. Boca Ratón, Florida, EEUU. [ Links ]
Lee, I. 2009. Evaluación integral del manejo del recurso pesquero tortugas marinas en la zona D (Jardines del Rey). M.C. Universidad de La Habana. La Habana, Cuba. [ Links ]
León, Y.M. & C.E. Diez. 1999. Population structure of hawksbill turtles on a foraging ground in the Dominican Republic. Chel. Cons. Biol. 3: 230-236. [ Links ]
Limpus, C.J. 1992. The hawksbill turtle, Eretmochelys imbricata, in Queensland: Population structure within a southern Great Barrier Reef feeding. Wildl. Res. 19: 489-506. [ Links ]
Limpus, C.J. & J. D. Miller. 2008. Australian Hawksbill Turtle Population Dynamics Project. Environmental Protection Agency. Queensland, Australia. [ Links ]
Limpus, C.J. & M. Chaloupka. 1997. Non parametric regression modeling of green sea turtle growth rates (southern Great Barrier Reef). Mar. Ecol. Prog. Ser. 149: 23-34. [ Links ]
Limpus, C.J., D.J. Limpus, K.E. Arthur & C.J. Parmenter. 2005. Monitoring Green Turtle Population Dynamics in Shoalwater Bay: 2000-2004. Great Barrier Reef Marine Park Authority. Queensland, Australia. [ Links ]
Limpus, C.J., P.J. Couper & M.A. Reed. 1994. The green turtle, Chelonia mydas, in Queensland: population structure in a warm temperate feeding area. Mem. Queens. Mus. 37: 139-154. [ Links ]
Meylan, A.B. 1999. International movements of immature and adult hawksbill turtles (Eretmochelys imbricata) in the Caribbean region. Chel. Cons. Biol. 3: 189-194. [ Links ]
Miller, J.D. & C.J. Limpus. 2003. Ontogeny of Marine Turtle Gonads, p. 199-224. In: Lutz, P.L., J.A. Musick & J. Wyneken (eds.). The Biology of Sea Turtles II. CRC. Boca Ratón, Florida, EEUU. [ Links ]
Moncada, F., E. Carrillo, A. Saenz & G. Nodarse. 1999. Reproduction and nesting of the hawksbill turtle, Eretmochelys imbricata, in the Cuban archipelago. Chel. Cons. Biol. 3: 257-263. [ Links ]
Owens, D.W. 1997. Hormones in the Life History of Sea Turtle, p. 315-341. In: Lutz, P.L. & J.A. Musick (eds.). The Biology of Sea Turtles, CRC, Boca Ratón, Florida, EEUU. [ Links ]
Pilcher, N.J. 1999. The hawksbill turtle, Eretmochelys imbricata, in the Arabian Gulf. Chel. Cons. Biol. 3: 312-317. [ Links ]
Seminoff, J.A., A. Resendiz, J.N. Wallace & T. T. Jones. 2002. Growth Rates of Wild Green Turtles (Chelonia mydas) at a Temperate Foraging Area in the Gulf of California, México. Copeia. 610-617. [ Links ]
Uribe, M.C., G.L. Portales & L.J. Guillette, Jr. 1996. Ovarian folliculogenesis in the oviparous mexican lizard Ctenosaura pectinata. J. Morphol. 230: 99-112. [ Links ]
van Burskirk, J. & L.B. Crowder. 1994. Life-history variation in marine turtles. Copeia. 66-81. [ Links ]
Wibbels, T., D.W. Owens, C. Limpus, P. Reed & M. Amoss, Jr. 1990. Seasonal changes in serum gonadal steroids associated migration, mating, and nesting in the loggerhead sea turtle (Caretta caretta). Gen. Comp. Endocrinol. 79: 154-164. [ Links ]
Wyneken, J. 2004. La Anatomía de las Tortugas Marinas. U.S. Department of Commerce, NOAA Technical Memorandum NMFS-SEFSC-470. Miami, Florida, EEUU. [ Links ]