Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.57 n.4 San José Dec. 2009
Histología y morfometría del ojo del pez dulceacuícola Paracheirodon axelrodi (Characiformes: Characidae)
Mario O. Tovar; Martha J. Obando; Edwin Gómez; María L. Caldas & Hernán Hurtado
Laboratorio de Histoembriología, Grupo de Ictiología, Programa de Biología Aplicada, Facultad de Ciencias Básicas, Universidad Militar Nueva Granada, Colombia; mario.tovar@unimilitar.edu.co
Abstract: Histology and morphometry of the eye in the freshwater Paracheirodon axelrodi (Characiformes: Characidae). The visual system of Teleost fishes has a wide range of adaptations. The eye has suffered modifications, mainly towards better sensitivity and visual resolution according to specific environmental conditions. In that way, this organ is so important for survival. In spite of being the most commercialized Orinoquía species, and one of the most important ornamental fish worldwide, there are almost no studies on the communication systems of P. axelrodi (including vision). We studied the eye in ten individuals of P. axelrodi, with a mean total length of 2.7 cm (SD= 0.2, n= 20). We measured eye relative size (TRO) after sacrifice. Heads were processed for hematoxylin-eosin, and 8 μm thick sections were obtained. Images were digitalized for histological identification and morphometrics. The relation between TRO and body length was 9.8% (SD= 1.1, n= 20); lens was spherical with a relative size of 64.3% (SD= 4.9, n= 20). Rete mirabilis choroid was composed mainly by capillaries, while sclera was composed of cartilaginous tissue. Retina with eight layers and two membranes. An areae centrales was observed in the posterior retina. Iris covered by a simple cubic epithelium. Cornea of endothelial tissue with two membranes. Pupil almost circular, with a naso-caudal elongation. Measures of retina thickness were as follows: lateral retina 144.5 μm (SD= 5.4, n= 20), temporal retina 210.4 μm (SD= 14.8, n= 20). Lens measurements were: dorso- ventral 759.6 μm (SD= 31.7, n= 20), antero-posterior 763.4 μm (SD= 30.7, n= 20). Cornea thickness was 27.6 μm (SD= 4.3, n= 20); iris thickness was 18.9 μm (SD= 1.9, n= 20); rete mirabilis choroid 22.2 μm (SD= 3.2, n= 20) and sclera: 15.9 μm (SD= 1.2, n= 20). This species has a typical Teleost eye conformation. The retina was thicker in the posterior area, probably related to the presence of neuron groups. This modification allows for a better sharpness and visual resolution. The TRO, areae centrales in the retina, and thin cornea, suggests the need of a well developed visual system resulting from a predatory diet. Rev. Biol. Trop. 57 (4): 1107-1118. Epub 2009 December 01.
Key words: histology, visual sensitivity, morphometry, visual ecology, teleosts.
P. axelrodi pertenece al orden de los Characiformes, que es el grupo más representativo en número de especies en la Orinoquía Colombiana con el 15.69% del total de especies ornamentales de interés comercial (Mancera y Álvarez 2008). La distribución de esta especie se da en las cuencas de los ríos Amazonas, Orinoco y Negro (Froese y Pauly 2006). Según registros de captura y comercialización de peces ornamentales en Puerto Carreño e Inírida (Ramírez et al. 2001), P. axelrodi es una de las especies más comercializadas en nuestro país, ocupando el primer lugar entre 1998 y 2004. Asimismo, en Brasil constituye alrededor del 80% del mercado total de peces ornamentales exportados (Mancera y Álvarez 2008).
La mayoría de estudios se han realizado en peces de zonas templadas. Las especies de la zona neotropical, por su parte, han sido relegadas a un segundo plano (Winemiller 1989, Bergmann y Motta 2005). Por ello se conoce muy poco a cerca de la biología básica de P. axelrodi y prácticamente no se conoce nada sobre sus sistemas de comunicación (Froese y Pauly 2006), a pesar de ser una de las principales especies a nivel mundial (Walker 2004, Mancera y Álvarez 2008). Por esta razón cobra importancia la investigación sobre esta especie. En el presente artículo nos concentraremos en la interacción de este pez con el ambiente mediante el estudio de los órganos de los sentidos, en particular, del ojo. Para este caso debe tenerse en cuenta que el desempeño visual de los peces es dependiente de la intensidad de la luz, la turbidez, las adaptaciones visuales, el tamaño y desarrollo de la especie y el color de las presas (Sandström 1999).
Teniendo en cuenta que las condiciones fóticas de los ecosistemas acuáticos son variables (Collin y Shand 2003), el hábitat visual de los peces se convierte en un nicho complejo dado que hay una variación de los componentes físicos y biológicos. En el ambiente físico la luz puede variar en longitud de onda (color) e intensidad (luminosidad), también puede cambiar en dispersión (turbidez y polarización). En cuanto a los componentes biológicos, algunos de estos son: el estímulo predador- presa, el reconocimiento inter e intraespecífico, la interacción con el medio, la adquisición de alimento y la diferenciación de los ciclos diarios y anuales de luz (Zanuy y Carrillo 1990, Evans 2004). De acuerdo con lo anterior, se pueden presentar adaptaciones en la estructura del ojo en respuesta a las condiciones del medio. Tales adaptaciones pueden ayudar a determinar la importancia de la visión en cada especie (Collin y Shand 2003).
En términos generales la anatomía del ojo se ha estudiado en tres capas. La primera es la capa externa o túnica fibrosa, también denominada capa epitelial. La túnica está compuesta por la esclera y la córnea. La esclera se encuentra en la parte posterior del ojo y la córnea en la parte anterior (Smith 2000, Ross 2002).
La segunda es la túnica media o uveal. Se encuentra ubicada entre la esclera y la retina, está conformada por la coroides, la zona ciliar y el iris (el cual forma la pupila). La coroides presenta alta vascularización y su función es suministrar los requerimientos nutricionales y de oxígeno a la retina para que pueda mantener su alto metabolismo (Ross 2002). La zona ciliar generalmente es imperceptible en teleósteos (Walls 1942). El iris controla la cantidad de luz que penetra hacia la retina, generalmente es inmóvil y puede tener forma circular o asimétrica (Douglas et al. 1998).
El cristalino es la única estructura que cumple las funciones ópticas en teleósteos y en la mayoría de peces es de forma casi esférica (Walls 1942, Ross 2002). En peces, generalmente el cristalino cumple la función de enfocar la luz por mecanismos de acomodación, que se dan por el movimiento del cristalino a través del plano pupilar (Gratzek y Matthews 1992).
La tercera capa, la retina –también conocida como capa interna–, es una estructura neuroepitelial segregada en capas, formada por neuronas responsables de colectar, transformar y transmitir información al cerebro (Fernald 2000). En general, está compuesta por diferentes tipos de células dispuestas en ocho capas y dos membranas (Ali y Anctil 1976). La mayoría de vertebrados acuáticos estudiados tienen areae centrales, que es una región especializada de la retina en la que se concentran subpoblaciones de neuronas, lo que les permite incrementar el poder de resolución de un sector del campo visual (Collin y Shand 2003).
Se han realizado estudios ontogénicos, estructurales e histológicos detallados del ojo, al igual que estudios sobre cómo algunas sustancias pueden afectar su desarrollo (Wahl et al. 1993, Pankhurst y Eagar 1996, Wanzenböck et al. 1996, Collin y Shand 2003). Sin embargo, muchas especies de peces ornamentales colombianas carecen de estudios básicos de la conformación ocular. Es por esto que la descripción histológica junto con el análisis morfométrico del ojo cobra interés; además permite relacionar la estructura de este órgano con el medio en el que habita.
Materiales y métodos
Se emplearon diez individuos de la especie P. axelrodi. Los especímenes fueron adquiridos en una tienda acuarista, se sacrificaron por sobredosis de MS 222 (0.1 g/l), de acuerdo con los protocolos de manejo ético de peces. Los individuos se pesaron con una balanza OHAUS AdventureTM 0.001 de precisión. Posteriormente fueron medidos con un calibrador de 0.01 mm de precisión. Luego del sacrificio, las cabezas se separaron y se fijaron en formaldehído al 4% durante ocho días. Después de la fijación, se midió con el calibrador el diámetro antero-posterior, dorso-ventral y latero-medial de los ojos. El diámetro antero-posterior del ojo se utilizó para calcular el tamaño relativo del ojo (TRO= (diámetro antero-posterior del ojo/longitud total del pez)*100) (modificado de: Paul 1986, Pankhurst 1987).
Luego de realizar las mediciones anteriores, las cabezas fueron decalcificadas con ácido nítrico al 7% a temperatura ambiente durante siete días; pasado este tiempo se realizaron cinco lavados con agua corriente de media hora cada uno, y por último, se dejaron 24 horas en formaldehído. Posteriormente se llevó a cabo el proceso de deshidratación con alcoholes en concentración ascendente, de acuerdo con los protocolos establecidos para histología (Prophet 1995). Se hicieron cortes transversales a 8 μm de espesor con un micrótomo rotatorio (MICROM HM 340E). La tinción se realizó con la técnica de hematoxilina-eosina (H-E) y se realizaron los montajes permanentes. Se hicieron observaciones en un microscopio de luz (Carl Zeiss Axioscop 2 Plus) para la descripción histológica de las estructuras presentes en el ojo. El análisis morfométrico se realizó sobre las imágenes digitalizadas con el programa Scion Image PC (2000) de libre distribución en Internet (www.scioncorp.com). Se llevaron a cabo mediciones del espesor de la esclera, la córnea, la coroides y el iris (en dos secciones). Asimismo se midió el diámetro del cristalino en sección antero-posterior y dorso-ventral. El espesor de la retina se midió en cuatro sectores, dos en la parte temporal (cerca al nervio óptico), una en la parte antero-lateral y una en la parte postero-lateral (cercanas al iris). El tamaño relativo del cristalino se calculó como (TRC= (diámetro antero-posterior del cristalino/ diámetro antero-posterior del ojo)*100, (modificado de: Paul 1986, Pankhurst 1987), el diámetro antero-posterior del cristalino se obtuvo de las imágenes digitalizadas y el diámetro antero-posterior del ojo se obtuvo de las medidas macroscópicas.
Para el análisis estadístico de los parámetros evaluados se tomaron cortes a diferentes niveles, a los que se les hicieron las respectivas mediciones, y se calculó el promedio y la desviación estándar de cada estructura medida. Los datos obtenidos se analizaron con el paquete estadístico de libre distribución R versión 2.6.2 (http://www.r-project.org/). A los datos obtenidos se les realizaron pruebas de análisis de varianza (ANOVA) y Tukey (Zar 1999).
Resultados
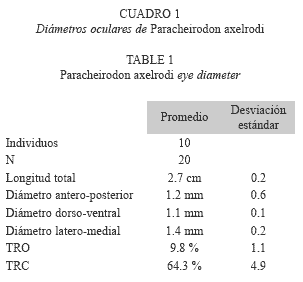
Los diez individuos empleados presentaron una longitud total promedio de 2.7 cm (SD= 0.2, n= 10) y un peso promedio de 0.2 g (SD= 0.1, n= 10). El ojo tiene un diámetro anteroposterior promedio de 1.2 mm (SD= 0.6, n= 20), un diámetro dorso-ventral promedio de 1.1 mm (SD= 0.1, n= 20) y un diámetro lateromedial promedio de 1.4 mm (SD= 0.2, n= 20) (Cuadro 1). La forma del ojo de P. axelrodi es circular, por lo cual el diámetro antero-posterior es igual al diámetro dorso- ventral (p> 0.05, t= 0.05). No se observaron diferencias entre el ojo derecho y el izquierdo para el diámetro anteroposterior (p> 0.05, ANOVA= 0.05), ni para el diámetro dorso-ventral (p> 0.05, ANOVA= 0.05), tampoco para el diámetro latero-medial (p> 0.05, t= 0.05). La pupila es circular cuando está dilatada, un poco alargada antero-posteriormente (Cuadro 1).
El TRO promedio respecto a la longitud total es de 9.8% (SD= 1.1, n= 20) y el TRC promedio respecto al tamaño del ojo es de 64.3% (SD= 4.9, n= 20) (Cuadro 1).
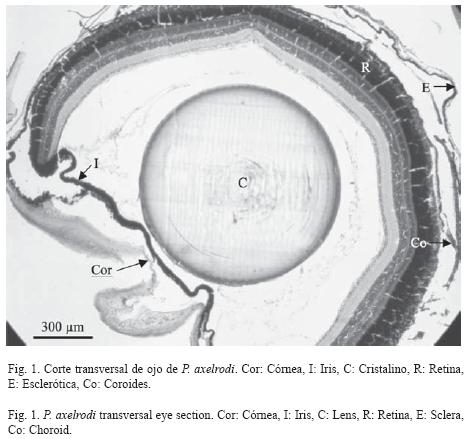
De acuerdo con el análisis histológico, el ojo de P. axelrodi está constituido por la túnica fibrosa (córnea y esclera), la túnica media (coroides e iris), la retina y el cristalino. La esclerótica está compuesta por tejido conectivo denso, cartílago y una lámina fusca muy delgada que recubre el cartílago (Fig. 1). La esclerótica tiene un espesor promedio de 15.9 μm (SD= 1.2, n= 20) (Cuadro 2).
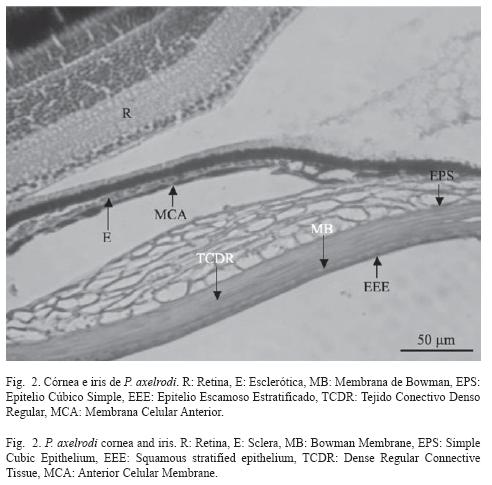
Desde la zona más cercana al vítreo hacia el exterior, la córnea está formada por una capa endotelial, seguida de la membrana de Descemet, la cual está formada por tejido conectivo laxo. La substancia propia es la capa más notoria de la córnea, está compuesta por tejido conectivo laxo, un poco más organizado que en la membrana de Descemet. Luego se encuentra la membrana de Bowman (Fig. 2). La córnea tiene un espesor promedio de 27.6 μm (SD= 4.3, n= 20) (Cuadro 2).
La rete mirabilis coroides en neón cardenal no es muy notoria, está conformada principalmente por capilares y tiene un espesor promedio de 22.2 μm (SD= 3.2, n= 20) (Cuadro 2). El iris es la proyección de la coroides, está recubierto por la membrana celular anterior, que es la continuación del endotelio de la córnea, y por el epitelio posterior, hacia la cámara posterior. En medio de la membrana celular anterior y el epitelio posterior se encuentra el estroma que está conformado por tejido conectivo laxo (Fig. 2). El iris tiene un espesor promedio de 18.9 μm (SD= 1.9, n= 20). No se encontraron diferencias significativas entre las dos zonas del iris (p> 0.05, t= 0.05) (Cuadro 2).
El cristalino tiene tres capas. Una interna, que son fibras dispuestas de forma concéntrica. Una en medio, donde se encuentra el epitelio simple cuboidal, que también es llamado epitelio subcapsular. Por último, una capa externa, que corresponde a la cápsula del cristalino, donde no se observan células (Fig. 3). El cristalino tiene un diámetro vertical promedio de 759.6 μm (SD= 31.7, n= 20) y un diámetro horizontal promedio de 763.4 μm (SD= 30.7, n= 20) (Cuadro 2). No hay diferencias entre los dos diámetros (p> 0.98, t= 0.05), lo que significa que el cristalino es una estructura prácticamente circular.
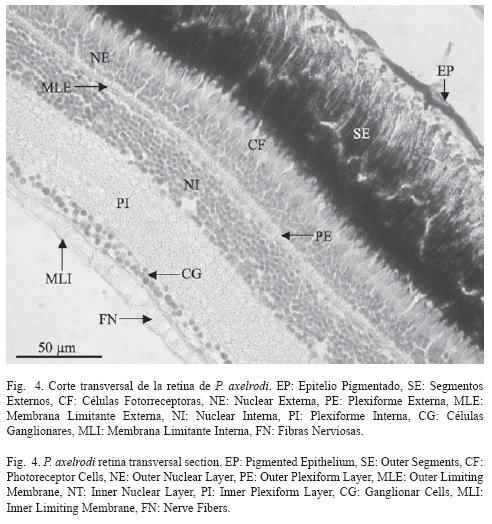
La retina está formada por ocho capas y dos membranas. La retina externa está formada por el epitelio simple cuboidal, que es el epitelio pigmentario con gránulos de melanina; este tiene las prolongaciones típicas recubriendo los segmentos externos de las células fotorreceptoras, los cuales conforman la capa de fotorreceptores. Posteriormente, más hacia el vítreo, está la capa nuclear externa compuesta por los núcleos de los conos y los bastones. A continuación está la membrana limitante externa, que se ubica entre la capa de fotorreceptores y la capa nuclear externa, esta membrana está formada por fibras radiales (Fig. 4).
La capa plexiforme externa contiene las prolongaciones axónicas de las células fotorreceptoras. Continuando hacia el vítreo se encuentra la retina interna, donde se ubica la capa nuclear interna compuesta por los núcleos de las células horizontales, bipolares y amacrinas, ubicadas desde la esclera hacia el vítreo en este orden. La capa plexiforme interna está formada por las prolongaciones axónicas de las células de la capa nuclear interna. La última capa nuclear que se encuentra hacia el vítreo está formada por los núcleos de las células ganglionares, que pueden ser grandes o pequeños. Posteriormente se encuentran los axones de las células ganglionares que pasan a través de la retina y forman el nervio óptico. Finalmente se encuentra la membrana limitante interna, que separa las fibras del humor vítreo, y al igual que la membrana limitante externa, está formada por fibras dispuestas a lo largo de la retina (Fig. 4).
El espesor promedio de la retina en la zona lateral es de 144.5 μm (SD= 5.4, n= 20); no se encontraron diferencias entre las dos zonas laterales medidas (p> 0.05, t= 0.05). Tampoco hay diferencias entre las dos zonas posteriores (p> 0.05, t= 0.05); el promedio general de la parte temporal de la retina es de 210.4 μm (SD= 14.8, n= 20) (Cuadro 2). Con los resultados obtenidos en este trabajo se observσ que hay diferencias significativas entre el espesor de la retina en la parte posterior y la lateral (p> 2.2 .10-16, t= 0.05), ya que la retina posterior tiene mayor espesor.
Discusión
P. axelrodi tiene un TRO de 9.8%. Se ha reportado que el TRO para especies de hábitos diurnos generalmente es del 4%, como es el caso de Oncorhynchus mykiss (Tovar et al. 2008), Barbus tauricus (Verep et al. 2006) y Pimephales promelas (Anseeuw et al. 2005). Para especies de hábitos nocturnos el promedio es del 3%; por ejemplo, Salmo salar m. sebago, Salmo trutta m. lacustris y Salvelinus alpinus tienen un TRO de 5% (Pakkasmaa et al. 1998); mientras especies como Thymallus thymallus, Paralabrax maculatofasciatus (Peña y Dumas 2007), Pargus auratus y Forsterygion varium tienen un TRO mayor a 6% (Baumgartner et al. 1988, Lythgoe 1989).
El TRO se ha relacionado con los hábitos alimenticios de los peces, de tal manera que las especies carnívoras, así como las de hábitos crepusculares y nocturnos, tienden a tener un ojo de mayor tamaño. El tamaño del ojo favorece la agudeza y la sensibilidad visual, las cuales son una manera indirecta de conocer la habilidad visual de las especies (Paul 1986, Pankhurst 1989, Kroger y Fernald 1994, Corti y Crosetti 1996). Se debe tener en cuenta que los hábitos alimenticios, comportamentales y el tipo de hábitat determinan la "radiación adaptativa" y la ecología visual de las especies (Wagner 1990). La turbidez del agua tiene efectos marcados en relación con la capacidad para localizar y cazar a las presas, así como para evadir a los predadores; además determina la distribución horizontal de las especies en la columna de agua (Pekcan-Hekim 2007). Al aumentar la turbidez, disminuye el campo visual y cuando la luminosidad es muy alta afecta la capacidad de enfocar y el contraste (Utne-Palm 1999). Teniendo en cuenta que P. axelrodi es una especie omnívora con tendencia carnívora y muy activa durante el día (Marshall et al. 2008), que habita en aguas turbias, es de esperarse que tenga un sistema visual desarrollado que le beneficie durante la caza y la evasión.
El cristalino en los teleósteos generalmente es circular para compensar la carencia de refracción causada por la córnea en los peces (Gratzek y Matthews 1992). Resultados que se corroboran con los obtenidos en este estudio para P. axelrodi, y los obtenidos en E. mutisii y O. mykiss (Tovar et al. 2008) y con los obtenidos por Rao et al. (2006) para Danio rerio. El tamaño del cristalino es de gran importancia, debido a la función que cumple, además hay una relación directa entre el tamaño del cristalino y el de la retina (Sandström 1999). Teniendo en cuenta que el TRC en P. axelrodi corresponde a un 64.3%, si se compara con los resultados obtenidos en E. mutisii (40.9%) y O. mykiss (40.4%) (Tovar et al. 2008), el cristalino es proporcionalmente más grande en P. axelrodi que en las otras dos especies. Una mayor proporción entre el tamaño del cristalino y el tamaño del ojo favorece la resolución visual, ya que más luz es enfocada en la retina. Se debe tener en cuenta que el radio del lente está relacionado con la longitud focal, toda vez que al aumentar dicha longitud, aumenta el ángulo de incidencia de los rayos de luz sobre la retina, por lo cual también aumenta el número de células fotorreceptoras estimuladas (Pankhurst 1987).
La esclerótica es una capa firme que rodea la coroides, provee rigidez y le da la forma al ojo, además es una estructura que está relacionada con la velocidad de nado en los peces (Munz 1971). P. axelrodi consume presas vivas y habita en lugares con flujo de agua constante. Por otro lado, la presencia de cartílago en la esclerótica puede ayudar a mantener la forma del ojo para equilibrar la distorsión producida durante el nado (Nakamura y Yamaguchi 1991).
La presencia de la rete mirabilis coroides muestra una alta demanda metabólica, debido a que su función principal es regular la presión sanguínea del ojo y suplir las necesidades metabólicas de la retina, uno de los tejidos con mayor actividad (Herbert et al. 2002). Por lo tanto la necesidad visual y la condición cazadora de P. axelrodi se ve reflejada en la demanda de oxígeno y nutrientes de la retina. Se ha reportado que en general los peces de ojos pequeños carecen de esta rete mirabilis (Bridges et al. 1998); sin embargo, se debe considerar que su presencia depende de los hábitos de la especie y del grosor de la retina (Waser y Heisler 2005). Por ejemplo el neón cardenal tiene una retina posterior gruesa (210.4 μm) comparada con el tamaρo del ojo y, por ello – a pesar de ser un pez pequeño (2.7 cm de longitud total) –, tiene una rete mirabilis coroides, aunque no es muy notoria.
El espesor promedio del iris (18.9 μm) es menor al promedio obtenido por Tovar et al. (2008) en capitán de la sabana y trucha arco iris (31.2 μm y 41.2 μm respectivamente). El espesor reducido del iris en estas tres especies puede ser explicado porque la pupila tiene poca actividad en la mayorνa de teleósteos (Douglas y Bjamgoz 1990). Sin embargo, Douglas et al. (1998) reportan la importancia del movimiento de la pupila en peces, principalmente los que habitan en ambientes oscuros. La capacidad de dilatación de la pupila determina la cantidad de luz que penetra hacia la retina, lo cual es algo que se puede modificar dependiendo de la necesidad y la disponibilidad de luz. La diferencia en el espesor de la pupila entre E. mutisii, O. mykiss y P. axelrodi está relacionada con la proporción entre el tamaño del ojo y el tamaño del cuerpo. En el caso del neón cardenal, a pesar de tener menor tamaño corporal, proporcionalmente las estructuras del ojo tienen mayor espesor que el de las otras especies.
El espesor promedio de la córnea en neón cardenal (27.6 μm) es similar al de E. mutissi (20.6 μm) (Tovar et al. 2008) y D. rerio (26 μm) (Zhao et al. 2006). Por otro lado, O. mykiss tiene un espesor de 300.4 μm (Tovar et al. 2008) y Cyprinus carpio de 325.9 μm (Lynch et al. 2007). P. axelrodi, aunque tiene un espesor promedio similar al de E. mutissi, no tiene el falso parpado para la protección del ojo, que sí posee el capitán de la sabana (Tovar et al. 2008).
Lo antedicho indica que se debe considerar la diferencia de ambientes; ya que el capitán de la sabana es una especie de hábitos bentónicos (Amaya 1975), mientras que neón cardenal es una especie que habita en aguas donde hay menor riesgo de abrasión con elementos del fondo. El neón cardenal habita en ambientes pelágicos con alta vegetación, por lo que la disponibilidad de luz es baja (Froese y Pauly 2006). Se debe tener en cuenta que la función principal de la córnea es dejar pasar los rayos de luz incidentes (Douglas y Bjamgoz 1990), por lo tanto una córnea de menor espesor y mayor transparencia permite una mayor sensibilidad (Smelser 1962).
P. axelrodi tiene una pupila circular y un poco alargada naso-caudalmente, lo que favorece la estimulación de mayor numero de neuronas visuales. Una especie con pupila de forma circular tiene más aberración esférica debido a que los rayos de luz incidentes en el borde del cristalino son interrumpidos por el iris cuando el lente es protruido a través de este, por lo tanto la corrección de esta aberración no se da por la forma de la pupila (Sivak y Luer 1991), debido a esto el control de luz tiene lugar en el epitelio pigmentado de la retina y/o en los fotorreceptores (Douglas y Bjamgoz 1990). Se han realizado estudios que afirman que la forma de la pupila influye en la distribución de células ganglionares y fotorreceptoras (Peterson y Rowe 1980).
Se ha reportado que el grosor promedio de la retina en algunas especies de teleósteos está entre 200 y 300 μm, sin tener en cuenta los efectos del encogimiento causados por la deshidratación (Bowmaker 1990). Waser y Heisler (2005) obtuvieron un espesor promedio de la retina de O. mykiss de 436 μm. Tovar et al. (2008) presentaron resultados similares para la misma especie con un espesor promedio en esta estructura de 389.5 μm y Rao et al. en el 2006 reportaron para D. rerio un espesor promedio de 123 μm.
La comparación entre el espesor de la retina temporal y la retina dorsal reveló diferencias significativas, lo cual se ve reflejado en la presencia de areae centrales en la parte posterior de la retina. Collin y Shand (2003) reportan que una mayor incidencia de luz puede afectar la cantidad de fotorreceptores presentes en una zona de la retina, generalmente la de la parte posterior. Se debe tener en cuenta que pueden haber diferencias en la funcionalidad de las zonas de la retina: el área temporal puede ser útil para ver las presas en la parte frontal inferior del campo visual, el área nasal (lateral en este estudio) puede ser usada para la vigilancia de predadores que se ubiquen en la parte caudal inferior del campo visual (Collin y Partridge 1996).
A partir de este estudio se podría inferir que P. axelrodi tiene una retina relativamente gruesa comparada con el tamaño del ojo y que la zona temporal de la retina tiene mayor espesor que la zona lateral. Un mayor número de células fotorreceptoras, más anchas y con segmentos externos más largos favorecen el poder de resolución. Este tipo de adaptaciones se ven reflejadas en una capa de células fotorreceptoras más gruesa (Frohlich et al. 1995). Tapas y Josobanta (2002) describen la importancia de realizar estudios topográficos de la retina, lo cual ayudaría a confirmar los resultados obtenidos en P. axelrodi.
El TRO (9.8%) está relacionado con el hábito diurno de la especie. Si se relaciona este hábito con la histología y morfometría del ojo de P. axelrodi se observa que tiene adaptaciones como las siguientes: una esclera con cartílago, una córnea delgada, la rete mirabilis coroides, un cristalino circular proporcionalmente grande y la presencia de areae centrales en la retina. Lo cual indica que las necesidades visuales del neón cardenal para adaptarse a las condiciones del hábitat son altas debido a su condición de cazador, a pesar de tener un tamaño corporal pequeño. Para esto es necesario tener un sistema visual muy desarrollado que mejore la agudeza y sensibilidad visual.
Agradecimientos
Esta investigación se realizó gracias al apoyo económico de Vicerrectoría de investigaciones de la Universidad Militar Nueva Granada en el marco del proyecto CIAS 2004-12. A Alexander Bustos por su colaboración con el análisis estadístico.
Resumen
El pez dulceacuícola P. axelrodi es de gran importancia comercial en la Orinoquía Colombiana y a nivel mundial, pero carece de estudios acerca de su visión. Se utilizaron diez individuos, con longitud total promedio de 2.7 cm (SD= 0.2, n= 20). Se realizaron cortes a 8 μm y se tiρeron con H-E. El tamaño relativo del ojo es 9.8% (SD= 1.1, n= 20); el cristalino tiene un tamaño relativo de 64.3% (SD= 4.9, n=20). Una esclerótica con tejido cartilaginoso. La retina está constituida por ocho capas y dos membranas, hay areae centrales en la zona posterior, por lo tanto tiene mayor espesor que la zona lateral. El espesor promedio de las estructuras es: retina lateral: 144.5 μm (SD= 5.4, n= 20), retina temporal: 210.4 μm (SD= 14.8, n= 20); cristalino (esfιrico): dorso-ventral 759.6 μm (SD= 31.7, n= 20) y antero- posterior 763.4 μm (SD= 30.7, n= 20) y cσrnea: 27.6 μm (SD= 4.3, n= 20). El tamaρo relativo del ojo, relacionado con la presencia de areae centrales y una córnea delgada, muestra las necesidades visuales del neón cardenal (cazador) para adaptarse al hábitat, lo que hace necesario tener un sistema visual desarrollado que le permita tener mejor sensibilidad y resolución visual.
Palabras clave: histología, sensibilidad visual, morfometría, ecología visual, teleósteos.
Referencias
Ali, M.A. & M. Anctil. 1976. Retinas in fish: an atlas. p. 139-170. En S.P. Collin & J.N. Marshall (eds.). Sensory Processing in Aquatic Environments. Springer, Nueva York, EEUU. [ Links ]
Amaya, R. 1975. Contribución al estudio biológico del capitán de la sabana Eremophilus mutisii (Humboldt 1805) en el lago de Tota. Trabajo de grado. Facultad de Biología Marina. Universidad Jorge Tadeo Lozano. Bogotá, Colombia. [ Links ]
Anseeuw, D., T. Gaethofs & G. Louette. 2005. First record and morphometry of the non-indigenous fathead minnow Pimephales promelas (Rafinesque, 1820) (Teleostei, Cyprinidae) in Flanders (Belgium). Belg. J. Zool. 135: 87-90. [ Links ]
Baumgartner, J.V., M.A. Bell & P.H. Weinberg. 1988. Body form differences between the Enos Lake species pair of threespine sticklebacks (Gasterosteus aculeatus complex). Can. J. Zool. 66: 467-474. [ Links ]
Bergmann, G.T. & P.J. Motta. 2005. Diet and morphology through ontogeny of the nonindigenous Mayan cichlid Cichlasoma (Nandopsis) urophthalmus (Günther 1862) in southern Florida. Environ. Biol. Fish. 72: 205–211. [ Links ]
Bowmaker, J.K. 1990. Visual pigments of fishes. p. 81-108. En R.H. Douglas & M.B.A. Djamgoz (eds.). The Visual System of fish. Chapman & Hall, Londres, Inglaterra. [ Links ]
Bridges, C.R., M. Berenbrink, R. Müller & W. Waser. 1998. Physiology and biochemistry of the pseudobranch: an unanswered question? Comp. Biochem. Physiol. 119: 67-77. [ Links ]
Collin, S.P. & J.C Partridge. 1996. FISH VISION: Retinal specializations in the eyes of deep-sea teleosts. J. Fish. Biol. 49: 157-174. [ Links ]
Collin, S.P. & J. Shand. 2003. Retinal Sampling and the Visual Field in Fishes. p. 139-170. En S.P. Collin & J.N. Marshall (eds.). Sensory Processing in Aquatic Environments. Springer, Nueva York, EEUU. [ Links ]
Corti, M. & D. Crosetti. 1996. Geographic variation in the grey mullet: a geometric morphometric analysis using partial warp scores. J. Fish Biol. 48: 255-269. [ Links ]
Douglas, B. & M.B. Djamgoz. 1990. In the visual system of fish. Springer, Londres, Inglaterra. [ Links ]
Douglas, R.H., R.D. Harper & J.F. Case. 1998. The pupil response of a teleost fish, Porichthys notatus: description and comparison to other species. Vision Res. 38: 2697-2710. [ Links ]
Evans, B. 2004. A fish’s eyes view of habitat change. p.1- 30. En G. Von Der Emde, J. Mordans & B.G. Kapoor (eds.). The Senses of Fish, adaptations for the receptions of natural stimuli. Kluwer, Dordrecht, Holanda. [ Links ]
Fernald, R.D. 2000. Sensory systems. p. 225-233, 451-462. En G. Ostrander. The Laboratory Fish. Academic, Londres, Inglaterra. [ Links ]
Frohlich E., K. Negishi & H.J. Wagner. 1995. Patterns of Rod Proliferation in Deep- sea Fish Retinae. Vision Res. 35: 1799-1811. [ Links ]
Gratzek, J.B. & J.R. Matthews. 1992. Aquarology: The science of fish health management. Tetra, Nueva York, EEUU. [ Links ]
Herbert, N.A., M.G. Wells & J. Baldwin. 2002. Correlates of choroid rete development with the metabolic potential of various tropical reef fish and the effect of strenuous exercise on visual performance. J. Exp. Mar. Biol. Ecol. 275: 31–46. [ Links ]
Lynch, G.L., A. Hoffman & T. Blocker. 2007. Central corneal thickness in koi fish: effects of age, sex, body length, and corneal diameter. Vet. Ophthalmol. 10: 211–215. [ Links ]
Lythgoe, J.N. 1989. The ecology of vision: ecological adaptations. p. 431 - 445. En Pankhurst, N.W (ed.). The relationship of ocular morphology to feeding modes and activity periods in shallow marine teleost from New Zealand. Environ. Biol. Fish. 26: 201- 211. [ Links ]
Mancera-Rodríguez, N.J. & R. Álvarez-León. 2008. Comercio de peces ornamentales en Colombia. Acta Biol. Colomb. 13: 23–52. [ Links ]
Marshall, B.G., B.R. Forsberg & M.J.F. Thomé-Souza. 2008. Autotrophic energy sources for Paracheirodon axelrodi (Osteichthyes, Characidae) in the middle Negro River, Central Amazon, Brazil. Hydrobiologia. 596: 95-103. [ Links ]
Munz, F.W. 1971. Vision: Visual Pigments, p. 1-3. En W.S. Hoar & D.J. Randall. Fish Physiology. Academic Press, Nueva York, EEUU. [ Links ]
Nakamura, K. & H. Yamaguchi. 1991. Distribution of scleral ossicles in teleost fishes. Memoirs of Faculty of Fisheries, Kagoshima University, Kagoshima, Japón. [ Links ]
Pakkasmaa, S., E. Ranta & J.A. Piironen. 1998. Morphometric study on four land- locked salmonid species. Ann. Zool. Fennici. 35: 131-140. [ Links ]
Pankhurst, N.W. 1987. Intra and Interspecific changes in retina morphology among mesopelagic and demersal teleosts from the slope of New Zealand. Environ. Biol. Fish. 4: 269-280. [ Links ]
Pankhurst, N.W. 1989. The relationship of ocular morphology to feeding modes and activity periods in shallow marine teleost from New Zealand. Environ. Biol. Fish. 26: 201-211. [ Links ]
Pankhurst, P.M. & R. Eagar. 1996. Changes in visual morphology through life history stages of the new Zealand snapper, Pagrus auratus. New Zeal. J. Mar. Fresh. Res. 30: 70-90. [ Links ]
Paul, L.J. 1986. An identification guide. Reed Methuen. Auckland, Nueva Zelandia. [ Links ]
Pekcan-Hekim, Z. 2007. Effects of turbidity on feeding and distribution of fish. Ph.D. Tesis. Universidad de Helsinki, Helsinki, Finlandia. [ Links ]
Peña, R. & S. Dumas. 2007. Desarrollo de la retina en lavas de cabrilla arenera Paralabrax maculatofasciatus (Percoidei: Serranidae) bajo condiciones de cultivo. Cienc. Mar. 33: 293-300. [ Links ]
Peterson, E.H. & M.H. Rowe. 1980. Different regional specializations of neurons in the ganglion cell layer and inner plexiform layer of the California horned shark, Heterodontus francisci. Brain Res. 201: 195-201. [ Links ]
Prophet, E. 1995. Instituto de Patología de los EEUU de América (AFIP). Métodos Histotecnológicos. Registro de patología de los EEUU de América. Washington, EEUU. [ Links ]
Ramírez, H., L. Carrillo, E. Lacera & R. Ajiaco. 2001. La pesca de especies de interés ornamental en el área de influencia de Puerto Carreño. p. 90-92. En H. Ramírez & R. Ajiaco (eds). La pesca en la baja Orinoquía Colombiana: Una visión Integral. INPA, Colombia. [ Links ]
Rao, K.D., Y. Verma, H.S. Patel & P.K. Gupta. 2006. Non-invasive ophthalmic imaging adult zebrafish eye using optical coherence tomography. Curr. Sci. Invidia. 90:10-11. [ Links ]
Ross, M.H. 2002. Histology. A Text and Atlas. Lippincott, Baltimore, Maryland, EEUU. [ Links ]
Sandström, A. 1999. Visual ecology of fish – a review with special reference to percids. National Board of Fisheries Pub. Fiskeriverket rapport. 2: 45-80. [ Links ]
Sivak, J.G. & C.A. Luer. 1991. Optical development of the ocular lens of an elasmobranch Raja elanteria. Vision Res. 31: 373-382. [ Links ]
Smelser, G.K. 1962. Corneal hydration comparative physiology of fish and mammals. Invest. Ophth. Visual. 1: 11-32. [ Links ]
Smith, C.U.M. 2000. Biology of Sensory System. Wiley, Nueva York, EEUU. [ Links ]
Tapas, C. & B. Josobanta. 2002. Retinal cytoarchitecture in some mountain stream teleosts of India. Env. Biol. Fish. 63: 435-449. [ Links ]
Tovar, M.O., L.F. Contreras, M.L. Caldas, D. Rodríguez & H. Hurtado. 2008. Comparación histológica y morfométrica entre el ojo de Eremophilus mutisii (Trichomycteridae) y el de Oncorhynchus mykiss (Salmonidae). Acta Biol. Colomb. 13: 75 – 90. [ Links ]
Utne-Palm, A.C. 1999. The effects of prey mobility, prey contrast, turbidity and spectral composition on the reaction distance of Gobiusculus flavescens to its planktonic prey. J. Fish. Biol. 54:1244-1258. [ Links ]
Verep, B., D. Turan, & V. Kovac. 2006. Preliminary results on morphometry of barbell (Barbus tauricus, Kessler, 1887) in the streams of Rize and Artvin providences (Turkey). Turk. J. Fish. Aquat. Sci. 6: 17-21. [ Links ]
Wagner, H.J. 1990. Retinal structure of fishes. p. 81-108. En J.K. Bowmaker. In the Visual System of fish. Chapman & Hall, Londres, Inglaterra. [ Links ]
Wahl, C.M., E.L. Mills, W.N. McFarland, & J.S. DeGisi. 1993. Ontogenetic changes in prey selection and visual acuity of the yellow perch, Perca flavescens. Can. J. Fish. Aquat. Sci. 50: 743-749. [ Links ]
Walker, I. 2004. The food spectrum of the cardinal-tetra (Paracheirodon axelrodi, Characidae) in its natural habitat. Acta Amazonica. 34: 69–73. [ Links ]
Walls, G.I. 1942. The Vertebrate eye and its Adaptative radiation. Hafner, Nueva York, EEUU. [ Links ]
Wanzenböck, J., M. Zaunreiter, C.M. Wahl, & D.L.G. Noakes. 1996. Comparison of behavioral and morphological measures of visual resolution during ontogeny of roach (Rutilus rutilus) and yellow perch (Perch flavescens). Can. J. Fish. Aquat. Sci. 53: 1506-1512. [ Links ]
Waser W. & N. Heisler. 2005. Oxygen delivery to the fish eye: Root effect as crucial factor for elevated retinal PO2. J. Exp. Biol. 208: 4035-4047. [ Links ]
Winemiller, K.O. 1989. Ontogenetic diet shifts and resource partitioning among piscivorous fishes in the Venezuela llanos. Environ. Biol. Fish. 26: 177–199. [ Links ]
Zanuy, J. & M. Carrillo. 1990. La reproducción de los teleósteos y su aplicación en la acuicultura. INRA, Paris, Francia. [ Links ]
Zar, J.H. 1999. Biostatistical Analysis. Prentice-Hall. Englewood Cliffs, Nueva Jersey, EEUU. [ Links ]
Zhao, X.C., R.W. Yee, E. Norcom, H. Burgess, A.S. Avanesov, J.P. Barrish, & J. Malicki. 2006. The zebrafish cornea: structure and development. Invest. Ophthalmol. Vis. Sci. 47: 4341-4348. [ Links ]
Referencias de internet
Froese, R. & D. Pauly. 2006. Fishbase. Paris, Francia. (Consultado: junio de 2006, www.fishbase.org). [ Links ]