Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.56 n.3 San José Sep. 2008
Lactonas sesquiterpénicas de las plantas Viguiera sylvatica y Decachaeta thieleana (Asteraceae) modulan la producción de óxido nítrico y la fagocitosis de macrófagos RAW
Omar A. Dupuy L.1,3, Renato Murillo2 & José A. Bonilla V.1
1. Centro para Investigaciones en Biología Celular y Molecular (CIBCM), Universidad de Costa Rica, San Pedro, San José, Costa Rica. Fax: 00506-2207-3190; jbonilla@cariari.ucr.ac.cr
2. Escuela de Química. Universidad de Costa Rica, San Pedro, San José, Costa Rica; renato@calzada.equi.ucr.ac.cr
3. Laboratorio de Fisiología Animal e Inmunobiología Dr. Erich Graetz. Facultad de Ciencias Naturales, Exactas y Tecnología. Universidad de Panamá, Ciudad de Panamá, Panamá; omarielsag@yahoo.com
Abstract: Sesquiterpene lactones of the plants Viguiera sylvatica and Decachaeta thieleana (Asteraceae) modulate nitric oxide production and phagocytosis of macrophages cell line RAW. Different species of the Asteraceae family are a potential source of sesquiterpene lactones with anti-inflammatory properties. Macrophages play a central role in the regulation of immune responses. In the present study, the in vitro effect of two sesquiterpene lactones, a millerenolide and a thieleanin, was assessed by measuring the production of nitric oxide (NO) by cell line RAW (murine macrophages) using the Griess reagent. Additionally, the effect of these sesquiterpene lactones on phagocytic capacity of latex particles and the reduction of nitroblue tetrazolium (NBT) were evaluated microscopically. Treatment of macrophages with >2.5 µg/ml of both sesquiterpene lactones, reduced the production of NO. A decreased number of macrophages able to reduce NBT were observed when these cells were treated with 3 µg/ml of millerenolide or 7.5 µg/ml of thieleanin. Treatment of macrophages with 4 µg/ml of millerenolide or 7.5 µg/ml of thieleanin, reduced the phagocytic capacity of macrophages. Cytotoxic effects on the macrophages were only observed when the concentration was increased to 8 µg/ml of millerenolide or 25 µg/ml of thieleanin. Our results suggest that these sesquiterpene lactones could be useful compounds in the elaboration of anti-inflammatory drugs. Rev. Biol. Trop. 56 (3): 1063-1073. Epub 2008 September 30.
Key words: sesquiterpene lactones, millerenolide, thieleanin, immunomodulation, Asteraceae.
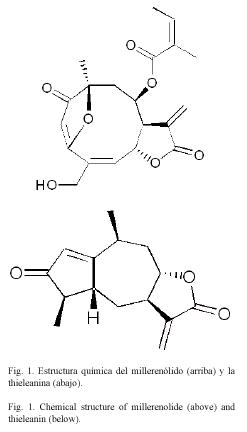
Las lactonas sesquiterpénicas constituyen un grupo de terpenoides C 15 con un anillo lactónico, que representan los componentes activos de muchas plantas medicinales de la familia Asteraceae. Estos compuestos se obtienen a partir de hojas y flores de plantas como Milleria quinqueflora, Viguiera sylvatica, Decachaeta thieleana (Castro et al. 2000), Vanillomopsis arborea (Vischnewski et al. 1999) y Arnica montana (Willuhn et al. 1984), entre otras.
Algunos ensayos demuestran que los extractos de estas plantas, así como también, las lactonas sesquiterpénicas purificadas poseen propiedades antiinflamatorias (García-Piñeres et al. 2001, Humar et al. 2003). Los macrófagos desempeñan una función central en la regulación de la respuesta inmu ne, así como también en la reparación tisular (Unanue 1989). En respuesta al lipopolisacárido (LPS), los macrófagos secretan citocinas proinflamatorias (Laskin y Pendino 1995) y radicales libres o especies reactivas del oxíge no (ROS, del inglés reactive oxygen species), tales como, los aniones superóxido (Víctor et al. 1998, 2000).
Se ha sugerido que el estrés oxidativo cau sado por ROS, es uno de los principales efectos dañinos inducidos por el LPS (McKechnie et al. 1986, Víctor et al. 1998, 2002).
El LPS induce la producción de óxido nítrico (NO) en los macrófagos. La oxidación producida por el NO en la célula, lleva a la formación de un producto nitrito estable, el cual puede ser cuantificado espectrofotométricamente en el sobrenadante del cultivo celular debido a que produce un cromóforo al reaccionar con el reactivo de Griess (Hirvonen et al. 1996).
En este estudio se evaluó el efecto in vitro de dos lactonas sesquiterpénicas (Fig. 1), que fueron aisladas en Costa Rica de plantas de la familia Asteraceae, sobre la producción de NO y la función fagocítica de una línea celular de macrófagos murinos (RAW). Nuestros datos indican que estas lactonas sesquiterpénicas pueden disminuir la producción de NO y la cantidad de partículas fagocitadas por los macrófagos RAW.
Materiales y métodos
Lactonas sesquiterpénicas: El millerenólido y la thieleanina (Fig. 1) evaluados en este estudio, fueron aislados y purificados de Viguiera sylvatica y Decachaeta thieleana, respectivamente (Castro et al. 2000).
Un milígramo de lactona sesquiterpénica fue disuelto en 0.1 ml de dimetilsulfóxido (DMSO) y luego fue diluído en 0.9 ml de medio de cultivo RPMI 1640 (Sigma, No. Cat. R-8755), para obtener una solución "stock" de 1 mg/ml, a partir de la cual se realizaron diluciones para los diferentes ensayos.
Línea celular: La línea celular de macrófagos murinos (RAW) fue cultivada en medio de cultivo RPMI 1640, suplementado con suero fetal bovino (SFB) al 10%, 50 µg/ml de estreptomicina, 100 UI/ml de penicilina, 2mM de glutamina, 5 mM de 2-mercaptoetanol, 10 mM de solución MEM de aminoácidos esenciales, 45 mM de bicarbonato de sodio, 0.8 mM de glucosa y 25 mM de N-(2-hidroexitietil) piperazina-N-(ácido 2-etanosulfónico) (HEPES).
Las células fueron incubadas a 37oC en cámara húmeda, en una atmósfera al 5% de CO2. El medio de cultivo fue reemplazado cada cuatro días y los pasajes fueron realizados cada siete días.
Los ensayos posteriores se realizaron sembrando 1 x 105 macrófagos/pocillo en placas de 96 pocillos de fondo plano (Costar). El volumen final agregado en cada pocillo fue de 200 µl.
Viabilidad celular: Los macrófagos tratados y no tratados con las lactonas sesquiterpénicas (0 -35 µg/ml) fueron incubados a 37oC, en una atmósfera al 5% de CO2 por 72 horas. Posteriormente, la viabilidad de las células fue determinada con el método descrito por Mosmann con las modificaciones hechas por Bonilla y colaboradores (Mosmann 1983, Bonilla et al. 1993). Brevemente, se emplearon 50 µl por pocillo de una solución de sal de tetrazolio (XTT) (Sigma, No. Cat. X-4251) (1 mg/ml) y N-metilfenacina metasulfato (PMS) (0.01 M). Los macrófagos fueron incubados durante dos horas a 37 °C en oscuridad. Posteriormente, se transfirieron 100 µl del sobrenadante de cada pocillo a otra placa de 96 pocillos y se cuantificó el cambio de color en un lector de microplacas Dynex MRX (Dynex Technologies), a una longitud de onda de 450 nm y con un filtro de referencia de 650 nm. Adicionalmente, la viabilidad de las células fue determinada con azul Tripán.
Producción de óxido nítrico por macrófagos: Macrófagos tratados y no tratados con las lactonas sesquiterpénicas (0 – 7.5 µg/ml), fueron estimulados con 50 µl de lipopolisacárido (LPS) (1 µg/ml de RPMI 1640) y se incubaron a 37°C durante 24 horas. Posteriormente, se transfirieron 100 µl de sobrenadante de cada pocillo a otra placa similar y se agregó igual volumen de reactivo de Griess (1% de sulfanilamida, Sigma, No. Cat. S-9251 y 0.1% de naftilenediamina, Sigma, No. Cat. N-9125 disuelto en ácido fosfórico al 5%). Luego se determinó la absorbancia a 550 nm de cada una de las soluciones de prueba y de los controles, utilizando un lector de microplacas BioRad. La concentración de NO se determinó por extrapolación en una curva ajustada, por el método de mínimos cuadrados que fue diseñada con un patrón de nitrito de sodio, en donde la absorbancia se encuentra directamente relacionada con la cantidad de NO producido.
Reducción de nitroazul de tetrazolio (NBT): Macrófagos tratados y no tratados con las lactonas sesquiterpénicas (0 – 10 µg/ ml), fueron estimulados con 10 µl de extracto bacterial no viable (Sigma, No. Cat. 840-15) (1 µg/ml) y 25 µl de NBT (Sigma, No. Cat. 840-10) (1 mg/ml) e incubados a 37°C durante 20 min. Luego, el sobrenadante fue descartado, las células fueron teñidas con Giemsa y observadas en un microscopio invertido (Olympus CK30), para determinar la cantidad de macrófagos NBT positivos (células que contenían depósitos azules). Además, se realizó el mismo experimento con macrófagos no estimulados.
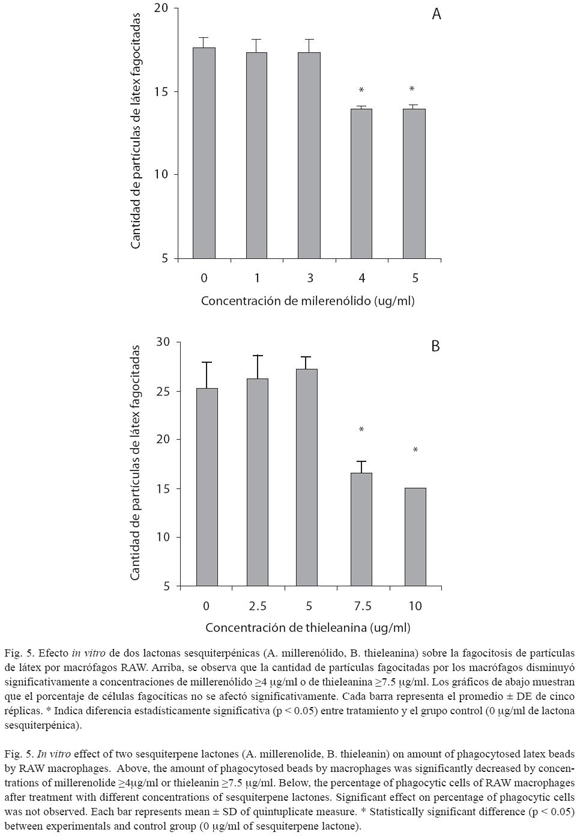
Capacidad fagocítica de los macrófagos: Macrófagos tratados y no tratados con las lactonas sesquiterpénicas (0 – 10 µg/ml), fueron incubados a 37°C durante 48 horas con una suspensión de partículas de látex teñidas de azul oscuro (0.846 µm de diámetro; Sigma, No. Cat. L-1398), en una relación macrófago: partículas = 1:30. Posteriormente, las células fueron lavadas con PBS frío para eliminar las partículas libres, se fijaron con metanol y se tiñeron con Giemsa. Las placas fueron observadas en un microscopio invertido para determinar el porcentaje de células fagocíticas y la cantidad promedio de partículas de látex fagocitadas por macrófago.
Análisis estadístico: Los datos fueron evaluados por medio de un análisis de varianza (ANOVA) y la prueba de Dunnett. Todas las pruebas estadísticas fueron realizadas con el SigmaStat Statistical Analysis Software (Jandel Corporation). Los resultados se presentan como el promedio de cinco réplicas de cada tratamiento y de los controles ± la desviación estándar respectiva. P < 0.05 fue considerado como nivel satisfactorio de significancia estadística.
Resultados
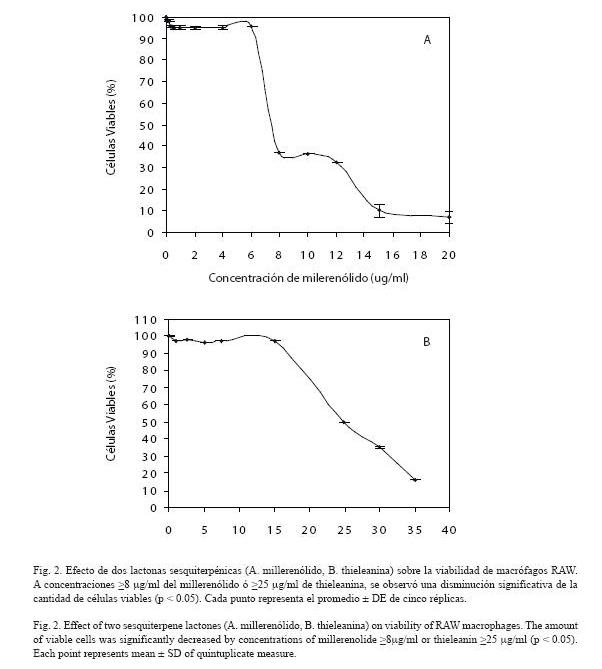
Viabilidad celular: La cantidad de macrófagos vivos sólo disminuyó significativamente (p<0.05) cuando la concentración de millerenólido se incrementó a 8 µg/ml o la de thieleanina se aumentó a 25 µg/ml (Fig. 2). Por debajo de estas concentraciones no se observaron efectos citotóxicos sobre los macrófagos.
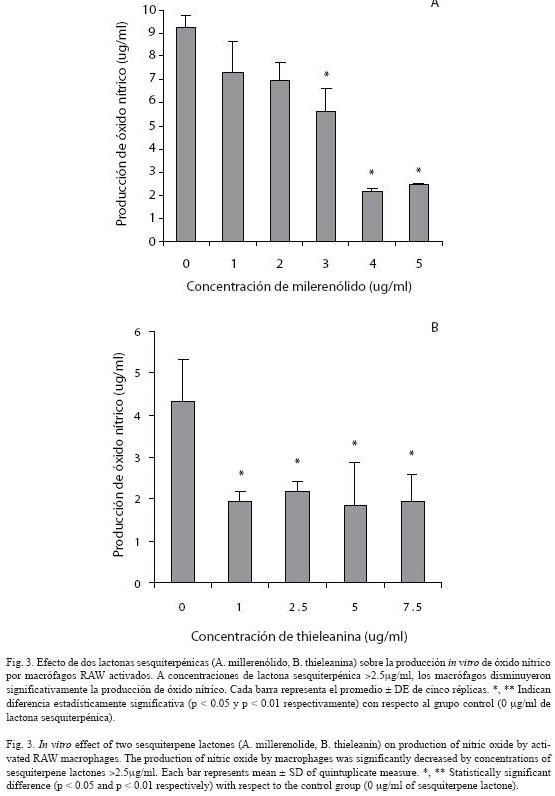
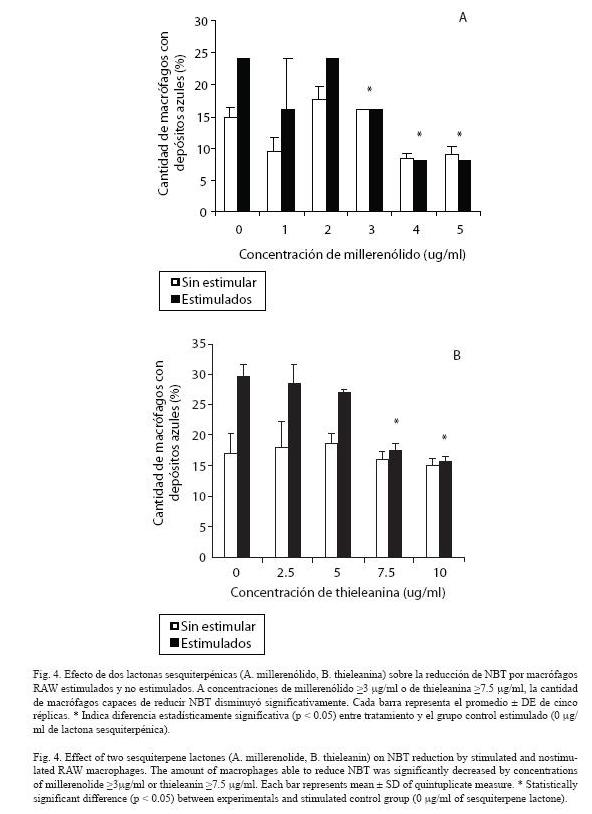
Producción de óxido nítrico y reducción de NBT: Los macrófagos tratados con las lactonas sesquiterpénicas (>2.5 µg/ml) disminuyeron significativamente (p<0.05) la producción de óxido nítrico (Fig. 3). Además, se observó una disminución significativa (p<0.05) de la cantidad de macrófagos capaces de reducir NBT, una vez tratados con millerenólido (3 µg/ml) o thieleanina (7.5 µg/ml) (Fig. 4).
Capacidad fagocítica de los macrófagos: Se observó una disminución significativa (p<0.05) de la cantidad promedio de partículas fagocitadas por los macrófagos al ser expuestos a millerenólido (4 µg/ml) o thieleanina (7.5 µg/ml) (Fig. 5). Sin embargo, no hay diferencia entre tratamientos y control en cuanto al por centaje de células fagocíticas (p>0.05).
Discusión
Los macrófagos participan en la respuesta inmune, en parte produciendo NO como mediador citotóxico (Hibbs et al. 1987, Nathan 1992). Esta actividad citotóxica provoca la disminución de la vida media de los macrófagos in vitro (Albina et al. 1989).
Existe evidencia que sugiere que sustancias antioxidantes pueden disminuir los efectos citotóxicos causados en el macrófago por la síntesis aumentada de NO inducida por LPS (Hagenlocker et al. 1990, Goode y Webster 1993, Hirvonen et al. 1996). Estos reportes permiten postular que los antioxidantes son capaces de proteger al macrófago en situaciones de estrés oxidativo, como habita durante la respuesta inmune inespecífica contra bacterias gram-negativas (Peristeris et al. 1992, Yoshikawa et al. 1994, Víctor y De La Fuente 2003). En este sentido, los cultivos de macrófagos RAW 264.7 utilizados en esta investigación nos permitieron estudiar la capacidad protectora antioxidante del millerenólido y de la thieleanina a concentraciones no tóxicas (Fig. 2). Estas células expuestas a LPS producen NO por medio de la activación de la sintasa de NO inducible (iNOS, del inglés inducible nitric oxide synthase) por citocinas (Stuehr y Marletta 1985, Hibbs et al. 1988, Hirvonen et al. 1996).
La producción de NO y la cantidad de macrófagos capaces de reducir NBT disminuyeron significativamente (p < 0.05) en los cultivos de macrófagos RAW tratados con las lactonas sesquiterpénicas (>2.5 µg/ml) (Fig. 3 y 4). Esto es consistente con lo reportado por otros investigadores, las lactonas sesquiterpénicas interfieren en varias fases de la respuesta inflamatoria, inhiben el factor de transcripción, factor nuclear-kB (NF-kB) y esto afecta la producción de citocinas proinflamatorias y la síntesis de iNOS (Bork et al. 1997, Lyb et al. 1997, Rüngeler et al. 1999, Wong y Menendez 1999, García-Piñeres et al. 2001, Humar et al. 2003). La inactivación de NF-kB se debe, principalmente, a la alquilación de la cisteína 38, en el dominio de unión al ADN de la subunidad p65, lo que previene la interacción del factor de transcripción con el ADN. Esta interferencia habita debido a que las lactonas sesquiterpénicas, poseen dominios 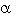
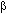
El incremento de ROS es el resultado del estallido respiratorio inducido por el LPS en macrófagos (Hagenlocker et al. 1990, Goode y Webster 1993). Al disminuir la producción de ROS por acción de las lactonas sesquiterpénicas, se protege al macrófago de una situación de estrés oxidativo. Sin embargo, el hecho de que a concentraciones elevadas de lactona sesquiterpénica, se observaran efectos citotóxicos significativos (p < 0.05) sobre los macrófagos (Fig. 2), denota que un exceso de estos compuestos puede interferir con procesos vitales para estas células. Todos los experimentos presentados en este reporte se hicieron a concentraciones de millerenólido (≤ 4µg/ml) y thieleanina (≤ 10µg/ml) muy por debajo de las concentraciones citotóxicas.
Los macrófagos contribuyen al estado oxidativo inducido por el LPS y además pueden sufrir cambios en sus funciones como consecuencia del estrés oxidativo. Se ha sugerido que la producción de radicales libres, tales como aniones superóxidos, está relacionada a la mortalidad observada en procesos inflamatorios agudos como el "shock" endotóxico. Estos resultados pueden ser importantes para el desarrollo de posibles terapias que implican el uso de antioxidantes y otros captadores de radicales libres (Víctor y De La Fuente 2003).
La producción de ROS está involucrada en la morbilidad y mortalidad observada en procesos infecciosos (Henson y Johnston 1987, Novelli et al. 1989, Weiss 1989, Peristeris et al. 1992, Yoshikawa et al. 1994). La liberación de ROS es estimulada por varias citocinas, como el factor de necrosis tumoral alfa (TNFa) y la interleucina-1 beta (IL-1b) (Meier et al. 1989, Jensen et al. 1992). Los intermediarios del oxígeno, a su vez, aumentan la síntesis de citocinas en los macrófagos, creando así, un círculo vicioso para la producción de ambos tipos de mediadores inflamatorios (Jensen et al. 1992, DeForge et al. 1992).
Se sugiere que existe una relación directa entre la producción de ROS y la fagocitosis, el LPS causa un estrés oxidativo y éste estimula diferentes pasos del proceso fagocítico en macrófagos peritoneales murinos, tales como la adherencia e ingestión de partículas inertes ("latex beads") y la inhibición de la movilidad (Víctor y De La Fuente 2003), entonces, es posible que al disminuir ROS, también se reduzca la fagocitosis, por lo que una sustancia que module la producción de ROS podría modular la fagocitosis. Esto es consistente con nuestras observaciones, el millerenólido (4 µg/ ml) y la thieleanina (7.5 µg/ml) causan la disminución de la cantidad promedio de partículas fagocitadas por los macrófagos RAW (Fig. 5) aunque el porcentaje de células fagocíticas no resulta afectado (p > 0.05).
Otros investigadores han reportado variaciones en la actividad antiinflamatoria de diferentes subfamilias de lactonas sesquiterpénicas (Rüngeler et al. 1999, Humar et al. 2003). El millerenólido, un compuesto perteneciente a la subfamilia de los germacranólidos, tiene aproximadamente el doble de actividad que la thieleanina, un miembro de la subfamilia de los guaianólidos. Tales diferencias pueden explicarse en virtud de que el millerenólido es bifuncional pues posee dos elementos estructurales a,b-insaturados carbonil, los cuales pueden inducir una mayor actividad antiinflamatoria (Rüngeler et al. 1999). El millerenólido, al igual que otros germacranólidos, se caracteriza por poseer un sistema anillado de 10 miembros con una gran flexibilidad conformacional. La thieleanina tiene una forma más rígida (Siedle et al. 2003). En consecuencia, el millerenólido es más reactivo que la thieleanina, tiene una mayor interacción con las proteínas blanco y, por ende, una mayor actividad antiinflamatoria a concentraciones más bajas (Rüngeler et al. 1999, Humar et al. 2003).
En resumen, las lactonas sesquiterpénicas evaluadas en este estudio exhiben un efecto antioxidante sobre macrófagos RAW y causan la disminución de la producción de NO que se genera en respuesta a la estimulación con LPS. Así, estos compuestos podrían contribuir a modular la producción de ROS en los macrófagos, en situaciones de estrés oxidativo.
Agradecimientos
Se agradece al Servicio Alemán de Intercambio Académico (DAAD) y a la Organización de las Naciones Unidas para la Educación, la Ciencia y la Cultura (UNESCO), por financiar, en parte, esta investigación. Este trabajo fue realizado como parte de los requisitos exigidos por la Universidad de Costa Rica para otorgar el grado de Doctor en Ciencias a Omar Dupuy. Además, agradecemos a Norman Rojas por suministrarnos la línea celular de macrófagos de ratón (RAW).
Resumen
Las plantas de la familia Asteraceae son una fuente potencial de lactonas sesquiterpénicas con propiedades antiinflamatorias. Los macrófagos son células que desempeñan una función central en la regulación de la respuesta inmune. Este estudio evaluó el efecto in vitro de dos lactonas sesquiterpénicas, un millerenólido y thieleanina, sobre la producción de óxido nítrico (NO) en una línea celular de macrófagos de ratón (RAW), utilizando el reactivo de Griess. Además, se estudió el efecto sobre la capacidad fagocítica de RAW, evaluando al microscopio la fagocitosis de partículas inertes de látex y la reducción de nitroazul de tetrazolio (NBT). Se observó que los macrófagos tratados con lactona sesquiterpénica (>2.5 µg/ml) disminuyeron la producción de NO. Además, se observó una disminución de la cantidad de macrófagos capaces de reducir NBT, después que fueron tratados con millerenólido (3 µg/ml) o thieleanina (7.5 µg/ ml). Por otro lado, la exposición a 4 µg/ml de millerenólido ó 7.5 µg/ml de thieleanina redujo la cantidad promedio de partículas de látex fagocitadas. No se observaron diferencias entre tratamientos y control en cuanto al porcentaje de células fagocíticas. Sólo se observaron efectos citotóxicos sobre los macrófagos, cuando la concentración de millerenólido se incrementó a 8 µg/ml o la de thieleanina se aumentó a 25 µg/ml. Estos resultados sugieren que el millerenólido y la thieleanina podrían ser compuestos útiles en la elaboración de drogas antiinflamatorias.
Palabras clave: lactonas sesquiterpénicas, millerenólido, thieleanina, inmunomodulación, Asteraceae.
Recibido 27-X-2005. Corregido 30-VI-2008. Aceptado 31-VII-2008.
Referencias
Albina, J.E., C.D. Mills, W.L. Henry & M.D. Caldwell. 1989. Regulation of macrophage physiology by L-arginine: role of the oxidative L-arginine deiminase pathway. J. Immunol. 143: 3641-3646. [ Links ]
Bonilla, J.A., M.G. Mesén & W. Cartín. 1993. Modificación de un método colorimétrico que usa XTT, para la determinación de linfoproliferación. Rev. Cost. Cien. Med. 14: 25-31. [ Links ]
Bork, P.M., M.L. Schmitz, M. Kuhnt, C. Escher & M. Heinrich. 1997. Sesquiterpene lactone containing Mexican Indian medicinal plants and pure sesquiterpene lactones as potent inhibitors of transcription factor NF-kappaB. FEBS Lett. 402: 85-90. [ Links ]
Castro, V., P. Rüngeler, R. Murillo, E. Hernandez, G. Mora, H.L. Pahl & I. Merfort. 2000. Study of sesquiterpene lactones from Milleria quinqueflora on their antiinflammatory activity using the transcription factor NF-kappa B as molecular target. Phytochemistry 53: 257-263. [ Links ]
DeForge, L.E., J.C. Fantone, J.S. Kenney & D.G. Remick. 1992. Oxygen radical scavengers selectively inhibit interleukin-8 production in human whole blood. J. Clin. Invest. 90: 2123-2129. [ Links ]
García-Piñeres, A.J., V. Castro, G. Mora, T.J. Schmidt, E. Strunck, H.L. Pahl & I. Merfort. 2001. Cysteine 38 in p65/NF-kB plays a crucial role in DNA binding inhibition by sesquiterpene lactones. J. Biol. Chem. 276: 39713-39720. [ Links ]
Goode, H.F. & N.R. Webster. 1993. Free radicals and antioxidant in sepsis. Crit. Care Med. 21: 1770-1776. [ Links ]
Hagenlocker, B.E., B.A. Walker & P.A. Ward. 1990. Superoxide responses of immune complex-stimulated rat alveolar macrophages. Intracellular calcium and priming. J. Immunol. 144: 3898-3906. [ Links ]
Henson, P.M. & R.B. Johnston. 1987. Tissue injury in inflammation: oxidants, proteinases, and cationic proteins. J. Clin. Invest. 79: 669-674. [ Links ]
Hibbs, J.B., Z. Vavrin & R.R. Taintor. 1987. L-arginine is required for expression of the activated macrophage effector mechanism causing selective metabolic inhibition in target cells. J. Immunol. 138: 550-565. [ Links ]
Hibbs, J.B., R.R. Taintor, Z. Vavrin & E.M. Rachlin. 1988. Nitric oxide: a cytotoxic activated macrophage effector molecule. Biochem. Biophys. Res. Commun. 157: 87-94. [ Links ]
Hirvonen, M-R., B. Brüne & E.G. Lapetina. 1996. Heat shock proteins and macrophage resistance to the toxic effects of nitric oxide. Biochem. J. 315: 845-849. [ Links ]
Humar, M., A.J. García-Piñeres, V. Castro & I. Merfort. 2003. Effect of sesquiterpene lactones on the expression of the activation marker CD69 and of IL-2 in T-lymphocytes in whole blood. Biochem. Pharmacol. 65: 1551-1563. [ Links ]
Jensen, J.C., H.W. Pogrebniak, H.I. Pass, C. Buresh, M.J. Merino, D. Kauffman, D. Venzon, H.N. Langstein & J.A. Norton. 1992. Role of tumor necrosis factor in oxygen toxicity. J. Appl. Physiol. 72: 1902-1907. [ Links ]
Laskin, D.L. & K.J. Pendino. 1995. Macrophages and inflammatory mediators in tissue injury. Annu. Rev. Pharmacol. Toxicol. 35: 655-677. [ Links ]
Lyb, G., T.J. Schmidt, I. Merfort & H.L. Pahl. 1997. Helenalin, an anti-inflammatory sesquiterpene lactone from Arnica, selectively inhibits transcription factor NF-kB. Biol. Chem. 378: 951-961. [ Links ]
McKechnie, K., B.L. Furman & J.R. Parratt. 1986. Modification by oxygen free radical scavengers of the metabolic and cardiovascular effects of endotoxin infusion in conscious rats. Circ. Shock 19: 429-439. [ Links ]
Meier, B., H.H. Radeke, S. Delle, M. Younes, H. Sies, K. Resch & G.G. Habermehl. 1989. Human fibroblasts release reactive oxygen species in response to interleukin-1 or tumor necrosis factor-a. Biochem. J. 263: 539-545. [ Links ]
Mosmann, T. 1983. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J. Immunol. Methods 65: 55-63. [ Links ]
Nathan, C. 1992. Nitric oxide as a secretory product of mammalian cells. FASEB J. 6: 3051-3064. [ Links ]
Novelli, G.P., P. Angiolini, P. Livi & E. Paternostro. 1989. Oxygen-derived free radicals in the pathogenesis of experimental shock. Resuscitation 18: 195-205. [ Links ]
Peristeris, P., B.D. Clark, S. Gatti, R. Faggioni, A. Mantovani, M. Mengozzi, S.F. Orencole, M. Sironi & P. Ghezzi. 1992. N-acetylcysteine and glutathione as inhibitors of tumor necrosis factor production. Cell Immunol. 140: 390-399. [ Links ]
Rüngeler, P., V. Castro, G. Mora, N. Gören, W. Vischnewski, H.L. Pahl, I. Merfort & T.J. Schmidt. 1999. Inhibition of transcription factor NF-kB by sesquiterpene lactones: a proposed molecular mechanism of action. Bioorg. Med. Chem. 7: 2343-2352. [ Links ]
Siedle, B., L. Gustavsson, S. Johansson, R. Murillo, V. Castro, L. Bohlin & I. Merfort. 2003. The effect of sesquiterpene lactones on the release of human neutrophil elastase. Biochem. Pharmacol. 65: 897-903. [ Links ]
Stuehr, D.J. & M.A. Marletta. 1985. Mammalian nitrate biosynthesis: mouse macrophages produce nitrite and nitrate in response to Escherichia coli lipopolysaccharide. Proc. Natl. Acad. Sci. U.S.A. 82: 7738-7742. [ Links ]
Unanue, E.R. 1989. Macrophages, antigen-presenting cells, and the phenomena of antigen handling and presentation, p. 95-115. In W.E. Paul (ed.). Fundamental Immunology. Raven, Nueva York, EEUU. [ Links ]
Víctor, V.M., M. Miñano, N. Guayerbas, M. Del Río, S. Medina & M. De La Fuente. 1998. Effects of endotoxic shock in several functions of murine peritoneal macrophages. Mol. Cell Biochem. 189: 25-31. [ Links ]
Víctor, V.M., N. Guayerbas, M. Puerto, S. Medina & M. De La Fuente. 2000. Ascorbic acid modulates in vitro the function of macrophages from mice with endotoxic shock. Immunopharmacology 46: 89-101. [ Links ]
Víctor, V.M., D. Rubio & M. De La Fuente. 2002. Comparative study of several lymphocyte functions in two strains of mice with different models of endotoxic shock. Physiol. Res. 51: 291-298. [ Links ]
Víctor, V.M. & M. De La Fuente. 2003. Changes in the superoxide production and other macrophage functions could be related to the mortality of mice with endotoxin-induced oxidative stress. Physiol. Res. 52: 101-110. [ Links ]
Vischnewski, W., C.A. Skrochy, A.M. Nasi, C. Lopes & W. Herz. 1999. 15-Hydroxyeremantholide and derivatives from Eremanthus arboreus. Phytochemistry 50: 317-320. [ Links ]
Weiss, S.J. 1989. Tissue destruction by neutrophils. New Engl. J. Med. 320: 365-376. [ Links ]
Willuhn, G., P.M. Röttger & D. Wendisch. 1984. Helenalinund 11a13-dihydrohelenalinester aus Blüten von Arnica montana. Planta Med. 50: 35-37. [ Links ]
Wong, H.R. & I.Y. Menendez. 1999. Sesquiterpene lactones inhibit inducible nitric oxide synthase gene expression in cultured rat aortic smooth muscle cells. Biochem. Biophys. Res. Cummun. 262: 375-380. [ Links ]
Yoshikawa, T., H. Takano, S. Takahashi, H. Ichikawa & M. Kondo. 1994. Changes in tissue antioxidant enzyme activities and lipid peroxides in endotoxin-induced multiple organ failure. Circ. Shock 42: 53-58. [ Links ]