Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.55 n.3-4 San José Sep./Dec. 2007
Inestabilidad cariológica durante la formación de células madres del polen en Aloe vera (Aloaceae)
José Imery-Buiza
Laboratorio de Genética Vegetal, Departamento de Biología, Escuela de Ciencias, Universidad de Oriente. Apdo. 245, Cumaná 6101, Venezuela; jimery@sucre.udo.edu.ve
Abstract: Karyological instability during pollen mother cells formation in Aloe vera (Aloaceae). In order to clarify possible cytogenetic anomalies that reduce pollen fertility, premeiotic mitosis was studied in Aloe vera plants from a naturalized population in the northeast of Venezuela (10°3415 N and 64°1208 W). Karyological configurations were evaluated during the stage of cell proliferation leading to the formation of pollen mother cells (PMCs). The sampling was carried out in March 2005, choosing inflorescences without mechanical or biological damage from 25 plants selected at random. Flower buds (FB) 2 to 6 mm in length were collected from 7:00 AM through 6:00 PM, their perianths removed, and fixed in Carnoy I (3:1 ethanol/glacial acetic acid) for 24 h and stored in ethanol (70 % v/v) until observation. Light microscope observations were done on temporary preparations obtained by overflowing anther content suspended in acetic orcein (1.5 % w/v) for 5 min and softly squashing with the cover slip. A total of 9 411 cells were analyzed. Upper mitotic activity was observed in FB from 3.8 ± 0.09 mm long, collected at 11:00 AM through 1:00 PM; 17% of PMCs showed one to eight sister chromatid bridges from anaphase to telophase; 13%, one to seven micronucleus of variable diameter (0.9 to 4.8 µm); 8.1% were united by thin chromatin filaments, and 0.1% lacked a nucleus. Other evaluated cells (61.8%) had apparently normal mitotic configurations, without considerable morphometric variations. The evident irregular proliferation of a PMCs fraction (39.2%) suggests that environmental stress conditions (day temperatures ranging 32.7 to 39.8ºC, high solar radiation and low humidity) induce chromosome instability and physiologic changes that affect the normal development during premeiotic mitosis. As a consequence, loss or addition of chromosome fragments can occur in association with deficiencies and gene duplications. Rev. Biol. Trop. 55 (3-4): 805-813. Epub 2007 December, 28.
Key words: Aloe vera, premeiotic mitosis, chromosome abnormalities, micronucleus, dicentric chromosome bridges.
Aloe vera (L.) Burm.f. (=A. barbadensis Mill.), una planta con múltiples propiedades medicinales (Davis 1997), fue introducida en América en el siglo XVI durante la ocupación española. En la actualidad es extensamente cultivada en regiones áridas y semiáridas del sur de EE.UU., México, Venezuela, islas del Caribe y en muchos otros países de la zona tórrida (Hodge 1953, Rowley 1997, Newton 2004).
Las caracterizaciones botánicas realizadas en poblaciones naturales del Viejo Mundo (Noroccidente de África, Mediterráneo y península de Arabia), en general describen a la especie A. vera como una hierba perenne, acaule, con hojas suculentas, glaucas, angosto lanceoladas, de 50 a 80 cm de longitud y bordes espinuliformes; flores amarillas, liliformes, agrupadas en racimos individuales o compuestos; frutos en forma de cápsulas dehiscentes, oblongas y triangulares, con semillas elipsoidales y aplanadas (Jacobsen 1955, Reynolds 1950, 1966, Carter 1994). En Venezuela, la mayoría de estos rasgos morfológicos son también observados en plantas de A. vera naturalizadas o cultivadas con fines ornamentales y terapéuticos (Schnee 1984, Hoyos 1985). Sin embargo, la producción de frutos y semillas es extremadamente escasa (Imery 2000).
En las regiones costeras del estado Sucre (Venezuela) no se observan frutos, aún después de la floración de miles de plantas que han sido visitadas frecuentemente por numerosos vectores, tales como colibríes, abejas, avispas y mariposas (Imery 2002). Para tratar de dilucidar este fenómeno, se han realizado estudios citogenéticos (Imery y Cequea 2002, Albornoz e Imery 2003) y de biología reproductiva (Imery 2001, Velásquez e Imery 2004, 2005), revelándose la existencia de anormalidades cromosómicas, dicogamia y autoincompatibilidad que, en definitiva, limitan la reproducción sexual en estas plantas. Los resultados preliminares del análisis microsporogénico sugieren la necesidad de examinar el proceso de proliferación celular que antecede a la meiosis, a fin de precisar la existencia de otras anormalidades cariológicas que contribuyan a reducir la fertilidad del polen. En este sentido, el objetivo del presente trabajo fue reconocer marcadores citológicos que evidencien posibles deficiencias y/o duplicaciones génicas durante la formación de células madres del polen, en una población de plantas de A. vera en la península de Araya.
Materiales y métodos
Material vegetal y muestreo de campo: El muestreo se llevó a cabo en marzo de 2005 en una población naturalizada de aproximadamente 4 ha, ubicada en el valle de Manicuare (10°3415 N y 64°1208 O), península de Araya-Venezuela. Se seleccionaron 25 plantas al azar, tomando en cuenta la presencia de inflorescencias bien desarrolladas y libres de patógenos, plagas o daños mecánicos. Se recolectaron botones florales a diferentes horas del día (7:00 a.m. -6:00 p.m.) y diferentes estados de desarrollo (2 -6 mm de longitud). Se eliminó rápidamente el perianto para facilitar la penetración de los reactivos y se depositaron en viales con solución fresca de fijador Carnoy I (3:1 etanol/ácido acético glacial) por 24 h y luego fueron almacenados en etanol (70 % v/v) hasta su uso.
Observaciones de laboratorio: Las observaciones se realizaron con un microscopio Bausch & Lomb PBV-4B a partir de láminas temporales preparadas mediante el fraccionamiento transversal de anteras suspendidas en una o dos gotas de orceína acética (1.5 % p/v), desbordamiento y tinción de su contenido durante 5 minutos y, finalmente, colocación del cubreobjeto y aplastamiento muy suave para uniformizar la profundidad de observación y eliminar el exceso de colorante. Al menos cinco botones florales en división mitótica fueron analizados en cada inflorescencia. Las fotomicrografías se tomaron con cámara digital Sony DSC-P52 acoplada al microscopio y las imágenes fueron analizadas en computadora con el programa SigmaScan Pro 5.
Conservación de los especimenes: Una vez finalizadas las evaluaciones cariológicas, se trasladaron las 25 plantas estudiadas hasta el banco de germoplasma de especies suculentas UDO-Biología, Cumaná-Venezuela (10°2632 N y 64°0914 O), se registraron con los códigos 129/2005-0001 al 0025 y actualmente se mantienen in vivo bajo las condiciones ambientales de un bosque muy seco tropical.
Resultados
El estudio morfométrico de las muestras permitió distinguir el tamaño y pigmentación de las estructuras florales en cada una de las etapas de formación del polen en A. vera. Durante la división celular premeiótica, el botón floral está cubierto completamente por la bráctea, presenta un perianto de 3.8 ± 0.09 mm de longitud y color amarillo claro, atravesado longitudinalmente por líneas verdes, más acentuadas hacia el ápice. Las anteras son aún muy pálidas, sin depósitos de polenkit y con eje polar de 0.9 ± 0.03 mm. La mayor actividad mitótica se registró en botones florales colectados entre 11:00 a.m. y 1:00 p.m. A medida que se incrementa el tamaño de los componentes florales, se observan las diferentes fases meióticas, en botones más oscuros y de 4.6 ± 0.12 mm de longitud. El inicio de la meiosis fue tomado como indicador de la finalización del proceso de proliferación celular, actuando como límite superior en los estados de desarrollo evaluados.
Luego de analizar un total de 9 411 células premeióticas, se determinó la existencia de uno a ocho puentes entre cromátidas hermanas en anafase y telofase (Fig. 1), unión de CMPs a través de filamentos de cromatina (Fig. 2A), CMPs con micronúcleos entre 0.9 a 4.8 µm de diámetro (Fig. 2B-E), y CMPs sin núcleo (Fig. 2F). El resto de las células observadas presentaron configuraciones mitóticas aparentemente normales y sin variaciones morfométricas considerables. Todas estas configuraciones cariológicas y sus respectivas frecuencias de observación se resumen en el Cuadro 1.
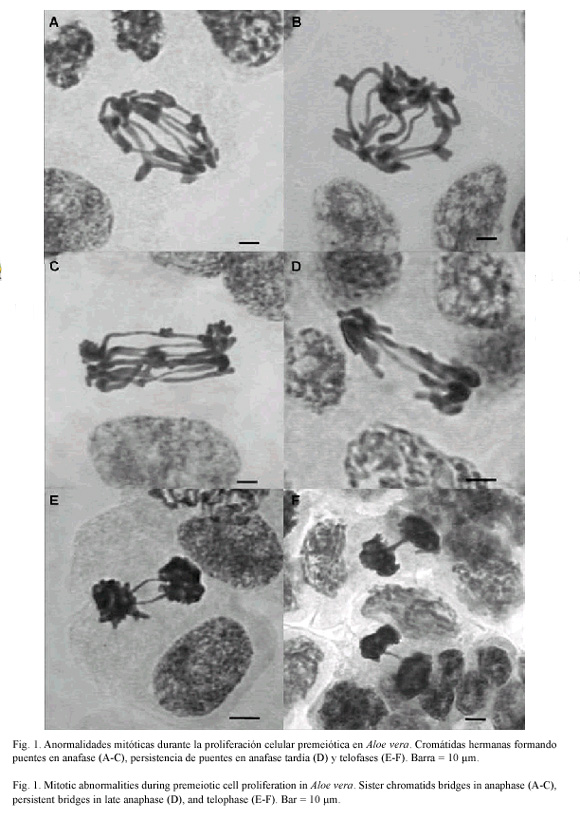
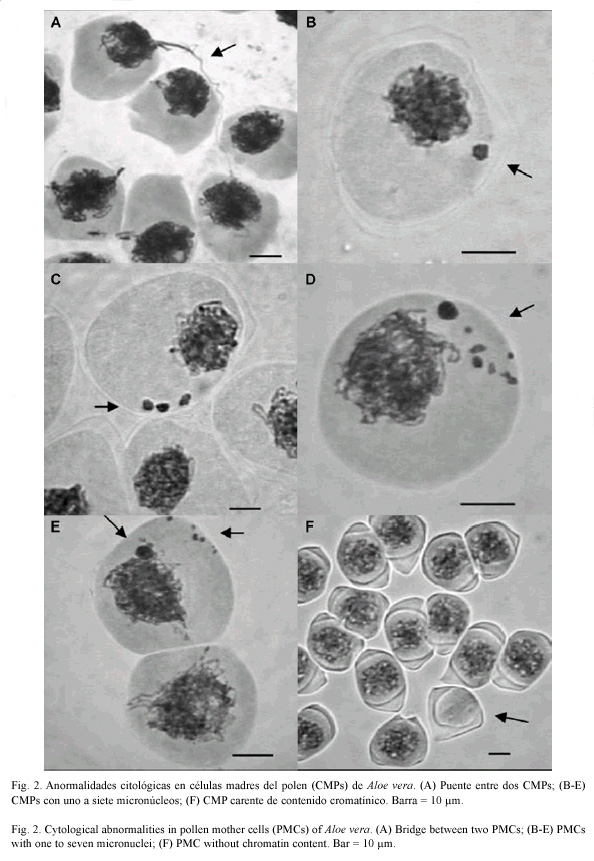

Discusión
Las primeras referencias de anormalidades mitóticas, similares a las observadas en el presente trabajo, fueron descritas por Gates (1911) como fenómenos de citomixis en Oenothera gigas y más tarde en Gossypium hirsutum (Jacob 1941, Brown 1947, Sarvella 1958), Pisum sativum (Gottschalk 1970), Allium cepa (Bowes 1973) y Helicanthes elastica (Soman y Bhavanandan 1993). En la mayoría de estas especies, al igual que en A. vera, se registraron puentes cromosómicos y fragmentos mitóticos claramente visibles entre anafase/telofase y en los microsporocitos primarios, los cuales son indicadores de irregularidades asociadas a deficiencias y duplicaciones génicas que afectan el desarrollo normal de la microsporogénesis y, finalmente, reducen la fertilidad del polen.
Estudios en países de clima templado han relacionado las irregularidades premeióticas con fluctuaciones en las condiciones ambientales, considerando que la frecuencia de accidentes cariológicos en algunas especies vegetales es promovida por el incremento de las temperaturas diurnas durante los cambios de estación. Esta correlación ha sido reconocida en Hemerocallis spp (Narain 1979), Urochloa panicoides (Basavaiah y Murthy 1987), Jasminum spp (George y Geethamma 1988), Capsicum annuum (Lakshmi et al. 1989) y Helicanthes elastica (Soman y Bhavanandan 1993), pero aún no había sido referida en A. vera.
Algunos autores atribuyen el origen de las anormalidades premeióticas a daños mecánicos o heridas cercanas a la yema floral (Sarvella 1958), errores de fijación y manipulación de las muestras (Takats 1959, Kamra 1960), ataque de patógenos (Morisset 1978), contaminación con productos químicos de uso agrícola (Bobak y Herich 1978) y mutaciones puntuales en los genes que regulan los mecanismos de sinapsis, entrecruzamiento y separación de cromátidas (Omara 1976). En el caso particular de A. vera, la selección sistemática de botones florales en condiciones óptimas de desarrollo y la aplicación de un protocolo estándar de preparación (Imery 2002, Cequea et al. 2003), reducen los errores experimentales y respaldan la posibilidad de que las anormalidades premeióticas observadas tengan un origen genético o resulten de una considerable sensibilidad ambiental.
En mamíferos, la exposición prolongada a agentes genotóxicos induce la formación de micronúcleos similares a los observados en esta investigación. Los efectos mutagénicos de algunas antraquinonas de A. vera, entre ellas aloína, antranol, ácido aloético, barboleína y emodina, han sido demostrados en varios experimentos con animales en laboratorio (Mori et al. 1985, 1986, Murakami et al. 1987, Müller et al. 1996, 1997, 1998). Estas antraquinonas incrementan su concentración en el acíbar de plantas de A. vera sometidas a altas temperaturas, sobreexposición a la radiación solar y déficit hídrico (Yépez et al. 1993, Díaz 2001). En base a estos argumentos, es posible que el estrés ambiental imperante en la zona de estudio (temperaturas diurnas entre 32.7 y 39.8 ºC, elevada radiación solar y escasez de humedad) promueva la acumulación de altos niveles de antraquinonas genotóxicas que ocasionan la inestabilidad cromosómica durante la formación de CMPs. Los daños cromosómicos provocados por estas sustancias endógenas deben estar asociados a la observación de "cromosomas pegajosos" (Del Campo y Coletto 1998) referidos en otras especies de Aloe, que expresan también altos niveles de antraquinonas (Brandham 1971, Riley y Majumdar 1979).
La unión entre cromátidas hermanas durante mitosis, e inclusive el mantenimiento de tales puentes después de la citocinesis, puede explicar la presencia de micronúcleos de tamaño y número variable en el interior de los microsporocitos primarios, como consecuencia de la ruptura de dichos puentes a diferentes niveles de longitud (Jackson 1985). En este sentido, la correspondencia entre el número máximo de puentes y micronúcleos observados en esta investigación y el número de cromosomas somáticos (2n = 2x = 8L + 6S), que integran el cariotipo bimodal de A. vera según Sapre (1978), Imery y Caldera (2002), Albornoz e Imery (2003), entre otros, sugiere que las fusiones e intercambios atípicos entre cromátidas hermanas deben ocurrir exclusivamente en cromosomas grandes.
Los rompimientos espontáneos y errores de apareamiento entre homólogos son irregularidades que han sido observadas en la meiosis de especies vegetales como Trillium hagae (Matsuura 1950), Paris verticillata (Haga 1953), Secale cereale (Rees y Thompson 1955), Tradescantia sp y Paeonia broowni (Lewis y John 1966). En A. vera, también se han descrito anormalidades cromosómicas durante la microsporogénesis, atribuidas principalmente a los entrecruzamientos atípicos a nivel de cromátidas o subcromátidas, que generan puentes dicéntricos tipo V o U, visibles en anafase I (Brandham 1970, Sapre 1975, Imery y Cequea 2002). Los resultados de la presente investigación indican que tales fraccionamientos y errores de apareamiento también pueden suceder durante el proceso de proliferación celular que precede a la meiosis, y en consecuencia, contribuyen a la reducción de la fertilidad de los granos de polen debido a desbalances génicos provocados por la adición o pérdida de fragmentos cromosómicos.
Desde el punto de vista evolutivo, las anormalidades premeióticas son aún tema de debates e interpretaciones divergentes. Son consideradas como mecanismos celulares que dan origen a aneuploidías (Sarvella 1958), cromosomas B y microsporocitos hipoploides o hiperploides (Soman y Bhavanandan 1993). Sin embargo, Gottschalk (1970) señala que este tipo de irregularidades cariológicas son inofensivas y podrían ser eliminadas en procesos de división posteriores o desecharse debido a una reducción de la viabilidad y habilidad competitiva del gameto portador o por algún efecto deletéreo a nivel pre o postcigótico. En todo caso, este tipo de accidentes citológicos representa una fuente de variación importante que debe ser considerada en estudios biosistemáticos o para su aprovechamiento potencial en programas de mejoramiento genético.
Agradecimientos
El autor agradece al Consejo de Investigación de la Universidad de Oriente por el financiamiento otorgado para esta investigación, a través del proyecto CI-5-0101011223/05. Igualmente agradece la asesoría de Williams Lampe en materia de microscopía y procesamiento de imágenes y a Antulio Prieto por la lectura crítica del manuscrito.
Resumen
Con el objetivo de esclarecer la posible existencia de anomalías citogenéticas que aminoren la fertilidad del polen de Aloe vera, se analizó la etapa de proliferación celular que lleva a la formación de células madres del polen (CMPs). Se recolectaron botones florales (BF) en 25 plantas de una población ubicada a 10°3415 N, 64°1208 W, los cuales fueron fijados en Carnoy I por 24 h y almacenados en etanol (70 % v/v). Las observaciones se realizaron en preparaciones temporales obtenidas por la tinción del contenido de las anteras suspendidas en orceína acética (1.5 % p/v) por 5 minutos. De las 9 411 células analizadas, 17 % mostraron 1-8 puentes entre cromátidas hermanas, 13 % 1-7 micronúcleos de 0.9-4.8 µm, 8.1 % estaban unidas por puentes y 0.1 % no contenían cromatina. El resto de las células (61.8 %) presentó configuraciones aparentemente normales y sin variaciones morfométricas. La proliferación irregular de una fracción de CMPs (39.2 %) sugiere que las condiciones ambientales de la zona árida donde se realizaron los muestreos inducen inestabilidad cromosómica y cambios fisiológicos que afectan el normal desarrollo de la mitosis premeiótica, generando pérdida o adición de fragmentos, asociados a deficiencias y duplicaciones génicas.
Palabras claves: Aloe vera, mitosis premeióticas, anormalidades cromosómicas, micronúcleos, puentes cromosómicos dicéntricos.
Referencias
Albornoz, A.R. & J. Imery. 2003. Evaluación citogenética de ocho poblaciones de Aloe vera L. de la península de Araya-Venezuela. Ciencia (LUZ) 11: 5-13. [ Links ]
Basavaiah, A. & T.C.S Murthy. 1987. Cytomixis in pollen cells of Urochloa panicoides P. Beauv. (Poaceae). Cytologia 52: 69-74. [ Links ]
Bobak, M. & R. Herich. 1978. Cytomixis as a manifestation of pathological changes after the application of trifluraline. Nucleus 20: 22-26. [ Links ]
Bowes, B.G. 1973. Note on apparent case of cytomixis in the root apex of Allium cepa. Cytologia 38: 125-129. [ Links ]
Brandham, P.E. 1970. Chromosome behaviour in the Aloineae. III. Correlations between spontaneous chromatid and subchromatic aberrations. Chromosoma 31: 1-17. [ Links ]
Brandham, P.E. 1971. The chromosome of the Liliaceae. III. Polyploidy and karyotype variation in the Aloineae. Kew Bull. 25: 381-399. [ Links ]
Brown, M.S. 1947. A case of spontaneous reduction of chromosome number in somatic tissue of cotton. Amer. J. Bot. 34: 384-388. [ Links ]
Carter, S. 1994. Aloaceae, p. 1-60. In R.M. Polhill (ed). Flora of tropical east Africa. Balkema, Rotterdam, Holanda Meridional, Países Bajos. [ Links ]
Cequea, H., D. Díaz, J. Imery & M. Nirchio. 2003. Cytogenetic study of paracentric inversions in Tridax procumbens (Compositae). Cytologia 68: 329-333. [ Links ]
Davis, R.H. 1997. Aloe vera: a scientific approach. Vantage, Nueva York, Nueva York, EEUU. [ Links ]
Del Campo, A. & R. Coletto. 1998. Capacidad genotóxica de la hydrazida maleica (MH) detectada por intercambios de cromátidas hermanas (SCE) y por otros bioensayos en Allium cepa. Ciencia (LUZ) 6: 7-21. [ Links ]
Díaz, M.L. 2001. Ecología experimental y ecofisiología: bases para el uso sostenible de los recursos naturales de las zonas áridas neo-tropicales. Interciencia 26: 472-478. [ Links ]
Gates, B.R. 1911. Pollen formation in Oenothera gigas. Ann. Bot. 25: 909-940. [ Links ]
George, K. & S. Geethamma. 1988. Cytomixis and meiotic abnormalities in Jasminum spp. Curr. Sci. 52: 1064-1065. [ Links ]
Gottschalk, W. 1970. Chromosome and nucleus migration during microsporogenesis of Pisum sativum. Nucleus 13: 1-9. [ Links ]
Haga, T. 1953. Meiosis in Paris. II. Spontaneous breakage and fusion of chromosomes. Cytologia 18: 50-66. [ Links ]
Hodge, W.H. 1953. The drug aloes of commerce, with special reference to the cape species. Econ. Bot. 7: 99-129. [ Links ]
Hoyos, J. 1985. Flora de la isla de Margarita, Venezuela. Soc. Ciencias Nat. La Salle, Caracas, Venezuela. [ Links ]
Imery, J. 2000. Inducción de tetraploidía en Aloe vera (L.) Burm.f. (Aloaceae). Tesis de maestría, Universidad de Oriente, Cumaná, Venezuela. 73 p. [ Links ]
Imery, J. 2001. Protandría y autoincompatibilidad en Aloe vera L. LI ASOVAC. San Cristobal, Venezuela. Acta Cient. Venez. 55: s.p. [ Links ]
Imery, J. 2002. Anormalidades cromosómicas en la microsporogénesis de Aloe vera (L.) Burm.f. (Aloaceae). Trabajo de Ascenso. Universidad de Oriente, Cumaná, Venezuela. [ Links ]
Imery, J. & H. Cequea. 2002. Anormalidades cromosómicas en la microsporogénesis de Aloe vera (L.) Burm.f. (Aloaceae). Acta Bot. Venez. 25: 143-152. [ Links ]
Imery, J. & T. Caldera. 2002. Estudio cromosómico comparativo de cinco especies de Aloe (Aloaceae). Acta Bot. Venez. 25: 47-66. [ Links ]
Jackson, R.C. 1985. Mitotic instability in Haplopappus: structural and genic causes. Amer. J. Bot. 72: 1452-1457. [ Links ]
Jacob, K.T. 1941. Certain abnormalities in the root tips of cotton. Curr. Sci. 10: 174-175. [ Links ]
Jacobsen, H. 1955. Succulent plants: description, cultivation and uses of succulent plants, other than cacti (authorized translation by V. Higgins). Ernest Benn, Londres, Inglaterra. [ Links ]
Kamra, O.P. 1960. Chromatin extrusion and cytomixis in pollen mother cells of Hordeum. Hereditas 46: 592-600. [ Links ]
Lakshmi, N., N.S. Prakash, I. Harini & Y.R. Rama. 1989. A case of spontaneous cytomixis coupled with desynapsis in Capsicum annum L. Cytologia 54: 287-291. [ Links ]
Lewis, K.R. & B. John. 1966. The meiotic consequences of spontaneous chromosome breakage. Chromosoma 18: 287-304. [ Links ]
Matsuura, H. 1950. Chromosome studies on Trillium kamtschaticum Pall. and its allies XIX. Chromatid breakage and reunion at chiasmata. Cytologia 16: 48-57. [ Links ]
Mori, H., S. Sugie, K. Niwa, M. Takahashi & K. Kawai. 1985. Induction of intestinal tumors in rats by chrysazin. Br. J. Cancer. 52: 781-783. [ Links ]
Mori, H., S. Sugie, K. Niwa, N. Yishimi, T. Tanaka & I. Hirono. 1986. Carcinogenicity of chrysazin in large intestine and liver of mice. Jpn. J. Cancer. Res. 77: 871-876. [ Links ]
Morisset, P. 1978. Cytomixis in pollen mother cells of Ononis (Leguminosae). Can. J. Genet. Cytol. 20: 383-388. [ Links ]
Müller, S.O., H. Stopper & W. Dekant. 1998. Biotransformation of the anthraquinones emodin and chrysophanol by cytochrome P450 enzymes. Bioactivation to genotoxic metabolites. Drug Metab. Dispos. 26: 540-546. [ Links ]
Müller, S.O., I. Eckert, W.K. Lutz & H. Stopper. 1996. Genotoxicity of the laxative drug components emodin, aloe-emodin and danthron in mammalian cells: topoisomerase II mediated? Mutat. Res. 371: 165-173. [ Links ]
Müller, S.O., W. Dekant, H. Stopper & W.K. Lutz. 1997. Detection of the anthraquinones physcion and chrysophanol in vegetables, and mutagenicity in mouse lymphoma cells. Fundam. Appl. Toxicol. 36: 234. [ Links ]
Murakami, H., J. Kobayashi, T. Masuda, N. Morooka & Y. Ueno. 1987. .-Hydroxyemodin, a major hepatic metabolite of emodin in various animals and its mutagenic activity. Mutat. Res. 180: 147-153. [ Links ]
Narain, P. 1979. Cytomixis in pollen mother cells of Hemerocallis Linn. Curr. Sci. 48: 996-998. [ Links ]
Newton, L.E. 2004. Aloe in habitat, p. 3-14. In T. Reynolds (ed). Aloes, the genus Aloe. CRC, Boca Ratón, Florida, EEUU. [ Links ]
Omara, M.K. 1976. Cytomixis in Lolium perenne. Chromosoma 55: 267-271. [ Links ]
Rees, H. & J.B. Thompson. 1955. Localization of chromosome breakage at meiosis. Heredity 9: 399-407. [ Links ]
Reynolds, G.W. 1950. The Aloes of South Africa. Aloes of South Africa Book Fund., Johannesburgo, Gauteng, Sudáfrica. [ Links ]
Reynolds, G.W. 1966. The Aloes of Tropical Africa and Madagascar. Aloes Book Fund., Mbabane, Hhohho, Suazilandia. [ Links ]
Riley, H.P. & S.K. Majumdar. 1979. The Aloineae: a biosystematic survey. University, Lexington, Kentucky, EEUU. [ Links ]
Rowley, G.D. 1997. Ahistory of succulent plant. Strawberry, Mill Valley, California, EEUU. [ Links ]
Sapre, A. 1975. Meiosis and pollen mitosis in Aloe barbadensis Mill. (A. perfoliata var. vera L., A. vera Auth. non Mill.). Cytologia 40: 525-533. [ Links ]
Sapre, A.B. 1978. Karyotype of Aloe barbadensis Mill.: a reinvestigation. Cytologia 43: 237-241. [ Links ]
Sarvella, P. 1958. Cytomixis and the loss of chromosomes in meiotic and somatic cells of Gossypium. Cytologia 23: 14-24. [ Links ]
Schnee, L. 1984. Plantas comunes de Venezuela. Ediciones de la Biblioteca de la Universidad Central de Venezuela, Caracas, Venezuela. [ Links ]
Soman, T.A. & K.V. Bhavanandan. 1993. Temperature sensitive cytomixis in Helicanthes elastica (Desr.) Dans. (Loranthaceae). Cytologia 58: 21-26. [ Links ]
Takats, S.T. 1959. Chromatin extrusion and DNA transfer during microsporogenesis. Chromosoma 10: 430-453. [ Links ]
Velásquez, R. & J. Imery. 2004. Estudio fenológico reproductivo de Aloe vera (L.) Burm.f. y Aloe saponaria Haw. (Aloaceae) en condiciones de vivero. LIV ASOVAC. Valencia, Venezuela. Acta Cient. Venez. 55: s.p. [ Links ]
Velásquez, R. & J. Imery. 2005. Biología reproductiva de Aloe vera (L.) Burm.f. y Aloe saponaria Haw. (Aloaceae). XVI Congreso Venezolano de Botánica. Maturín, Venezuela. Saber 17: 120-122. [ Links ]
Yépez, L.M., M.L. Díaz, E. Granadillo & F. Chacín. 1993. Frecuencia óptima de riego y fertilización en Aloe vera L. Turrialba 43: 261-267. [ Links ]














