Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.54 n.2 San José Jun. 2006
Valor nutricional de los alimentos de Tayassu pecari (Artiodactyla: Tayassuidae) en el Parque Nacional Corcovado, Costa Rica
Marco Tulio López1, Mariana Altrichter2, Joel Sáenz3 & Eduardo Eduarte4
1 Department of Biology, University of Massachusetts Boston 100 Morrissey Boulevard Boston, MA 02125-3393; marco.lopez@umb.edu
2 School of Renewable Natural Resources, University of Arizona. 104 Bio Sciences East. Tucson, Arizona, 85721; mariana@email.arizona.edu
3 Programa Regional en Manejo de Vida Silvestre, Universidad Nacional, Apartado 1350-3000 Heredia, Costa Rica; jsaenz@una.ac.cr
4 Laboratorio de Nutrición Animal y Bioquímica de Forrajes, Escuela de Ciencias Agrarias, Universidad Nacional, Heredia, Costa Rica; e_eduarte@yahoo.com
Recibido 22-V-2002. Corregido 02-VI-2004. Aceptado 30-XI-2004.
Abstract. Nutritional values in the diet of white-lipped peccary Tayassu pecari (Artiodactyla: Tayassuidae) in Corcovado National Park, Costa Rica. We determined the potential nutritional levels in 25 species of plants, and in earthworms, that constitute part of the diet of white-lipped peccary (Tayassu pecari) in Corcovado National Park, Costa Rica, from January 1998 to March 1999. The highest content of fat and energy was found in seeds of the Myristicacea family. The highest content of calcium was found in vegetative parts of Dieffenbachia spp. Nutritious contents differed among plant parts (seeds, fruits, stems and leaves). Fat and energy content were larger in seeds and fruits, whereas the largest content of protein was found in fruits and leaves. Mineral content also differed among plant parts. Calcium, potassium and magnesium were higher in leaves whereas copper and zinc were higher in seeds. Differences of diet between white-lipped peccaries in Corcovado and in other tropical regions of Latin America could be partially explained by our results. We found several species with higher fat and energy content than palms, which can explain the low consumption of palm seeds in Corcovado. It is possible that the regular consumption of stems and leaves of some species is related to their high mineral content. Seasonality of reproduction in Corcovado seems to be related not only to fruit availability but also to the nutritional quality of food. Rev. Biol. Trop. 54(2): 687-700. Epub 2006 Jun 01.
Key words: diet, nutrition, rain forest, Tayassu pecari, white-lipped peccary.
Conocer los aspectos nutritivos de la dieta de una especie es importante para entender la sobreviviencia y productividad de las poblaciones (Robbins 1993). El análisis nutritivo de la dieta de una especie, posibilita evaluar la capacidad de un área para satisfacer los requerimientos de la especie y evaluar la contribución de los diferentes tipos de alimento a la condición nutritiva.
Desde el punto de vista ecológico, la adecuación de una especie animal a un hábitat es afectada por factores tales como disponibilidad de alimento, refugio y existencia de depredadores (Krebs 1985). En este sentido, se debe diferenciar disponibilidad de alimentos no solo en términos de cantidad sino también de calidad, sobre todo en los momentos fisiológicos demandantes nutricionalmente. La calidad del alimento requerido por los animales está determinada por el contenido de nutrientes que se encuentran en ellos y por la capacidad del animal de digerirlos o utilizarlos, y ademas por el consumo que se haga de los mismos. La composición química de los alimentos que consumen los animales permite evaluar su potencial nutritivo. Esta varía debido a factores como el tipo de alimento (vegetal o animal), especies utilizadas, estaciones de año, estado de madurez y efectos del sitio (Bailey 1984, Haufler y Servello 1996).
Debido a que la nutrición afecta la reproducción y sobrevivencia, es importante conocer la composición química de la dieta, especialmente cuando se trata de la conservación y manejo de una especie amenazada (Bailey 1984). En este caso nos interesa conocer el aporte de la dieta del chancho cariblanco (Tayassu pecari, Link 1795), un ungulado frugívoro restringido al neotrópico cuya distribución comprende la región neotropical desde el sureste de México hasta Bolivia, norte de Argentina, Paraguay y sur de Brasil (Sowls 1997).
Muchas poblaciones de esta especie están desapareciendo por la acelerada destrucción de su hábitat y la presión de cacería (March 1993, Sowls 1997). Esta especie es y ha sido un recurso cultural y alimentario muy importante en el desarrollo de muchas culturas indígenas del neotrópico (Sowls 1997). En Costa Rica, la mayor población de chanchos cariblancos vive aparentemente en el Parque Nacional Corcovado (Carrillo 2000), pero su existencia está amenazada por cacería ilegal dentro y fuera del Parque (Altrichter y Almeida 2002). Aparentemente, una escasez de frutos al final de la época lluviosa provoca que algunas manadas salgan del Parque y recorran la Península de Osa, probablemente en búsqueda de alimento, y en este momento sufren alta presión de cacería (Altrichter y Almeida 2002). Aunque los chanchos en Corcovado consumen principalmente frutos, hacia el final de la época lluviosa las hojas y tallos llegan a constituir el 80% de su dieta (Altrichter 1997). Las lombrices de tierra son también una importante parte de la dieta de los chanchos en Corcovado durante la época lluviosa (Altrichter 1997, Altrichter et al. 2000).
Al estudiar la dieta de los chanchos cariblancos en Corcovado surgieron algunas preguntas sobre los hábitos alimentarios y reproductivos, que podrían ser contestadas, de manera exploratoria, con un mayor conocimiento de la calidad nutritiva de los componentes de la dieta: a) Independientemente de la disponibilidad de frutos, los chanchos se alimentan durante todo el año de hojas y tallos de platanillos (Heliconia spp.) y distintas especies de la familia Araceae. Estas especies deben ofrecer algún elemento nutritivo que no se encuentra en frutos o que se presenta en mayor proporción que en los frutos. b) Los frutos de Ficus sp. son de baja calidad en términos de carbohidratos (Fleming 1986), y sin embargo, los chanchos consumen frutos de este género durante casi todo el año. Estos frutos deben tener algún contenido nutritivo importante. c) A diferencia de otras regiones de Latinoamérica, en la dieta de los chanchos en Corcovado las palmas no son los componentes más importantes, a pesar de que son abundantes en el Parque. Estudios realizados en la Amazonía Peruana determinaron que el principal recurso alimenticio del chancho cariblanco lo constituyen semillas duras de palmas (Kiltie 1980, 1981, Bodmer 1989, Bodmer et al. 1997). Lo mismo se ha observado en la Amazonía de Brasil (Fragoso 1994, 1998). Se cree que el consumo de semillas duras de palmas es una respuesta a la presión competitiva con otros frugívoros (Kiltie 1982, Bodmer 1989) ya que son buena fuente de energía (Bodmer et al. 1997). Por ejemplo, frutos de palmas tales como Iriartea sp., Euterpe sp. son ricos en carbohidratos y frutos de Astrocaryum sp. son ricos en grasas (Bodmer et al. 1997). Es posible que en Corcovado existan otros frutos y semillas con alto contenido de grasas que no requieran tanto esfuerzo de procesamiento como las semillas duras de las palmas. d) El porcentaje de materia animal encontrado en las heces de los chanchos en Corcovado fue mucho menor a lo que se encontró en la Amazonía peruana (Kiltie 1981, Bodmer 1989, Bodmer et al. 1997). Bodmer et al. (1997) señalan que los pecaríes consumen pequeñas cantidades de materia animal para vencer las limitaciones de alimentos ricos en proteinas en los bosques tropicales. Es posible que en Corcovado el consumo de lombrices este supliendo la cantidad necesaria de proteinas. e) Tanto el comportamiento alimenticio de los chanchos, como el reproductivo, parecen cambiar a través del año, como respuesta a la disponibilidad de frutos (Altrichter et al. 2001). Se ha observado que, a diferencia de otras regiones de America Latina (Gottdenker y Bodmer 1998), los chanchos cariblancos en Corcovado, presentan cierta estacionalidad en la reproducción, con picos de nacimientos entre Julio-Agosto (Altrichter et al. 2001). Esto podría estar relacionado a la disponibilidad estacional de alimento de una calidad nutritiva tal que le permita a las hembras cubrir los costos de preñez y lactancia.
Determinar las características nutritivas, generales y específicas, de la dieta del chancho cariblanco en el Parque Nacional Corcovado nos permitirá ampliar el conocimiento que se tiene sobre esta especie ya que hasta la fecha existe un vacío de información en lo referente a los aspectos nutricionales de su dieta (Sowls 1997). El objetivo general de este estudio fue determinar la composición química y el valor nutritivo potencial de algunos de los principales componentes de la dieta del chancho cariblanco en el Parque Nacional Corcovado. Los objetivos específicos fueron: a) determinar el contenido nutritivo y mineral de algunas de las especies consumidas por los chanchos cariblancos en Corcovado, b) comparar el contenido nutritivo y mineral entre partes de la planta (hojas, tallos, frutos y semillas), b) determinar el contenido nutritivo de lombrices de tierra, c) determinar la relación calcio– fósforo de las especies vegetales utilizadas por el chancho cariblanco.
Area de estudio: El estudio se llevó a cabo en el Parque Nacional Corcovado, ubicado al sur oeste de la Península de Osa, en el sur de Costa Rica (8º26 y 8º39 N y 83º25 y 83º45 W) el cual tiene una extensión de 46774 ha (García 1997). La mayor parte del Parque se encuentra ubicada dentro de la zona de vida de "bosque muy húmedo tropical" según la clasificación de Holdridge (1967). El clima es caliente, lluvioso y muy húmedo, con una época seca de diciembre a abril y una lluviosa de mayo a noviembre. Los meses de máxima precipitación son octubre y noviembre (> 500 mm/mes) y los más secos son febrero y marzo (< 100 mm/mes). La temperatura media anual es de 26º C y la precipitación varía desde 3800 mm anuales en las bajuras hasta 6500 mm en las áreas altas (Hartshorn 1983). El Parque tiene una topografía en gran parte de llanuras y una zona montañosa de hasta 745 msnm. A gran escala, se pueden diferenciar bosque primario, bosque secundario, bosque costero, bosque de yolillo (Raphia taedigera) y pantano herbáceo.
Materiales y métodos
El estudio se realizó desde enero de 1998 hasta marzo de 1999. Se hicieron nueve visitas de siete días en promedio para colectar muestras de frutos, semillas, partes vegetativas (tallos y hojas) y lombrices de tierra (Ponthoscolex corethurus). El análisis químico de las muestras se realizó en el Laboratorio de Nutrición Animal y Bioquímica de Forrajes de la Escuela de Ciencias Agrarias de la Universidad Nacional de Costa Rica.
Colecta de muestras: la recolecta de las semillas, frutos y partes vegetativas de las especies consumidas por el chancho cariblanco en el Parque Nacional Corcovado se realizó en la época seca y en la época lluviosa, en los tres hábitats (bosque costero, bosque primario y bosque secundario) utilizados por el chancho cariblanco durante 1996-97 (Altrichter 1997). Se utilizó como guía el listado generado por Altrichter (1997) de las especies consumidas por el chancho y se completó con algunas observaciones de campo realizadas por otros investigadores en años previos (Sáenz, com. pers.).
En promedio se recolectaron 250 g de frutos y 500 g de tallos y hojas de cada una de las especies consumidas por el chancho cariblanco. Los frutos y semillas se recogieron del suelo ya que en ese momento es cuando están disponibles para el chancho. Para las partes vegetativas, se consideró su estado de madurez (hojas y tallos jóvenes) y la altura a la que éstas pueden estar disponibles para el chancho (no mayor a un metro desde la superficie del suelo).
De las 56 especies identificadas como parte de la dieta de los chanchos en Corcovado (Altrichter 1997) se colectaron 25 (45%) para este estudio, dentro de las cuales se encuentran siete de las diez especies mencionadas como consumidas con mayor frecuencia. Estas especies representan el 28% de las 25 especies colectadas. Lamentablemente, El Niño (DAS 1999) influyó en el ciclo fenológico y muchas de las especies constituyentes de la dieta de los chanchos no fructificaron en el período esperado (Aguilar com. pers.) por lo que no se pudieron colectar.
Las lombrices de tierra fueron colectadas en la época lluviosa ya que es en esta estación cuando las lombrices son mas abundantes y los chanchos invierten más tiempo en su búsqueda (Altrichter 1997). Para la colecta de lombrices se hicieron 5 parcelas de 0.025 m3 en cada uno de los hábitats utilizados por el chancho, lo que permitió además realizar un estimado de la disponibilidad de lombrices por hectárea en cada uno de ellos. La cantidad de lombrices colectadas por hábitat fue de 7 g en el bosque costero, 20 g en el bosque primario y 20 g en el bosque secundario.
Análisis de las muestras vegetales y animales. Las muestras de frutos, semillas y partes vegetativas se pesaron al momento de su colecta y fueron colocadas en un horno a 60ºC por 48 hrs. para la determinación del procentaje de humedad. Una vez secas, las muestras fueron molidas en un molino Wiley Mill con una criba de un mm. Los frutos y semillas mas grasosos fueron procesados en un molino manual. Para la obtención de los valores de materia seca se colocaron dos g de cada una de las muestras por duplicado en un horno al vacío a 70ºC y a una presión de 17 mm de mercurio durante 24 hrs., lo que permitió tener una idea de la concentración del material una vez que toda la humedad fue extraída. Las lombrices fueron liofilizadas a una temperatura de - 40ºC, lo que permitió conservar la integridad de la muestra animal.
1. Grasa: para el análisis del contenido de grasas se utilizó el método propuesto por la AOAC (1975), el cual se basa en realizar una extracción de la grasa de la muestra utilizando un compuesto como el éter durante 3 h, en un sistema cerrado de reflujo (Micro Soxhlet).
2. Proteína cruda: la proteína cruda se determinó utilizando el método propuesto por la AOAC (1975), el cual se basa en la estimación del contenido de nitrógeno de la muestra. Se pesó 0.1 g de muestra de cada una de las especies vegetales y animales. Estas muestras fueron digeridas en una solución de ácido sulfúrico (H2SO4) a una temperatura de 90ºC durante una h. El resultado de la digestión se destiló con hidróxido de sodio (NaOH) al 40%. Como resultado de la destilación se obtuvo amónio (NH4), el cual fue capturado en ácido bórico (H3BO3) y se tituló con un ácido de normalidad conocida. Para el proceso de destilación se utilizó el Tecator Kjeltec System 1026 Destilling Unit.
3. Fibra: el análisis de fibra se realizó con el método propuesto por Goering y Van Soest (1971), el cual se realiza en dos etapas: a) fibra neutro detergente y b) fibra ácido detergente:
a) Fibra neutro detergente: se colocó 0.5 g de muestra en un beaker con 100 ml de solución detergente neutro y se calentó a 600 C durante una hr. Luego se lavó la muestra para eliminar restos de la solución y se puso a secar durante 12 h. Este método divide la materia seca de los alimentos muy cerca al punto que separa los constituyentes solubles y nutricionalmente disponibles (98%) de aquellos que son aprovechables de manera imcompleta y dependen de la fermentación microbiana (Goering y Van Soest 1971). El resultado de este análisis nos permite conocer el porcentaje de contenido de la pared celular.
b) Fibra ácido detergente: se utilizó el residuo del material del análisis anterior para este análisis. Se colocó la muestra en 100 ml de solución ácida y se calentó durante una hr. a la misma temperatura. Luego la muestra se lavó y secó durante 12 hrs. Este procedimiento provee un método rápido para la determinación de lignocelulosa de los alimentos. La diferencia entre los constituyentes de la pared celular y la fibra detergente ácido es un estimado de la hemicelulosa (Goering y Van Soest 1971).
4. Energía bruta: la estimación de la energía bruta se realizó usando el método propuesto por la ASTM (1982) el cual se basa en quemar una muestra del alimento en una atmósfera de oxígeno presurizada (20 atmósferas). Cuando se quema la muestra, el calor que se libera eleva la temperatura del agua que rodea el recipiente donde se encuentra la muestra y el aumento de temperatura suministra la base para calcular el valor energético. Para este análisis se utilizó una Bomba Calorimétrica Adiabática.
5. Minerales: para la determinación de los minerales presentes en las muestras vegetales y animal (lombrices) se calcinaron dos g de muestra en un horno a 500ºC durante tres hrs., luego se llevó a cabo una digestión con ácido clorhídrico (HCL 6N). El producto de la digestión se colocó en un balón volumétrico de 50 mililitros y se aforó con agua destilada. Seguidamente se tomó una muestra de un mililitro de cada muestra digerida y se diluyó en agua destilada. Las lecturas de las diluciones se realizaron en un espectrofotómetro de Absorción Atómica Shimadzu AA-640-13.
Análisis de datos. Los valores nutritivos (grasa, pared celular, lignocelulosa, proteína cruda, energía bruta y minerales) de todas las especies vegetales fueron agrupados según la parte de la planta consumida por los chanchos cariblancos (semillas, frutos, tallos y hojas) para comparar el contenido nutritivo entre las partes. Hojas simples y compuestas son consideradas en una misma categoría. Como frutos se considera el conjunto de la pulpa más la semilla. Las semillas corresponden a los frutos cuya pulpa fue retirada, debido a que éstas estuvieron disponibles así para los chanchos en estado natural (otras especies como monos y aves comen la pulpa y dejan caer la semilla al suelo). Se realizó un análisis de varianza de una vía no paramétrica (Kruskal-Wallis) para comparar los valores nutritivos y el contenido mineral entre partes de la planta.
Resultados
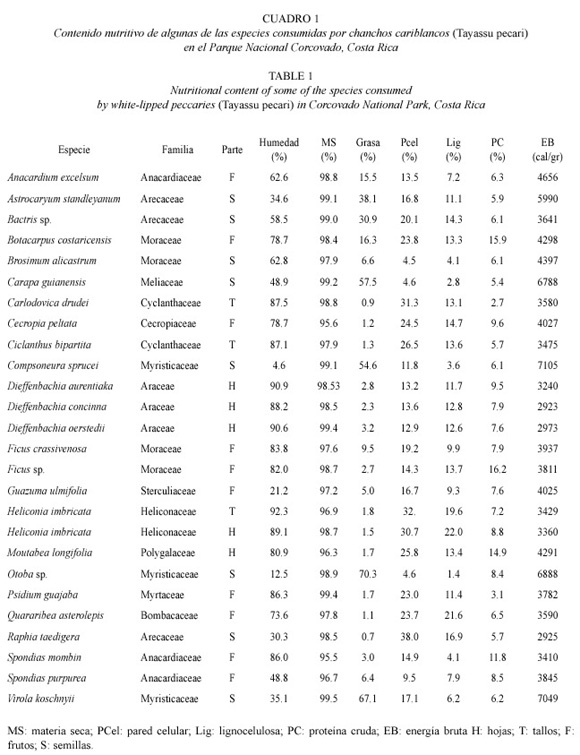
Contenido nutritivo de los diferentes componentes de la dieta. El mayor contenido de grasa se encontró en semillas de Otoba sp. (70.28%) y Virola koschnyii (67.1%). Otras semillas con más de 50% de grasa fueron Carapa guianensis y Compsoneura sprucei. El mayor valor de proteína cruda se encontró en frutos de Ficus sp. (16.64%) y Botacarpus costaricencis (15.99%). El mayor valor de pared celular se encontró en semillas de Raphia taedigera (38.0%) y el de lignocelulosa en Heliconia imbricata (27.53%). El contenido de energía bruta varió entre 2 923.28 cal/g y 7 105.91 cal/g. El mayor contenido de energía bruta se encontró en semillas de C. sprucei, V. koschnyii, Otoba sp. y C. guianensis (Cuadro 1). La oferta energética medida en términos de energía total o en términos de extracto etéreo cuya relación con la energía total es alta (r = 0.69) se presentó en un nivel promedio annual de 4 246.30 cal/g (n = 39).
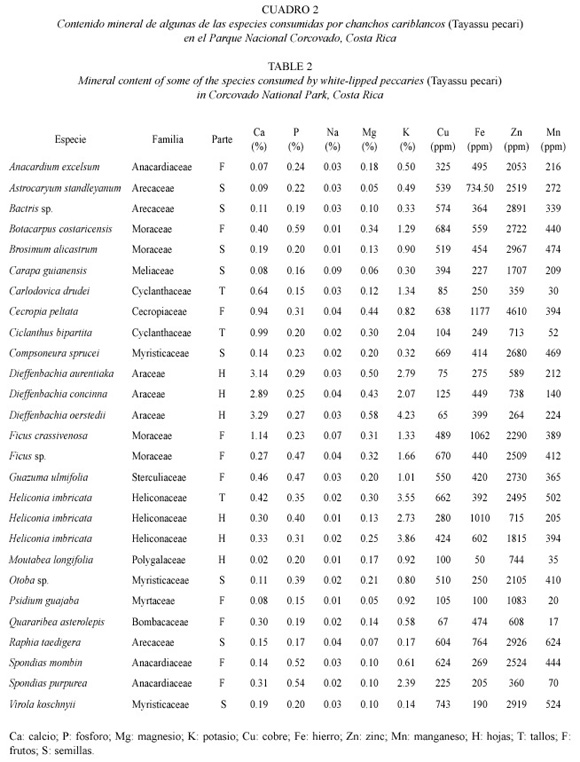
Contenido mineral de los componentes de la dieta. El contenido de calcio varió entre 0.02% en hojas de Moutabea longifolia y 3.39% en hojas de Dieffenbachia aurentiaka. Los mayores valores de calcio se encontraron en las hojas de tres especies del género Dieffenbackia. El contenido de fósforo fue mayor en frutos de B. costaricensis (0.59%), el de magnesio fue mayor en hojas de Dieffenbachia spp. (0.58%), y el de potasio fue mayor en hojas de H. imbricata (4.98%). El contenido de cobre varió entre 65 ppm en hojas de D. aurentiaka y 750 ppm en frutos de Ficus sp., y el de zinc varió entre 154 ppm en hojas de Carludovica drudei y 4 610 ppm en frutos de Cecropia peltata (Cuadro 2).
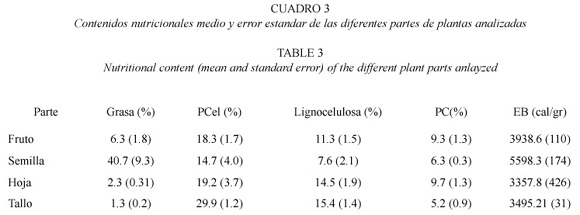
Contenido nutritivo en las diferentes partes de las plantas (semillas, frutos, tallos y hojas). El contenido nutritivo fue diferente entre las partes de plantas analizadas (Cuadro 3). Se encontró mayor contenido de grasa en semillas que en las otras partes (H = 18.31, p < 0.001, n = 39), mayor contenido de pared celular en tallos (H = 12.56, p = 0.005), mayor contenido de lignocelulosa en tallos y en hojas (H = 8.38, p = 0.038), y mayor contenido de proteína cruda en frutos y hojas (H = 15.01, p = 0.002). La energía bruta fue mayor en semillas y frutos y menor en tallos y hojas (H = 17.37, p < 0.001).
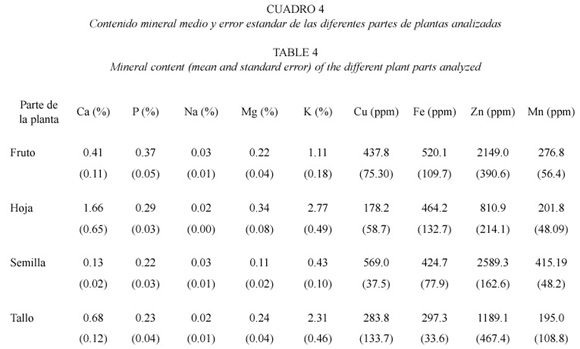
Contenido mineral en las diferentes partes de las plantas (semillas, frutos, tallos y hojas). Se encontraron diferencias significativas en el contenido de calcio, fósforo, magnesio, potasio, cobre y zinc entre las partes de las plantas (Cuadro 4). El contenido de fósforo fue mayor en frutos y menor en semillas (H = 8.10, p = 0.043). Los contenido de calcio, magnesio y potasio fueron mayores en hojas (H = 14.48, p = 0.002; H = 15.07, p = 0.001; H = 25.90, p< 0.001, respectivamente). Los contenidos de cobre y zinc fueron mayores en semillas (H = 9.87, p = 0.019; H = 10.95, p = 0.012 respectivamente). Los otros minerales analizados (sodio, hierro y manganeso), no fueron diferentes entre las partes.
Relación calcio – fósforo de las especies consumidas por el chancho cariblanco. Las proporciones en la relación C:P se presentaron para calcio entre 1:1-14:1 y para el fósforo entre 1:1-1:10, encontrándose una concentración de valores altos en el calcio y valores bajos en el fósforo. Estas proporciones indican que en general la absorción del calcio no se vería afectada por la presencia del fósforo como un efecto cinérgico negativo.
Contenido nutritivo de las lombrices de tierra. El contenido nutricional potencial de las lombrices de tierra mostró los siguientes valores: grasa cruda 2.86%, proteína cruda 16.67%, energía bruta 2 682.70 cal/gr, calcio 0.33%, fósforo 0.47%, sodio 0.03%, magnesio 0.50%, potasio 0.18%, cobre 110 ppm, hierro 600 ppm, zinc 554 ppm y manganeso 270 ppm.
Discusión
El Parque Nacional Corcovado presenta una variedad de especies vegetales que aparentemente proveen suficiente calidad de alimento para los chanchos cariblancos durante la mayor parte del año. El hecho de que los chanchos cariblancos se alimenten principlamente de frutos y semillas, aún cuando las partes vegetativas constituyen un recurso disponible y abundante durante todo el año, podría explicarse por el hecho de que los frutos y semillas tienen mayor contenido de grasa y energía bruta. La grasa es un elemento que se requiere diariamente, independientemente del estado fisiológico, ya que es la principal fuente energética. Cuando en Corcovado se produce una escaséz de frutos al final de la época lluviosa, la cantidad de frutos en la dieta de los chanchos disminuye a un 20% y el resto es compuesto por partes vegetativas (Altrichter et al. 2000). Es posible que la baja calidad de tallos y hojas como alimento, en términos de energía, sea lo que induce a los chanchos a recorrer las largas distancias que se los ha observado caminar durante esta época (Altrichter 1997). Aunque partes vegetativas llegan a constituir un 80% de la dieta en esta época, hojas y tallos de Heliconia spp. y Araceas son consumidos regularmente a lo largo de todo el año, independientemente de la disponibilidad de frutos. Esto puede deberse al hecho de que estas plantas contienen mayores niveles de minerales como calcio, magnesio y potasio, que los frutos y semillas. Estos minerales, especialmente el calcio, son muy importantes durante la lactancia.
En Corcovado se observó que las palmas, aun cuando son abundantes, no constituyen una parte importante en la dieta de los chanchos. Las palmas han sido mencionadas como especies clave para los pecaríes en el Amazonas (Terborgh 1992). Según Bodmer et al. (1997) las palmas amazónicas y los pecaríes parecen estar entrelazados en una relación coevolutiva que implica la producción de semillas muy duras por parte de las palmas y mecanismos de ingestión/digestión especializados por parte de los pecaríes. Algunos autores concuerdan en que la utilización de semillas duras de palmas por parte del chancho cariblanco es un recurso adaptativo para evitar competencia con otros ungulados frugívoros como dantas (Tapirus bairdii) y saínos (T. tajaccu) (Kiltie 1982, Bodmer 1989). Es posible que en Corcovado los chanchos no tengan alto nivel de competencia con otros ungulados, ya que los saínos son muy poco abundantes (Obs. Pers.) y las dantas son principalmente folívoras (Naranjo 1995, Foerester 1998). La dilución de la competencia interespecífica puede permitir que los chanchos se alimenten de otras semillas que también ofrecen alto contenido de grasas y no requieren tanto esfuerzo de procesamiento como las semillas duras de las palmas. En este estudio se encontró que semillas de Otoba sp., Virola koschnyii, Carapa gianensis y Compsoneura sprucei contienen altos contenidos de grasas (entre 54% y 70%), incluso mayores a los de palmas en Corcovado y en otras regiones tropicales de Sur América (Owen 1980).
Es de destacar que los altos contenidos de grasas insaturadas en la dieta del chancho cariblanco en Corcovado hacen suponer una digestión eficiente de las mismas (hidrólisis). A pesar de que se desconoce cuánto de esta energía bruta llega a ser metabolizada y neta disponible para el animal, se puede deducir que el chancho cariblanco en Corcovado estaría haciendo buena utilización de las grasas para cubrir sus requerimientos energéticos en funciones como mantenimiento, reproducción y termoregulación. Los valores de energía bruta sólo nos permiten conocer cual es la oferta energética de las especies consumidas por el chancho cariblanco, pero se necesita conocer cual es la capacidad digestiva del animal para interpretar mejor estos valores en términos de su utilización.
Los frutos de Ficus spp, han sido mencionados como alimento de baja calidad (Fleming 1986). Por esta razón se hipotetizó en un estudio anterior (Altrichter 1997) que su consumo podría ser una respuesta a la escaséz de otros alimentos de mejor calidad. Sin embargo, en este estudio se observó que, aunque bajos en grasa y energía bruta, estos frutos tienen altos contenidos de proteína. Es posible entonces, que el hecho de que los chanchos los consumen a lo largo de casi todo el año, se deba a su calidad en términos de proteína más que a una respuesta a la escazés de otros frutos.
Los niveles de proteína cruda encontrados en las especies vegetales en este estudio son bajos comparados con los estándares de alimentación de cerdos domésticos, de peso similar a un chancho cariblanco, sometidos a estrés reproductivo (Maynard et al. 1981). En otras latitudes se ha observado que los chanchos suplen la falta de proteínas consumiendo insectos y otros animales, mientras que en Corcovado la proporción de materia animal encontrada en la heces es muy baja (Altichter et al. 2000). Sin embargo, se observó que los chanchos invierten mucho de su tiempo al consumo de lombrices, alimento abundante y disponible durante toda la época lluviosa (Altrichter et al. 2001). Probablemente los chanchos en Corcovado suplen la necesidad de proteínas con la utilización de lombrices. Aunque en el análisis de contenido nutritivo de lombrices en este estudio se encontró solo un 16% de proteína, ésta tiene mayor valor que la proteína vegetal ya que tiene la capacidad de cubrir altas demandas en corto tiempo. La obtención de proteína de alto valor biológico a partir de las lombrices durante la época lluviosa no requeriría una alta inversión energética para su búsqueda ni para su digestión, ya que es digerible en un alto porcentaje y casi toda su proteína es disponible.
Probablemente la estacionalidad de la reproducción de los chanchos en Corcovado puede explicarse por el hecho de que existe mayor disponibilidad de frutos en la época lluviosa (Altrichter et al. 2001), y aparentemente también existe una mayor oferta de proteína y minerales. El contenido de proteína cruda de la oferta alimentaria que consume el chancho cariblanco en Corcovado se distribuye a través del año a un nivel promedio de 7.8% (n = 39), observándose un pico en la época lluviosa que llegó hasta 16% en algunas especies. Este pico de proteína coincide con la época de nacimientos y primeros meses de lactancia de los chanchos cariblancos. La lactancia es uno de los estados fisiológicos más demandantes de proteínas que necesita cubrir sus requerimientos en la forma más rápida posible. La obtención de proteínas de alto valor biológico y de minerales tales como calcio y fósforo, son determinantes para el mantenimiento de este proceso dado que los nutrientes de la leche provienen básicamente de las reservas corporales. Según Robbins (1993), la lactancia es nutricionalmente de 2 a 3 veces más costosa que la gestación. El gasto de energía total incluyendo la producción de leche por hembras lactantes es de 65% a 215% más alta que el de hembras no lactantes.
La presencia de niveles altos o bajos de proteína no garantiza la calidad de la misma ya que no todo el nitrógeno analizado como proteína cruda es proteico, existiendo una proporción de hasta 40% de nitrógeno no proteico (NNP) en las plantas en general (Van Soest 1982). El sistema digestivo de los saínos (Lochmiller et al. 1989) y, posiblemente, de los chanchos cariblanco les permitiría estar aprovechando parte de este NNP para enriquecer biológicamente la proteína obtenida a través del proceso de fermentación microbiana en su pre estómago, además de la síntesis de aminoácidos, los cuales se presentan en bajas concentraciones en los alimentos de origen vegetal (Maynard et al.1981). Carl y Brown (1985) encontraron que los requerimientos proteicos para el saíno son bajos pero que su sistema digestivo les permite tener una alta digestibilidad de la misma lo que podría explicar su adaptación a ambientes que le aporten poca proteína.
En términos generales, los niveles de minerales que se encontraron son adecuados a los límites reportados por Ullrey y Allen (1986) y Robbins (1993) para animales en cautiverio y en estado silvestre. Los mayores valores de minerales provienen de tres especies de plantas de la familia Araceae (Dieffenbachia concinna, D. oerstedii y D. aurentiaka). Para miembros de esta familia se ha señalado una alta toxicidad asociada a la presencia de oxalatos de calcio (Escobar 1972, Vargas et al. 1994). Los materiales estructurales tóxicos presentes en las plantas no pueden ser digeridos por los vertebrados a menos que sea por medio de fermentación microbiana (Owen 1980), lo que hace pensar que la utilización de estas plantas por parte del chancho cariblanco está asociada a esa capacidad digestiva.
Investigaciones realizadas en el saíno (Langer 1978, 1979, Carl y Brown 1986) sugieren que los sacos ciegos permiten a los pecaríes digerir la fibra de una forma similar a los rumiantes. Carl y Brown (1986) determinaron que la lenta tasa de pasaje de los alimentos en los pecaríes (52 hrs.), puede incrementar la asimilación de la materia orgánica lo que resulta en altos valores de digestión de los componentes fibrosos de los alimentos. La digestión de los componentes fibrosos se facilita por medio del desdoblamiento microbiano. La utilización de proteína de alto valor biológico estaría favoreciendo el incremento de la población microbiana en el sistema digestivo de los chanchos. De este modo podrían aprovechar vitaminas que no puedan sintetizar. Esto tambien explicaría la utilización de tallos y hojas jóvenes (Altrichter et al. 2000) ya que estas partes son más digeribles.
Los elementos minerales contenidos en los alimentos son necesarios en la dieta de los animales para llevar a cabo las funciones corporales primordiales para su sobrevivencia. Deficiencias o desequilibrios en la obtención de estos minerales son determinantes importantes de la condición del animal, de su fertilidad, la productividad y la mortalidad. Si bien es cierto que hasta ahora sólo se ha resaltado la importancia de minerales como el calcio y el fósforo en la reproducción y la lactancia, esto no significa que los demás minerales no jueguen un papel importante en los diferentes estados fisiológicos del animal, pero se asume que si éstos llegan con éxito a la reproducción es que han cubierto las necesidades mínimas de los demás minerales.
La determinación del valor nutritivo de la dieta del chancho cariblanco en el Parque Nacional Corcovado permitió conocer la calidad nutritiva potencial de la oferta alimentaria y su aporte en términos generales a la sobrevivencia de la especie en el área. Sería necesario completar el estudio con el análisis del contendio nutritivo del resto de las especies que constituyen la dieta del chancho en Corcovado. Sin embargo, con la información obtenida se puede deducir que la oferta nutritiva del hábitat parece ser adecuada en términos de la calidad del alimento para cubrir los requerimientos mínimos del chancho cariblanco en los diferentes estados fisiológicos durante la mayor parte del año. Sin embargo, al final de la época lluviosa, cuando solo tienen disponibles tallos y hojas (Altrichter et al. 2001), se observa una escaséz de oferta de grasas y energía bruta. Este es aparentemente un momento de estrés nutritivo para los chanchos cariblancos que puede estar relacionado con los grandes movimientos que realizan en esta época (Altrichter 1997).
Sería necesario realizar un perfil de ácidos grasos de las especies que presentan mayores cantidades de grasa para conocer cual es el aporte de estas especies a la condición nutritiva del chancho cariblanco, además permitiría conocer cuales ácidos grasos están siendo aportado por ellas. Además, sería importante realizar estudios sobre el consumo real de materia seca, digestibilidad, fisiología y anatomía digestiva del chancho cariblanco para llegar a construir un modelo nutricional para el animal en el Parque Nacional Corcovado y así contribuir a la conservación de la especie.
Agradecimientos
Al Programa Regional en Manejo y Conservación de Vida Silvestre de la Universidad Nacional por el apoyo logístico a esta investigación. A World Preservation Trust International y el Servicio Alemán de Intercambio Académico (DAAD) por financiar parcialmente este estudio. A Aida Lobo y a Carlos Cervantes del Laboratorio de Suelos de la Escuela de Ciencias Agrarias (ECA), por su ayuda durante los análisis. Al personal de la Estación Biológica Sirena en el Parque Nacional Corcovado y MINAE por haber permitido y apoyado la investigación. A Eduardo Carrillo por facilitar el trabajo dentro de su proyecto. A Claudine Sierra por su ayuda en la revision del manuscrito. A Luis Poveda del herbario de la UNA y Reynaldo Aguilar del InBio por identificar las especies vegetales colectadas. A Robert Lochmiller (Q.E.P.D.) quien aportó referencias importantes durante el desarrollo de la investigación original cuyos resultados generaron este artículo.
Resumen
Se determinó el valor nutritivo y mineral de 25 especies vegetales y una especie animal (lombriz de tierra) que forman parte de la dieta del chancho cariblanco (Tayassu pecari) en el Parque Nacional Corcovado, Costa Rica, desde enero de 1998 hasta marzo de 1999. Los mayores contenidos de grasa y energía bruta se encontraron en semillas de la familia Myristicaceae. El mayor contenido de calcio se encontró en partes vegetativas de Dieffenbachia spp. Los contenidos nutritivos fueron diferentes entre las diferentes partes vegetativas analizadas (semillas, frutos, tallos y hojas). El contenido de grasa y energía bruta fue mayor en semillas y frutos, mientras que el mayor contenido de proteina cruda se encontró en frutos y hojas. El contenido de minerales tambien fue diferente entre las partes vegetativas analizadas. Los contenidos de calcio, potasio y magnesio fueron mayores en hojas mientras que los de cobre y zinc fueron mayores en semillas. Diferencias en la dieta de los chanchos cariblancos de Corcovado con los de otras regiones tropicales de Latinoamérica pueden ser parcialmente explicadas con los resultados nutritivos de este estudio. Se encontraron varias especies con mayor contenido de grasa y energía bruta que las palmas, lo que puede explicar el bajo consumo de semillas de palmas en Corcovado. Es posible que el consumo regular de partes vegetativas (hojas y tallos) de algunas especies se deba al alto contenido mineral de estas. La estacionalidad de la reproducción parece estar relacionada no solo a la disponibilidad de alimentos sino tambien a la calidad nutritiva de los mismos.
Palabras clave: dieta, nutrición, bosque tropical, Tayassu pecari, chancho cariblanco.
Referencias
Altrichter, M. & R. Almeida. 2002. Exploitation of whitelipped peccaries Tayassu pecari (Artiodactyla: Tayassuidae) on the Osa Peninsula, Costa Rica. Oryx 36: 126-132. [ Links ]
Altrichter, M. 1997. Estrategia de alimentación y comportamiento del chancho cariblanco (Tayassu pecari) en un bosque húmedo tropical de Costa Rica.M. Sc. Tesis, Universidad Nacional de Costa Rica, Heredia, Costa Rica. [ Links ]
Altrichter, M., C. Drews, E. Carillo & J. Sáenz. 2001. Sex ratio and breeding of white-lipped peccaries Tayassu pecari (Artiodactyla: Tayassuidae) in a Costa Rican rain forest. Rev. Biol. Trop. 49: 383-389. [ Links ]
Altrichter, M., J. Sáenz, E. Carrillo & T. Fuller. 2000. Dieta estacional del Tayassu pecari (Artiodactyla: Tayassuidae) en el Parque Nacional Corcovado, Costa Rica. Rev. Biol. Trop. 48: 689-702. [ Links ]
Altrichter, M., E. Carrillo, J. Sáenz & T. Fuller. 2001. White-lipped peccary (Tayassu pecari, Artiodactyla: Tayassuidae) diet and fruit availability in a Costa Rican rain forest. Rev. Biol. Trop. 49: 1105-1114. [ Links ]
Association of Official Agricultural Chemists (AOAC). 1975. Official methods of analysis of the Association of Official Analytical Chemists. 12th ed. Assoc.Off. Anal. Chem. Washington, D.C. EEUU. 1094 p. [ Links ]
American Society for Testing and Materials (ASTM). 1982. Gross Calorific Value of Solid Fuel by the Adiabatic Bomb Calorimeter, p. 9-17. In Standars for Bomb Calorimetry and Combustion Methods. Parr Instrument Company, EEUU. [ Links ]
Bailey, J. 1984. Principles of Wildlife Management. Colorado State University, Colorado, 373 p. [ Links ]
Bodmer, R.E. 1989. Frugivory in amazon ungulates. Ph.D.Thesis, University of Cambridge, Cambridge, Inglaterra. 311 p. [ Links ]
Bodmer, R.E, R. Aquino, P.E. Puertas, C.J. Reyes, T.G. Fang & N.L. Gottdenker. 1997. Manejo y uso sustentable de pecaríes en la Amazonía Peruana. Paper ocasional No. 18 de la Comisión de Supervivencia de Especies, Lima, Perú. 102 p. [ Links ]
Carrillo, E. 2000. Ecology and conservation of whitelipped peccaries and jaguars in Corcovado National Park. Ph.D. Thesis, University of Massachusetts, Cambridge, Massachusetts, EEUU. [ Links ]
Carl, G.R & R.D.Brown. 1985. Protein requirement of adult collared peccaries. J. Wildl. Manage. 49: 351- 355. [ Links ]
Carl, G.R & R.D.Brown. 1986. Comparative digestive efficiency and feed intake of the collared peccary. Southwest. Nat. 31: 79-85. [ Links ] Escobar, N. 1972. Flora tóxica de Panamá. EUPAN, Panamá. 272 p. [ Links ]
Fleming, T. H. 1986. Opportunism versus specialization. The evolution of feeding strategies in frugivorous bats, p. 105-108. In A. Estrada & T. Fleming (eds.). Frugivores and seed dispersal. Netherlands, Boston, Dr. W. Junk, La Haya, Holanda. [ Links ]
Foerester, C. 1998. Ecología de la danta centroamericana Tapirus bairdii en un bosque húmedo tropical de Costa Rica. M.Sc. tesis, Universidad Nacional de Costa Rica, Heredia, Costa Rica. [ Links ]
Fragoso, J. M.V. 1994. Large Mammals and the community of an Amazonian rain forest. Ph. D. thesis, Universidad de Florida, Florida. [ Links ]
Fragoso, J.M.V. 1998. White-lipped peccaries and palms on the Ilho de Maracá, p. 151-163. In W. Milliken & J. Ratter (eds.). Maracá: The biodiversity and environment of an Amazonian rain forest. John Witey, Nueva York, NY. [ Links ]
García, R.V. 1997. Biología de la conservación y áreas silvestres protegidas: situación actual y perspectivas en Costa Rica. Instituto Nacional de Biodiversidad. Heredia, Costa Rica. 64 p. [ Links ]
Goering, H.K & P.J. Van Soest. 1971. Forage Fiber Analysis (Apparatus, reagents, procedures and some applications). Agriculture handbook No.379.Agricultural Research Service. United States Department of Agriculture, EEUU. 20 p. [ Links ]
Gottdenker, N & R.E. Bodmer. 1998. Reproduction and productivity of white-lipped peccaries in the Peruvian Amazon. J. Zool. Lond. 245: 423-430. [ Links ]
Haufler, J & Servello, F. 1996. Techniques for Wildlife Nutritional Analysis, p. 302-323. In T.A. Bookhout (ed.). Research and Management Techniques for Wildlife and Habitats. The Wildlife Society, Bethesda, Maruland, EEUU. [ Links ]
Hartshorn, G.S. 1983. Plants, p. 118-157. In D.H. Jansen (ed.). Costa Rican Natural History, University of Chicago, EEUU. [ Links ]
Holdridge, L.R. 1967. Life Zone Ecology.Tropical Science Center. San José, Costa Rica. [ Links ]
Kiltie, R.A. 1980. Seed predation and group size in rain forest peccaries. Ph.D. Dissertation, Princeton University, Princeton, Nueva Jersey, EEUU. [ Links ]
Kiltie, R.A. 1981. Stomach contents of rain forest peccaries (Tajassu tajacu and T. pecari). Biotropica 13: 234-235. [ Links ]
Kiltie, R.A. 1982. Bite forces as basis for niche differentiation between rain forest peccaries (Tayassu tajacu and T. pecari). Biotropica 14: 188-195. [ Links ]
Krebs. Ch.J. 1985. Ecología, Análisis experimental de la distribución y abundancia. Ediciones Pirámide, Madrid, España. 782 p. [ Links ]
Langer, P. 1978. Anatomy of the stomach of the collared peccary, Dicotyles tajacu (Artiodactyla: Mammalia). Z. Saugetierk. 43: 42-59. [ Links ]
Langer, P. 1979. Adaptational significance of the forestomach of the collared peccary, Dicotyles tajacu (L. 1758) Mammalia: Artiodactyla. Mammalia 43: 235-245. [ Links ]
Lochmiller, R.L, E.C. Hellgren, J.F. Gallagher, L.W. Varner & W.E. Grant. 1989. Volatile fatty acids in the gastrointestinal tract of the collered peccary (Tayassu tajacu). J. Mammal. 70: 189-191. [ Links ]
March, I.J. 1993. The White-lipped Peccary (Tayassu pecari), p. 13-22. In W.L.R. Oliver (ed.). Pigs, Peccaries and Hippos: Status Survey and Conservation Action [ Links ]
Plan. IUCN, Gland, Suiza. Maynard, L.A., J.K. Loosli, H.F. Hintz & R.G. Warner. 1981. Nutrición Animal. McGraw Hill, México, DF. 640 p. [ Links ]
Naranjo, E.P. 1994. Abundancia, uso de hábitat y hábitos de alimentación del tápir (Tapirus bairdii) en un bosque húmedo tropical en Costa Rica. M. Sc. Tesis, Universidad Nacional de Costa Rica, Heredia, Costa Rica. [ Links ]
Owen, J. 1980. Feeding Strategy. The University of Chicago Press. Chicago, Illinois, EEUU, 161 p. [ Links ]
Robbins, CH.T. 1993. Wildlife Feeding and Nutrition. A Series of Monographs. Washington State University, Washington, EEUU, 343 p. [ Links ]
Sowls, L.K. 1997. Javelinas and other Peccaries, their biology, management and use. Second edition. The University of Arizona, Tucson, Arizona, EEUU, 324 p. [ Links ]
Terborgh, J. 1992. Diversity and the tropical rain forest. Scientific American Library, Nueva York, EEUU. Ullrey, D.E & M.E. Allen. 1986. Principles of zoo mammal nutrition, p. 516-532. In M.E. Fowler (ed.) Zoo and wild animal medicine, Filadelphia, Pensilvania, EEUU. [ Links ]
Van Soest, P.J. 1982. Nutritional Ecology of the Ruminants. Ruminant metabolism, nutritional strategies, the cellulolytic fermentation and the chemistry of forages and plant fiber. O & B Brooks Cornell University,
Cornell, Nueva York, EEUU. 374 p. Vargas, M.M, H.R. Navas & X.C. Rojas. 1994. Plantas tóxicas para el ganado. Instituto Nacional de Aprendizaje, Sección de Zootecnia. Universidad Nacional, Escuela de Ciencias Agrarias, San José, Costa Rica. 70 p. [ Links ]
Referencia de internet
Department of Atmosferic Science. 1999. The Weather Wold 2010 Project. University of Illinois. (consultado: 20 julio 2003, http://ww2010.atmos.uiuc.edu/(Gh)/home.rxml). [ Links ]