Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.52 suppl.1 San José Sep. 2004
del Mar Caribe mexicano
D.U. Hernández-Becerril1 & A. Almazán Becerril2
1 Lab. Diversidad y Ecología del Fitoplancton Marino, Instituto de Ciencias del Mar y Limnología, UNAM, Apdo. Postal 70-305, México, D.F. 04510 México; dhernand@mar.icmyl.unam.mx
2 Lab. Ecología del Plancton, Depto. Ecología Marina, División Oceanología, CICESE, Km 107, Carretera Tijuana-Ensenada, Ensenada, B.C., México; almazan@cicese.mx
Recibido 31-X-2002. Corregido 21-IX-2003. Aceptado 11-XII-2003.
Abstract
Some dinoflagellates with benthic habits are related to ciguatera intoxication by fish consumption, especially in tropical areas. In the Mexican Caribbean, ciguatera is relatively common, but only one paper seems to have been published on the subject, and there are very few publicactions on phytoplankton and benthic microalgae. Material collected along the coast of the State of Quintana Roo with phytoplankton net (54 mm) and directly from sediment and epiphytes of macroscopic plants, was searched for toxic and other associated dinoflagellates. Samples were studied by light and scanning electron microscopy. Morphological characters were useful for species identification, but eventually physiological, ecological and molecular characters could also be used. Three species of Gambierdiscus, related to the production of ciguatera toxins, were identified: G. belizeanus, G. toxicus and G. yasumotoi. They are distributed in shallow coastal areas, including coastal lagoons.
Key words: Ciguatera, dinoflagellates, distribution, Gambierdiscus, Mexican Caribbean, new record.
Palabras clave: Ciguatera, dinoflagelados, distribución, Gambierdiscus, registros nuevos, Caribe mexicano.
Existen muchas especies de dinoflagelados marinos que desarrollan grandes proliferaciones y eventualmente dan coloración al mar. Algunas especies producen toxinas y pueden causar envenenamientos en la vida marina y humana, de manera directa o indirecta (por consumo de alimentos que contienen las toxinas) (Hallegraeff 1993). Entre los dinoflagelados marinos de vida libre (no parásitos) se pueden reconocer las formas realmente planctónicas que son tóxicas y que producen mareas rojas, o bien las que son sésiles (bénticas o epífitas): las primeras se asocian con diversas intoxicaciones como el Envenenamiento Diarreico por consumo de Mariscos (EDM), el Envenenamiento Paralítico por consumo de Mariscos (EPM), y el Envenenamiento Neurotóxico por consumo de Mariscos (ENM), mientras que las últimas están relacionadas con la ciguatera, por consumo de pescado, básicamente en áreas tropicales (Margalef 1998).
El envenamiento más importante relacionado con dinoflagelados en regiones tropicales, incluyendo el área del Mar Caribe de México , es sin duda la ciguatera. En las costas de los Estados de Quintana Roo y Yucatán (Caribe mexicano y sur del Golfo de México) la ciguatera es un evento recurrente y de 291 casos registrados en México en los últimos 16 años, estos Estados ocupan el 14% y 7%, respectivamente (Núñez-Vázquez et al. 2000). Y aunque se registran dinoflagelados que podrían causar el EDM, el EPM y el ENM en esta área (Almazán Becerril 2000), no se ha documentado ningún caso adecuadamente. Por otra parte, en el Pacífico mexicano existe ya información sobre casos de ciguatera (Lechuga-Devéze y Sierra-Beltrán 1995).
Las costas del Caribe mexicano (básicamente las costas del Estado de Quintana Roo) han recibido poca atención en cuanto al estudio de las especies tóxicas presentes en el área, a pesar de que la región del Caribe es considerada como una de las de más alta incidencia a nivel global. Se cuenta con informes no publicados sobre diatomeas y dinoflagelados (Hernández- Becerril, en prep.), con el registro de Pyrodinium bahamense, un dinoflagelado planctónico que aparentemente es inocuo (Gómez- Aguirre 1998) y con el estudio de dinoflagelados potencialmente tóxicos (y asociados) a lo largo de las costas del Caribe mexicano (Almazán Becerril 2000). Sin embargo, otros antecedentes que tenemos sobre dinoflagelados (tóxicos o no) son de la costa de Belice (muy cercana a nuestra área de estudio) (Faust 1996), donde se han descrito nuevas especies y se han estudiado otras de los géneros Prorocentrum (Faust 1990, 1991, 1993a, 1993b, 1994), Coolia (Faust 1992, 1995), Gambierdiscus (Faust 1995), Ostreopsis (Faust y Morton 1995, Faust et al. 1996), Plagiodinium (Faust y Balech 1993), Sinophysis (Faust 1993c), y de costas de Puerto Rico (Ballantine et al. 1985, 1988), la gran mayoría formas bénticas.
La identificación de los dinoflagelados tóxicos es importante y hasta ahora se han usado los caracteres morfológicos como la herramienta más práctica y útil para el reconocimiento de las especies. En el caso de los dinoflagelados tecados, la morfología de las placas es un caracter conservativo de empleo general, aunque recientemente se combina el uso de caracteres morfológicos con análisis moleculares (Chinain et al. 1999). En este trabajo se pretende dar a conocer las especies de dinoflagelados del género Gambierdiscus, potencialmente tóxicos e involucrados con la ciguatera, en la zona costera del Caribe mexicano (costas del Estado de Quintana Roo), incluyendo descripciones e ilustraciones y datos de distribución local, información que pudiera servir como base para estudios futuros de ecología, fisiología, taxonomía, toxicología, y que ayuden a establecer las áreas potencialmente riesgosas respecto a la ciguatera en el Caribe mexicano.
Materiales y métodos
Área de estudio
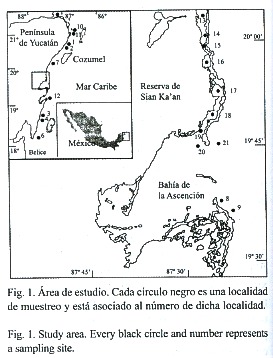
El Caribe mexicano está constituido fundamentalmente por las costas del Estado de Quintana Roo, en la parte oriental de la Península de Yucatán, sureste de México (Fig. 1). Entre la Península de Yucatán y la Isla de Cuba hay una depresión conocida como el Canal de Yucatán, el que divide propiamente las cuencas del Golfo de México y el Mar Caribe. En el Caribe mexicano la plataforma continental es muy estrecha (20 km enfrente de Cancún, estrechándose hacia el sur).
Existen muchas islas pequeñas, donde Cozumel es la de mayor tamaño, bancos y cayos, de los cuáles el más importante es el de Chinchorro. Las costas del Caribe mexicano sustentan la segunda barrera de coral más gran del mundo, que se extiende desde Isla Contoy hasta Belice, en América Central. Otros hábitats de importancia son las áreas de manglar, lagunas costeras y pequeñas caletas, algunas de las cuáles reciben influencia de agua continental periodicamente, tanto por filtración como por lluvia.
Los patrones de circulación han sido poco estudiados en aguas costeras del Caribe mexicano, aunque se ha encontrado que las masas de agua más grandes se mueven hacia el norte, con pequeños movimientos locales hacia el sur. El área de Cabo Catoche se considera una zona de surgencias, donde hay una alta productividad primaria, pero en general toda la zona costera hacia el sur es baja en nutrientes y productividad.
Recolección y análisis de muestras
Las muestras utilizadas para este estudio fueron obtenidas en varias localidades a lo largo de las costas del Estado de Quintana Roo, en ambientes neríticos y mixohalinos (incluyendo lagunas costeras y áreas de manglar). Las principales localidades fueron: Holbox, Isla Mujeres, Puerto Morelos, Bahía de la Ascención, Boca Paila, Punta Herrero y Xcalak (Cuadro 1, Fig. 1). Se recolectó material de fitoplancton y microalgas en diferentes fechas y localidades durante 1990 y 1991, mientras que en 1996 y 1997 se tomaron muestras particularmente en lagunas interiores y zona arrecifal de Bahía de la Ascención. El Cuadro 1 muestra detalles de las fechas y lugares de recolecta.
La recolecta de muestras se hizo básicamente por medio de red de fitoplancton (54 µm de luz de malla), en arrastres horizontales sub-superficiales (0-1.5 m), aunque también se analizaron algunas pocas muestras de sedimento y epífitas de plantas macroscópicas, cada muestra se preservó en formol al 4%. Se registraron temperatura y salinidad superficial para cada localidad.
El estudio del material se efectuó por medio de microscopía de luz (ML) y electrónica de barrido (MEB). Para el ML (Zeiss AXIOLAB) se utilizaron muestras enjuagadas (libres de sal y preservadores), ya sea observando gotas de cada muestra o aislando especimenes con micropipeta, siguiendo las técnicas de campo claro y contraste de fases, con objetivos de 40X y 100X, haciendo identificaciones preliminares y mediciones de especímenes. Para el MEB (JEOL JMS 35, operado a 20 kv) también se usaron gotas de muestra enjuagada o especímenes aislados, que fueron secados y posteriormente metalizados con oro para su observación inmediata, sin empleo del punto crítico de secado.
Para la descripción de las especies se siguió la terminología común para los dinoflagelados, procedente de varias referencias (Balech 1980, Sournia 1986, Fensome et al. 1993, Steidinger y Tangen 1997). La clasificación sistemática se basa en la obra de Fensome et al. (1993).
Resultados
En el área de estudio se encontraron e identificaron varias especies de dinoflagelados planctónicos y bénticos (Almazán Becerril 2000), de los cuáles para los propósitos de este trabajo destacaremos las especies detectadas del género Gambierdiscus. A continuación se describen dichas especies y se anotan datos sistemáticos, merísticos y de distribución.
División Dinophyta
(= Dinoflagellata (Bütschli) Fensome et al.)
Subdivisión Dinokaryota Fensome et al.
Clase Dinophyceae Pascher
Subclase Peridiniphycidae Fensome et al.
Orden Gonyaulacales Taylor
Suborden Goniodomineae Fensome et al.
Familia Goniodomaceae Lindemann
Subfamilia Gambierdiscoideae Fensome et al.
Género Gambierdiscus Adachi et Fukuyo
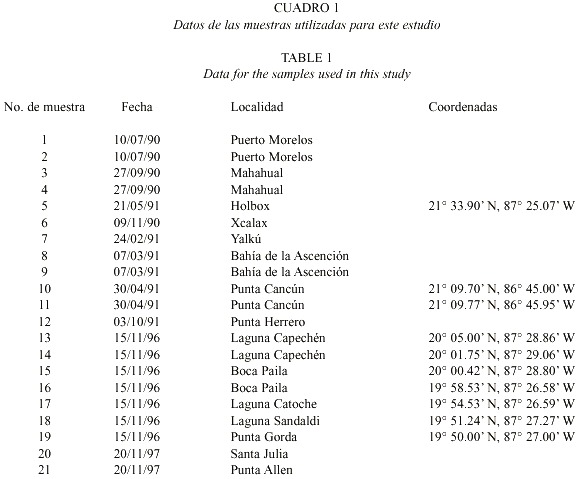
Gambierdiscus belizeanus Faust, 1995
Figs. 2, 3 Faust 1995, pp. 997, Figs. 3-5.
Células encontradas en forma solitaria, de talla mediana a grande, y forma lenticular tanto en vista lateral como apical/antapical. La epiteca e hipoteca son subiguales. La estructura de la teca está fuertemente areolada, con las areolas ovaladas de bordes redondeados o irregulares. Las bandas intercalares son anchas y perfectamente distinguibles en la superficie de la teca. El cingulum es estrecho y excavado, con las aletas cingulares (anterior y posterior) poco desarrolladas y provistas de numerosos radios. La tabulación de esta especie es: Po, 3, 7, 6c, 8s, 5, 1p, 2.
El complejo del poro apical, en la epiteca, se encuentra orientado ventralmente con una placa elíptica rodeada por un margen sinuoso. La arquitectura de esta placa está conformada por una hilera marginal de poros que rodean la parte interna del borde, con un diámetro de 0.5 µm. De esta hilera de poros se proyecta un apéndice igualmente elíptico y perforado, de tal manera que entre éste y el borde interno se forma un canal. Las dimensiones del complejo del poro son: 6 µm de largo y 4.2 µm de ancho.
Dimensiones: 70 µm transdiámetro, 64 µm longitud dorsoventral.
Distribución: Costas de Belice. En este estudio se encontró en Puerto Morelos.
Toxicidad: No se ha comprobado su toxicidad, pero vive asociada con especies potencialmente tóxicas (especies de Prorocentrum, Ostreopsis y Coolia).
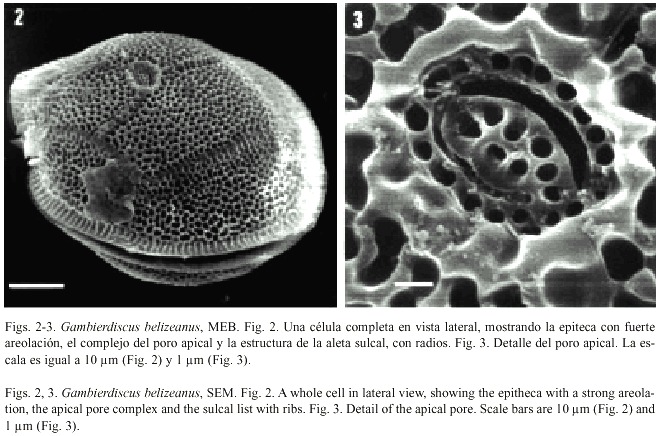
Gambierdiscus toxicus Adachi et Fukuyo, 1979
Figs. 4-9 Adachi y Fukuyo 1979, pp. 68, figs. 1-7; Besada et al. 1982, pp. 732, fig. 20c; Taylor et al. 1995, pp. 301, figs 15.19, 15.38f; Chinain et al. 1999, pp. 1285, figs. 1-4.
Células solitarias, de longitud variable (generalmente grande) y forma redondeada a ovalada en vista apical/antapical, con una constricción a nivel del sulcus y comprimidas en el sentido antero-posterior. Las tecas están densamente perforadas por poros pequeños, sin presencia de areolas. Las lineas intercalares son delgadas. El cingulum es estrecho, poco excavado, ascendente y con incipientes aletas cingulares, sin radios. El sulcus es angosto y muy excavado. La fórmula tabular es: Po, 3, 7, 6c, 8s, 5, 1p, 2.
El complejo del poro apical, muy evidente incluso en microscopía de luz, tiene forma elíptica (o triangular) y se orienta hacia la porción ventral del cuerpo, con una estructura más simple que en la especie anterior; sus dimensiones son 5.4 µm de largo y 4.5 µm de ancho.
Se observó un ejemplar vivo cuyo movimiento fue muy lento. Esta especie presenta numerosos cloroplastos de color café-dorado.
Dimensiones: 97-102 µm transdiámetro, 83-88 µm longitud dorsoventral. Estas dimensiones son muy similares a las encontradas por otros autores en ejemplares de Polinesia (Chinain et al. 1999).
Distribución: Se considera que esta especie tiene distribución circuntropical. En este estudio se encontró a lo largo de toda la costa del Caribe mexicano, principalmente en el norte y centro.
Toxicidad: Desde su descripción original se detectó la producción de ciguatoxina y maitotoxina, principales fuentes de la ciguatera, aparentemente su toxicidad se produce en todas la regiones tropicales donde se desarrolla.
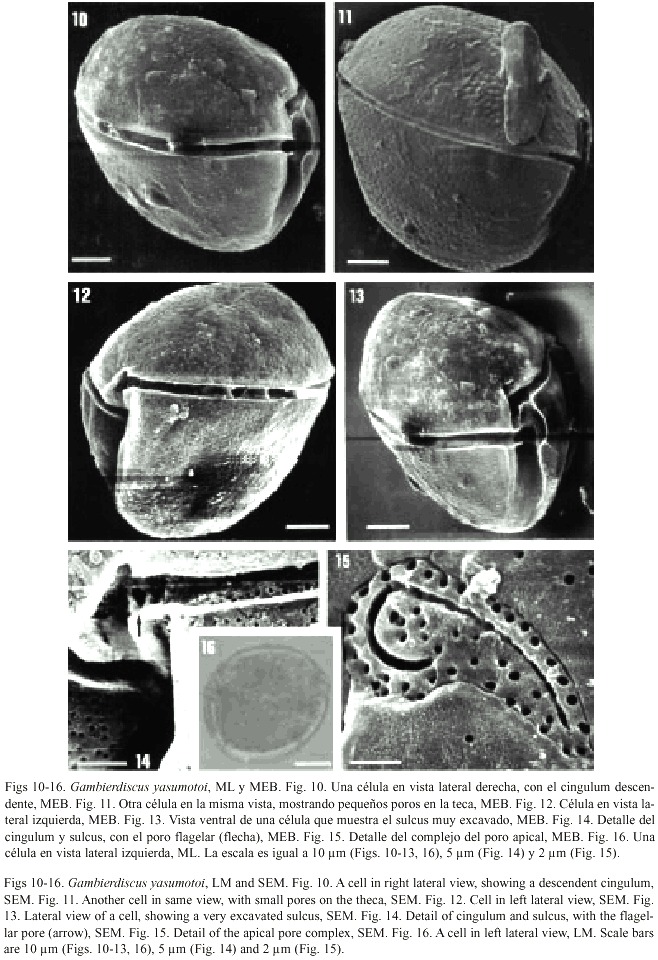
Gambierdiscus yasumotoi Holmes, 1998
Figs. 10-16 Holmes 1998, pp. 661, figs. 1-8.
Las células se encontraron solitarias. Son de talla mediana y tienen forma globular en vistas lateral y ventral/dorsal, ligeramente comprimidas lateralmente. La epiteca es más reducida que la hipoteca. Las lineas de sutura son poco evidentes. La superficie de las placas es porosa, sin areolación, con una densidad de poros menor que en G. toxicus. El cingulum es amplio, excavado y claramente descendente; las aletas cingulares son muy reducidas y carecen de radios. La región del sulcus en su porción anterior es también excavada, pero se proyecta hasta el polo antapical; se pudo apreciar el poro flagelar en un ejemplar. La fórmula tecal es: Po, 3, 7, 6c, 6s, 5, 2.
El complejo del poro apical es diferente con respecto a las dos especies anteriores: tiene forma de anzuelo y es de mayor longitud (10 µm), aunque también están presentes los numerosos poros que rodean el canal.
Dimensiones: 60-63 µm longitud dorso-ventral.
Distribución: Aparente distribución circuntropical. Había sido registrada en Singapur anteriormente. Se encontró en la localidad de Boca Paila.
Toxicidad: En la descripción original se detectó producción de ciguatoxina.
Discusión
El género Gambierdiscus es de relativa reciente erección, por Adachi y Fukuyo (1979) y hasta 1998 se habían descrito sólo tres especies. Sin embargo, más recientemente se describieron tres nuevas especies por Chinain et al. (1999). Ya desde 1977, Yasumoto et al. habían supuesto que la especie que se describió posteriormente, G. toxicus, por Adachi y Fukuyo (1979), era el agente causante de la ciguatera.
Desde el punto de vista taxonómico, el género Gambierdiscus se relaciona con el género Goniodoma, principalmente por la forma de la placa sulcal posterior, por lo que se incluyó como un miembro de la familia Heteraulaceae, aunque posteriormente Besada et al. (1982) colocaron el género Gambierdiscus en la familia Ostreopsidaceae, sobre la base del análisis de homologías presentes en el patrón tabular de las géneros Coolia, Ostreopsis y el mismo Gambierdiscus. En la más reciente clasificación de los dinoflagelados (Fensome et al. 1993), Gambierdiscus, fue incorporado a la familia Goniodomaceae y a la subfamilia, creada por esos autores, Gambierdiscoideae.
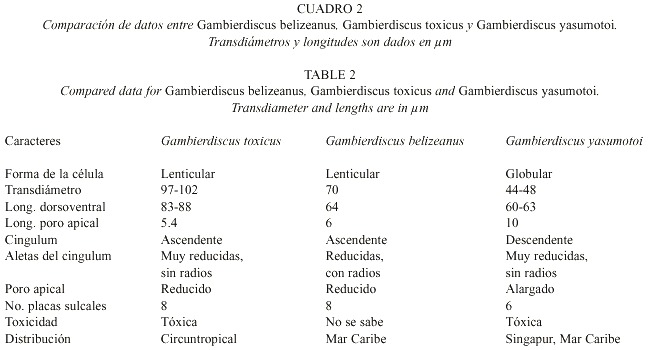
De las seis especies del género Gambierdiscus descritas en la actualidad, se han encontrado tres en este trabajo, pero es posible que estudios futuros revelen la presencia de otras más: las tres especies nuevas descritas en aguas de la Polinesia (Chinain et al. 1999) son muy semejantes morfológicamente a G. toxicus. Las especies que nosotros detectamos en el área de estudio: G. belizeanus, G. toxicus y G. yasumotoi están claramente diferenciadas en términos morfológicos: talla y forma de las células, y la estructura de las tecas y del complejo del poro apical (Cuadro 2). Las características del cingulum y sus aletas son también específicas para las especies encontradas (Cuadro 2).
Los caracteres morfológicos destacados en este estudio muestran su utilidad, pero es posible que en otras especies y géneros de dinoflagelados algunos caracteres pueden ser ambiguos, poco constantes o sobrepuestos entre sí, por lo que se cuestiona el empleo exclusivo de este criterio y actualmente se tratan de considerar criterios adicionales o complementarios, como caracteres fisiológicos, ecológicos y/o moleculares (John y Maggs 1997). Bomber et al. (1989) estudiaron la toxicidad de 17 cepas de G. toxicus, demostrando variabilidad en este característica dentro de una sola especie. Muchas consideraciones sobre esta variabilidad fisiológica y diferencias ecológicas de las especies conducen al cuestionamiento del concepto de especie que se ha usado tradicionalmente en dinoflagelados (y todas las microalgas) o a la postulación de la existencia de "especies crípticas" y complejos de especies (John y Maggs 1997, Mann 1999).
Chinain et al. (1999) compararon las seis especies del género. Algunas de las diferencias morfológicas descritas en ese artículo, entre G. toxicus y G. australes, G. pacificus y G. polinesiensis, están basadas en las dimensiones, y especialmente en la talla de la placa intercalar posterior (1p), así como la forma y talla del complejo del poro apical. Sin embargo la separación de las especies también se apoyó en análisis moleculares (Chinain et al. 1999).
La distribución de las especies muestra aspectos interesantes sobre la ecología de cada una de ellas: G. belizeanus fue encontrada solamente en una localidad (Puerto Morelos) y aparentemente está restringida a la zona del Caribe, mientras que G. toxicus fue encontrada de manera relativamente común en la mayoría de las localidades estudiadas, con una mayor difusión en las partes norte y central.
El hallazgo de G. yasumotoi en nuestro material parece ser un registro importante, el primero en el Caribe, que amplía la distribución de la especie, más allá del lugar donde fue descrito originalmente, Singapur (Holmes 1998). Las condiciones hidrográficas y ambientales de la localidad donde se encontró esta especie, Boca Paila, en la Reserva de Sian Kaan, muestran un área de poca profundidad (0.4 a 2.5 m), baja salinidad (22 ups) y relativa alta temperatura (25-28ºC), que en el caso de la salinidad coincide con los datos de Holmes (1998), de 30-33 ups.
Estas observaciones indican que las especies de Gambierdiscus ocurren a todo lo largo del litoral del Caribe mexicano, especialmente en ambientes someros, como lagunas costeras y entre la playa y la barrera de coral. El complejo lagunar de la Reserva de Sian Kaan es particularmente importante como ubicación de poblaciones núcleo, con una diversidad muy amplia de ambientes donde, al menos las especies de Gambierdiscus, pueden desarrollarse. La diversidad de ambientes también favorece la presencia de una gran variedad de consumidores primarios y secundarios (básicamente peces pequeños y medianos), incrementando las posibilidades de vectores de la ciguatera.
Las bajas densidades de células de las especies pueden explicarse parcialmente por el método de muestreo empleado (red de fitoplancton), que recolecta principalmente especies del ambiente pelágico (plancton) mientras que la forma de vida de las especies de Gambierdiscus es predominantemente béntica. Una recolecta más específica, sobre macroalgas y plantas acuáticas debería ofrecer una mayor cantidad de ejemplares y posiblemente de especies.
Debemos añadir, finalmente, que aunque las especies de Gambierdiscus se relacionan directamente con la ciguatera, no son las únicas productoras de las toxinas que ocasionan esta intoxicación, sino que pertenecen a la llamada "comunidad ciguatoxigénica", donde también están consideradas especies de los géneros Prorocentrum, Ostreopsis y Coolia, algunas de las cuáles también se encontraron en el área de estudio (Almazán Becerril 2000).
Creemos en la importancia del reconocimiento de las especies tóxicas y potencialmente tóxicas o nocivas y consideramos que se deben elaborar obras sobre la flora de dinoflagelados de esta área, así como complementar estas investigaciones con estudios biológicos (ciclos de vida, variabilidad genética), ecológicos (autoecología de especies tóxicas, análisis de factores ambientales), fisiológicos (tasas de crecimiento, producción de toxinas) y epidemiológicos.
Agradecimientos
Se agradece el apoyo de El Colegio de la Frontera Sur, Unidad Chetumal (antes CIQRO) para la recolecta de cierto material analizado en este trabajo. También agradecemos a Yolanda Hornelas O. por su colaboración en el empleo de microscopía electrónica de barrido. Finalmente se reconoce el apoyo de una beca otorgada por la DGAPA (PAPIIT), UNAM, (No. IN221898), para A.A.B.
Resumen
Algunos dinoflagelados de hábitos bénticos están relacionados con la ciguatera, por consumo de pescado, en áreas tropicales. En el Caribe mexicano la ciguatera es un padecimiento relativamente común, sin embargo solo existe un trabajo sobre este tema y muy pocos antecedentes publicados sobre fitoplancton y microalgas bénticas. En este estudio se analizó material recolectado en varios puntos a lo largo de las costas del Estado de Quintana Roo, tanto con red de fitoplancton (54 mm), como de sedimento y epífitas de plantas macroscópicas, para estudiar los dinoflagelados tóxicos y asociados. Se registra la presencia de tres especies del género Gambierdiscus, asociadas con la producción de toxinas causantes de la ciguatera: G. belizeanus, G. toxicus y G. yasumotoi, todas distribuídas en áreas costeras poco profundas, incluyendo lagunas costeras. Las especies han sido estudiadas con microscopía de luz y electrónica de barrido. Para el reconocimiento de las especies se emplearon los caracteres morfológicos usuales, pero eventualmente se pueden usar caracteres fisiológicos, ecológicos y moleculares. La llamada "comunidad ciguatoxigénica" también está formada por especies de los géneros Prorocentrum, Ostreopsis y Coolia, cuyo estudio florístico y taxonómico se recomienda ampliamente, así como investigaciones complementarias de aspectos biológicos, ecológicos, fisiológicos y epidemiológicos de esta comunidad.
Referencias
Adachi, R. & Y. Fukuyo. 1979. The thecal structure of the marine toxic dinoflagellate Gambierdiscus toxicus gen. et sp. nov. collected in a ciguatera endemic area. Bull. Jap. Soc. Sci. Fish. 45: 67-71 [ Links ]
Almazán Becerril, A. 2000. Estudio taxonómico de algunos dinoflagelados potencialmente tóxicos en el Caribe mexicano. Tesis de Maestría, Fac. Ciencias, Universidad Nacional Autónoma de México, México, D.F. [ Links ]
Balech, E. 1980. On thecal morphology of dinoflagellates with special emphasis on cingular and sulcal plates. An. Centro Cienc. Mar. Limnol., UNAM 7: 57-68 [ Links ]
Ballantine, D.L., A.T. Bardales, T.R. Tosteson & H.D. Durst. 1985. Seasonal abundance of Gambierdiscus toxicus and Ostreopsis sp. in coastal waters of southwest Puerto Rico. In Prod. 5th . Int. Coral Reef Congr. Tahiti. 4: 417-22. [ Links ]
Ballantine, D.L., T.R. Tosteson & A.T. Bardales. 1988. Populations dynamic and toxicity of natural populations of benthic dinoflagellates in southwestern Puerto Rico. J. Exp. Mar. Biol. Ecol. 119: 201-212. [ Links ]
Besada, E.G., L.A. Loeblich & A.R. Loeblich III. 1982. Observations on tropical, benthic dinoflagellates, from endemic areas: Coolia, Gambierdiscus and Ostreopsis. Bull. Mar. Sci. 32: 723-35. [ Links ]
Bomber, J.W., D.R. Tindall & D.M. Miller. 1989. Genetic variability in toxin potencies among seventeen clones of Gambierdiscus toxicus (Dinophyceae). J. Phycol. 25: 617-125. [ Links ]
Chinain, M., M.A. Faust & S. Pauillac. 1999. Morphology and molecular analyses of three toxic species of Gambierdiscus (Dinophyceae): G. pacificus, sp. nov., G. australes, sp. nov., and G. polynesiensis, sp. nov. J. Phycol. 35: 1282-1296. [ Links ]
Faust, M.A. 1990. Morphologic details of six benthic species of Prorocentrum (Pyrrophyta) from a mangrove island, Twin Cays, Belize, including two new species. J. Phycol. 26: 548-558. [ Links ]
Faust, M.A. 1991. Morphology of ciguatera-causing Prorocentrum lima (Pyrrophyta) from widely differing sites. J. Phycol. 27: 642-648. [ Links ]
Faust, M.A. 1992. Observations on the morphology and sexual reproduction of Coolia monotis (Dinophyceae). J. Phycol. 28: 94-104. [ Links ]
Faust, M.A. 1993a. Prorocentrum belizeanum, Prorocentrum elegans and Prorocentrum caribbaeum, three new benthic species (Dynophyceae) from mangrove island Twin Cays, Belize. J. Phycol. 29: 100-107. [ Links ]
Faust, M.A. 1993b. Three new benthic species of Prorocentrum (Dinophyceae) from a mangrove island Twin Cays, Belize. J. Phycol. 32: 410-418. [ Links ]
Faust, M.A. 1993c. Surface morphology of the marine dinoflagellate Sinophysis microcephalus (Dinophyceae) from a mangrove island, Twin Cays, Belize. J. Phycol. 29: 355-363. [ Links ]
Faust, M.A. 1994. Three new species of Prorocentrum (Dinophyceae) from Carrie Bow Cay, Belize: P. sabulosum sp. nov., P. sculptile sp. nov., and P. arenarium sp. nov. J. Phycol. 30: 755-763. [ Links ]
Faust, M.A. 1995. Observations of sand-dwelling toxic dinoflagellates (Dinophyceae) from widely differing sites, including two new species. J. Phycol. 31: 996- 1003. [ Links ]
Faust, M.A. 1996. Dinoflagellates in a mangrove ecosystem. Twins Cays, Belize. Nova Hedwigia 112: 447-460. [ Links ]
Faust, M.A. & E. Balech. 1993. A further study of marine benthic dinoflagellates from a mangrove island, Twin Cays, Belize, including Plagiodinium belizeanum gen et sp. nov. Phycologia 37: 47-52. [ Links ]
Faust, M.A., S.L. Morton & J.P. Quod. 1996. Further SEM study of marine dinoflagellates: the genus Ostreopsis (Dinophyceae). J. Phycol. 32: 1053-1065. [ Links ]
Faust, M.A. & S.L. Morton. 1995. Morphology and ecology of the marine dinoflagellate Ostreopsis labens sp. nov. (Dinophyceae). J. Phycol. 32: 669-675. [ Links ]
Fensome, R.A., F.J.R. Taylor, G. Norris, W.A.S. Sarjeant, D.I. Wharton & G.L. Williams. 1993. A classification of living and fossil dinoflagellates. Micropaleontology Special Publication 7: 351 p. [ Links ]
Gómez-Aguirre, S. 1998. First record of Pyrodinium bahamense (Dinoflagellata) in brackish waters of the Mexican Caribbean coast. An. Inst. Biol., UNAM, Ser. Zool. 69: 121-123. [ Links ]
Hallegraeff, G.M. 1993. A review of harmful algal blooms and their apparent global increase. Phycologia 32:79-99. [ Links ]
Holmes, M.J. 1998. Gambierdiscus yasumotoi sp. nov. (Dinophyceae), a toxic benthic dinoflagellate from southeastern Asia. J. Phycol. 34:661-668. [ Links ]
John, D.M. & C.A. Maggs. 1997. Species problems in eukaryotic algae: a modern perspective, pp. 83-107. In M.F. Claridge, H.A. Dawah & M.R. Wilson (eds.). Species: The Units of Biodiversity. Chapman & Hall. [ Links ]
Lechuga-Devéze, C.H. & A. Sierra-Beltrán. 1995. Documented case of Ciguatera on the Mexican Pacific coast. Natural Toxins 3: 415-418. [ Links ]
Mann, D.G. 1999. The species concept in diatoms. Phycologia 38: 437-495. [ Links ]
Margalef, R. 1998. Red tides and Ciguatera as successful ways in the evolution and survival of an admirable old Phylum, pp. 3-7. In B. Reguera, J. Blanco, M.L. Fernández & T. Wyatt (eds.). Harmful Algae. Xunta de Galicia & IOC-UNESCO, Vigo. [ Links ]
Nuñez-Vázquez. E.J., A. Almazán-Becerril, A. Heredia-Tapia, D.U. Hernández-Becerril, L. Troccoli-Ghinaglia, B.O. Arredondo-Vega, J.A. Vázquez-Castellanos & J.L. Ochoa. 2000. Incidencia del envenenamiento por Ciguatera en México. In Resúmenes 4a Reunión de Expertos en Envenenamiento por Animales Ponzoñosos; 30 y 31 de marzo, Cuernavaca, México. [ Links ]
Sournia, A. 1986. Atlas du phytoplancton marin. I. Centre National de la Recherche Scientifique, Paris. pp. 216. [ Links ]
Steidinger, K.A. & K. Tangen. 1997. Dinoflagellates. pp. 387-584. In C.R. Tomas (ed.). Identifying Marine Phytoplankton. Academic, San Diego. [ Links ]
Taylor, F.J.R., Y. Fukuyo & J. Larsen. 1995. Taxonomy of harmful dinoflagellates, pp. 283-318. In G.M. Hallegraeff, D.M. Anderson & A.D. Cembella (eds.). Manual on Harmful Marine Microalgae. IOC-UNESCO, Paris. [ Links ]
Yasumoto, T., I. Nakajima, R. Bagnis & R. Adachi. 1977. Finding a dinoflagellate as a likely culprit of Ciguatera. Bull. Jap. Soc. Sci. Fish. 43: 1021-1026. [ Links ]