Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.52 n.3 San José Sep. 2004
Un método de transformación genética de maíz para conferirle resistencia ulterior a enfermedades virales
Marta Valdez1 , Kenneth Madriz2, * & Pilar Ramírez1,2
1 Escuela de Biología, Universidad de Costa Rica, San José, Costa Rica; mvaldez@biologia.ucr.ac.cr.
2 Centro de Investigación en Biología Celular y Molecular, Universidad de Costa Rica, 2060 San José, Costa Rica.
* Dirección actual: Biotécnica Análisis Moleculares S. A.
Recibido 14-VII-2004. Corregido 02-IX-2004. Aceptado 02-IX-2004
Abstract
A method for genetic transformation of maize for resistance to viral diseases. A system for the genetic transformation of maize was developed for two Costa Rican varieties: CR-7 and Diamantes 8843, that can allow the subsequent transfer of viral-derived genes in order to confer resistance to the disease caused by maize rayado fino virus (MRFV). The method is based on particle bombardment of organogenic calli derived from shoot tips. On the other hand, the molecular construction pRFcp-bar, containing the coat protein gene of MRFV and the marker gene bar, was elaborated. For the visual selection of the transformed material was used also the plasmid pDM803 that contains the reporter gene uidA (GUS).The results indicate that devices evaluated: the PIG (" Particle Inflow Gun ") and the Bio-Rad are both enough efficient to transfer foreign genes to the genome of the maize. Rev. Biol. Trop. 52(3): 787-793. Epub 2004 Dic 15.
Key words: Zea mays, Biotechnology, Genetic Transformation, Biolistics, maize rayado fino virus (MRFV).
Palabras clave: Zea mays, Biotecnología, Transformación Genética, Biobalística, virus del rayado fino del maíz (MRFV).
El maíz es uno de los tres cereales de mayor importancia en el mundo. Más de cuatrocientos millones de personas en América Central, México, África y Asia dependen de ese cultivo para su subsistencia. En países tropicales su productividad es baja debido en gran parte a enfermedades virales (FAO y CIMMYT 1997). En América Latina hay muchos virus que atacan el cultivo, siendo uno de los más importantes el virus del rayado fino del maíz (MRFV), descrito y caracterizado por Gámez (1969, 1983). A nivel molecular, su genoma fue clonado y secuenciado por Hammond y Ramírez (2001), quienes además desarrollaron métodos moleculares para el diagnóstico de la enfermedad. Este virus es transmitido exclusivamente por el insecto cicadélido Dalbulus maidis (DeLong y Wocott fide Gámez 1973), y ocasiona pérdidas de 40 a 50% en el peso de las mazorcas en cultivares criollos adaptados a las condiciones locales en Mesoamérica.
Los nuevos cultivares e híbridos desarrollados por los fitomejoradores son, no obstante, muy susceptibles al MRFV, donde las pérdidas pueden alcanzar el 100%. En varios estadíos de la enfermedad, la planta entera se marchita llegando hasta a morir (Gámez 1980). Es entonces, de fundamental importancia el introducir resistencia no convencional al MRFV en los cultivares de maíz que se siembran en América Latina y en Costa Rica para aumentar su producción, y reducir la aplicación de plaguicidas para el control del insecto vector del virus.
Las técnicas biotecnológicas modernas representan nuevas alternativas para el control de enfermedades virales. Algunas de esas estrategias se basan en la expresión in planta, de genes virales o de secuencias derivadas del patógeno, mediante técnicas de ingeniería genética y de transformación genética (Madriz-Ordeñana 1999). Esta forma de resistencia se conoce como: "resistencia derivada del patógeno" (Sanford y Johnston 1985).
La expresión de la proteína de cubierta viral en plantas transgénicas es una estrategia que ha sido muy utilizada para conferir resistencia a enfermedades virales en muchos cultivos vegetales de importancia agrícola (Beachy et al. 1990). Algunos han sido liberados para el cultivo comercial. Estos incluyen tomates resistentes al virus del mosaico de tomate (ToMV) y al virus del mosaico del pepino (CMV), pepino resistente a CMV, calabaza resistente a virus del mosaico amarillo del zuchini (ZYMV) y al virus del mosaico de la sandía (WMV2), etc. (Lomonossoff 1995). Kogel et al. (1996), clonaron el gen de la proteína de cubierta del MRFV (cpMRFV), clon que luego fue utilizado en la elaboración de una construcción molecular que pudiese ser expresada en plantas transgénicas de maíz. OConnor-Sánchez et al. (2002) desarrollaron un sistema muy eficiente de regeneración de plantas de genotipos tropicales de maíz, basado en la inducción de callos organo-embriogénicos derivados de ápices, para ser utilizado en experimentos de transformación genética por medio de biobalística. Es entonces de gran interés aplicar este método a los genotipos costarricenses de maíz, para confererirles resistencia a enfermedades virales y otras plagas.
El objetivo de la presente investigación fue desarrollar una metodología para la transformación genética de variedades costarricenses de maíz, utilizando genes marcadores como el gen bar y el gen reportero GUS, así como el gen cpMRFV, por medio del método de bombardeo con micropartículas (biobalística) y de técnicas biotecnológicas de cultivo in vitro, que permitan la transferencia ulterior del gen cpMRFV a su genoma para poder conferirle resistencia a la enfermedad ocasionada por el MRFV.
Metodología
Se utilizó semillas de los genotipos costarricenses CR-5, CR-7 y Diamantes 8843, que fueron proveidas por la Oficina Nacional de Semillas de Costa Rica. Los métodos de desinfección de explantes, y de inducción de callos morfogénicos son similares a los descritos por OConnor-Sánchez et al. (2002). Para la regeneración de plantas los callos se cultivaron en frascos de vidrio Gerber con medio MS (Murashige y Skoog 1962), sin reguladores de crecimiento, en un cuarto de crecimiento con un fotoperíodo de 12 h generado por lámparas fluorescentes blancas y rosadas para el crecimiento de plantas (2000 lux).
Por otro lado, se elaboró la construcción molecular que denominamos pRFcp-bar. Para ello se utilizó un fragmento de 580 pares de bases del gen de la cubierta proteica viral del MRFV regulado por el promotor constitutivo de la actina del arroz (McElroy et al. 1991) y con la secuencia de terminación del gen que codifica para la enzima ribulosa –1,5– difosfato carboxilasa oxigenasa (rubisco) (Gloria et al. 1984). Como gen marcador de selección, se incluyó el gen bar que codifica para la enzima fosfinotricina acetil-transferasa (PAT) (Thomson et al. 1987), regulado por el promotor de la Ubiquitina I del maíz (Christensen et al. 1992) y la secuencia de terminación nos proveniente de Agrobacterium tumefaciens (Bevan et al. 1983). El gen bar contrarresta el efecto inhibidor de la fosfinotricina (PPT) sobre la glutamina sintetasa en las células vegetales, previniendo la acumulación de amoníaco y por ende la muerte celular. Así, la expresión de ese gen foráneo, permite la selección en un medio que contiene PPT de las células vegetales, en relación con aquellas que no lo poseen (Spencer et al. 1990). La Figura 1 muestra la construcción molecular final que fué utilizada para los experimentos de transformación genética del presente trabajo. El proceso de elaboración se describe en detalle en Madriz-Ordeñana (1999).
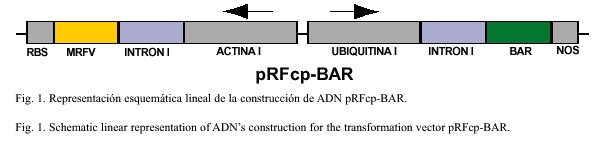
Para efectos de selección visual del material transformado se utilizó el plásmido pDM803 que contiene el gen reportero uidA (GUS) que codifica para la enzima ß-glucuro-nidasa (Jefferson 1987), conjuntamente con el pRFcp-bar. Al pDM803 se le eliminó el gen bar ya que se encuentra también en el pRFcp-bar (Madriz-Ordeñana 1999). Ese plásmido fue cedido por los Laboratorios Carlsberg de Dinamarca. El método de preparación del ADN y de los microproyectiles de oro, es similar al presentado por Valdez et al. (1998).
La preparación de los explantes, así como las condiciones de mantenimiento de los callos de maíz, antes y después de la transferencia de genes, se realizó de acuerdo con los métodos desarrollados por OConnor-Sánchez et al. (2002). Se realizaron experimentos de bombardeo de los genes transportados por los microproyectiles por medio de dos aceleradores de partículas: el PIG ("Particle Inflow Gun") (Finner et al. 1992) y el Bio-Rad "PDS-1000, Helium System" (Sanford et al. 1987). Este último aparato pertenece al Laboratorio de Biotecnología del Centro Agronómico Tropical (CATIE) con sede en Turrialba, Costa Rica. Con esos dos aparatos se compararon las eficiencias de transformación genética, en relación con la expresión transitoria del gen reportero GUS (Jefferson 1987) y con la resistencia conferida a los tejidos vegetales por el gen marcador bar. La expresión en los tejidos del gen uidA (GUS) se detectó mediante un ensayo histoquímico, en el cual se colocó una muestra de tejido en la solución reveladora X-gluc (5-bromo-4-cloro-3-indolil-D-glucurónido). La enzima degrada el sustrato y como resultado se genera una coloración azul (foci) en los tejidos transformados que contienen el gen (Gallagher 1992, Vasil y Thorpe 1994).
Para detectar el gen marcador bar se desarrolló un protocolo experimental de selección de los callos morfogénicos de nuestros genotipos de maíz bombardeados con los dos aceleradores de partículas. Este protocolo consistió en la utilización del agente selectivo glufosinato de amonio (fosfinotricina: PPT) en concentraciones de 3, 4, 5 y 6 mgL-1 en el medio de cultivo para el mantenimiento de los callos control (no transformados), para determinar la susceptibilidad natural de este tipo de material al agente selectivo. De esa manera se determinó la concentración adecuada para discriminar los tejidos efectivamente transformados luego de los experimentos de biobalística. Los experimentos de cultivo in vitro y de bombardeo de micropartículas con el PIG, se llevaron a cabo en el laboratorio de cultivo in vitro y de transformación genética de plantas, de la Escuela de Biología de la Universidad de Costa Rica. Los de transformación por medio del acelerador Bio-Rad se realizaron en el laboratorio de Biotecnología del CATIE. El tiempo total de ejecución de los experimentos fue de enero de 1999 a mayo de 2003.
Resultados
Los ápices de maíz cultivados en medio MS suplementado con 2 mgL-1 BAP (6- benzilaminopurina), 1 mgL-1 de 2,4-D (ácido 2,4-diclorofenoxiacético) y 40 mgL-1 de Adenina (Medio MPC), generaron estructuras organogénicas que luego de ocho semanas generaron callos con capacidad para la regeneración de plantas (Fig. 2 A y B). El porcentaje de formación de estructuras organogénicas fue de 32 a 40% para la variedad Diamantes 8843, de 73 a 84% para CR-5 y de 55 a 100% para CR-7. Todos los callos generados fueron capaces de regenerar plantas al ser transferidos a medio de regeneración luego de seis semanas de cultivo. El número de plántulas regeneradas por gramo de peso fresco de callo varió según el genotipo: 5 para CR-5, 9 para CR-7 y 39 para Diamantes 8843. La capacidad para la inducción de callos entonces, no parece estar relacionada con la capacidad para la regeneración de esas estructuras globulares. En consecuencia, los experimentos de transformación genética se realizaron sólo en los genotipos Diamantes 8843 y CR-7.
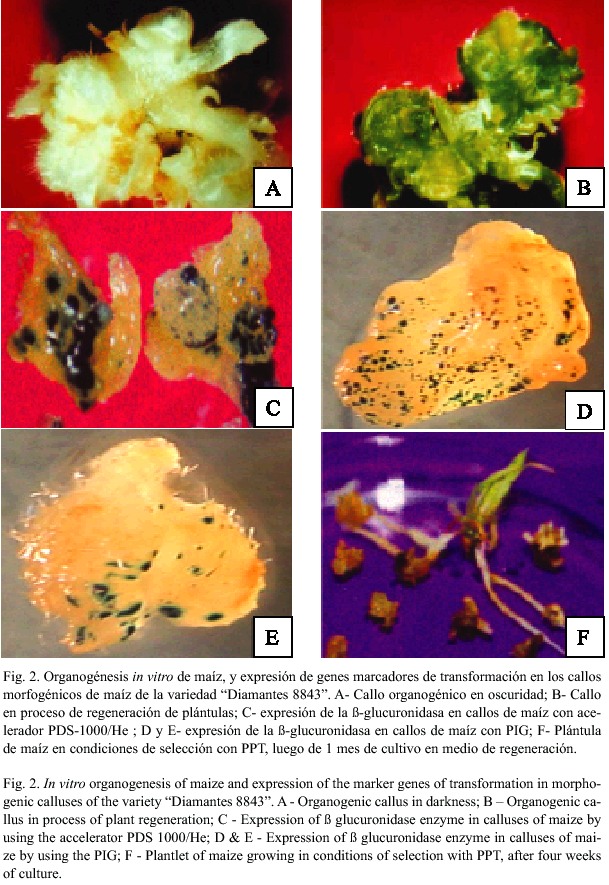
La expresión transitoria de la ß-glucuronidasa en los callos de maíz bombardeados con los aceleradores PDS-1000/He y PIG se muestra en la figura 2 (C, D y E). En relación con la tolerancia natural de ambos genotipos al agente de selección PPT, los resultados indican que la concentración adecuada de ese agente es de 6 mgL-1 , ya que alrededor del 73 al 75% de los callos control de ambos genotipos se necrosaron. El número de foci azúles, generados por la actividad de la enzima ß-glucuronidasa (gen GUS) fue mayor, con un promedio de 41 por muestra, cuando el bombardeo se realizó con el acelerador Bio-Rad , que cuando se utilizó la PIG (Cuadro 1). El uso de un tratamiento osmótico (medio MPC suplementado con 12% de sacarosa) por 24 horas antes y después del bombardeo, también mostró un efecto positivo sobre la expresión transitoria del gen GUS, a las 48 horas después del bombardeo. La expresión de este gen siempre fue mayor con el tratamiento osmótico, en ambos aceleradores.
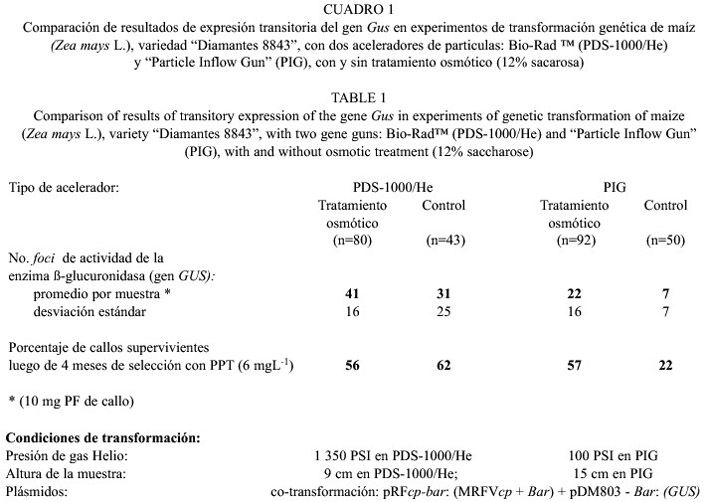
El porcentaje de callos supervivientes luego de 4 meses de selección con 6 mgL-1 de PPT varió entre 56% para el tratamiento osmótico en la Bio-Rad y 57% en la PIG. Luego de cinco meses de selección con PPT, se obtuvieron 14 clonas resistentes del genotipo Diamantes 8843 cuando se utilizó el aparato PIG y solo 3 con el Bio-Rad , no obstante los mejores resultados en expresión transitoria del gen GUS, obtenidos con este dispositivo en las semanas siguientes al bombardeo (Cuadro 1). Este último resultado se debió probablemente al largo traslado del material vegetal, para realizar los experimentos de bombardeo en el laboratorio del CATIE en Turrialba.
El Cuadro 1 presenta las condiciones más adecuadas con los dos dispositivos de aceleración de micropartículas cubiertas de ADN evaluados, para la transformación genética de los genotipos costarricenses de maíz examinados. Con esas condiciones se recuperaron 11 eventos adicionales de transformación del genotipo CR-7, con el acelerador PIG luego de 5 meses de selección. Esos callos desafortunadamente, en su mayoría, perdieron su capacidad de regeneración, debido posiblemente al largo período de cultivo en medio de selección, por lo que no fue posible regenerar las plántulas. Sólo una logró sobrevivir dos meses en medio de regeneración (Fig. 2F).
Discusión
Los métodos de transformación genética del maíz, utilizados de manera comercial, requieren del cultivo de embriones inmaduros que producen el tipo de callo "Hi-II", de muy alta capacidad embriogénica. Desafortunadamente, sólo unos pocos genotipos, como el A-188, sin interés comercial, producen este tipo de callos morfogénicos (Rhodes et al. 1988, Fromm et al. 1990, Gordon-Kamm et al. 1990). Los transgenes de interés agronómico, integrados de esta manera al genoma del maíz, son luego transferidos por mejoramiento convencional, a las líneas de maíz de valor comercial, lo que toma varios ciclos reproductivos a fín de eliminar los caracteres genéticos no deseados. Este es además, un proceso de alto costo debido a las complejas manipulaciones para aislar embriones inmaduros en cada generación (OConnor-Sánchez et al. 2002).
Por esta razón, y con la finalidad de producir plantas transgénicas de maíz, de interés agronómico, resistentes al virus del rayado fino del maíz (MRFV) en el futuro, esta investigación desarrolló un método alternativo para la regeneración y transformación genética de plantas de maíz de genotipos costarricenses.
Agradecimientos
Los autores agradecen a Rosemarie Hammond por el asesoramiento en las técnicas moleculares, a Narcy Villalobos y Marlon Delgado por su asistencia en el trabajo experimental, a Oscar Rocha por la revisión del manuscrito. Se agradece la colaboración de María Elena Aguilar y de Nelly Vázquez del Departamento de Biotecnología del Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), por facilitar sus instalaciones y equipo. Este trabajo fue financiado por la Universidad de Costa Rica (Proyecto No 111-96-222), por el Ministerio de Ciencia y Tecnología a través del Fondo de Incentivos, y por el Centro Internacional de Ingeniería Genética y Biotecnología (ICGEB).
Resumen
Se desarrolló un sistema de transformación genética para dos variedades costarricenses de maíz: CR-7 y Diamantes 8843, que permita la transferencia ulterior de genes de origen viral a su genoma, y conferirles resistencia a la enfermedad ocasionada por el virus del rayado fino del maíz (MRFV). El método se basa en el bombardeo de microproyectiles en callos organogénicos derivados de ápices de jóvenes vitrogerminaciones. Por otro lado, se elaboró la construcción molecular pRFcp-bar que contiene el gen de la cubierta proteica del MRFV y el gen marcador bar. Para la selección visual del material transformado, se utilizo también el plásmido pDM803 que contiene el gen reportero uidA (GUS). Los resultados indican que los dos aceleradores de partículas evaluados: el PIG ("Particle Inflow Gun") y el Bio-Rad son igualmente eficientes para transferir genes foráneos al genoma
del maíz.
Referencias
Beachy, R.N., S. Loesch-Fries & N.E. Tumer. 1990. Coat protein-mediated resistance against virus infection. Annu. Rev. Phytopathol. 28: 451-474. [ Links ]
Bevan, MW., R.B. Flavell. & M.D. Chilton. 1983. Structure and transcription of the nopaline synthase gene region of the T-DNA. Nucl. Ac. Res. 11: 369-385. [ Links ]
Christensen, A.H., R.A. Sharrock & P.H. Quail. 1992. Maize polyubiquitin genes: Structure, thermal perturbation of expression, transcript splicing, and promoter activity following transfer to protoplasts by electroporation. Plant Mol. Biol. 18: 675-689. [ Links ]
Finner, J., P. Vain, M.W. Jones & M.D. McMullen. 1992. Development of the Particle Inflow Gun for AND delivery to plant cells. Plant Cell Rep. 11: 323-328. [ Links ]
FAO & CIMMYT (Food and Agriculture Organization of the United Nations) and (International Maize and Wheat Improvement Center). 1997. White maize: a traditional food grain in developing countries. 22 p. [ Links ]
Fromm, M.E., F. Morrish, C. Armstrong, R. Williams, J. Thomas & T.M. Klein. 1990. Inheritance and expression of chimeric genes in the progeny of transgenic maize plants. Bio Technol. 8: 833-839. [ Links ]
Gallagher, S. 1992. GUS protocols: Using the GUS gene as a reporter of gene expression. Academic, USA. 219 p. [ Links ]
Gámez, R. 1969. A new Leafhopper-borne virus of corn in Central America. Plant Dis. Rep. 53: 929-932. [ Links ]
Gámez, R. 1973. Transmission of rayado fino virus of maize (Zea mays) by Dalbulus maidis. Ann. Appl. Biol. 73: 285-292. [ Links ]
Gámez, R. 1980. Rayado Fino Virus disease of maize in the American tropics. Trop. Pest Manage. 26: 26-33. [ Links ]
Gámez, R. 1983. The ecology of maize rayado fino virus in the American tropics. In R.T. Plum & J.M. Thresh (eds.). Plant Virus Epidemiology. Blackwell Scientific, Oxford, pp: 267-275. [ Links ]
Gloria, C., R. Broglie, C. Edward & N-H. Chua. 1984. Tissue specif and light-regulated expression of a pea nuclear gene encoding the small subunit of ribulose-1,5- bisphosphate carboxylase. Eur. Mol. Biol. Org. J. 3: 1671-1679. [ Links ]
Gordon-Kamm, W.J., T.M. Spencer, M.L. Manganno, T.R. Adams, R.J. Daines, N.G. Willets, T.B. Rice, C.J. Mackey, R.W. Krueger, A.P. Kaush & P.G. Lamaux. 1990. Transformation of maize cells and regeneration of fertile transgenic plants. Plant Cell 2: 603-608. [ Links ]
Hammond, R.W. & P. Ramirez. 2001 Molecular characterization of the genome of Maize Rayado Fino Virus, the Type member of the Genus Marafivirus. Virol. 282: 338-347. [ Links ]
Jefferson, R.A. 1987. Assaying chimeric genes in plants: the GUS gene fusion system. Plant Mol. Biol. 6: 265-270. [ Links ]
Kogel, R., R.W. Hammond & P. Ramirez 1996. Incidence and geographic distribution of maize rayado fino virus (MRFV). Plant Dis. 80: 679-683. [ Links ]
Lomonossoff, G.P. 1995. Pathogen-derived resistance to plant viruses. Annu. Rev. Phytopathol. 33: 323-343. [ Links ]
Madriz-Ordeñana, K. 1999. Molecular studies of the defence responses of maize (Zea mys L.) in interaction with Maize Rayado Fino Marafivirus (MRFV). Tesis PhD. The Royal Veterinary & Agricultural University, Copenhagen, Denmark. [ Links ]
McElroy, D., A.D. Blowers, B. Jenes & R. Wu. 1991. Construction of expression vectors based on the rice actin 1(Act1) 5_region for use in monocot transformation. Mol. Gen. Genet. 231: 150-160. [ Links ]
Murashige T. & F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15: 473-497. [ Links ]
OConnor-Sánchez, A., J.L. Cabrera-Ponce, M. Valdez-Melara, P. Téllez-Rodríguez, J.L. Pons-Hernández & L. Herrera-Estrella. 2002. Transgenic maize plants of tropical and subtropical genotypes obtained from calluses containing organogenic and embryogenic-like structures derived from shoot tips. Plant Cell Rep. 21: 302-312. [ Links ]
Rhodes, C.A., D.A. Pierce, J.L. Mettler, D. Mascarenhas & J.J. Detmer. 1988. Genetically transformed maize plants from protoplasts. Science 240: 204-207. [ Links ]
Sanford, J.C. & S.A. Johnston. 1985. The concept of parasite- derived resistance: deriving resistance genes from the parasites own genome. J. Theor. Biol. 115: 395-405. [ Links ]
Sanford, J.C., T.M. Klein, E.D. Wolf, & N. Allen. 1987. Delivery of sustances into cells and tissues using a particle bombardment process. Part. Sci. Technol. 5: 27-37. [ Links ]
Spencer, T.M., W.J. Gordon-Kamm, R.J. Daines, & P.G. Lemaux . 1990. Bialaphos selection of stable transformants from maize cell cultures. Theor. Appl. Genet. 79: 625-631. [ Links ]
Thomson, C.J., N.R. Nova, R. Tizzard, R. Crameri, J.E. Davis, M. Lauwerys & J. Botterman. 1987. Characterization of the herbicide resistance gene bar from Streptomyces hygroscopicus. Eur. Mol. Biol. Org. J. 6: 2519-2523. [ Links ]
Valdez, M., J.L. Cabrera-Ponce, D. Sudhakar, L. Herrera-Estrella & P. Christou. 1998. Transgenic Central American, West African and Asian elite rice varieties resulting from particle bombardment of foreign DNA into mature seed-derived explants utilizing three different bombardment devices. Ann. Bot. 82: 795-801. [ Links ]
Vasil, I., & T. Thorpe. 1994. Plant cell and tissue culture. Kluwer Academics, Netherlands. 593 p. [ Links ]














