Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.52 n.1 San José Mar. 2004
Diterpenos y otros constituyentes de Croton hirtus (Euphorbiaceae)
J.C. Fuentes1 , V. Castro1 , J. Jakupovic2 & R. Murillo1
1 Escuela de Química y Centro de Investigación de Productos Naturales (CIPRONA), Universidad de Costa Rica, San José, Costa Rica; renato@calzada.equi.ucr.ac.cr
2 Institute of Organic Chemistry, Technical University of Berlin, D-10623 Berlin, Germany.
Recibido 20-VI-2001. Corregido 13-VIII-2003. Aceptado 21-VIII-2003.
Abstract
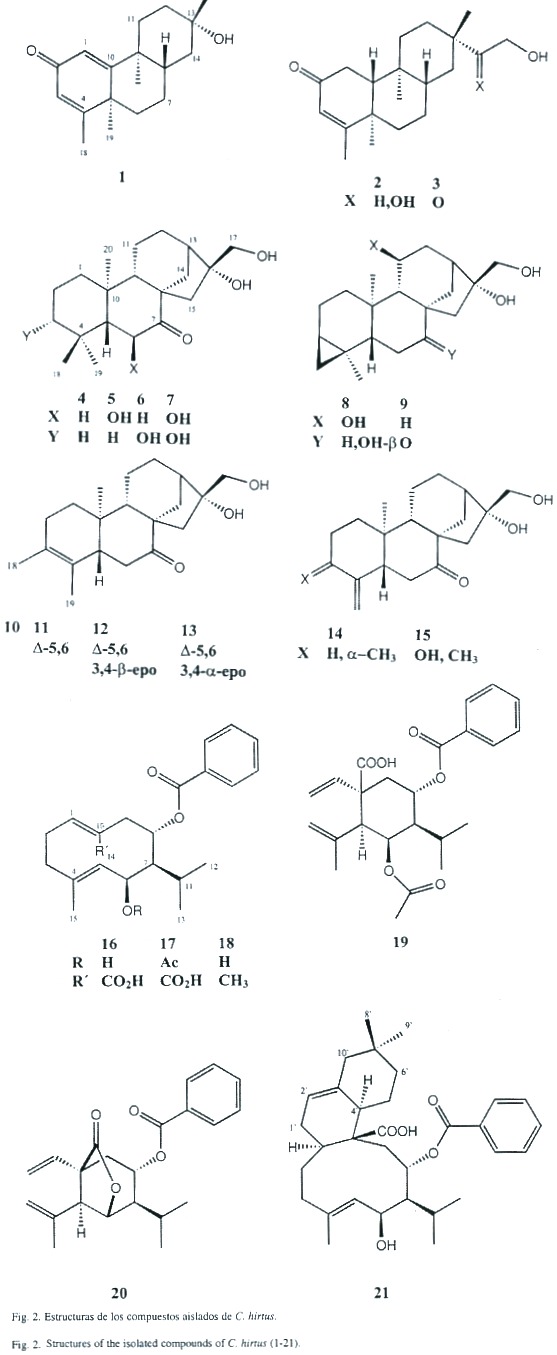
The roots of Croton hirtus (Euphorbiaceae) collected in Paraiso, Cartago (Costa Rica) afforded, in addition to the few known metabolites, 20 new compounds: the bis-nor dolabradane 1, the dolabradanes 2 and 3, the kauranes 4-7, the cyclopropakauranes 8 and 9, the hirtusanes 10-15, the germacradiene esters 16-18 and the C-25 compound 21, presumably formed by a Diels-Alder reaction between compound 18 and a monoterpene. All structures were elucidated using high field 1D and 2D NMR techniques. MS fragmentation patterns are here reported. The absolute configurations of 4 and 9 were elucidated by using circular dichroism. The separation was performed with modern chromatographic technics.
Key words: Croton hirtus, Euphorbiaceae, diterpenes, kauranes, 3,18-cyclopropakaurane, hirtusane, sesquiterpenes.
El género Croton contiene alrededor de 700 especies, siendo uno de los más grandes de la familia Euphorbiaceae (Trease 1988). Se encuentra colocado en la subfamilia Crotonoidae, cuyas especies se caracterizan por la presencia de diterpenos (Merrit 1992, Hanson 1995). De este género, un gran número de especies han sido investigadas y los clerodanos son el tipo de diterpeno más comúnmente aislado, aunque también se han obtenido otros diterpenos relacionados biogenéticamente a los clerodanos, como los labdanos.
El género Croton ha sido motivo de estudios fitoquímicos debido principalmente a las posibilidades terapéuticas que han podido ser identificadas en estas plantas. Una de las plantas más estudiadas, por su uso para el tratamiento del cáncer (Pieters 1992) e inflamaciones (Cai 1993), es la Croton lechleri.
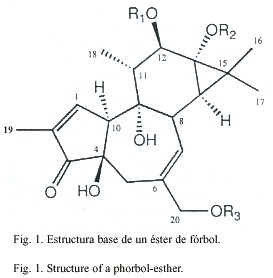
De los compuestos presentes en el género, con actividad promotora de tumores, se encuentran los ésteres de fórbol (Fig. 1)
Los ésteres de fórbol se encuentran generalmente en forma de diésteres 12, 13. Los triésteres son conocidos como irritantes crípticos, debido a que no exhiben actividad a menos que ocurra la hidrólisis del éster en C-20 (R3 ). C. tiglium es la planta de la cual se han aislado la mayor cantidad de este tipo de compuestos (Hecker 1974)
Se han informado diferentes usos de especies de este género, por ejemplo, la decocción de las hojas de C. antisiphiliticus se utiliza contra enfermedades venéreas, como diurético y contra la mordedura de serpientes (Hirschmann 1987). Por su parte, C. bonplandianus es utilizada como antiséptico (Bandoni 1976). Inclusive se ha informado que el extracto acuoso de la especie C. caudatus ha sido utilizado contra la malaria (Kumar 1980).
De C. draco (Murillo et al. 2001) y C. jimenezii (Murillo y Jakupovic 2000) se han aislado una serie de diterpenos, con estructuras muy singulares para especies de la familia Euphorbiaceae y Asteraceae. Aunque en muchas de las investigaciones presentadas para estas especies no se registra un estudio de actividad biológica, se hace interesante el análisis sistemático, pues se ha comprobado la actividad promotora de tumores para compuestos derivados de este género, tal es el caso de ésteres de fórbol aislados de C. flavens (Hecker 1984). Como puede apreciarse en la literatura, la presencia de compuestos interesantes en las especies del género Croton ha motivado nuestro estudio fitoquímico de plantas de este género en Costa Rica, pues se encuentran ampliamente distribuidas en las diferentes zonas del país.
Continuando nuestra investigación fitoquímica de la familia, informamos aquí los resultados de una muestra de C. hirtus recolectada en Costa Rica, especie que no ha sido investigada hasta el momento.
Materiales y métodos
La planta (C. hirtus) fue recolectada en setiembre de 1991, en Paraíso de Cartago, Costa Rica. Un espécimen fue depositado en el Herbario Nacional de Costa Rica (# 26943). La parte aérea de la planta (950 g, peso seco) fue extraída a temperatura ambiente, durante 24 horas, con Et2O(éter etílico)/MeOH(metanol), en proporción 9:1. Después de la evaporación, el extracto (9.5 g) fue separado con distintas técnicas cromatográficas, CC (cromatografía de columna), TLC (cromatografía de capa fina) y HPLC (cromatografía líquida de alta eficiencia) con una columna RP-8, 250 x 8 mm, flujo de 3 mL/min, MeOH/H2O 4:1 (HP1), 7:3 (HP2), 3:2 (HP3). El extracto fue separado inicialmente con CC donde se obtuvieron ocho fracciones (fr.) con las siguientes condiciones: fr.1 éter de petroleo(PE); fr. 2 PE/éter metilter-butílico (MTB), 9:1; fr. 3 PE/MTB, 3:1; fr. 4 PE/MTB, 1:1; fr. 5 MTB; fr. 6 MTB/MeOH, 9:1; fr. 7 MTB/MeOH, 3:1; fr. 8 MTB/MeOH, 1:1.
La raíz (800 g) fue secada, molida y extraída (igual que las partes aéreas) para obtener 10 g de extracto, el cual fue separado por CC como se describió anteriormente.
La cromatografía líquida de alta eficiencia fue llevada a cabo con un cromatógrafo líquido preparativo marca Knauer. Los espectros de resonancia magnética nuclear fueron medidos con un equipo Bruker 400. Los espectros de masas fueron medidos con un equipo Varian MAT 711 y MAT 44 (ionización química, CI). El dicroísmo circular fue medido con un instrumento Dichrograph Mark III.
Resultados
Parte aérea
Las fracciones 1 y 2 contenían 50 mg de cariofileno, 40 mg de d -cadinano, 20 mg de germacreno-D, 40 mg de a -humuleno y 50 mg de escualeno. De la fracción 3 se aislaron 200 mg de óxido de cariofileno, la fracción 4 no fue separada debido a su alto contenido de grasa. Las fracciones 5 y 6 fueron combinadas (3.2 g.) y se tomaron 80 mg para separarlos por HPLC (HP1) de donde se obtuvieron 2 mg de 16 (R t 6.8 min) y 50 mg de 17 (Rt 6.8 min). La fracción 7 (700 mg) fue separada con HPLC (HP1) de donde se obtuvieron trazas de 16 y 17, y 10 mg de 18 (Rt 8.3 min). La fracción 8 contenía una mezcla de carbohidratos, los cuales no fueron analizados.
Raíz
La fracción 1 contenía 50 mg de cipereno. Las fracciones 2-4 contenían principalmente triacilgliceroles y no fueron analizadas a profundidad. Una parte de la fracción 5 (200 mg de un total de 1 270 mg) fue tratada con diazometano y separada con TLC (PE/MTB, 9:1) para dar una mezcla (90 mg), la cual fue separada por HPLC (HP2) para dar 5 mg de 14 (Rt 0.3 min) y 20 mg de 18Me (compuesto 18 metilado) (Rt 19.2 min). Una mezcla de 30 mg (Rf 0.3) fue separada por HPLC (HP3) para dar 3 mg de 17Me (Rt 9.4 min).
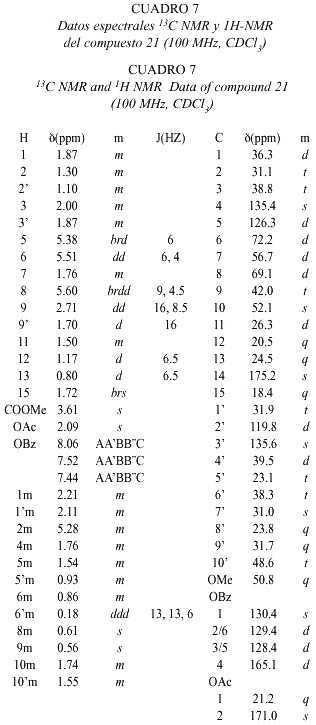
La fracción 6 consistió en 1.5 g de 17 casi puro. De la fracción 7, 400 mg fueron separados por TLC (PE/MTB, 3:7) para dar 100 mg de 17 y una banda (95 mg, Rf 0.2) que se separó por HPLC (HP3), obteniendo 15 mg de 1 (Rt 20.8 min). La fracción 8 (500 mg) fue separada por TLC (MTB/MeOH, 99:1) para dar tres bandas (I: Rf 0.61, II: Rf 0.42 y III: Rf 0.24), cada una de las cuales fue separada por HPLC (HP2). La banda I (25 mg) dió 3 mg de 2 (Rt 10.8 min). La banda II (94 mg) dio 3 mg de 15 (Rt 6.6 min), 24 mg de 1 (Rt 7.5 min), 6 mg de 3 (Rt 11.3 min), 3 mg de 5 (Rt 19.2 min), 3 mg de 9 (Rt 21.8 min), 8.5 mg de 10 (Rt 23.9 min) y 5 mg de 4 (Rt 26.2 min). La banda III (HP2) dio 5 mg de 7 (Rt 4.3 min), 2 mg de 6 (Rt 5.0 min), 14 mg de 12 (Rt 6.0 min), 12 mg de 14 (Rt 6.8 min), 8 mg de 13 (Rt 8.1 min) 5 mg de 11 (Rt 14.7 min) y 3 mg de 8 (Rt 21.0 min). Los compuestos conocidos fueron identificados por comparación con datos de la literatura. Los resultados están resumidos en los Cuadros 1-7 y en la Fig. 2.
Los espectros de masas de los compuestos 1-18 se describen a continuación:
1 Bisnor-[15,16]-13a -hidroxi-2-oxodolabra- 1(10)-3-dieno, MS m/z (int. rel.): 274.193 [M]+ (calc. para C18 H26 O2 274.193) (55), 259 [M-Me]+ (20), 257 [M-OH]+ (11), 246 [M-CO]+ (24), 241 [259- H2 O]+ (23), 231 [246-Me]+ (45), 213 [231-H2O]+ (68), 136 (100), 135 (96).
2 15,16-Dihidroxi-2-oxodolabradan-3-eno MS m/z (int. rel.): 320.235[M]+ (calc. para C20 H32 O3 320.235) (9), 302 [M-H2O]+ 4), 289 [M-CH2OH]+ (19), 259 [M-CH( OH)CH2OH]+ (55), 163 (43), 135 (57), 73 (100).
3 16-Hidroxi-2,15-dioxodolabradan-3-eno MS m/z (int. rel.): 318.219 [M]+ (calc. para C20 H30 O3 318.219) (5), 287 [M-CH2OH]+ (11), 259 [M-COCH2OH]+ (100), 163 (33), 135 (28).
4 16a ,17-Dihidroxi-7-oxokaurano MS m/z (int. rel.): 320.235 [M]+ (calc. para C20 H32 O3 320.235) (9), 303 [M-OH]+ (11), 289 [M-CH2OH]+ (100) 247 (30), 196 (51), 137 (42).
5 6b ,16a ,17-Trihidroxi-7-oxokaurano MS m/z (rel. int.): 336.230 [M]+ (calc. para C20 H32 O4 336.230) (2), 318 [M-H2O]+ (9), 305 [M-CH2OH]+ (10), 287 [318- CH2OH]+ (8), 259 (4), 245 (5), 212 (10), 73 (100).
6 3a ,16a ,17-Trihidroxi-7-oxokaurano MS m/z (int. rel.): 336.230 [M]+ (calc. para C20 H32 O4 336.230) (6), 305 [M-CH2OH]+ (100), 263 (8), 196 (60), 137 (87).
7 3a ,6b ,16a ,17-Tetrahidroxi-7-oxokaurano MS m/z (int. rel.): 352.225 [M]+ (calc. para C20 H32 O5 352.225) (4), 334 [M-H2O]+ (14), 321 [M-CH2OH] + (27), 303 [334- CH2OH] + (13), 212 (20), 183 (15), 167 (35), 55 (100).
8 7b ,11b ,16a ,17-Tetrahidroxiciclo-[ 3.18]kaurano MS m/z (int. rel.): 318.219 [M-H2 O]+ (calc. para C20 H30 O3 318.219) (8), 300 [318-H2O] + (31), 187 (42), 57 (100), 55 (90).
9 16a ,17-Dihidroxi-7-oxociclo[3.18]kaurano MS m/z (int. rel.): 318.219 [M] + (calc. para C20 H30 O3 318.219) (5), 300 [M-H2O]+ (5), 287 [M-CH2OH]+ (47), 276 (25), 245 [276-CH 2 OH] + (21), 55 (100).
10 16a ,17-Dihidroxi-7-oxohirtusan-3-eno MS m/z (int. rel.): 318.219 [M]+ (calc. para C20 H30 O3 318.219) (5), 301 [M-OH]+ (4), 287 [M-CH2OH]+ (8), 272 (14), 55 (100).
11 16a ,17-Dihidroxi-7-oxohirtusan-3,5-dieno MS m/z (int. rel.): 316.204 [M]+ (calc. para C20 H28 O3 316.204) (22), 299 [M-OH]+ (15), 298 [M-H2O]+ (15), 285 [M-CH2OH]+ (55), 257 [285-CO]+ (75), 55 (100).
12 3b ,4b -Epoxi-16a ,17-dihidroxi-7-oxohirtusan- 5-eno MS m/z (int. rel.): 332.199 [M]+ (calc. para C20 H28 O4 332.199) (4), 303 [M-CHO]+ (16), 301 [M-CH2OH]+ (12), 272 (100).
13 3a ,4a -Epoxi-16a ,17-dihidroxi-7-oxohirtusan- 5-eno MS m/z (int. rel.): 332.199 [M]+ (calc. para C20 H28 O4 332.199) (4), 301 [M-CH2OH] + (10), 272 (100).
14 3b -H-16a ,17-Dihidroxi-7-oxohirtusan-4[ 19]-eno MS m/z (int. rel.): 334.214 [M]+ (calc. para C20 H30 O4 334.214) (4), 303 [M-CH2OH] + (42), 292 (14), 289 (22), 285 (14), 248 (14), 219 (40), 86 (100).
15 3b ,16a ,17-Trihidroxi-7-oxohirtusan-4[ 19]-eno. No fue posible la medición del espectro de masas.
16 Ácido 6b ,8a -dihidroxi-8-O-benzoilger-macra- 1(10)Z,4E-dien-14-oico. CIMS m/z (int. rel.): 355 [M-H2O + 1]+ (100), 233 [355-C6 H5 COOH + 1 ]+ (95).
17 Ácido 6b ,8a -dihidroxi-6-O-acetil-8-O-benzoilgermacra- 1(10)Z,4E-dien-14-oico MS m/z (int. rel.): 414.204 [M]+ (calc. para C24 H30 O64 414.204) (3), 292 [M-C6 H5 COOH]+ (2), 232 [292-AcOH]+ (13), 189 (23), 145 (40), 105 [C6 H5 CO]+ (100).
18 6b ,8a -Dihidroxi-8-O-benzoilgermacra-1( 10)E,4E-dieno. MS m/z (int. rel.): 292 [M-C6 H5 COOH]+ (3), 232 [292-AcOH]+ (3), 145 (80), 133 (70), 105 [C6 H5 CO]+ (100); CIMS: 415 [M + 1]+ (12), 355 [M-AcOH + 1]+ (8), 293 [M-C6 H5 COOH + 1]+ (100).
19 Ácido 6b ,8a -dihidroxi-6-O-acetil-8-O-benzoileleman- 1(2),3(4)-dien-14-oico. No fue posible la medición del espectro de masas.
20 6b ,8a -Dihidroxi-8-O-benzoileleman-1( 2),3(4)-dien-14-carboxil-g -lactona. No fue posible la medición del espectro de masas.
21 No fue posible la medición del espectro de masas.
Discusión
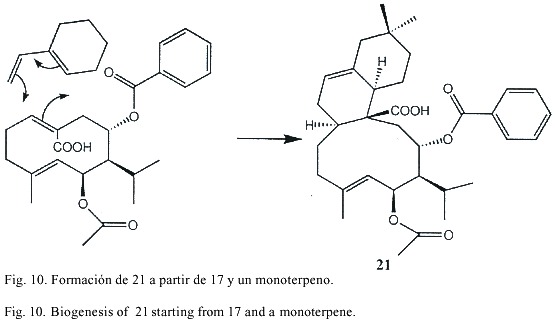
Del extracto de las raíces de Croton hirtus se obtuvo cipereno, el bisnorditerpeno 1, los diterpenos 2-15 (10-15 presentan un esqueleto carbonado no antes publicado), los sesquiterpenos 16-20, y un compuesto 21 C-25 probablemente formado por una reacción de Diels-Alder entre el compuesto 16 y un monoterpeno (el cual no fue aislado). Según nuestro conocimiento, ninguno de estos compuestos ha sido aislado previamente.
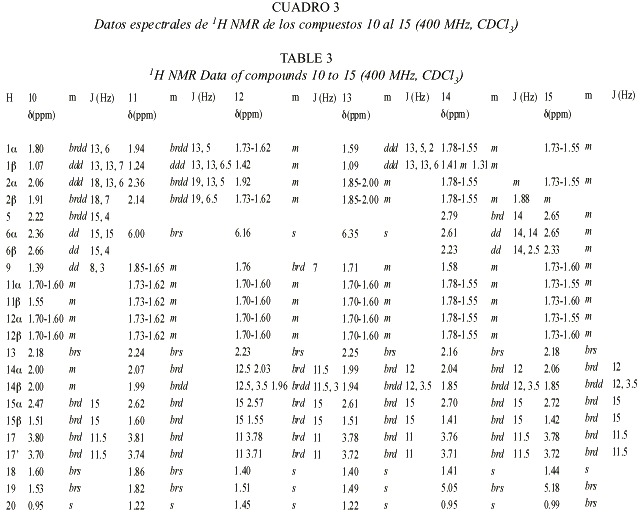
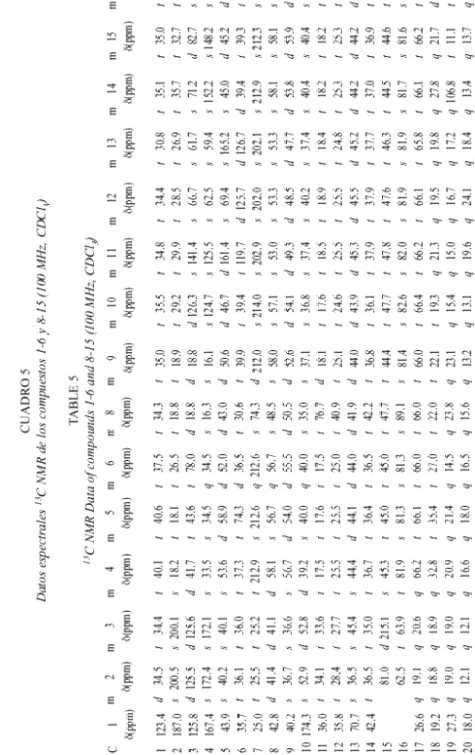
Las estructuras de los diterpenos fue deducida a partir de técnicas de 1H-NMR, 13C-NMR y diferentes experimentos de multipulsos de 1D y 2D.
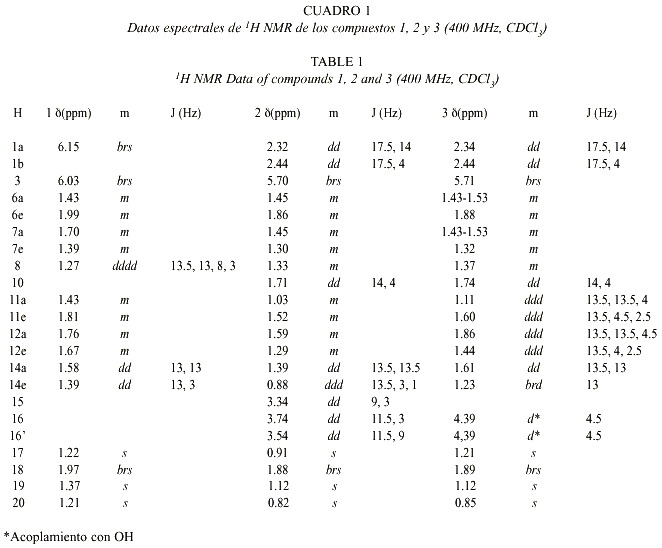
El espectro 13C-NMR del compuesto 1 muestra 18 señales sugiriendo así la presencia de un bisnorditerpeno, debido a que no se pueden identificar residuos no terpenoides conocidos. La señal a d 187.0 s en conexión con cuatro señales de carbonos olefínicos (Cuadro 5) sugiere la presencia de una dienona conjugada, con ambos dobles enlaces sustituidos en posiciones b . La correlación J 3 observada en el espectro HMBC entre ambos hidrógenos a y un carbono singulete a d 43.5, completa la secuencia del anillo A a una ciclohexadienona. Los experimentos de desacoplamiento de spin llevan a las siguientes dos secuencias: (i) H-6 a H-8(H-14) y (ii) H-11 a H-12. La conexión de H-12, H-14 y H-17 fue resuelta con el acoplamiento W observado entre H-17 y H-12 axial, y entre H-17 y H-14 axial (indicando además una posición axial de C-17). El sistema tricíclico fue completado con las correlaciones obtenidas del espectro HMBC: H-1 y H-20 con C-9 y C-10; H-18 y H-19 con C-4 y C-5, y entre H-17 con C-12, C-13 y C-14. La estereoquímica de los centros quirales C-5 y C-9 fue deducida de las interacciones dipolares observadas entre H-19 y H-20, indicando su orientación 1,3 diaxial. El acoplamiento J8,14 = 14 Hz requiere de una posición axial de H-8.
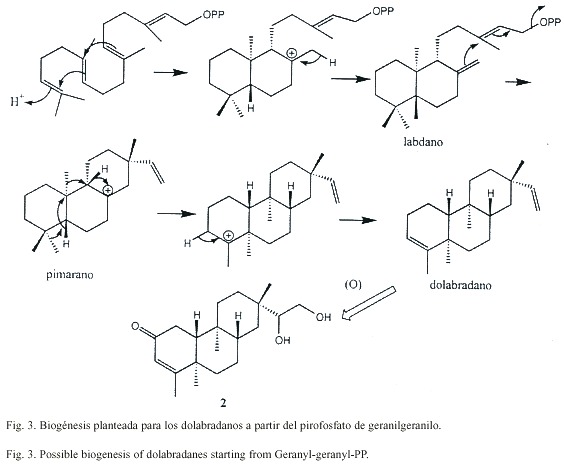
Los espectros de 1H-NMR y 13C-NMR de 2 y 3 presentan similitudes y difieren principalmente en las señales de la cadena lateral. El compuesto 2 presenta una masa molecular de 320.235 Dalton, indicando una fórmula molecular de C20 H32 O3 con un total de cinco insaturaciones. Del espectro 13C-NMR se deduce la presencia de un compuesto tricíclico con una cetona a , b -insaturada, donde el doble enlace posee solo un hidrógeno enlazado en posición a . También sobresalen cuatro grupos metilo (singuletes). Del espectro H,H-COSY se pueden deducir las siguientes secuencias: H-6 a H-8 (H-14), H-1 a H-10, H-11 a H-12 y H-15 a H-16, además se pudo observar un acoplamiento alílico de H-3 con H-18. Las conectividades entre estos segmentos pudieron ser determinadas de las correlaciones heteronucleares a larga distancia, observadas en el espectro HMBC. La estereoquímica fue elucidada de los datos obtenidos de los experimentos NOE. En el caso del compuesto 3 se observaron las siguientes interacciones dipolares; H-20 con H-19 (6%), H-20 con H-14 axial (4%), H-20 con H-12 axial (4%) y H-20 con H-7 axial (4%), además, una interacción dipolar se observó entre H-17 y H-8 (10%), situación que solo es posible para la estereoquímica planteada para este compuesto. El compuesto 2 presentó resultados similares. Ambos compuestos pertenecen a un raro grupo de dolabradanos, los cuales son derivados del esqueleto del pimarano (Fig 3). El compuesto 1 se deriva de una oxidación de la cadena lateral de estos compuestos.
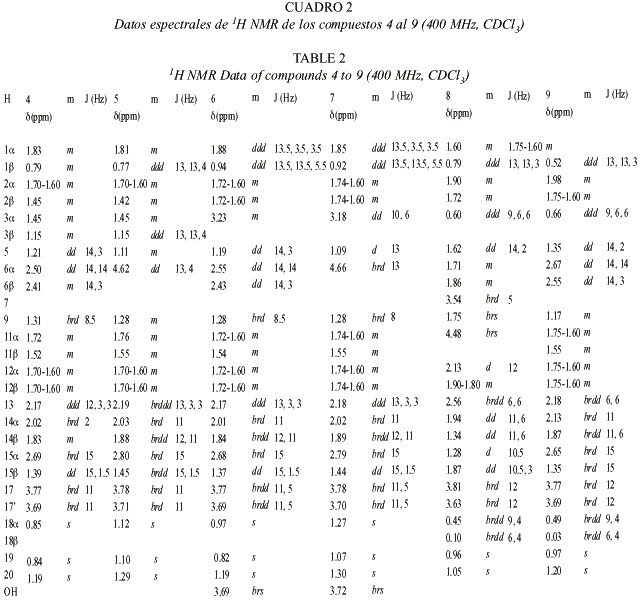
Para los compuestos 4-15 se discutirá la elucidación de la estructura del compuesto 4 y luego las variaciones que llevan a los otros compuestos. Con excepción del compuesto 8, todos los demás compuestos presentan particularidades espectrales similares, especialmente en los anillos C y D.
El espectro de masas del compuesto 4 presenta un ión molecular con una masa de 320.235, el cual coincide con la fórmula molecular C20 H32 O3 teniendo de esta forma la posibilidad de la presencia de un terpeno. Las señales en el espectro 1H-NMR muestran el patrón típico de un esqueleto carbonado de kaurano (con cuatro equivalentes de metilo singulete). El desdoblamiento geminal de H-17 a d 3.77 y d 3.69, y las señales en 13C-NMR a d 81.9 s y 66.2 t indican la presencia de un diol-16,17. El cambio químico y los acoplamientos de H-6 requieren la presencia de un grupo carbonilo en C-7, lo cual se ve reflejado por la desprotección anisotrópica que sufre H-15 y corroborada con la señal de una cetona en el espectro de 13C-NMR. La estructura y la estereoquímica planteadas concuerdan con los espectros H,H-COSY, HMBC y NOESY.
En el espectro 1 H-NMR de 5 la señal de H-5 se presenta como un doblete y H-6 dd (doblete de dobletes) presenta un desplazamiento químico de d 4.62. Esta señal se transformó en un doblete con la adición de D 2 O indicando la presencia de un grupo hidroxi en C-6. La posición ecuatorial de este OH se comprobó por la constante de acoplamiento J5,6 = 13 Hz.
En el caso del compuesto 6 las señales de H-5 y H-6 corresponden a las observadas en 4. Un multiplete a d 3.23 (1H-NMR) requiere la presencia de un grupo hidroxi en C-1 o C-3. Debido a la pequeña cantidad de sustancia, solo se pudo medir el HMQC (no se presentan datos de 13C). La diferencias en cambios químicos entre H-18 y H-19, en comparación con los datos obtenidos para 4 sugiere la presencia del grupo hidroxi en C-3.
Los datos de 1H-NMR de 7 son similares a los de 5 y 6, indicando la presencia de un diol-3,6. El espectro de 13C-NMR no pudo ser medido debido a la pequeña cantidad aislada de 7.
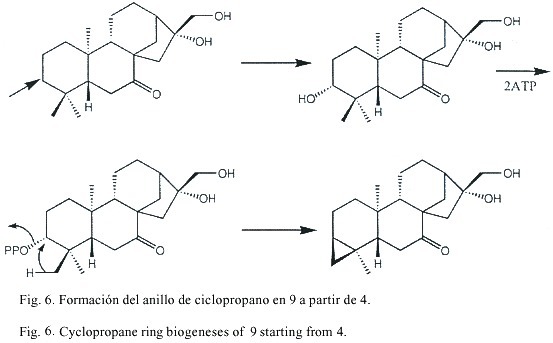
En los espectros de 1H-NMR de 8 y 9 se observa la presencia de un ciclopropano (indicado por las señales a campo alto). Como la señal de un metilo desapareció con respecto a los compuestos anteriores, se supuso la participación de un metilo en la formación del ciclopropano. Esto fue confirmado por los experimentos de desacoplamiento que llevan a la secuencia H-1 a H-3(H-18) en ambos compuestos. La parte residual del espectro del compuesto 9 es similar a la de la cetona 4. Se observan más diferencias en los espectros de 8. La señal de la cetona en el espectro 13C-NMR del compuesto 9 no se encuentra presente en 8, en su lugar, se observa la presencia de dos alcoholes secundarios (d 74.3 d y 76.7 d). La
posición axial de H-7 y H-11 se deduce por las constantes de acoplamiento observadas para las señales a ä 4.48 y 3.54 en el espectro 1H-NMR.
El espectro de 13C-NMR de 10 muestra las señales de un doble enlace tetrasustituido. En el espectro 1H-NMR se pueden observar las señales de dos metilos alílicos formando singuletes anchos y acoplando con las señales de H-2 y H-5. De esta manera, la estructura 10 o un isómero con un anillo de ciclopentano con un sustituyente isopropilideno en C-3 pueden ser consideradas. Las correlaciones a larga distancia observadas para H-18 y H-19 con C-3 y C-5, respectivamente, corroboran la estructura propuesta para este compuesto.
La estructura de 11 fue fácilmente deducida por comparación con los espectros del compuesto 10. Las señales a campo alto de H-5 y H-6 no fueron detectadas, en su lugar fue observada una señal olefínica (H-6) en el espectro 1H-NMR y dos carbonos olefínicos en el espectro 13C-NMR. Además, la estructura planteada concuerda con las correlaciones observadas en el espectro HMBC.
Los datos espectrales de los compuestos 12 y 13 son muy similares a los del compuesto 11 (indicando además, que los experimentos de desacoplamiento homo- y heteronuclear señalan que 12 y 13 son estereoisómeros). Sin embargo, los cambios químicos observados para C-3 y C-4 en el espectro 13C-NMR son típicos de un epóxido. El corrimiento a 5 ppm a campo alto de C-1 en el espectro de 12, indica una configuración b para el epóxido, a causa de la interacción entre H-1 b y el oxígeno del epóxido.
La estructura del compuesto 15 fue elucidada por comparación de los espectros de los compuestos anteriores y la presencia de dos señales de un exometileno y un metilo singulete a d 1.41 en el espectro 1H-NMR. La estructura isomérica con un intercambio de los grupos entre C-3 y C-4 fue excluida por una interacción dipolar observada entre el exometileno H-19 y H-5. En el caso del compuesto 14 el metilo singulete no se encuentra presente, en su lugar se pudo detectar la presencia de un metilo en doblete.
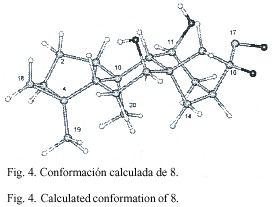
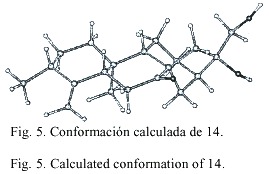
La estereoquímica de los kauranos 4-7 se dedujo principalmente de las constantes de acoplamiento, la de los compuestos 8 a 14 fue aclarada principalmente de los experimentos NOE. En el experimento NOE del compuesto 8 (Fig. 4) se observaron las siguientes interacciones dipolares: H-18 con H-5 (5%), entre H-19 con H-6 (6%), H-6 (5%), H-3 (5%) y H-18 (3%), entre H-20 con H-12 (15%), H-14 (8%), H-2 (3%) y H-6 (7%), entre H-7 con H-14 (4%) y H-15 (3%) y entre H-11 y H-1 (6%). Resultados similares fueron observados con el compuesto 9. En el caso de 14 la interacción dipolar observada entre H-3 y H-5 sugiere una estereoquímica ecuatorial para el grupo metilo en C-3 (Fig. 5).
La formación del anillo de ciclopropano en los compuestos 8 y 9 ocurre posiblemente con una oxidación y fosforilación de C-3 y una posterior ciclización con pérdida de fosfato, como se plantea en la Fig. 6. Así, los compuestos 8 y 9 se forman a partir de un progenitor con un pirofosfato en C-3. Este producto luego sufre un reordenamiento catalizado por ácido para obtener la raíces carbonadas de los compuestos 10-15.
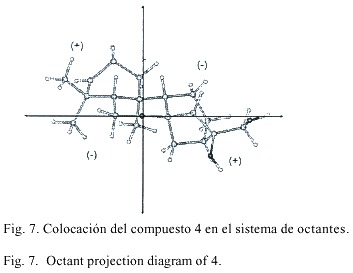
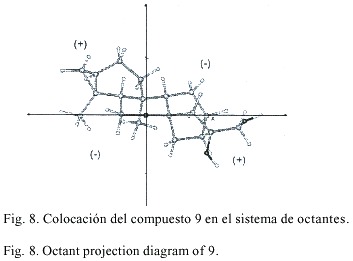
La estereoquímica absoluta de 4 fue determinada a partir del efecto Cotton donde se obtuvo una absorción dicroica diferencial, D e , de +1.41. El efecto Cotton positivo se puede comprobar al proyectar en el octante el cromóforo carbonilo de dicha molécula (Fig. 7). En el caso de 9 se siguió el mismo procedimiento y se obtuvo un D e de +2.31. La Fig. 8 presenta el cromóforo colocado en los octantes como en el caso de 4.
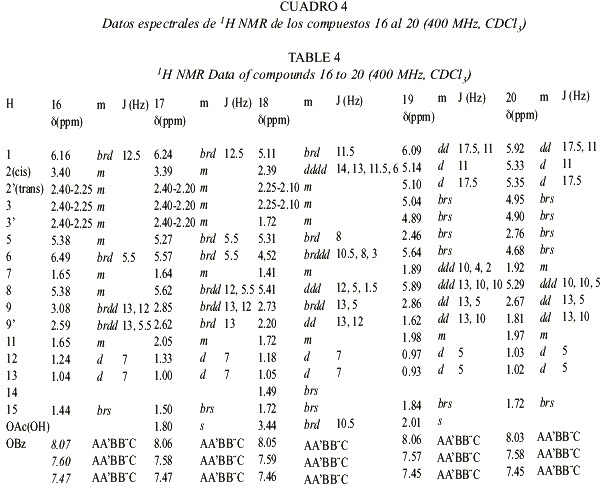
Además de los terpenos, se obtuvieron los sesquiterpenos 16 a 20, y el producto de una posible reacción de Diels-Alder 21.
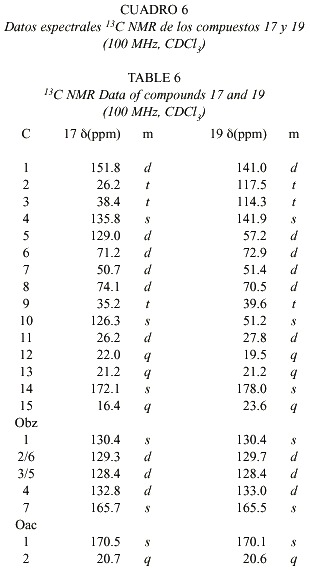
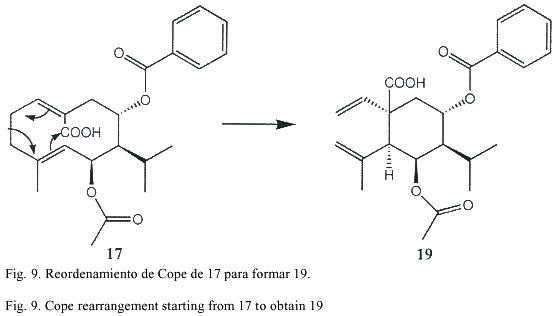
La estructura del compuesto 18 presenta espectros muy similares a los de 16. En 16 no se observa señal de H-14 y además H-1 presenta un desplazamiento a campo bajo, lo cual concuerda con la presencia de un grupo carboxilo en C-10. En los espectros 1H-NMR y 13C-NMR de 17 se observan las señales típicas de un acetato y un corrimiento químico a campo bajo de H-6, correspondiendo éste a la base del acetato. Las estructuras planteadas corresponden a los datos obtenidos de los experimentos de desacoplamiento en ID y 2D. Las señales típicas de un grupo vinilo y un propenilo en los espectros de 19, indican la presencia de la raíz carbonada de un elemano, el cual se forma posiblemente por un reordenamiento de Cope a partir de los germacradienos (Fig. 9).
La presencia de las señales del acetato y el benzoato en las posiciones señaladas (deducidas del espectro HMBC) corroboran la biogénesis planteada. Esta reacción fue verificada calentando 17 en benceno en un tubo de ensayo sellado por dos horas a 150° C siendo el producto principal idéntico al narural. La estrucrura de 20 pudo ser determinada utilizando técnicas de desacoplamiento horno- y heteronuclear.
La estructura del compuesto 21 fue elucidada después de hacerlo reaccionar con diazometano, lo cual permitió observar una estructura parcial muy similar a la de 17. Las señales de acetato y benzoato, así como el isopropil y el metilo olefínico comprueban la similitud planteada. La aparición del éster de metilo indica que uno de los grupos metilo fue oxidado a ácido carboxílico. El espectro 13CNMR muestra, además de las señales de los ésteres, 25 señales para la aglicona. Asumiendo a 17 o algún compuesto parecido (sesquiterpeno) como precursor de este compuesto, debe identificarse la unidad C-10 restante. En el espectro 1H-NMR se observan dos grupos metilo a 00.62 y 0.56. La mayoría de las señales a campo alto aparecen como multipletes superpuestos y la obvia presencia de confórmeros hizo difícil su elucidación estructural. Para el asignamiento de las señales se recurrió a los experimentos HMQC, HMBC y H,H-COSY. De este último se pudieron derivar las siguientes secuencias: (i) H-5(H-15)-H-7 (H-11(H-12)-H-13)-H-9 y (ii)H-1 - H-3 - H-2M(H-10M)H-4M-H-6M. El acoplamiento W entre H-6M y H-10M y entre H-9M y H-6M completó el anillo de ciclohexano. La formación de este compuesto inusual puede ser aclarado en términos de una reacción de Diels-Alder entre el compuesto 17 y una unidad de monoterpeno (Fig. 10). La estereoquímica fue deducida del espectro NOE.
Resumen
De las raices de Croton hirtus (Euphorbiaceae), recolectadas en Paraiso de Cartago (Costa Rica) se aislaron, a parte de unos pocos compuestos conocidos, 20 compuestos que no habían sido publicados antes, el bisnordolabradano 1, los dolabradanes 2 y 3, los kauranes 4-7, cyclopropakauranos 8 y 9, los hirtusanos 10-15, los ésteres de germacreno 16-18, los elemanos 19 y 20 y un compuesto C-25, 21, el cual es formado presumiblemente por una reacción de Diels-Alder entre el compuesto 18 y un monoterpeno. Todas las estructuras fueron elucidadas con la utilización de técnicas de RMN de una y dos dimensiones. Los patrones de fraccionamiento de los compuestos nuevos también se registran. Las separaciones fueron llevadas a cabo con técnicas cromatográficas modernas.
Referencias
Bondoni, A., M. Mendonio, R. Rondina & J. Coussiod. 1976. Survey of Argentine Medicinal Plants. Econ. Bol. 30: 161-185. [ Links ]
Cai, l., Z.P. Chen & J. Phillipson. 1993. Diterpenes from Croton Lechleri. Phytochemistry 32 (3): 755-760. [ Links ]
Hanson, J.R. 1995. Diterpenoids. Natur. Prod. Rep. 12: 245-271. [ Links ] Hecker, E. 1984. Co-carcinogenic diterpene esters as principal risk factors in locallife style esophageal cancer in Curaçao. Acta Pharm. Toxicol. 55: 148-153. [ Links ]
Hecker, F. & R. Schmidl. 1974. Phorbol esters, the irritant and co-carcinogens of Croton tiglium L. Fortsch. Chem. Organ. Natur. 31: 377. [ Links ]
Hischrmann, G .S. & A. Rojas. 1987. A survey of medicinal plants ofMinas Gerais, Brazil. J. Ethnopharm. 29 (2): 213-219. [ Links ]
Kumar, y, K. Haridasan & R. Rao. 1980. Ethnobotanical notes on certain medicinal plants among some garo people around Balphakram Sanctuary in Meghalaya. Bull. Bol. Surv. India 22: 161-165. [ Links ]
Merrit, A.T. & S.Y. Ley 1992. Clerodane Diterpenoids, Natur. Prod. Rep. 9: 243-287. [ Links ]
Murillo, R.M. & J. Jakupovic. 2000. Clerodanos y secoclerodanos de Croton jimenezii. Ing. Cien. Quím. 20: 68-73. [ Links ]
Murillo, R.M., J. Jakupovic, J. Rivera & Y.H. Castro. 2001. Diterpenes and other constituents from Croton draco. Rev. Biol. Trop. 49: 257-262. [ Links ]
Pieters, L., T. De Bruyne, G. Mei, G. Lemiere, D. Vanden Berghe & AJ. Vlietinck. 1992. In vitro and in vivo biological activity of South American Dragon's Blood and its constituents. Planta Med. 58 (Supl. 1): A582-A583. [ Links ]
Trease, G.E. & W.Ch. Evans. 1988. Tratado de Farmacognosia. 12ª Ed. Interamericana. México D.F. pp. 206. [ Links ]