Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.51 n.2 San José Jun. 2003
Abstract
The venoms of Latrodectus sp. have been reported to induce contraction probably mediated by adrenergic and cholinergic transmitters. We have demonstrated that the venom of Chilean Latrodectus mactans contains neurotoxins that induce a contraction partially independent of transmitters release. Transmembrane mobility of Na+ and Ca 2+ ions and more specifically, the increase of cytoplasmic calcium concentration are responsible for tonic contraction in smooth muscle. Calcium may enter the cell by several ways, such as the voltage-dependent Ca 2+ L-type channels and the Na+ /Ca2+ exchanger. This study aimed to examine the participation of this exchanger in the tonic contraction of smooth muscle in vas deferent of rat induced by the venom of the Chilean spider L. mactans. Blockers of Na+ channels (amiloride) and Ca2+ L-type channels (nifedipine), and a stimulator of the exchanger (modified Tyrode, Na+ 80 mM) were used. Simultaneously, variations of the cytoplasmic concentration of Ca2+ were registered by microfluorimetry (Fura-2 indicator) in the presence of nifedipine. In presence of amiloride, dose-dependent inhibition of venom-induced contraction was observed, suggesting the participation of voltage-dependent Ca2+ L-type channels. The contraction was only partially inhibited by nifedipine and the Ca2+ cytoplasmic concentration increased, as assessed by the microfluorimetric registration. Finally, the venom-induced contraction increased in the presence of modified Tyrode, probably due to the action of the Na+ /Ca2+ exchanger. Taken together, our results support the idea that the Na+ /Ca2+ exchanger is active and may be, at least in part, responsible for the contraction induced by the venom of Chilean L. mactans.
Key words: Latrodectus mactans, spider venom, smooth muscle, calcium channels, sodium /calcium exchanger.
La araña Latrodectus mactans de Chile (Zapfe 1959), perteneciente al género Latrodectus Walckenaer, 1805 mundialmente distribuido, conocida como "araña del trigo" o "viuda negra", habita en diversas regiones del país. Su mordedura a humanos genera un efecto sistémico conocido como "latrodectismo" o "aracnoidismo sistémico", causando en algunos casos la muerte en adultos o niños (Scherone et al. 1957, Scherone 1966).
En Chile, se ha demostrado que el veneno de la araña L. mactans chilena, recolectada en las regiones VIII y IX, induce un efecto tónico sostenido en tejido muscular cardíaco y liso (Romero et al. 2000). En el músculo liso, el mecanismo de la contracción se relaciona, entre otros, con la permeabilidad de los iones Na+ y Ca2+, que son moduladores de esta respuesta (Nouailhetas et al. 1985) con un componente rápido, fásico, y luego uno más lento y sostenido, tónico (Van Breemen et al. 1979, Bolton 1979, Aboulafia et al. 1987, Shimuta et al. 1990). Así mismo, siendo muy pequeños los depósitos intracelulares de Ca2+, la respuesta contráctil sería dependiente de su entrada desde el medio externo. Entre los mecanismos que intervienen en la regulación de la concentración de Ca2+ intracelular, los estudios de Sitrin y Bohr (1971) demostraron la importancia del intercambiador Na+ /Ca2+, postulado por Reuter y Seitz (1968). Nouailhetas et al. (1985) observaron que, al inicio de la fase tónica, el descenso de la concentración de Na+ externo produce la aparición temprana del efecto máximo tónico, el cual se explicaría por un aumento de la activación del intercambiador Na+ /Ca2+ inducida por el gradiente de concentración de sodio intra-extracelular. Recientes estudios acerca del intercambiador Na+ /Ca2+ han llevado a postular que este tipo de intercambiador posee una participación más relevante en la determinación de las concentraciones de Ca2+ intracelular que lo anteriormente propuesto (Iwamoto et al. 1992, Kim et al. 1999, Hisamitsu et al. 2001, Kraev et al. 2001, Schweda et al. 2001).
Por otra parte, diversos bloqueadores han sido utilizados en el estudio de estas corrientes iónicas. Entre ellos el amiloride, el cual ejerce una inhibición competitiva que afecta la respuesta contráctil de la arteria caudal de rata, causando un bloqueo de corrientes de Na+ de modo reversible en contracciones inducidas por receptores a-1-adrenoceptores (Sharma et al. 1988). El mismo bloqueador, en músculo liso de Taenia de cuy, induce relajación afectando la respuesta contráctil generada por aumento de concentración de K+ en el medio externo (45.4 mM) o por el agonista adrenérgico Carbacol (10 µM) (Ozaki et al. 1987). Amiloride afectaría además, en diverso grado, a intercambiadores como Na+ /H+ y Na+ /Ca2+ (Blaustein y Lederer 1999). Otro bloqueador utilizado es la nifedipina, reconocida por su efecto sobre canales lentos de Ca2+ en terminales nerviosas de músculo estriado (Nayler 1988). Sugiura y Ko (1997) demostraron que nifedipina es un potente inhibidor de la actividad de canales de calcio presinápticos en preparaciones mioneurales de rana, conejo y de diafragma de rata, entre otros. En músculo liso, la molécula bloquea la respuesta de excitación y contracción, por reducción de potencial en fibras musculares de pelvis renal de cuy (Takano et al. 2000), disminuyendo la concentración de Ca 2+ citoplasmática, como fuera demostrado por Hashitani et al. (2001) en músculo liso de vejiga del mismo animal.
Los estudios de contractilidad realizados por nuestro equipo en conducto deferente de rata, han demostrado que el efecto inducido por el veneno de la araña L. mactans chilena es parcialmente independiente de mediadores adrenérgicos y colinérgicos (Romero et al. 2000). Lo anterior, abre interrogantes acerca del mecanismo de acción de las toxinas sobre músculo liso, más aún, considerando que se han identificado receptores dependientes e independientes de calcio, para las neurotoxinas de la especie euroasiática de Latrodectus (especialmente estudiada ha sido la alfa-latrotoxina, -LTX) (Uschkaryov et al. 1992, Krasnoperov et al. 1996). El objetivo de este trabajo es analizar la posible participación del intercambiador Na+ /Ca2+ en la respuesta contráctil tónica inducida por veneno de L. mactans de Chile en la musculatura lisa de conducto deferente de rata, mediante el uso de bloqueadores de canales iónicos y la medición de la variación de calcio citoplasmático asociada al desarrollo de tensión.
Materiales y métodos
Captura de arañas: La captura de arañas hembras adultas de L. mactans de Chile se realizó en los meses de verano (diciembre 2000 y enero 2001) en zonas del Alto Bío Bío, en la VIII Región (72º16’51" W, 7º45’24" S), esencialmente de acuerdo con lo descrito por Romero et al. (2000). Los especímenes, en frascos individuales, fueron dejados en ayuno por 30 días, mantenidos con agua, para estimular la producción y concentración del veneno en las glándulas. Nuestro equipo ha recolectado arañas en la zona mencionada los tres últimos años, cuidando de no retirar ootecas.
Obtención de veneno: Las arañas fueron sumergidas en nitrógeno líquido y luego de 1 min trasladadas a una solución de tampón fosfato salino (PBS: NaH2 PO4 0,1 M, Na 2 HPO4 0,01 M, NaCl 1,35 M), pH 7.4, a 4 ºC. Se retiraron los quelíceros, seccionando la membrana que los adhiere a su base. Cada quelícero con su glándula de veneno, se depositó en un tubo con el tampón mencionado (25 pares de glándulas por 100 µl de PBS), siendo homogeneizados e inmediatamente centrifugados a 1 060 g por 15 min. El sobrenadante alicuotado, denominado veneno total (VT), se congeló de inmediato a -20ºC, hasta su utilización. Paramedir el contenido protéico de VT, se utilizó la técnica de Bradford (1976) con leves modificaciones (BioRad Protein Assay).
Registro de contracción isométrica de músculo liso: Los segmentos de tejido que se utilizaron en los ensayos experimentales se obtuvieron de ratas Wistar machos, de un peso aproximado de 250 g sacrificadas por decapitación, a las cuales se les removió rápidamente los conductos deferentes (fracción epididimal). Los segmentos (3 cm) fueron colocados en cámara de órgano aislado termorregulado de 6 ml en solución Tyrode a 30ºC, conteniendo (concentración en mM): NaCl 137, KCl 5.4, CaCl2 2.7, MgCl 2 0.5 NaHCO3 11.9, NaH2 PO4 0.45 y glucosa 5.55, a pH 7.4, oxigenando con una mezcla de 95% O2 y 5% CO2. Los registros de actividad contráctil se realizaron a través de un transductor de tensión UFI modelo 1040 y un fisiopolígrafo Gilson Modelo ICM-5. La preparación se instaló con una tensión de reposo basal de 1 g. Luego de un período de estabilización de 60 min, se realizó el registro en las diferentes condiciones experimentales.
Series experimentales: Para la determinación de la respuesta máxima contráctil (control) se usó BaCl2 0.01 M. Posteriormente, se lavó y estabilizó por 30 min en Tyrode. A continuación se registró la tensión inducida con dosis máxima de VT (84 µg/ml).
Las soluciones experimentales fueron utilizadas en las siguientes concentraciones finales: bloqueador de canal lento de Na+, amiloride (Sigma), 0.2, 0.02 y 0.002 µM; bloqueador de canal tipo L de Ca2+, nifedipina (Sigma), 0.5 µM; solución activadora del intercambiador Na+ /Ca2+, Tyrode conteniendo Na + 80 mM.
Los resultados fueron analizados estadísticamente (prueba t) con significancia p<0.05 y se graficaron con el software GraphPad Prim.3_V.3.02.
Registro simultáneo de la variación del calcio citoplasmático y tensión muscular: El registro de la variación de concentración de Ca2+ citoplasmático se realizó mediante el método de microfluorimetría, esencialmente de acuerdo con Ferreira et al. (2000). Utilizando Fura-2 1 µM como indicador, y bajo espectro de excitación alternada 340/380 nm, la fluorescencia (505 nm) se detectó en un espectrofluorómetro Fluoro-Max 2. Para el registro de tensión muscular se utilizó el sistema de microcámara con agitador descrito por los mismos autores.
Resultados
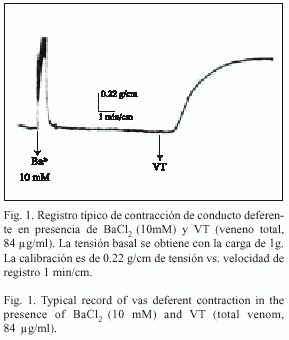
Respuestas contráctiles a VT y a Ba 2+: En condiciones de tensión basal producida por carga de 1 g en la preparación de conducto deferente de rata (n=9), BaCl2 (0.01 M) indujo una respuesta control de contracción bifásica, en tanto que VT (84 µg/ml) generó una respuesta tónica sostenida en presencia de la concentración máxima de veneno (Fig. 1), equivalente a la generada por BaCl2 .
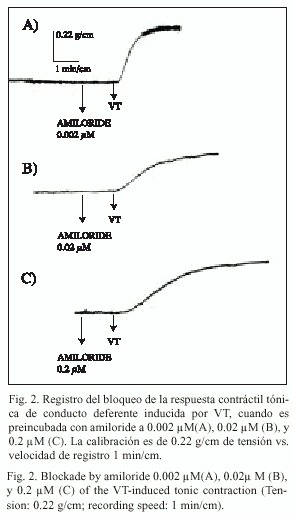
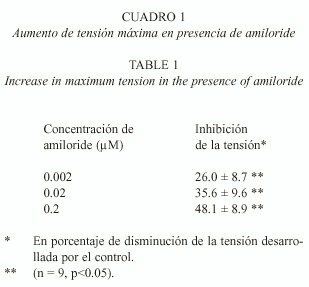
Inhibición de la respuesta a VT al preincubar con amiloride: La respuesta contráctil tónica máxima de conducto deferente de rata (n=9), inducida por VT, sufre diferentes porcentajes de inhibición cuando la preparación es preincubada con amiloride (0.002, 0.02, y 0.2 µM), que es el bloqueador del canal lento de Na+ . En el Cuadro 1 se observa que el porcentaje de bloqueo es dependiente de la concentración de amiloride (prueba t, p<0.05). En la Fig. 2 se muestran registros típicos, correspondientes a un mismo protocolo.
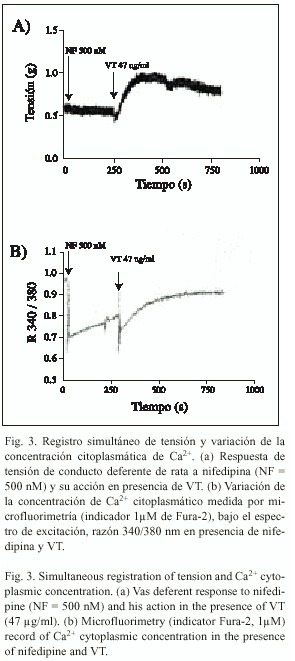
Respuesta a VT en presencia de nifepidina: La nifedipina (500 nM), bloqueador específico de canales de Ca2+ tipo L, no altera la respuesta contráctil tónica basal inducida por VT (47 µg/ml) (n=9). En la Fig. 3, se observa que el VT induce efecto de respuesta tónica aún en presencia del bloqueador.
Aumento de la concentración de Ca2+ citoplasmático en presencia de nifepidina: Los resultados de la determinación microfluorimétrica de Ca2+ en presencia de nifedipina y VT se observan en la Fig. 3b. El perfil de sensibilidad de calcio libre citoplasmático disminuye en presencia de nifedipina, y luego es incrementado al adicionar VT.
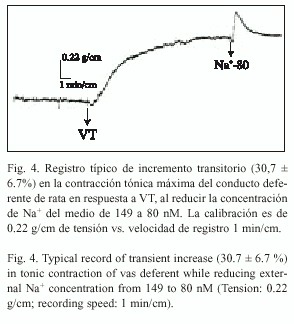
Aumento de la tensión en presencia de una disminución de [Na+] extracelular: La disminución de la concentración total de Na+ extracelular, de 149 a 80 mM, induce un aumento de la contracción tónica máxima desarrollada como respuesta a la aplicación de VT 84 µg/ml. En la Fig. 4 se observa un registro típico temporal de tensión transitorio. El incremento es de un 30.7 ± 6.7 % en la tensión (n=6), en relación con la respuesta control (prueba t, p<0.05) al adicionar VT 84 µg/ml.
Discusión
Confirmando hallazgos anteriores (Romero et al. 2000), observamos que las toxinas contenidas en el veneno de arañas L. mactans de Chile inducen una respuesta contráctil tónica sobre músculo liso de conducto deferente de rata. Los estudios de Grider et al. 1988 demostraron que la respuesta tónica en el músculo liso es dependiente de la entrada de Ca2+ a la célula, debido al tamaño reducido de los depósitos intracelulares del ion. Por su parte, Klöckner (1996) demostró, en células aisladas de arteria coronaria de cuy, que la respuesta a Ba 2+, al usar este ion el mismo canal que el Ca2+, puede ser usada como control de respuesta tónica máxima. Por lo anterior, la respuesta máxima observada en presencia de VT en el conducto deferente, podría estar relacionada con la movilización de calcio desde el medio extracelular, ya que es comparable en magnitud de tensión a la desarrollada cuando el tejido está en presencia sólo de bario (Fig. 1).
Por otra parte, la presencia de amiloride, el cual bloquea los canales de Na+ y también diversos intercambiadores, induce sobre el registro temporal de contracción del conducto deferente una reducción de la amplitud de tensión de modo dependiente de la concentración (Fig. 2), lo que confirma que al atenuar la excitabilidad se altera la conductancia iónica de Ca2+ y se reduce el tono muscular, como fuera demostrado por Pitt y Knox (1996) en fibras musculares lisas de tráquea humana. Nuestros resultados permiten sugerir que el bloqueo de la corriente de Na+ compromete la respuesta de excitabilidad de la fibras musculares lisas del conducto deferente, afectando el ingreso de Ca2+ a través de los canales voltaje dependientes tipo L. Sin embargo, parte del efecto observado podría deberse a que el sitio de intercambio Na+ /Ca2+ de las células musculares lisas del conducto deferente de rata, se viera afectado en su funcionamiento.
Dado que el resultado obtenido con amiloride permite postular que la contracción inducida por VT es, en gran parte, dependiente de Ca2+ externo ligado a corriente de canales de Ca2+ tipo L, se usó nifedipina (bloqueador de este tipo de canales), para realizar un registro simultáneo de variación de Ca2+ citoplasmático, obtenido por microfluorimetría, y de contracción isométrica. De modo paradójico, observamos que VT, aún en presencia de nifedipina, produce aumento de la tensión isométrica y aumento de la concentración de Ca2+ en el citoplasma (Fig. 3). Es necesario comentar que, antes de la aplicación de VT, durante el bloqueo con nifedipina, existe un paulatino aumento de la concentración de Ca 2+ citoplasmático que no alcanza a generar tensión (Fig. 3b), el cual probablemente se debe a ingreso por difusión. Estos resultados implican que el aumento de [Ca2+] citoplasmático producto de la acción de VT está dependiendo de mecanismos distintos al del ingreso vía canales tipo L, entre los cuales podría estar el intercambiador Na+ /Ca 2+.
Por otra parte, Nouailhetas et al. (1985), en íleon de cuy, demostraron que el intercambiador Na+ /Ca2+ es sensible a una reducción de la concentración de Na + extracelular, activándose e induciendo una respuesta tónica sostenida. También Pitt y Knox (1996) relacionaron la activación del intercambiador Na+ /Ca2+ con el desarrollo de tono muscular liso. Para verificar si el intercambiador Na+ /Ca2+ opera correctamente durante la inducción de contracción por VT, redujimos la concentración del Na+ extracelular. Los resultados (Fig. 4) muestran que se desarrolla una tensión adicional transitoria (30.7 ± 6.7%) debida al estímulo del intercambiador, el cual, por lo tanto, no estaría siendo afectado por VT.
Estas evidencias, en conjunto, permiten postular que, entre otros posibles mecanismos de acción del veneno que contribuyan a elevar la concentración de Ca2+ intracelular, el intercambiador Na+ /Ca2+ puede tener una participación activa en la tensión tónica máxima observada en las fibras longitudinales del conducto deferente de rata en presencia de veneno de la araña L. mactans de Chile.
Agradecimientos
Agradecemos a María Etsuko y Alice Ferreira su colaboración en la determinación de la concentración de Ca2+ citoplasmático; a Dolly Standen la lectura crítica del presente manuscrito y sus valiosos comentarios. Agradecemos también el financiamiento de este trabajo por el Proyecto DIUFRO 2006 y Proyecto FONDECYT 1010729.
Resumen
El veneno de arañas del género Latrodectus induce contracción de músculo liso de mamíferos, postulándose como posible mecanismo la liberación de mediadores adrenérgicos y colinérgicos. El veneno de Latrodectus mactans de Chile contiene neurotoxinas que inducen actividad contráctil en músculo liso en forma parcialmente independiente de actividades adrenérgicas y colinérgicas, lo que deja abiertas interrogantes sobre el mecanismo de acción del veneno. La respuesta tónica en músculo liso depende de la movilidad de los iones sodio (Na+ )y calcio (Ca 2+) y, más es-pecíficamente, de la concentración de Ca2+ citoplasmático. Una de las vías de ingreso del calcio al músculo liso, además de los canales tipo L de Ca2+ , es el intercambiador Na+ /Ca2+ . En el presente trabajo se estudia la posible participación de este intercambiador en la respuesta tónica inducida por el veneno sobre músculo liso del conducto deferente de rata, en un modelo de órgano aislado. Utilizando bloqueadores de canales de Na+ (amiloride) y Ca 2+ (nifedipina) y una solución estimuladora del intercambiador (Tyrode pobre en sodio), se realizaron registros de tensión isométrica inducida por el veneno. Simultáneamente al uso de nifedipina, se registraron las variaciones de la [Ca2+] citoplasmática mediante microfluorimetría. Se observó que la inhibición de la contracción en presencia de amiloride depende de su concentración, mostrando una participación de los canales de Ca2+ dependientes de voltaje en la contracción. En presencia de nifedipina, la contracción inducida por el veneno sólo fue parcialmente inhibida, y la microfluorimetría mostró un aumento de la concentración de Ca2+ citoplasmático en presencia del bloqueador, lo que indica una participación de otros mecanismos para el ingreso de Ca2+ a la célula. Por último, al disminuir la concentración de Na+ extracelular se estimuló la contracción tónica en un 30.7%, atribuible, al menos en parte, al intercambiador Na +/Ca2+ . Estos resultados permiten proponer que el intercambiador Na+/Ca2+ se encuentra activo durante la contracción tónica inducida por el veneno de L. mactans de Chile y podría ser uno de los responsables del desarrollo de tensión.
Referencias
Aboulafia J., H. Capocci, T.B. Paiva & A.C.M. Paiva. 1987. Sodium-dependence of the nonspecific desensitization of the guinea-pig ileum induced by acetylcholine and histamine. Br. J. Pharmacol. 90: 347-353. [ Links ]
Bezanilla, F. & E. Stefani. 1994. Voltage-dependent gating of ionic channels. Ann. Rev. Biophys. Biomol. Struct. 23: 819-846. [ Links ]
Blaustein, M.P. & W.J. Lederer. 1999. Sodium/calcium exchange: Its physiological implications. Phys. Rev. 79: 763-854. [ Links ]
Bolton, T.B. 1979. Mechanism of action of transmitters and other substances on smooth muscle. Physiol. Rev. 59: 606. [ Links ]
Bradford, M. 1976. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72: 248-254. [ Links ]
Brading, A., E. Bülbring & T. Tomita. 1969. The effect of sodium and calcium on the action potential of the smooth muscle of the guinea-pig taenia coli. J. Physiol. 200: 637-654. [ Links ]
Bülbring, E. & H. Kuriyama. 1963. Effect of changes in the external sodium and calcium concentrations on spontaneous electrical activity in smooth muscle of the guineapig taenia coli. J. Physiol. 166: 29-58. [ Links ]
Ferreira, A.T., R. Neri, M.E.M. Oshiro & H. Kanaide. 2000. Simultaneous registration of contraction and cytosolic calcium ([Ca2+] i ) of smooth muscle strips using front-surface fluorimetry. J. Fluoresc. 10: 223-228. [ Links ]
Grider, J.R. & G.M. Makhoulf. 1988. Contraction mediated by Ca2+ release in circular and Ca2+ influx in longitudinal intestinal muscle cells. J. Pharmacol. Exp. Ther. 244: 432-437. [ Links ]
Hashitani, H., H. Fukuta, H. Takano, M.F. Klemm & H. Suzuki. 2001. Origin and propagation of spontaneous excitation in smooth muscle of the guinea-pig urinary bladder. J. Physiol. 530: 273-286. [ Links ]
Hisamitsu, T., H. Ohata, T. Kawanishi, T. Iwamoto, M. Shihgehawa, H. Amano, S. Yamada & K. Momose. 2001. A mechanism of Ca2+ release from Ca2+ stores coupling to the Na+/Ca2+ exchanger in cultured smooth muscle. Life Sci. 69: 2775-2787. [ Links ]
Holman, M.E. 1958. Membrane potentials recorded with high resistance micro-electrodes; and the effects of changes in ionic enviroment on the electrical and mechanical activity of the smooth muscle of the taenia coli of the guinea-pig. J. Physiol., London 141: 464-488. [ Links ]
Huddart, H. 1981. Calcium regulation in ileal smooth muscle-I. Sodium-calcium counter exchange. Gen. Pharmac. 12: 155-160. [ Links ]
Iwamoto, T., K. Harada, F. Nakajima & T. Sukamoto. 1992. Effects of ouabain on muscle tension and intracellular Ca2+ level in guinea-pig aorta. Eur. J. Pharmacol. 224: 71-76. [ Links ]
Kim, J.K., S.J. Kim, Y.C. Kim, I. So & K.W. Kim. 1999. Influence of extracellular Na+ removal on cytosolic Ca2+ concentration in smooth muscle cells of rabbit cerebral artery. J. Smooth Muscle Res. 35: 135-145. [ Links ]
Klöckner, U. 1996. Voltage-dependent L-type calcium channels in smooth muscle cells, pp. 1-12. In T.B. Bolton y T. Tomita (eds.). Smooth Muscle Excitation. Academic, Londres. [ Links ]
Kraev, A., B.D. Quednau, S. Leach, X.F. Li, R. Winkfein, M. Perizzolo, X. Cai, R. Yang, K.D. Philipson & J. Lytton. 2001. Molecular cloning of a third member of the potassium-dependent sodium-calcium exchanger gene family, NCKX3. J. Biol. Chem. 276: 23171-23172. [ Links ]
Krasnoperov V.G., R. Beavis, O.G. Chepumy, A.R. Little, A.N. Plotnikov & A.G. Petrenko. 1996. The calcium-independent receptor of alphalatrotoxin is not a neurexin. Biochem. Biophys. Res. Commun 227: 868-875. [ Links ]
Nayler, W.G. 1988. Calcium Antagonists. Academic, Londres, 347 p. [ Links ]
Nouailhetas, V.L.A., S.I. Shimuta, A.C.M. Paiva & T.B. Paiva. 1985. Calcium and sodium dependence of the biphasic response of the Guinea-pig ileum to agonists. European J. Pharmacol. 116: 41-47. [ Links ]
Ozaki H., T. Kojima, T. Moriyama, H. Karaki, N. Urakawua, K. Kohama & Y. Nonomura. 1987. Inhibition by amiloride of contractile elements in smooth muscle of guinea-pig taenia cecum and chicken gizzard. J. Pharmacol. Exp. Ther. 243: 370-377. [ Links ]
Pitt, A. & A. Knox . 1996. Molecular characterization of the human airway smooth muscle Na+/Ca2+ exchanger. Am. J. Respir. Cell. Mol. Biol. 15: 726-730. [ Links ]
Reuter, H. & N. Seitz. 1968. The dependence of calcium efflux for cardiac muscle on temperature and external ion composition. J. Physiol., London 195: 451-470. [ Links ]
Romero, F., E. Altieri, C. Quiñehual & A. Cayuqueo. 2000. Actividad contráctil de músculo papilar cardíaco y conducto deferente de rata inducido por veneno de la araña Lactrodectus mactans de Chile. Gayana 64: 161-170. [ Links ]
Scherone, H. 1966. Latrodectismo y loxoscelismo en Chile, incidencia, características clínicas, pronóstico, tratamientos y prevención. Mem. Inst. Butanta. 33: 207-212. [ Links ]
Scherone, H., G. Niedmann, L. Bahamonde & J. Bonnefoy. 1957. Algunas alteraciones cardiovasculares observadas en el latrodectismo. Bol. Chile. Parasit. 12:29-35. [ Links ]
Schweda, F., H. Seebauer, B.K. Krämer & A. Kurtz. 2001. Functional role of sodium-calcium exchange in the regulation of renalvascular resistance. Am. J. Physiol. Renal Physiol. 280: F155-161. [ Links ]
Sharma R.V., L.M. Bendhack & R.C. Bhalla. 1988. Mechanism of inhibition of rat caudal artery contraction by amiloride. J. Cardiovasc. Pharmacol. 12: 152-159. [ Links ]
Shimuta S.I., C.A. Kanashiro, M.E.M. Oshiro, T.B. Paiva & A.C.M. Paiva. 1990. Angiotensin II desensitisation and Ca++ and Na+ fluxes in cultured intestinal smooth muscle cells. J. Pharmacol. Exp. Ther. 253:1215-1221. [ Links ]
Sitrin, M.D. & D.F. Bohr. 1971. Ca and Na interaction in vascular smooth muscle contraction. Am. J. Physiol. 220: 1124-1128. [ Links ]
Siugura, Y. & C-P. Ko. 1997. Novel modulatory effect of L-type calcium channels at newly formed neuromuscular junctions. J. Neurosci. 17: 1101-1111. [ Links ]
Sommerville, L.E., & D.J. Hartshorne. 1986. Intracellular calcium and smooth muscle contraction. Cell Calcium 7: 353-364. [ Links ]
Takano, H., Y. Nakahira & H. Suzuki. 2000. Properties of spontaneous electrical activity in smooth muscle of the guinea-pig renal pelvis. Jpn. J. Physiol. 50: 597-603. [ Links ]
Uschkaryov Y.A., Petrenko A.G., Geppeert M. & T.C. Sudhof. 1992. Neurexins: synapsis cell surface proteins related to the alpha-latrotoxin receptor and laminin. Science 257: 500. [ Links ]
Van Breemen, C., S. Aaronson & R. Loutzenhiser. 1979. Sodium-calcium interaction in mammalian smooth muscle. European J. Pharmacol. 30: 167. [ Links ]
Zapfe, H. 1959. Clave para determinar familias y géneros de arañas chilenas. Inv. Zool. Chilena 5: 133-140. [ Links ]
1 Depto. de Ciencias Preclínicas, Facultad de Medicina, Universidad de La Frontera. Casilla 54-D, Temuco, Chile.
fromero@ufro.cl