Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.50 n.3-4 San José Dec. 2002
Abstract
The symptoms of Anopheles aquasalis larvae naturally infected by a microsporidium, and the ultrastructure of the infecting spores is describes. The larvae were maintained under laboratory conditions in salt concentrations of 10 g/l and 20 g/l of water. Daily recordings of the mortality of the larvae were made and the dates of change of instar were noted. Infected larvas were processed for transmission electronic microscopy using conventional methods at pH 7.2 and 260 mOsm/l. The infection by the microsporidia was positively correlated with an increase in the mean duration of the fourth instar of 2.88 to 6.33 days in 10 g/l of salt and of 2.47 to 6.14 days in 20 g/l of salt. Larval mortality also increased by approximately 50% during this instar in both salt concentrations. Development time and survival were not affected during the other immature stages. The mature spores found in the intestines of infected larvae were barrel shaped and measured approximately 2.6 x 2.4 mm. The exospore has a collar shaped prolongation at the posterior end of the spore. The spores are uninuclear with a posterior vacuole. The polar filament is anisofilar with nine rings, five with a diameter of 58 nm each and four with a diameter of 23 nm each. The polarplast is lamellate, and more tightly packed in the apical region. The reduction of the survival of A. aquasalis larvae infected with the microsporidia, and the increase in the development time suggest that this parasite might have a potential as a biological control of this pest. The microsporidium describes here has similar characteristics to that of the genus Parathelohania. I suggest that the rnicrosporidium found in A. aquasalis represents a new species and I propose the name Parathelohania aquasalensis. This is the first report of a microsporidium from a dipteran in Venezuela.
Key words
Anopheles aquasalis, larvae, microsporidia, Parathelohania, parasite.
Anopheles (Nyssorhynchus) aquasalis Curry 1932 ha sido reconocido como un importante vector de malaria en toda la costa Noroeste y Noreste de Sur América; desde Panamá hasta Ecuador en el Pacífico (Moreno y Berti 1997 ), y desde Guatemala hasta el sur de Brasil. incluyendo las Antillas Menores y Trinidad y Tobago en el Atlántico (Faran 1980 , Flemming 1986 ). En Venezuela. A. aqliastilis presenta una distribución en los estados Anzoátegui, Aragua, Carabobo, Delta Amacuro, Dtto. Federal, Falcón, Miranda, Monagas, Sucre, Trujillo, Yaracuy y Zulia ( Sutil 1980 ); sin embargo, es en el estado de Sucre donde tiene mayor importancia como vector de la malaria.
Los estadíos inmaduros de A. aquasalis se encuentran en diversos hábitats acuáticos, tales como lagunas, caños, pantanos, manglares, potreros inundados, los cuales muestran variaciones en la salinidad entre 0.4 y 38.4 g/l ( Berti et al. 1993 ). Estudios realizados en el laboratorio han revelado que el desarrollo de los estadíos inmaduros es más rápido, y la sobrevivencia de los mismos es mayor en concentraciones de salinidad de entre 10 y 20 g/l (Gómez y Osborn 2002 ).
El ente encargado para el control de A. aquasalis en el estado Sucre es el Servicio de Endemias Rurales de Malariología. Éste emplea un manejo integrado del vector, utilizando la bacteria Bacillus thuringiensis como medida de control biológico del estado larval y compuestos organofosforados y piretroides como medida de control químico de los adultos. Sin embargo, el uso de los insecticidas en algunas regiones de Sucre, ha provocado el desarrollo de resistencia a insecticidas piretroides en poblaciones de A. aquasalis (Molina et al. 1997 ). Este tipo de problemas puede causar resistencia cruzada con organofosforados (Bisset et al. 1997 ). Es de hacer notar que, en años recientes, aún con el uso de insecticidas biológicos y químicos para el control de las poblaciones del vector, los casos anuales de malaria en el estado Sucre han oscilado entre 9 000 y 15 500 (Anónimo 2003 ). Por lo tanto, es importante investigar otras alternativas de control, como por ejemplo, depredadores y parásitos que actúen como enemigos naturales de A. aquasalis.
Los microsporidios son protozoarios parásitos que atacan diferentes grupos de insectos, además de otras especies de invertebrados y vertebrados. El primer caso de un microsporidio parasítico reportado fue Nosema bombycis, aislado de larvas de Bombyx mori, el gusano de seda (Nägeli 1857 ). Balbiani (1882) sugirió el nombre "microsporidies" para ubicar a N. bombycis, el único microsporidio conocido para la época. En 1977, Sprague creó el phylum Microspora. Actualmente existen 42 géneros de microsporidios los cuales utilizan a miembros del orden Diptera como hospederos (Undeen y Vávra 1997 , Becnel y Andreadis 1999 ), de los cuales por lo menos 17 son parásitos en especies de la familia Culicidae (Undeen y Vávra 1997 ), y cinco géneros; Parathelohania (Hesse 1904 ), Nosema (Alger y Undeen 1970 ), Amblyospora (Hazard y Oldacre 1975 ), Issia, (Issi y Pankova 1983 ), Duboscquia (Sweeney et al. 1993 ) han sido reportados como parásitos de especies del género Anopheles. Aunque el empleo de los microsporidios como controladores biológicos no ha sido explorado extensivamente, Edhazardia aedis, ha sido investigado como un controlador biológico potencial de larvas de Aedes aegypti, vector de varias enfermedades tropicales, incluyendo el dengue y la fiebre amarilla (Becnel y Undeen 1992 , Nasci et al. 1992 ). En este trabajo se describen los síntomas de larvas de A. aquasalis naturalmente infectadas con un microsporidio parasítico, y se describe la ultraestructura de las esporas del mismo. Este es el primer reporte de un microsporidio parásito de un díptero en Venezuela y el primer reporte de un microsporidio en larvas de A. aquasalis.
Material y métodos
Cría de larvas: Hembras adultas de A. aquasalis, fueron recolectadas usando un succionador en los marcos metálicos de un potrero cerca de la población Muelle de Cariaco, Edo. Sucre (10º 20' N y 63º 34' 02" O). Inmediatamente fueron transferidos a envases de cartón parafinado, para el traslado al Instituto de Investigaciones en Biomedicina y Ciencias Aplicadas de la Universidad de Oriente, Cumaná.
Una vez en el laboratorio, las hembras fueron colocadas por separado en vasos plásticos de 60 ml, con el fondo relleno de algodón húmedo y cubierto con tres círculos de papel absorbente. Las hembras fueron mantenidas en condiciones ambientales de 28.5 + 1.5 ºC, 80.0 + 10.0% de humedad y 12:12 horas de fotoperíodo normal.
Las posturas obtenidas de hembras de A. aquasalis fueron colocadas en bandejas plásticas de 30 x 22 x 7 cm. Las larvas recién eclosionadas (entre seis y ocho horas de edad) se distribuyeron en dos grupos de 50 larvas por bandeja, en 200 ml de agua potable, con concentraciones de salinidad de 10 y 20 g/l respectivamente, para obtener una densidad larval de aproximadamente 0.15 larvas por cm2 (Delgado 1998, Gómez y Osborn 2002). La temperatura ambiental se mantuvo entre 31 + 2 ºC, y una humedad de 70.0 + 5.0%. A las larvas se les suministró una dieta diaria que consistió en una mezcla pulverizada de 55% Ictiosan® (alimento para peces), 15% de levadura deshidratada, 15% de hígado de res deshidratado, 7.5% de espinacas deshidratadas y 7.5% de hojuelas de avena Quaker ®. Esta mezcla fue añadida a las bandejas con las larvas una vez por día, hasta el segundo estadío (0.1 mg/larva) y dos veces al día, a partir del tercer estadío (0.4 mg/larva) (Delgado 1998 ).
Se revisaron las bandejas diariamente a la misma hora y se registró la fecha de cambio de estadío y la mortalidad. Es necesario enfatizar que estas larvas de A. aquasalis no fueron infectadas experimentalmente, simplemente se observó que la progenie de las hembras adultas colectadas, exhibió una sintomatología característica de infección por microsporidios, es decir, las larvas en el cuarto estadío tomaron una coloración blanca, opaca, lechosa, no mudaron al estado de pupa y eventualmente murieron.
Construcción de los cuadros horizontales de vida: A partir del número diario de larvas vivas (Nx ), se construyeron los cuadros horizontales de vida por día y por edad, y las curvas de supervivencia por día, según los métodos de Rabinovich (1980) y Service (1993) , para la fase inmadura de A. aquasalis infectada con los microsporidios. Estos fueron comparados con cuadros horizontales de vida de larvas sanas a la misma temperatura y las mismas concentraciones de salinidad.
La duración promedio de cada uno de los estadíos se calculó a través de la siguiente fórmula (Reisen y Siddiqui 1979 ):
Duración Promedio Estadío =
[ (larvas * dían )1 / Total larvas estadío
n = 1 es el día en que se observan por primera vez larvas del estadío en cuestión.
No se realizaron análisis estadísticos debido a que los datos del desarrollo de las larvas infectadas fueron obtenidos a partir de una sola réplica. (Los datos del desarrollo de las larvas sanas fueron obtenidos a partir de dos réplicas).
Procesamiento de las muestras para MET: Algunas larvas naturalmente infectadas, se prepararon para microscopía electrónica de transmisión (MET). Para ello, se cortó el abdómen de las larvas en trozos de 1 mm3 y se sumergieron inmediatamente en pre-fijador fresco (gluteraldehído al 2.5% y paraformaldehído al 1%) en solución buffer fosfato pH 7.2 y 260 mOsm/L. Después de tres lavados con solución buffer fosfato pH 7.2, se postfijaron los cortes en una solución de tetróxido de osmio (OSO 4) al 1% en solución buffer fosfato durante 90 minutos, y luego los tejidos se lavaron tres veces en buffer fosfato. Luego se deshidrataron en una serie creciente de etanol ( Stobbart y Shaw 1964 , Crossley y Waterhouse 1969 , Lu y Chow 1991 ). Después de la deshidratación, las muestras fueron infiltradas con óxido de propileno, para luego ser incluidas en resina epóxica Polybed 812, y polimerizadas a 60 ºC por 48 horas. Se realizaron cortes ultra finos, de 60-70 nm, con un ultra micrótomo Reichart-Jung, y se tiñeron con acetato de uranilo al 6% por cinco minutos y citrato de plomo por tres minutos. Las observaciones se hicieron en un microscopio electrónico de transmisión, Hitachi H-600.
Resultados
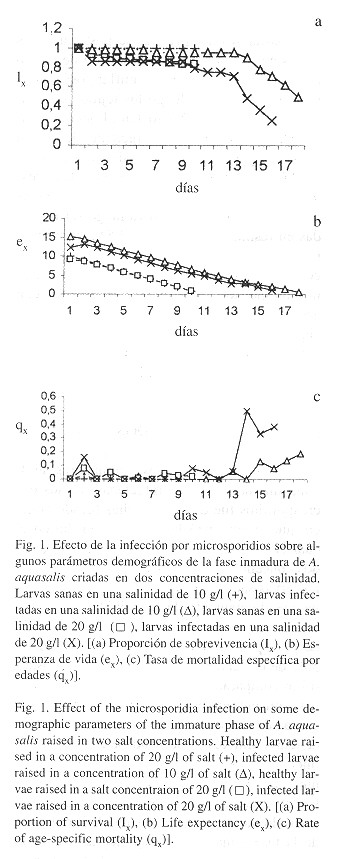
La duración de las fases inmaduras de A. aquasalis naturalmente infectadas con los microsporidios fue de 16 y 18 días (desde el día en que se comenzó la cría hasta el día en el cual emergió la última pupa en adulto) a las dos concentraciones utilizadas, a diferencia de las larvas sanas cuya duración fue de diez días independientemente de la salinidad (Fig. 1a ). En esta misma figura se observa una reducción de la supervivencia aproximadamente en un 50% de las larvas infectadas con los microsporidios comparado con las larvas sanas para ambas concentraciones de salinidad. Todas las curvas de la esperanza de vida mostraron tendencias similares, observándose una reducción lineal y constante en la e.. Sin embargo, hubo una esperanza de vida aparentemente mayor en las larvas infectadas, comparada con las larvas sanas, lo que se debe al aumento de la duración de la fase inmadura de estas larvas y no a la proporción de la supervivencia de las mismas (Fig. 1b ). La probabilidad de morir entre la edad x y x + 1 (qx) ( Fig. 1c ) fue similar en las larvas sanas y las infectadas hasta el día 13, cuando aumentó la mortalidad de las larvas infectadas mientras que las larvas sanas ya habían pasado a la fase adulto.
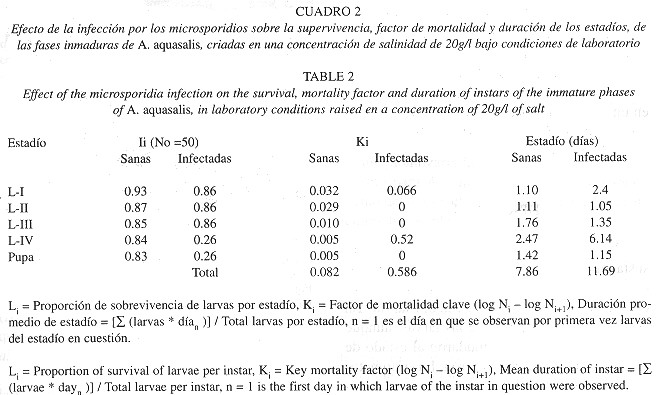
La infección de las larvas con los microsporidios produjo un incremento en la mortalidad de las mismas en el cuarto estadío para ambas concentraciones de salinidad, y el factor de mortalidad clave fue sustancialmente mayor en este estadío ( Cuadros 1 y 2 ). El tiempo total de desarrollo desde el primer estadío hasta la emergencia de los adultos se calculó a partir de la sumatoria de la duración promedio de los estadíos larvales. En las larvas infectadas, el número de días de desarrollo total aumentó de 7.7 a 13.33 días para la concentración de salinidad de 10 g/l ( Cuadro 1 ) y de 7.86 a 11.69 días para la de 20 g/l (Cuadro 2 ). Esto se debe principalmente a que la duración del 4to estadío larval fue de 2.2 a 2.5 veces mayor en las larvas infectadas que en las larvas sanas.

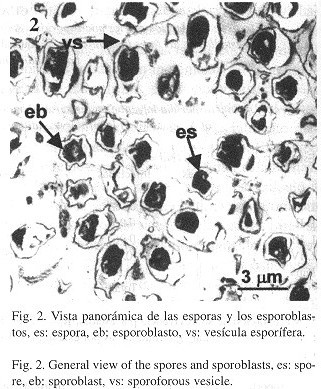
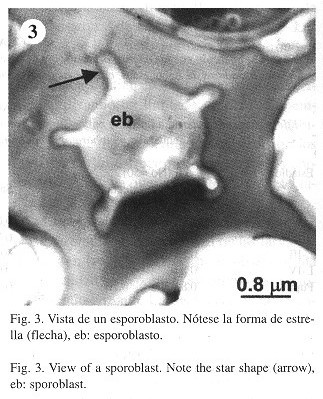
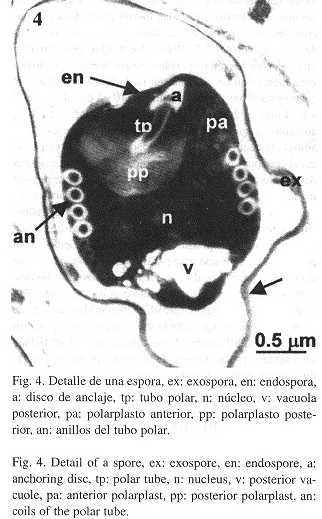
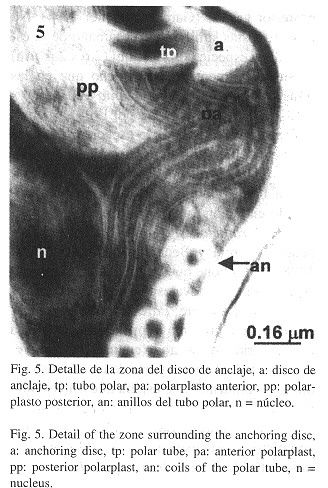
Las esporas y esporoblastos de los microsporidios en el tejido abdominal de las larvas se ilustran en las Figs. 2-5 . Se pudo observar una alta densidad de esporas y esporoblastos en todo el tejido cortado. Las esporas estaban organizadas en grupos de cuatro a seis, con cada grupo rodeado por una vesícula esporífera ( Fig. 2 ). Durante el proceso de esporogenia se observó que la exoespora tenía una forma de estrella con cinco puntas (Fig. 3 ). Las esporas maduras presentaron una exoespora de forma irregular, con una prolongación en forma de collar en la parte posterior de la espora. Las endoesporas fueron pentagonales y las esporas tenían un sólo núcleo. La zona de anclaje y el filamento polar se pudo observar claramente. Los nueve anillos del tubo polar se presentaron en forma alineada, son anisofilares, cinco con un diámetro de 58 nm cada uno, y cuatro con un diámetro de 23 nm cada uno (Fig. 4 ). El polarplasto posterior se distribuyó en forma lamelar, con el polarplasto posterior más denso que el polarplasto anterior ( Figs. 4 y 5 ). En la Fig. 5 se observa el polarplasto anterior claramente, con gránulos entre los filamentos.
Descripción de la especie
Parathelohania aquasalensis n. sp. Hospedero tipo. Anopheles (Nyssorhynchus) aquasalis Curry 1932
Espora. Espora en forma de barril, 2.6 x 2.4 m. Espora uninuclear con una vacuola posterior grande. Exoespora con una prolongación en forma de collar en la parte posterior de la espora. Polarplasto organizado en forma lamelar, con los lamelos más densos en la región apical. Filamento polar anisofilar con nueve anillos, de los cuales cinco anillos son anchos proximales y cuatro angostos distases, organizados en una sola línea.
Localidad tipo. La infección fue detectada en la progenie de hembras adultas colectadas en un potrero de vacas cerca de Muelle de Cariaco, Estado Sucre, Venezuela (10º 20' N y 63º 34'02" O).
Discusión
La infección por microsporidios afectó sustancialmente el desarrollo de la fase inmadura de A. aquasalis, y su sobrevivencia, especialmente durante el cuarto estadío larval. En este estadío se observó que las larvas, aunque siguieron comiendo, no mudaron al estado de pupa y eventualmente murieron. La sintomatología descrita aquí es similar a la reportada pa Amblyospora connecticus, que normalmenmata a su hospedero, Aedes cantator en el arto estadío, liberando las esporas al agua ( Becnel y Andreadis 1999 ).
Debido a las buenas condiciones de cría de las larvas, es muy probable que la infección fuese causada por transmisión transovarial. Sin embargo, el alto porcentaje de mortalidad en el cuarto estadío de las larvas sugiere que la transmisión horizontal de los microsporidios también ocurre. La combinación de transmisión ovarial y horizontal ha sido reportado para otras especies de microsporidios, por ejemplo, especies del género Amblyospora que infecta un amplio rango de especies de culícidos ( Becnel y Andreadis 1999 ) y Edhazardia aedis que parasita larvas de Aedes aegypti ( Becnel et al. 1989 , Johnson et al. 1997 ).
La reducción en la supervivencia de las larvas de A. aquasalis infectadas con los microsporidios, y el alargamiento del período de desarrollo sugiere que este parásito podría tener un uso potencial como controlador biológico de A. aquasalis. Una de las ventajas de los microsporidios del género Parathelohania es que se caracterizan por ser específicos al hospedero (García y Becnel 1994 , Baker et al. 1998 ), lo que garantizaría la acción específico de este parásito para A. aquasalis. Además, el alargamiento del desarrollo de las larvas aumentaría el tiempo disponible para que actúen otros controles biológicos. Por ejemplo, larvas de Lymantria dispar (Lepidoptera) pre-infectadas con el microsporidio Nosema sp. estaban más susceptibles a un patógeno viral que larvas no infectadas previamente (Bauer et al. 1998 ).
El microsporidio descrito aquí fue incluido en el género Parathelohania por las siguientes características: presencia de vesículas esporíferas, la prolongación en forma de collar de la exospora en la parte posterior de la espora, una espora uninuclear que posee un tubo polar anisofilar de nueve anillos, un polarplasto organizado en forma lamelar y una vacuola posterior grande (García y Becnel 1994 ). No obstante estas similitudes, el tamaño de la espora de la especie descrita aquí (2.6 x 2.4 m) es sustancialmente más pequeño que en las otras especies de Parathelohania (3.07-8.0 x 2.12-4.2
m) (García y Becnel 1994 ). Además la forma de la espora de la especie presentada es de barril, mientras que otras especies de Parathelohania tienden a ser ovoides (Undeen y Vávra 1997 ). Debido a estas diferencias y tomando en cuenta que la mayoría de las especies de Parathelohania son específicas al hospedero (García y Becnel 1994 , Baker et al. 1998 ), se propone que la especie aquí descrita representa una nueva especie para la ciencia y se sugiere el nombre; Parathelohania aquasalensis. Este representa el primer reporte de un microsporidio encontrado en un díptero en Venezuela, y el primer reporte de un microsporidio en A. aquasalis. Se espera que este estudio preliminar estimule investigaciones posteriores para la caracterización del ciclo de vida completo de esta especie, y su posible uso como control biológico de A. aquasalis.
Agradecimientos
A Cruz Gómez por su ayuda en la cría de A. aquasalis en el laboratorio. A Milagro Moreno, Antonio Gómez y Gilma Hemández por su ayuda técnica en el procesamiento de las muestras para MET. A Lucila Arcay (Instituto de Biología Experimental, Universidad Central de Venezuela) por comentarios que ayudaron a mejorar una primera versión del manuscrito. Este trabajo fue posible gracias a la ayuda financiera del Consejo de Investigación de la Universidad de Oriente a través del Proyecto No. CI-5-1901-0957/00.
Resumen
Se describen los síntomas en larvas de A. aquasalis infectadas naturalmente con un microsporidio parasítico, y la ultraestructura de las esporas del mismo. Las larvas fueron criadas bajo condiciones de laboratorio en concentraciones de salinidad de 10 g/l y 20 g/l, registrándose diariamente la mortalidad y la fecha del cambio de estadío de las mismas. Las larvas infectadas fueron procesadas por rnicroscopía electrónica de transmisión usando métodos convencionales con pH 7.2 y 260 mOsm/I. El incremento de la infección por los microsporidios estuvo correlacionado positivamente con un aumento en la duración promedio del cuarto estadío de 2.88 a 6.33 días en 10 g/l de sal y de 2.47 a 6.14 días en 20 g/l. La mortalidad de las larvas también aumentó en aproximadamente 50% durante este estadío a ambas concentraciones de salinidad. No se observaron estas alteraciones en los otros estadíos. Las esporas maduras de los microsporidios fueron encontradas en el intestino de las larvas. Estas esporas mostraron forma de barril y dimensiones de 2.6 x 2.4 m aproximadamente. La reducción en la supervivencia de las larvas de A. aquasalis infectadas con los microsporidios, y el aumento del tiempo de su desarrollo sugiere que este parásito podría ser un posible controlador biológico de esta plaga. El microsporidio descrito presenta características similares a las del género Parathelohania. Se sugiere que el microsporidio encontrado en las larvas de A. aquasalis es una especie nueva y se propone nombrarla Parathelohania aquasalensis. Este trabajo representa el primer reporte de un microsporidio encontrado en un díptero en Venezuela.
Referencias
Alger, N. & A. Undeen. 1970. The control of a microsporidian, Nosema sp. in an anopheline colony by an egg rinsing technique. J. Invertebr. Pathol. 15: 321-327. [ Links ]
Anónimo. 2003. Informe interno, Servicio de Endemias Rurales, Región XI, Estado Sucre, Ministerio de Salud y Desarrollo Social, Venezuela. [ Links ]
Balbiani, G. 1882. Sur les microsporidies ou psorospermies des articules. C. R. Acad. Sci. 95: 1168-1171. [ Links ]
Baker M., C. Vossbrinck, J. Becnel, & T. Andreadis. 1998. Phylogeny of Amblyospora and related genera based on small subunit ribosomal DNA data: a possible example of host parasite cospeciation. J. Invertebr. Pathol. 71: 199-206. [ Links ]
Bauer L., D. Miller, J. Maddox, & M. Mcmanus. 1998. Interactions between a Nosema sp. (Microspora: Nosematidae) and Nuclear Polyhedrosis Virus Infecting the Gypsy Moth Lymantria dispar (Lepidoptera: Lymantridae). J. Invertebr. Pathol. 74: 147-153. [ Links ]
Becnel J., & T. Andreadis. 1999. Microsporidia in insects. pp. 447-501. In Wittner & Weiss (eds.). The Microsporidia and Microsporidiosis. ASM, Washington, D.C. [ Links ]
Becnel J. & A. Undeen. 1992. Influence of temperature on developmental parameters of the parasitelhost system Edhazardia aedis (Mierosporidia: Amblyosporidac) and Aedes aegypti (Diptera: Culicidac). J. Invertebr. Pathol. 60: 299-303. [ Links ]
Becnel J., V. Sprague, T. Fukuda & E. Hazard. 1989. Development of Edhazardia aedis (Kudo, 1930) n.g., n. comb. (Microsporidia: Amblyosporidae) in the mosquito Aedes aegypti (L.) (Diptera: Culicidac). J. Protozool. 36: 119-130. [ Links ]
Berti, J., R. ZimmerTnan & J. Amarista. 1993. Spatial and temporal distribution of anopheline larvae in two malarious arcas in Sucre State, Venezuela. Mem. Inst. Oswaldo Cruz 88: 353-362.
Bisset, J., M. Rodriguez, A. Soca, N. Pasteur & M. Raymond. 1997. Cross- Resistance to pyrethroid and organophosphorus insecticidas in the Southem House mosquito (Diptera: Culicidac) from Cuba. J. Medical Entomology. 34: 244-246. [ Links ]
Crossley, A. & D. Waterhouse 1969. The ultrastructure of the osmeterium and the nature of its secretion in Papilio larvae (Lepidoptera). Tissue and Cell 1: 525-554. [ Links ]
Delgado, N. 1998. Parámetros demográficos de las fases inmaduras de Anopheles aquasalis Curry 1932 (Diptera: Culicidae) en condiciones de laboratorio. Bol. Entomol. Venezolano. 13: 27-43. [ Links ]
Faran, M. 1980. Mosquito studies (Diptera: Culicidae) XXXIV A revisión of the subgenus Nyssorhynchus of Anopheles. Contrib. Am. Entomol. Inst. 15: 1-215. [ Links ]
Flemming, G. 1986. Biología y ecología de los vectores de la malaria en las Américas. PAHO/WHO, PNSP/86.72. 54p. [ Links ]
García J. & J. Becnel. 1994. Eight new species of rnicrosporidia (Microspora) from Argentine Mosquitoes (Diptera: Culicidae). J. Invertebr. Pathol. 64: 243-252. [ Links ]
Gómez, C. & F. Osborn. 2002. Efectos de diferentes concentraciones salinas sobre el desarrollo de larvas y pupas de Anopheles aquasalis Cuny, 1932 (Diptera: Culicidae) en condiciones de laboratorio. Entomotrópica 17(2): 121-127. [ Links ]
Hazard E. & S. Oldacre. 1975. Revisión of microsporidia (Protozoa) close to Theloania with descriptions of one new family, eight new genera and thirteen new species. Tech. Bull. U.S. Dept. Agric. 1530: 1-104. [ Links ]
Hesse, E. 1904. Thelohania legeri n. sp., microsporidie nouvelle, parasite des larves d'Anopheles maculipennis Meig. C.R. Soc. Biol. 57: 570-571. [ Links ]
Issi, I. & T. Pankova. 1983. New species of microsporidian Issis globulifera sp. n. (Nosema) in the malarial mosquito Anopheles maculipennis. Parazitologiia 17: 189-194. [ Links ]
Johnson, M., J. Becnel & A. Undeen. 1997. A new sporulation sequence in Edhazardia aedis (Microsporidia: Culicosporidae), a parasite of the mosquito Aedes aegypti (Diptera: Culicidae). J. Invertebr. Padiol. 70: 69-75. [ Links ]
Lu, C. & Y. Chow. 1991. Fine structure of the larval osmeterium of Papilio demoleus libanius (Lepidoptera: Papilionidae). Annals. Entomol. Soc. America 84: 294-302. [ Links ]
Molina, D., F. Romero, J. Bisset, 0. Hidalgo, M. Castillo, W. Anaya, J. González, 0. Salas & H. Barazarte. 1997. Establecimiento de la línea de susceptibilidad de la fase adulta de Anopheles spp. a insecticidas químicas. Bol. Dir. Malariol. Saneam. Amb. 37: 55-69.
Moreno, J. & J. Berti. 1997. Estudio de la susceptibilidad de Anopheles aquasalis Curry 1932, a la infección con Plasmodium vivax en Venezuela. Bol. Dir. Malariol. Saneam. Amb. 37: 84. [ Links ]
Nägeli, C. 1857. Ubre die neue Krankheit der Seidenraupe und verwandte Organismen. Botan. SEIT. 15: 760-76 1. [ Links ]
Nasci, R., K. Tang, J. Becnel & T. Fukuda. 1992. Effect of per os Edhazardia aedis (Mcrosporidia: Amblyosporidae) infection on Aedes aegypti mortality and body size. J. Am. Mosq. Control. Assoc. 8: 131-136. [ Links ]
Rabinovich, J. 1980. Introducción a la ecología de poblaciones animales. Continental, México. 313 p. [ Links ]
Reisen, W. & T. Siddiqui. 1979. Horizontal and vertical estimates of immature survivorship for Culex tritaeniorhynchus (Diptera: Culicidae) in Pakistan. J. Med Entomol. 16: 207-218. [ Links ]
Service, M. 1993. Mosquito ecology: field sampling methods. 2nd ed. Chapman & Hall. Londres. 988p. [ Links ]
Sprague, V. 1977. Systematics of the Microsporidia. pp. 1-510. In L. Bulla & T. Cheng (ed.). Comparative Pathobiology 2. Plenum, New York. [ Links ]
Stobbart, R. & J. Shaw. 1964. Salt and water balance: excretion. pp. 189-235. In Rockstein (ed.). The physiology of insects, vol 3. Academic, Nueva York, Londrés. [ Links ]
Sútil, E. 1980. Enumeración histórica y geográfica de las especies de Culicidae de Venezuela ordenadas según su taxonomía. Bol. Dir. Malariol. Saneam. Amb. 20: 1-31. [ Links ]
Sweeney, A., S. Doggett & R. Piper. 1993. Life cycle of a new species of Duboscquia (Microsporidia: Thelohaniidae) infecting the mosquito Anopheles hilli and an intermediate copepod host, Apocyclops dengizicus. J. Invertebr. Pathol. 56: 415-418. [ Links ]
Undeen A. & J. Vávra. 1997. Research methods for entomopathenogenic Protozoa. pp. 117-151. In A. Undeen & J. Vávra (ed.). Manual of techniques on insect pathology. Academic, San Diego, California. [ Links ]
* Instituto de Investigaciones en Biomedicina y Ciencias Aplicadas, Universidad de Oriente. Cumaná, Estado Sucre, Venezuela. Fax: 58-293-4521297; fosborn2001@yahoo.com