Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.48 n.2-3 San José Jun. 2000
del Río Colorado, Baja California, México
Martha E. Valles-Ríos1 Gorgonio Ruiz-Campos1 y Lucio Galavíz-Silva 2
Recibido 19-VII-1999. Corregido 27-I-2000. Aceptado 4-II-2000.
Abstract
The parasitic prevalence and mean intensity in the striped mullet, Mugil cephalus, was seasonally determined during an annual cycle (February 1994 to February 1995) in the confluence of the Colorado and Hardy rivers, Baja California, México. Two species of parasites were identified, a nematode, Contracaecum multipapillatum (von Drasche, 1882) (Ascaridida: Anisakidae), and a copepod, Ergasilus versicolor Wilson, 1911 (Poecilostomatoida: Ergasilidae). The larvae of C. multipapillatum, which were represented by two size classes (A and B stages), had prevalences of 30% and 14.5%, respectively; while A. versicolor had a prevalence of 72.7%. The mean intensity of C. multipapillatum was 6.18 and 2.37 individuals per infected fish for A and B stages, respectively; and for A. versicolor, it was of 4.01. The number of parasites (taxa combined) increased with the size of fish (r= 0.22, p= 0.02), but it was independent of the hosts condition factor (KSL).
Key words
Mugil cephalus, parasites, prevalence, México.
La lisa cabezona, Mugil cephalus, es una especie costera circumtropical y de muchas regiones templadas confinadas a la isoterma 15 °C (Harrison 1995), es considerada una de las especies típicas en las lagunas costeras y estuarios del Pacífico mexicano (Yáñez-Arancibia 1977).
Esta especie prefiere los fondos fango-arenosos y rocosos, desde la orilla hasta ca. 120 m de profundidad, y dada su capacidad eurihalina penetra a las aguas continentales (Castro-Aguirre 1978, Harrison 1995). Realiza parte de su ciclo vital en la cuenca del Bajo Río Colorado, pero en invierno los adultos migran hacia el Golfo de California para desovar (McGinnis 1984). Allí, los juveniles recién transformados son transportados por corrientes al estuario del Río Colorado, el cual funciona como hábitat de crianza y alimentación (Dill 1944). Dentro de la dinámica trófica del ecosistema estuarino, la lisa cabezona juega un papel importante en el flujo de energía, ya que se alimenta de microalgas, microinvertebrados y detritus que abundan sobre los fondos fangosos y arenosos (Brusle 1981).
Los aspectos parasitológicos de la especie en cuestión, son conocidos en distintas localidades de su ámbito geográfico de distribución (cf. Rawson 1976, Fernández-Bargiela 1987); sin embargo, la región mexicana del Bajo Río Colorado carece de estudios al respecto, a pesar de la existencia de piscifactorías (de bagre de canal, Ictalurus punctatus, y tilapia, Tilapia spp.) en sitios adyacentes a los ríos Colorado y Hardy. Asimismo, la pesca artesanal de lisa cabezona es una actividad tradicional para la comunidad indígena Cucapá, que se remonta a sus orígenes.
Por tal motivo, en el presente estudio se determinó durante un ciclo anual, la prevalencia e intensidad parasitaria en la lisa cabezona de la región del Río Colorado-Río Hardy, Baja California, México.
Materiales y Métodos
Se recolectó un total de 110 ejemplares de M. cephalus (65.5 a 260 milímetros de longitud patrón, mm LP) durante un ciclo anual (febrero 1994 a febrero 1995); utilizando redes agalleras experimentales en cuatro sitios ubicados en el área de confluencia de los ríos Colorado y Hardy, Mexicali, Baja California, México (32º 06 49.20 N; 115º 13 57.6 W; Fig. 1). En cada sitio de muestreo se determinó siete variables físico-químicas del agua con un equipo multianalizador Hydrolab Scout 2 (Hydrolab Co., Austin, Texas): temperatura (ºC), profundidad (cm), oxígeno disuelto (ppm), potencial de iones hidrógeno, conductividad (mS/cm), salinidad (psu), y sólidos disueltos totales (g/l).
Los especímenes capturados se midieron (mm LP) y pesaron (g) en el campo. Para propósitos comparativos, los ejemplares fueron separados en dos clases de talla: talla I (£ 164 mm) y talla II (> 164 mm). El factor de condición (KLP) de Fulton (Lagler 1978) fue calculado para cada especímen como K= [W/LP3] 10,000: donde W= peso corporal (g) y LP= longitud patrón (mm). Cada espécimen fue disecado y examinado bajo un microscopio estereoscópico para escudriñar sus diferentes estructuras anatómicas externas e internas. El procesamiento de los parásitos fue como sigue: los nematodos fueron fijados en solución Bouin, preservados en alcohol etílico (70%), y finalmente transparentados con una mezcla de fenol-etanol (solución Lent). Los copépodos se fijaron en alcohol etílico (70%), se transparentaron con una mezcla de glicerina-alcohol y se montaron en gelatina-glicerina.
La identificación de los parásitos fue basada en Yamaguti (1961), Olson et al. (1983), Fernández-Bargiela (1987) y Berland (1989). Nomenclatura y posición taxonómica de las especies sigue a Nagasawa et al. (1989). El material parasitológico fue depositado en el Laboratorio de Vertebrados, Facultad de Ciencias, Universidad Autónoma de Baja California, en Ensenada.
La prevalencia e intensidad media parasitaria fue calculada de acuerdo con Margolis et al. (1982). La distribución Ji-cuadrada [X2] fue utilizada para probar la hipótesis de dependencia entre el número de parásitos (táxones combinados o separados) y la talla del huésped o la estación del año. Igualmente, la dependencia entre el número de ectoparásitos (copépodos) y la salinidad del agua fue probada mediante una prueba de X2 de contingencia. Se usó correlación de Pearson para determinar si existe asociación entre el número de parásitos (táxones combinados) y el factor de condición (KLP) del huésped.
Resultados
Las características físico-químicas del agua registradas en los tres sitios de muestreo, se presentan en el Cuadro 1.
Variables físico-químicas registradas en la región del Río Colorado-Río Hardy, Baja California, México.
(febrero 1994-febrero 1995). Mediciones realizadas con Hydrolab Scout 2.
TABLE 1
Physical-chemical parameters in the Río Colorado-Río Hardy region, Baja California, México.
(February 1994-February 1995). Measurements made with Hydrolab Scout 2.
| Varibles | | | | | | | | | | | | |
| Físico-químicas | | | | | | | | | | | | |
| | | | | | | | | | | | | |
| Temp. (°C) | | | | | | | | | | | | |
| Conduct. (mS/cm) | | | | | | | | | | | | |
| PH | | | | | | | | | | | | |
| Oxíg. dis. (ppm) | | | | | | | | | | | | |
| Prof. (cm) | | | | | | | | | | | | |
| Salinidad (psu) | | | | | | | | | | | | |
| TDS (g/l) | | | | | | | | | | | | |
| Hora | | | | | | | | | | | | |
| Fecha (d/m/a) | | | | | | | | | | | | |
- NM= no medido
Dos especies de parásitos fueron identificados de un total de 110 ejemplares recolectados de Mugil cephalus (65.5 y 260 mm LP): el nematodo Contracaecum multipapillatum (von Drasche0, 1882) (Ascaridida: Anisakidae) y el copépodo, Ergasilus versicolor Wilson, 1911 (Poecilostomatoida: Ergasilidae).
Se detectaron dos estadios larvarios del nematodo C. multipapillatum (A y B) en hígado, riñón y mesenterio intestinal. Esta separación fue basada en términos morfométricos. Por su parte, el copépodo E. versicolor, fue localizado sólo en branquias.
El valor promedio del factor de condición (KLP) registrado para la lisa cabezona durante el estudio fue 1.98 ± 0.20. Los KLP promedios por estación climática fueron: primavera (1.94 ± 0.22), verano (2.15 ± 0.27), otoño (1.93 ± 0.25), e invierno (1.98 ± 0.14).
De los 110 ejemplares examinados, 93 (84.5%) resultaron infectados por parásitos. Un 72.7% de los individuos están infectados por el copépodo E. versicolor, mientras que las formas larvarias A y B del nematodo C. multipapillatum, registraron prevalencias de 30.0% y 14.5%, respectivamente.
La intensidad media parasitaria (táxones combinados) fue 6.05 parásitos/pez infectado. A nivel de taxón, E. versicolor registró una intensidad media de 4.01; en cambio C. multipapillatum, exhibió intensidades medias de 6.18 y 2.37 en sus estadíos A y B, respectivamente.
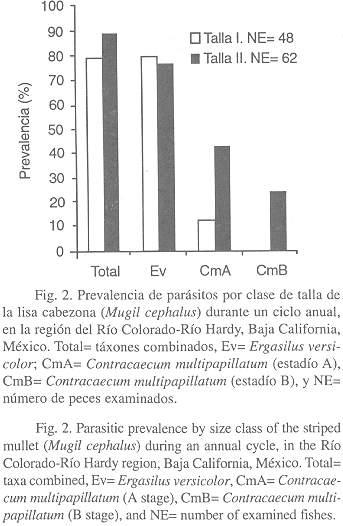
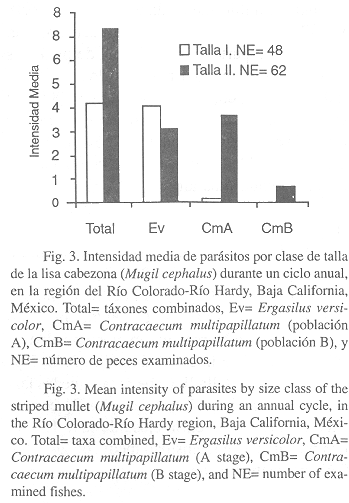
Por otra parte, la prevalencia de parásitos (táxones combinados) para las dos clases de talla del huésped, resultó ser mayor (88.7%) en la clase de talla II (> 164 mm) y menor (79.2%) en la clase de talla I (£ 164 mm) (Fig. 2). La intensidad media exhibió la misma tendencia, siendo más alta (7.32) en la clase de talla II y menor (4.18) en la clase de talla I (Fig. 3).
A nivel de taxón, E. versicolor registró una mayor prevalencia (79.2%, Fig. 2) e intensidad media (4.0, Fig. 3) en la clase de talla I. Asimismo, las larvas de C. multipapillatum (estadío A) exhibieron una mayor prevalencia (43.5%, Fig. 2) e intensidad media (3.58, Fig. 3) en la clase de talla II. Cabe notar, que las larvas de C. multipapillatum (estadío B) concurrieron únicamente en la clase de talla II, con una prevalencia e intensidad media de 24.2% y 0.67, respectivamente.
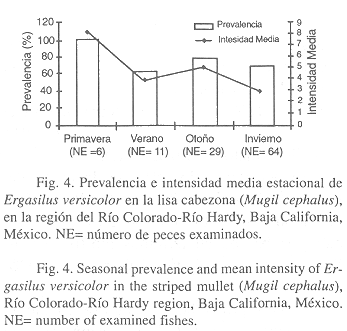
A nivel estacional, la prevalencia del copépodo E. versicolor fue mayor en primavera (100%) y menor en verano (63.6%). También, la intensidad media fue más alta en primavera (8.0) y más baja en invierno (3.0) (Fig. 4).
La prevalencia de parásitos (táxones combinados) fue independiente de KLP del huésped (X2= 1.16, p>0.05). En el caso de E. versicolor, su prevalencia fue independiente del KLP del huésped (r= -0.08 g.l., p= 0.30), de la estación del año (X2= 3.85, p>0.05) y de la salinidad del agua (X2= 2.32, p= 0.31).
El número de parásitos (táxones combinados) por pez infectado fue independiente del KLP del huésped (r= -0.08, g.l.= 108, p= 0.40). Asimismo, el número de parásitos (táxones combinados) y la talla del huésped mostraron una correlación directa significativa (r= 0.22, g.l.= 108, p= 0.02), lo cual indica un incremento en la cantidad de parásitos conforme el pez crece.
Discusión
La composición parasitaria de la lisa cabezona (65.54-260 mm LP) de la región mexicana del Bajo Río Colorado, está restringida a sólo dos especies: un nematodo, Contracaecum multipapillatum (von Drasche, 1882) (Ascaridida: Anisakidae), y un copépodo, Ergasilus versicolor Wilson, 1911 (Poecilostomatoida). Esta baja riqueza de parásitos contrasta con lo registrado por otros autores para esta especie huésped (e.g., Skinner 1975 [35 táxones], Rawson 1976 [5], Fernández-Bargiela 1987 [20], Juárez-Arroyo y Salgado-Maldonado 1989 [6]), quienes analizaron intervalos de tallas más amplios al nuestro. Lo anterior implica que la diversidad de parásitos se incrementa con la talla o edad del huésped debido al tiempo de exposición (Rawson 1976).
En el presente estudio, el nematodo C. multipapillatum posiblemente fue adquirido por los juveniles de la lisa cabezona al consumir copépodos infectados en el mar abierto (Huizinga 1967). Por su parte, el copépodo E. versicolor, cuyo ciclo vital es directo, fue posiblemente adquirido por el huésped vía interacción con peces infectados (Skinner 1975).
La lisa cabezona registró una mayor prevalencia del copépodo E. versicolor (72.7%), la cual es bastante superior al reportado de 14% por Fernández-Bargiela (1987) para este huésped en la localidad costera de Concepción, Chile. Sin embargo, la intensidad media (4.01 parásitos/pez infectado) fue ligeramente inferior a la registrada (6.7) por este mismo autor. Por otra parte, las larvas del nematodo C. multipapillatum (estadíos A y B) registraron respectivamente, prevalencias (P) de 30% y 14.5%, e intensidades medias (IM) de 6.18 y 2.37. Estos valores fueron menores que los estimados por Fernández-Bargiela (op. cit.) de P= 70% e IM= 6.3.
A nivel estacional, la prevalencia de E. versicolor osciló de 63.6% (verano) a 100% (primavera), lo cual sugiere que el contagio fue continuo debido a la concurrencia de hembras ovígeras a lo largo del año.
En lo que respecta a la intensidad media de parásitos en función de la talla, se encontró que la cantidad de parásitos (táxones combinados) aumentó con la talla de la lisa cabezona, similar a lo observado por Polyanski (1958) y Skinner (1975) para esta misma especie huésped. Este incremento de parásitos con la talla del huésped es atribuido a la acumulación del nematodo C. multipapillatum, el cual permanece alojado en el pez por varios años (Margolis 1970), así como a la mayor probabilidad de interacción con otros huéspedes infectados (Polyanski 1958).
El número de copépodos fue independiente de la talla de la lisa cabezona, lo cual difiere con lo reportado por Dogiel (1958) y Hudson et al. (1994), en el sentido de que la cantidad de ectoparásitos es directamente proporcional a la superfice de los filamentos branquiales del huésped. Nuestros resultados son similares con aquellos obtenidos por Muzall et al. (1995) para el copépodo E. centrarchidarum en los peces centrárquidos Ambloplites rupestris, Micropterus salmoides y Micropterus dolomieu. La baja correlación aquí registrada es posiblemente resultante de la corta duración del ciclo vital del copépodo, lo cual reduce su acumulación en el huésped (Hudson et al. 1994).
La prevalencia de este copépodo fue independiente de la salinidad registrada en el área, la cual osciló a través del año entre 0.9 y 7.7 psu. Por tanto, nuestro resultado demuestra la capacidad eurialina del copépodo, similar a lo reportado para su congénere (E. lizae) en la lisa cabezona (Paperna 1975).
El factor de condición o robustez (KLP) de la lisa cabezona en el área fue independiente de la cantidad de parásitos alojados. Una situación similar fue observada por Kennedy y Lie (1976) en la trucha café (Salmo trutta) del embalse Fernworthy, Devon (Gran Bretaña), donde la cantidad de larvas del nematodo Eustrongylides sp. no alteró la condición del huésped.
Finalmente, es importante resaltar que el presente trabajo constituye el primer registro parasitológico para esta especie íctica en la región mexicana del Bajo Río Colorado. Por tal motivo, nuestros resultados sobre la prevalencia e intensidad parasitaria a través de un ciclo anual, permitieron diagnosticar el estatus sanitario de este pez eurihalino de importancia alimentaria para la comunidad indígena Cucapá.
Agradecimientos
Agradecemos a Isabel Montes, Alejandro Gerardo, Federico Cota, Marcelo Rodríguez, y Rolando Mejía, por su ayuda en los muestreos ictiológicos. Asimismo, a tres revisores anónimos por sus comentarios al manuscrito. Este estudio fue parcialmente financiado por el proyecto CONACyT 431100-5-3587N: Diversidad y Bases de datos de los Ecosistemas Naturales de la Reserva de la Biósfera del Alto Golfo de California.
Resumen
La prevalencia e intensidad parasitaria de la lisa cabezona, Mugil cephalus Linnaeus, 1758, fue cuantificada durante un ciclo anual (febrero 1994 a febrero 1995) en la confluencia de los ríos Colorado y Hardy, Baja California, México. Dos especies de parásitos fueron reconocidas: Contracaecum multipapillatum (von Drasche, 1882) (Ascaridida: Anisakidae) y Ergasilus versicolor Wilson, 1911 (Poecilostomatoida: Ergasilidae). Las larvas del nematodo C. multipapillatum, representadas por dos estadíos (A y B), exhibieron prevalencias de 30% y 14.5%, respectivamente; mientras que el copépodo E. versicolor, mostró una prevalencia de 72.7%. La intensidad media de C. multipapillatum fue 6.18 y 2.37 parásitos/huésped para los estadíos A y B, respectivamente, y en E. versicolor, ésta fue de 4.01. El número de parásitos (táxones combinados) incrementó con la talla del pez (r= 0.22, p= 0.02), pero fue independiente del factor de condición (KLP) del huésped.
Referencias
Brusle, J. 1981. Food and feeding in grey mullet, p.185-218. In H. Oren (ed.). Aquaculture of grey mullets. International Biological Program 26. Cambridge University, Cambridge. [ Links ]
Berland, B. 1989. Identification of larval nematodes from fish, p.16-22. In H. Moller (ed.). Nematode problems in north Atlantic fish. Report from a workshop in Kiel. 3-4 April 1989. Int. Counc. Explor. Sea, C. M./F: 6. [ Links ]
Castro-Aguirre, J. L. 1978. Catálogo sistemático de los peces marinos que penetran a las aguas continentales de México, con aspectos ecológicos y zoogeográficos. Dirección General del Instituto Nacional de Pesca, México. Serie Científica Núm. 19. 290 p. [ Links ]
Dill, W. A. 1944. The fishery of the lower Colorado River. California Fish and Game 30: 134-181. [ Links ]
Dogiel, V. A. 1958. Ecology of the parasites of freshwater fishes, p.1-47. In V.A.
Dogiel, G. K. Petrushevski & Y. I. Polyanski (eds.). Parasitology of fishes. Leningrad University, Leningrado.
Fernández-Bargiela, J. 1987. Los parásitos de la lisa Mugil cephalus L., en Chile: sistemática y aspectos poblacionales (Perciformes: Mugilidae). Gayana, Zool. 51: 3-58. [ Links ]
Harrison, I. J. 1995. Mugilidae, p.1293-1298. In W. Fischer, F. Krupp, W. Schneider, C. Sommer, K. E. Carpenter & V. H. Niem (eds.). Guia FAO para la identificación de especies para los fines de la pesca. Pacífico centro-oriental. Volumen III. FAO, Roma. [ Links ]
Hudson, P. L., C. A. Bowen & R. M. Stedman. 1994. New records of Ergasilus (Copepoda: Ergasilidae) in the Laurentian Great Lakes, including a lakewide review of records and host associations. Can. J. Zool. 72: 1002-1009. [ Links ]
Huizinga, H. W. 1967. The life cycle of Contracaecum multipapillatum (von Drasche, 1882) Lucker, 1941 (Nematoda: Heterochelidae). J. Parasitol. 53: 368-375. [ Links ]
Juárez-Arroyo, J. & G. Salgado-Maldonado. 1989. Helmintos de la lisa Mugil cephalus Lin. en Topolobampo, Sinaloa, México. Anales Inst. Biol., Univ. Nac. Autón. México, Ser. Zool. 60: 279-298. [ Links ]
Kennedy, C. R. & S. F. Lie. 1976. The distribution and pathogenicity of larvae of Eustrongylides (Nematoda) in brown trout Salmo trutta L. in Fernworthy Reservoir Devon. J. Fish Biol. 8: 293-302. [ Links ]
Lagler, K.F. 1978. Freshwater fishery biology. WM. C. Brown, Dubuque, Iowa. 421 p. [ Links ]
Margolis, L. 1970. Nematoda diseases of marine fishes, p.190-208. In S.F. Sniezko (ed.). A symposium on diseases of fishes and shellfishes. American Fisheries Society, Special Publ. 5. [ Links ]
Margolis, L., G. W. Esch, J.C. Holmes, A. M. Kuris & G. A. Schad. 1982. The use of ecological terms in parasitology (report of an ad hoc committee of the American Society of Parasitologists). J. Parasitol. 68: 131-133. [ Links ]
McGinnis, S. M. 1984. Freshwater fishes of California. University of California, Berkeley. 316 p. [ Links ]
Muzzall, P. M., C. R. Peebles, J.L. Rosinisky & D. Harton. 1995. Parasitic copepods on three species of centrarchids from Gull Lake, Michigan. J. Helminthol. Soc. Wash. 62: 48-52. [ Links ]
Nagasawa, K., T. Awakura & S. Urawa. 1989. A checklist and bibliography of parasites of freshwater fishes of Hokkaido. Scientific Reports of the Hokkaido Fish Hatchery 44: 1-49. [ Links ]
Olson, A.C., Jr., M.D. Lewis & M.L. Hauser. 1983. Proper identification of anisakine worms. Am. J. Med. Technol. 49: 111-114. [ Links ]
Paperna, I. 1975. Parasites and diseases of the grey mullet (Mugilidae) with special reference to the seas of the near east. Aquaculture 5: 65-80. [ Links ]
Polyanski, Y.I. 1958. Ecology of parasites of marine fishes, p. 48-82. In V.A. Dogiel, G.K. Petrushevski & Y.I. Polyanski (eds.). Parasitology of fishes. Leningrad University, Leningrado. 384 p. [ Links ]
Rawson, M. V., Jr. 1976. Population biology of parasites of striped mullet, Mugil cephalus L. I. Monogenea. J. Fish. Biol. 9: 185-194. [ Links ]
Skinner, R. 1975. Parasites of the striped mullet, Mugil cephalus, from Biscayne Bay, Florida, with description of a new genus and three new species of trematodes. Bull. Mar. Sci. 25: 318-345. [ Links ]
Yamaguti, S. 1961. Systema helminthum. Vol. III. Partes I y II (The nematodes of vertebrates). Interscience, Nueva York. 1262 p.
Yáñez-Arancibia, A. 1977. Taxonomía, ecología y estructura de las comunidades ictiofaunísticas en nueve lagunas costeras del Estado de Guerrero (Pacífico Central de México). Tesis Doctoral. Centro de Ciencias del Mar y Limnología. Universidad Nacional Autónoma de México, México, D.F. 761 p. [ Links ]
1 Facultad de Ciencias, Universidad Autónoma de Baja California, Ensenada, Baja California, 22800, México; mvalles@faro.ens.uabc.mx, gruiz@bahia.ens.uabc.mx
2 Laboratorio de Parasitología, Centro Nacional de Sanidad Piscícola, Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León, Monterrey, N.L., México; lgalaviz@ccr.dsi.uanl.mx