Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.48 n.1 San José Mar. 2000
Strombidae, Turbinellidae, Neptuneidae
y Fasciolaridae)en Yucatán, México
Manuel Pérez Pérez y Dalila Aldana Aranda 1
Recibido 13-V-1999. Corregido 11-VIII-1999. Aceptado 28-VIII-1999.
Abstract
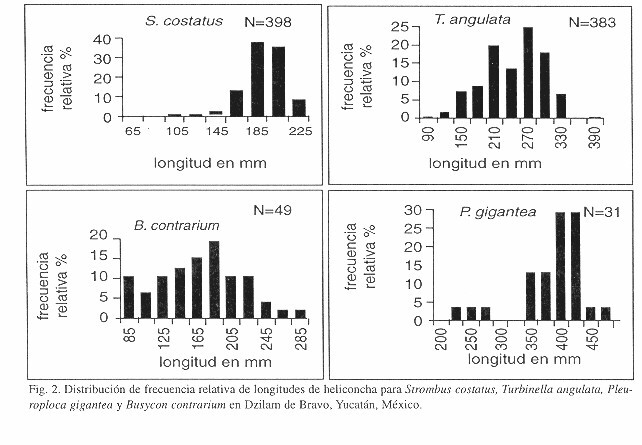
The distribution, abundance and morphology of four gastropod species are analized for Dzilam de Bravo, Yucatan, Mexico. Samples were taken by a snorkeler from 100 x 300 m plots (31 plots in a 930 000 m2 area) between august and september 1994. 896 individuals were examined and the more abundant species were Strombus costatus (44.42%), Turbinella angulata (42.75 %), Busycon contrarium (5.47 %) and Pleuroploca gigantea (3.46 %). Fasciolaria tulipa and Vasum muricatum represented 3.9 % of individuals. We estimated a mean of 0.00096 individuals/m2 . The mean shell length of S. costatus was 182 mm (SD±20;N 398), T. angulata 232 mm (SD±52; n=383), B. contrarium 175 mm (SD±48; n=49), and P. gigantea 377 mm (SD±55; n=31).
Key words
Abundance, distribution, morphology, gastropod.
La declinación de las poblaciones de caracol en la región del Caribe por sobrepesca, es tema de preocupación y estudio para los países que lo explotaron y continúan explotando a nivel comercial hasta puntos cercanos a la extinción (Appeldoorn 1987, Appeldoorn 1988 y Chávez 1990).
La mayoría de los estudios sobre distribución y abundancia del caracol en la región del Caribe y Golfo de México han sido realizados para Strombus gigas dada su demanda en el mercado y su elevado precio.
El caracol en Yucatán, México (Dzilam de Bravo) es un recurso pesquero multiespecífico compuesto por cuatro especies explotadas comercialmente: Strombus costatus, Turbinella angulata, Busycon contrarium y Pleuroploca gigantea. La legislación del volumen de captura se aplica como si fuera una sola especie y las medidas de regulación no son únicas.
Además de este problema de legislación, el caracol tiene características biológico-pesqueras particulares a los ciclos de vida de cada una de las especies que integran este recurso.
Los parámetros biológico pesqueros son imprescindibles en la administración de los recursos pesqueros; para la extracción máxima posible sin afectar la reproducción de las especies y mantener la población a largo plazo. En el caso de los caracoles, la colecta de datos biológico-pesqueros y su análisis resulta complicado por las características biológicas de su ciclo de vida: como el cese del crecimiento en longitud posterior a la edad de maduración, incrementándose solo el grosor del labio de la concha (Appeldoorn 1988, Stoner y Sandt 1992, Stoner y Schwarte 1993 y Stoner y Davis 1994). Por otra parte su crecimiento es diferencial en función de su hábitat, lo mismo que la mortalidad natural y reclutamiento que están determinadas por las características ecológicas.
Las medidas administrativas de manejo aplicadas a la pesquería del caracol en México, en particular a la Península de Yucatán son: el establecimiento de la talla mínima de captura, cuota de captura y la expedición de permisos de pesca a un número limitado de pescadores. La talla mínima de captura se basa en la longitud de la concha medida del ápice de la espira hasta la terminación del canal sifonal o longitud de la heliconcha de acuerdo a la Norma Oficial Mexicana NOM-013-PESC-1994, expedida el 21 de abril de 1995. Estas son de: 20 cm de la longitud de la heliconcha para S. gigas, 18 cm para S. costatus, 22 cm para B. contrarium y 30 cm para P. gigantea.
En 1994, el sector pesquero de Yucatán, México, manifestó, en base a sus observaciones que el caracol estaba recuperado como resultado de la veda aplicada. Para permitir o no nuevamente su explotación y manejo racional, en este estudio se determinó la distribución, abundancia y morfometría del caracol en Dzilam de Bravo, Yucatán, México.
Materiales y Métodos
Sitio de estudio: Se llevó a cabo un estudio sobre juveniles y adultos de S. costatus, T. angulata, B. contrarium y P. gigantea.
El sitio de estudio comprendió desde el puerto de Santa Clara, hasta el Faro de Yalkubul (área concesionada a la Sociedad de Pescadores de Dzilam de Bravo), ubicada entre los 21° 33´ 15 N, y los 088° 01´ 00 W, cubriendo una extensión de 76.25 Km2. La profundidad promedio es de 4.5 metros. El muestreo se realizó de agosto a septiembre de 1994.
Resumen de los métodos de muestreo aplicados en el Golfo de México y Mar Caribe para S. gigas.
| | | |
| Alcolado 1976 | Transectos de 2 x 100 m | Densidad y distribución |
| Hesse 1979 | Transectos de 180 m | Distribución y abundancia |
| Wood y Olsen 1982 | Transectos de 1 milla | Abundancia |
| Appeldoorn 1985 | Círculos de 16 m de radio | Estudio de sitio de siembra |
| Iversen et al. 1986 | Caminando en aguas bajas | Caracoles juveniles enterrados |
| Appeldoorn 1988 | Buceo con Scuba | Detección de agregaciones |
| Stoner et al. 1988 | Círculos de 5 m de radio | Densidad estimada |
| Berg et al. 1992b | Transectos de 2443 x 2 m | Distribución y abundancia |
| Stoner 1989 | Círculos de 2.5 m de radio | Densidad estimada |
| Berg et al. 1989 | Transectos de 2137 m | Distribución y abundancia |
| Waite y Stoner 1989 | Círculos de 2.5 m de radio | Densidad estimada |
| Berg et al. 1989 | Círculos de 30.5 m de radio | Número de organismos y masas de huevos. |
| Chavez 1990 | Transectos de 1 x 120 m | Densidad y abundancia |
| Stoner y Waite 1991 | Círculos de 15 m de radio | Densidad estimada |
| Stoner y Sandt 1992 | Círculos de 10 y 15 m de radio | Densidad estimada |
| Sandt y Stoner 1993 | Sección de 110 m con profundidades de 0 a 1.9 m | Distribución y abundancia |
| Stoner y Ray 1993 | Círculos de 4 m de radio | Densidad estimada |
| Stoner y Schwarte 1993 | Transectos de 5 x 380 m | Evaluación de la población |
| Stoner y Davis 1994 | Círculos de 4 m de radio | Densidad estimada |
Método de estudio: Distintos métodos de muestreo son utilizados para el estudio de distribución, densidad y abundancia del caracol (Cuadro 1). Se seleccionó para el estudio de distribución, el transecto perpendicular a la costa (Stoner y Schwarte 1993) de 100 metros de longitud por cinco metros de ancho, permitiendo muestrear el área por gradientes de profundidad. Se realizaron 31 cuadrantes de 30 000 m2 cada uno cubriéndose un área total de 930 000 m2 . Para la estimación de la densidad se seleccionó el método de círculos (Stoner y Waite 1991) de 50 metros de radio que es la longitud de la manguera del sistema Hooka de buceo que utilizan los pescadores de esta zona.
Para la determinación de la zona de investigación, se realizó un estudio de prospección en el área de pesca de 518 km2 , concesionada a los pescadores de Dzilam de Bravo desde la profundidad de dos m hasta los 12 m. La exploración del fondo marino se cubrió con un vehículo de video submarino autopropulsable "Phantom", el cual opera a control remoto desde una embarcación y puede filmar a profundidades hasta de 300 m a una velocidad de 1.8 m por segundo. Se realizaron recorridos con dirección perpendicular a la costa de 25 min. Dicha prospección delimitó la zona de investigación en 76.25 km2, en un ámbito de profundidad de uno a seis m.
Cuando el área se marcó como positiva (con presencia de caracoles), se realizaron de dos a cinco inmersiones de buceo para cuantificar el número de organismos, subirlos a bordo de la embarcación y efectuarles las medidas morfométricas.
En la distribución espacial del caracol se aplicó la proporción entre la varianza y la media la cual evalúa el grado de hacinamiento.
Resultados
Distribución, densidad y abundancia: De los 31 cuadrantes realizados, las densidades de caracol fueron altas para los cuadrantes 1, 2, 24 y 28 comparada con el resto que tuvieron valores entre 0.00006 y 0.0052 individuos por metrocuadrado, con una media de 0.00096 y una desviación estándar de 0.0012. La proporción entre la varianza y la media fue de 45.41, por lo que se clasifica como agregada.
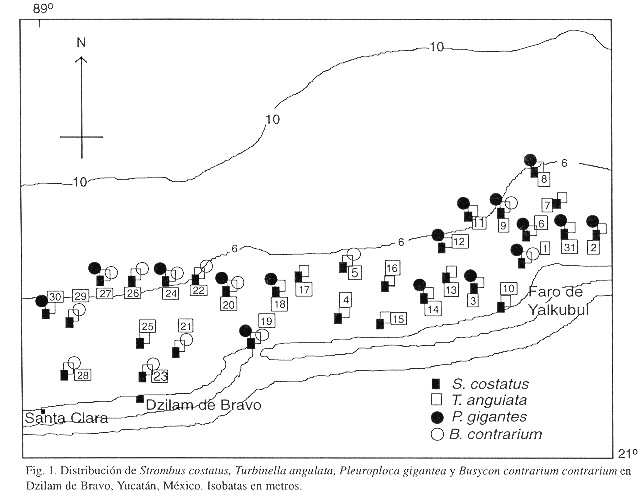
Los 896 organismos examinados en el área, pertenecen a las especies S. costatus (44.42%), T. angulata (42.75%), B. contrarium (5.47%), P. gigantea (3.46%), V. muricatum (3.57%) y F. tulipa (0.33%). La especie más abundante para el área fue S. costatus, con 398 organismos, con una presencia en 74% de los cuadrantes. T. angulata fue la especie que presentó la más amplia distribución, encontrándose en todos los cuadrantes. P. gigantea y B. contrarium, se encontraron en 58 y 41 % de los cuadrantes, respectivamente (Fig. 1).
Morfometría: La característica morfométrica que se registró para S. costatus, T. angulata, B. contrarium y P. gigantea, fue la longitud de la heliconcha.
De los 398 organismos de S. costatus, el 6 % presentaron tallas menores a la talla mínima comercial. Las tallas fueron entre 65 y 225 mm de longitud, con un promedio de 182 mm (DE±20). Para T. angulata, se registraron 383 organismos con longitudes entre 90 y 390 mm y un promedio de 232 mm (DE±52). Se registraron 49 organismos para B. contrarium con longitudes entre 85 y 285 mm, longitud promedio de 175 mm (DE±48) y una moda en 185 mm, siendo 16 % menor a la talla mínima comercial. Para P. gigantea se registraron 31 organismos con una longitud mínima de 225 mm y una máxima de 475 mm, una longitud promedio de 377 mm con dos modas en 400 y 425 mm (Fig. 2). Ambas tallas resultaron en 33 y 41 % mayores a la talla mínima comercial establecida en 300 mm.
Discusión
La literatura científica publicada en el tema de distribución y abundancia ha sido principalmente sobre S. gigas. Pocos autores (Appeldoorn 1985 y Torres 1987, entre otros) reportan información sobre este tópico para S. costatus, siendo la misma situación para T. angulata, B. contrarium y P. gigantea.
Franco et al. (1995), observaron que cuando los organismos están confinados a sitios específicos, se dice que el espacio es
discontinuo o discreto, aspecto necesario en los estudios de densidad. En el área de estudio las especies de caracol tuvieron también una distribución discontinua con un límite en la profundidad para su localización en seis metros.
Los resultados de la distribución de S. costatus, coinciden con lo reportado por Alcolado (1976) en el sentido de que la distribución está ligada con la profundidad. Este autor encontró que los caracoles adultos tienen una distribución batimétrica más amplia, habiéndolos encontrado formando grupos a 40 m de profundidad. Igualmente reporta que su distribución horizontal parece estar limitada a la zona donde el agua presenta determinadas características fisico-químicas marinas y donde el sustrato no sea fangoso.
Las densidades de caracoles por metro cuadrado obtenidas por Wood y Olsen (1982) de 0.00076, Torres Rosado (1987) de 0.00026 y Berg et al. (1992a y 1992b) de 0.00005, son menores a la densidad media para este estudio que fue de 0.00096. Contrariamente, otros autores encontraron densidades mayores a la de este trabajo como: Wood y Olsen (1982) en San Croix con 0.00097 caracoles por metro cuadrado y Friedlander et al. (1994) con 0.00119 y 0.0013 (Cuadro 2). Estas densidades encontradas en el Caribe son menores a lo reportado para el Caribe mexicano (Cuadro 3).
Densidades del caracol rosado (S. gigas) reportadas para el caribe. Citados por Stoner and Ray (1996).
| Autor y año | Método | Localidad | | |
| Alcolado 1976 | Transectos con natación | Cuba Diego Pérez Cabo Cruz | 3-4 0-5 | 0.01300 |
| Hesse 1979 | Transectos con natación | Islas de Turks y Caicos | | |
| Wood y Olsen 1983 | Transectos con trineo | Islas Vírgenes, Estados Unidos San Tomás Santa Cruz | - | 0.00076 |
| Smith y van Nierop 1984 | Transectos con natación | Bahamas Banco de pequeña Bahama Banco de la gran Bahama | 0 - 18 0 - 18 | 0.00285 0.00208 |
| Weil y Laughlin 1984 | Cuadrantes fijos | Los Roques Venezuela Zona de captura Zona en veda | 1-18 | 0.18860 |
| Torres Rosado 1987 | Transectos de natación | Puerto Rico, Estados Unidos de America | | |
| Berg et al. 1992 a | Transectos con buzo remolcado | Bermuda | | |
| Berg et al. 1992 b | Transectos estratificados con arrastre de buzos | Cayos de Florida, Estados Unidos de America | | |
| Friedlander et al. 1994 | Transectos a pie (caminados) | Islas Virgenes, Estados Unidos San Tomás San Juan | 5-30 | 0.00126 |
Densidades de caracol rosado Strombus gigas en las costas del Caribe mexicano.
Densidad de en organismos por metro cuadrado.
| | | | | |
| De la Torre 1984 | | | | Litoral Quintana Roo |
| Quijano 1988 | | | | Sur de Q. Roo |
| Quijano 1988 | | | | Norte de Q. Roo |
| Quijano 1988 | | | | Cozumel |
| Quijano 1988 | | | | Centro de Q. Roo |
| Cruz 1989 | | | | Cozumel |
| Chávez 1990 | | | | Banco Chinchorro |
| Domínguez-Viveros 1992 | | | | Banco Chinchorro |
| Martínez 1995 | | | | Cozumel |
| Basurto et al. 1996 | | | | Banco Chinchorro |
| Basurto et al. 1996 | | | | Cozumel |
De acuerdo a los resultados en el área de estudio, Strombus costatus presentó una alta tendencia a la agregación principalmente en los cuadrantes 1, 2, 24, 28 y 31. El mismo comportamiento lo observó Alcolado (1976) con S. gigas que tiende a asociarse en grupos de tamaño y edad similar.
La regulación de la talla mínima de captura del caracol, no se estableció con bases biológicas para el litoral de Yucatán. De acuerdo a los resultados, el 34 % de individuos de S. costatus se encontraban por debajo de la talla mínima de captura, 82 % de B. contrarium estuvo por debajo de esa talla y el 10 % para P. Gigantea. Dichos resultados reflejan la necesidad urgente de realizar estudios biológicos para cada una de las especies. La talla mínima de captura como medida de manejo del caracol ha sido frecuentemente utilizada por diversos autores. Esta medida simple y práctica, tiene varios inconvenientes: uno de estos es que la talla mínima no necesariamente corresponde a una realidad biológica, donde la longitud de la concha puede ser independiente de la primera madurez sexual. También puede haber diferencias entre las longitudes de hembras y machos.
A pesar de la veda permanente aplicada al Estado de Yucatán desde 1988 para el caracol, las poblaciones del área han sido sometidas permanentemente a una pesca ilegal, afectando la recuperación de las poblaciones.
La reglamentación de la pesquería del caracol en Yucatán, México, se basó en los estudios realizados en el litoral de Quintana Roo con S. gigas (De la Torre et al. 1984, Quijano 1988, Chávez 1990, entre otros) y S. costatus en Campeche (Baqueiro et al. 1991). Por ello se utilizó información biológica de pesquerías monoespecíficas y de regiones distintas para la citada reglamentación. Así, los resultados de este estudio son una aportación original y valiosa no solo para la reglamentación pesquera del caracol en las costas de Yucatán sino para otras regiones del Golfo de México.
Agradecimientos
Este trabajo fue realizado con el apoyo del laboratorio de Biología Marina e Ictiología del CINVESTAV IPN Unidad Mérida, del CRIP Yucalpetén, del CONACYT con la beca 96054. Damos las gracias al laboratorio James J. Howard Marine Science, Northeast Fisheries Science Center, National Marine Fisheries Service, NOAA. Se agradece la participación en el trabajo de campo a los pescadores de Dzilam de Bravo. Agradecemos a los revisores anónimos por sus comentarios al manuscrito.
Resumen
Se analizó la distribución, abundancia y morfometría de Strombus costatus, Turbinella angulata, Busycon contrarium y Pleuroploca gigantea en Dzilam de Bravo, Yucatán, México. La toma de datos se realizó con buceo libre mediante el método de cuadrantes de 100 m de longitud por 300 m de ancho (31 cuadrantes en un área de 930 000 m2) entre agosto y septiembre de 1994. De 896 individuos, las especies más abundantes fueron Strombus costatus (44.42%) y Turbinella angulata (42.75%), Busycon contrarium (5.47%) y Pleuroploca gigantea (3.46 %). El 3.9 % restante fue de Fasciolaria tulipa y Vasum muricatum. Se estimó una densidad promedio de 0.00096 organismos por metro cuadrado. La longitud promedio de la heliconcha de S. costatus fue de 182 mm (DE±20; n=398), de T. angulata 232 mm (DE±52; n=383), de B. contrarium 175 mm (DE±48; n=49), y de P. gigantea 377 mm (DE±55; n=31).
Referencias
Alcolado, P. M. 1976. Crecimiento, variaciones morfológicas de la concha y algunos datos biológicos del cobo Strombus gigas L. (Mollusca, Mesogastropoda). Acad. Cienc. Cub Ser. Oceanol. 34: 1-36. [ Links ]
Appeldoorn, R. S. 1985. Growth, mortality and dispersion of juvenile, laboratory-reared conchs, Strombus gigas and S. costatus, released at an offshore site. Bull. Mar. Sci. 37: 785-793. [ Links ]
Appeldoorn, R. S., 1987. Assesment of mortality in an offshore population of queen conch, Strombus gigas L., in southwest Puerto Rico. Fish. Bull. NOAA 85: 797-804. [ Links ]
Appeldoorn, R. S. 1988. Age determination, growth, mortality and age of first reproduction in adult queen conch, Strombus gigas L., off Puerto Rico. Fish. Res. 6: 363-378. [ Links ]
Baqueiro, C.E. M. Medina & H. Ramirez, 1991. Conch Fishery of Campeche. Sria. de Pesca. Instituto Nacional de la Pesca. Centro Regional de Investigación Pesquera, Lerma, Campeche. [ Links ]
Basurto, M., D. Martínez., P. Cadena., R. Fanjul & M. A. Rivero. 1996. Informe de Investigación del proyecto Caracol. Documento Interno, Centro Regional de Investigación Pesquera. Puerto Morelos. [ Links ]
Berg, C. J. & D.A. Olsen. 1989. Conservation and Management of queen conch (Strombus gigas) fisheries in the Caribbean, p. 421-442. In J. F. Caddy (ed.). Marine Invertebrate Fisheries: Their Assessment and Management. J. Wiley. Nueva York. [ Links ]
Berg, C. J. Jr., F. Couper, K. Nisbet & J. Ward. 1992a. Stock assessment of queen conch, Strombus gigas, in Bermuda. Proc. Gulf Caribb. Fish. Inst. 41:433-438. [ Links ]
Berg, C. J. Jr., R. Glazer, J. Carr, J. Krieger & S. Acton. 1992b. Status of the queen conch, Strombus gigas, in Florida waters: a progress report. Proc. Gulf Caribb. Fosh. Inst. 41:439-443. [ Links ]
Berg, C. J. Jr., J. Ward, B. Luckhurst, K. Nisbet, & F. Couper, 1989. Observations of breeding agregations of the queen conch, Strombus gigas, in Bermuda. Proc. Gulf Caribb. Fish. Inst. 42:161-171. [ Links ]
Chávez, E. A. 1990. An assessment of the queen conch (Strombus gigas) stock of Chinchorro Bank, México. Proc. Gulf Caribb. Fish. Inst 43:487-497. [ Links ]
Cruz, O. 1989. Informe del crucero de evaluación poblacional del recurso caracol marino en las zonas de pesca centro y sur del litoral de Quintana Roo, México. Doc. Int. Centro Regional de Investigación Pesquera. Instituto Nacional de Pesca. Puerto Morelos. [ Links ]
De la Torre, R. 1984. Pesquería de caracoles en el estado de Quintana Roo. Instituto Nacional de Pesca. Ser. Div. 14: 21. [ Links ]
Franco, J. L., et al., 1995. Manual de ecología. Trillas, México, D.F. 266 p. [ Links ]
Friedlander, A., R. S. Appeldoorn & J. Beets, 1994. Spatial and temporal variations in stock abundance of queen conch, Strombus gigas, in the U. S. Virgin Islands, p. 51-60. In Queen conch biology, fisheries and mariculture. R. S. Appeldoorn and B. Rodriguez Q. (eds.). Fundación Científica Los Roques, Caracas, Venezuela. [ Links ]
Hesse, K. O., 1979. Movement and migration of the queen conch, Strombus gigas, in the Turks and Caicos Islands. Bull. Mar. Sci. 29: 303-311. [ Links ]
Iversen, E.S., E.S. Rutherford, S.P. Bannerot & D.E. Jory, 1986. Biological data on Berry Islands (Bahamas) queen conchs, Strombus gigas, with mariculture and fisheries and management implications. Fish. Bull. NOAA. 85: 299-310. [ Links ]
Martínez, D. 1995. ¿Qué pasa con las poblaciones de caracol en Cozumel?. Centro Regional de Investigación Pesquera. Puerto Morelos Informa. Año 2 No. 2: 8-9.
Quijano, F. A. 1988. El recurso caracolero en el caribe mexicano. In: Los Recursos Pesqueros del País. Instituto Nacional de Pesca. Memorias XXV Aniversario. Secretaría de Pesca, México, D. F.: 497-512. [ Links ]
Sandt, V. J. & A. W. Stoner. 1993. Ontogenetic shift in habitat by early juvenile conch, Strombus gigas: patterns and potential mechanisms. Fish. Bull. 91: 516-525. [ Links ]
Stoner, A. W., 1989. Density-dependent growth and the grazing effects of juvenile queen conch (Strombus gigas L.) in a tropical seagrass meadow. J. Exp. Mar. Biol. Ecol. 130: 119-127. [ Links ]
Stoner, A. W. & V. J. Sandt. 1992. Population structure, sesonal movements and feeding of the queen conch, Strombus gigas, in deep-water habitats of the Bahamas. Bull. Mar. Sci. 51: 287-300. [ Links ]
Stoner, A. W. & K. C. Schwarte. 1994. Queen conch, Strombus gigas, reproductive stocks in the central Bahamas: Distribution and probable sources. Fish. Bull. 92:171-179. [ Links ]
Stoner, A. W. & M. Davis. 1994. Experimental outplanting of juvenile queen conch, Strombus gigas: comparison of wild and hatchery-reared stocks. Fish. Bull. 92:390-411. [ Links ]
Stoner, A. W. & J. M. Waite. 1991. Trophic biology of Strombus gigas in nursery habitats: diets and food sources in seagrass meadows. J. Moll. Stud. 57: 451- 60. [ Links ]
Stoner, A.W. & M. Ray. 1993. Aggregation dynamics in juvenile queen conch (Strombus gigas): population structure, mortality, growth, and migration. Mar. Biol. 116: 571-582. [ Links ]
Stoner, A.W. & M. Ray. 1996. Queen conch, Strombus gigas, in fished and unfished locations of the Bahamas: effects of a marine fishery reserve on adults, juveniles, and larval production. Fish. Bull. 94:551-565. [ Links ]
Stoner, A. W., R. N. Lipcius, L. S. Marshall, Jr & A. T. Bardales, 1988. Synchronous emergence and mass migration in juvenile queen conch. Mar. Ecol. Prog. Ser. 49: 51-55. [ Links ]
Torres Rosado, Z. A., 1987. Distribution of two mesogastropods, the queen conch, Strombus gigas, Linnaeus, and the milk conch, Strombus costatus Gmelin, in La Parguera, Ljas, Puerto Rico. M. S. thesis, Univ. Puerto Rico, Mayaguez, Puerto Rico. [ Links ]
Waite, J. M. & A. W. Stoner. 1989. Habitat Choice and the Distribution of Juvenile Conch. Proc. Gulf Caribb. Fish. Inst. 42:142-145. [ Links ]
Wood, R. S. & D. A. Olsen. 1982. Application of biological knowledge to the management of the Virgin Island conch fishery. Proc. Gulf Caribb. Fish. Inst. 35:112-121. [ Links ]
1 Laboratorio de Biología Marina, CINVESTAV IPN Unidad Mérida. A.P. 73 Cordemex, C.P. 97310 Mérida Yucatán México. Fax 81-29-17; daldana@kin.cieamer.conacyt.mx