Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.47 n.3 San José Sep. 1999
Abstract
The quantities of biomass produced in gametes, somatic tissue growth, byssus formation and organic matrix in the shell were studied from September 1988 through September 1989 in an exploited population of Perna perna (L.) in Guatapanare, State Sucre, Venezuela. The specific biomass of each component were evaluated using monthly length – dry weight equations and a model of population growth. Growth rate is high, reaching 87.84 mm at 12 months. The production of somatic tissue (Ps) was maximun at 10 months of age; however, organic matrix of shell (Pc) and byssus (Pb), reached a maximun at 8 months of age. Gonad production (Pg) evaluated by weight loss in two principal periods of spawning (October – December, 1988 and April – June 1989) increased with age from a value of 0.04 g / month at 4 months to 0.25 g/month at 14 months of age. The ratio production/biomass (P/B) decreased with population age; however, reproductive effort (Pg/Px 100) increased from 14.81 % at 4 months to 42.37 at 14 months of age, reveling a population strategy of scarse longevity and higher reproductive potential.
Key words
Production, growth energetic, mussel, Perna perna, bivalve, Venezuela.
Un bivalvo potencialmente cultivable en Venezuela es el mejillón Perna perna, principalmente en los bancos naturales de la costa norte del Estado Sucre donde su explotación es intensiva y responde básicamente a una práctica de tipo artesanal. Comparada con otras especies de géneros de la familia Mytilidae cercanamente relacionados, y particularmente con Mytilus edulis, la especie ha recibido poca atención. Algunos aspectos de su ciclo reproductivo han sido investigados por Velez y Martínez (1967), Carvajal (1969) y Velez (1971) en Venezuela; Lunetta (1969) en Brasil y Berry (1978) en Suráfrica.
Los estudios sobre productividad en bivalvos son muy abundantes en especies de zonas templadas (Burke y Mann 1974, Dare 1976, Bayne y Worrall 1980, Griffith 1980, Thompson 1984) pero muy escasos en especies de zonas tropicales (Prieto et al. 1985, Tata y Prieto 1991). Los primeros estudios sobre este tema (P) se basaron en estimaciones globales; sin embargo existe una progresiva tendencia a calcular la productividad de cada componente (soma, gónada, concha) en las diferentes clases de edades (MacDonald y Thompson 1986, MacDonald y Bourne 1987). En los estudios de flujo de materia se considera la energía utilizada en el crecimiento y la reproducción denominada en forma general P como la variable de mayor importancia cuando se trata de estimar el éxito de una población en el ambiente, ya que representa una respuesta integral de cada uno de sus individuos; además porque permite evaluar, por una parte, la biomasa disponible hacia otros niveles tróficos o de importancia económica y por la otra, analizar la distribución específica de la energía dentro de los diferentes grupos de edades de una población.
Hasta el momento, a pesar de la importancia que reviste el mejillón Perna perna como recurso pesquero, no existe en Venezuela información sobre la potencialidad de la producción de biomasa en las poblaciones naturales del nororiente de Venezuela, por ello se intenta en el presente trabajo establecer un patrón de distribución de la energía en los compartimientos de la producción de la especie en la población de Guatapanare y evaluar su evolución en individuos de diferentes edades a través del tiempo.
Materiales y métodos
Las muestras de Perna perna se obtuvieron mensualmente desde septiembre de 1988 hasta septiembre de 1989 en la ensenada de Guatapanare, situada en la costa norte del Estado Sucre a 63º 24´ 35" W; 10º 39´47" N. Las características ecológicas de esta área han sido descritas por Carvajal (1969). Los ejemplares se recolectaron mediante buceo simple a profundidades de 1 a 5 m y se colocaron en contenedores isotérmicos con agua de mar por un tiempo no menor de 6 horas a fin de eliminar el exceso de sedimento contenido en el tracto digestivo. Posteriormente se trasladaron al laboratorio donde se congelaron hasta su procesamiento. Cada organismo fue limpiado cuidadosamente de adherencias en la concha y determinada su longitud total (Lt) desde el gozne hasta el borde ventral de la concha con un vernier de apreciación 0.05 mm; luego utilizando un equipo de disección se extrajeron las partes blandas de cada mejillón separando cuidadosamente el material gonadal, tejido somático y el biso (este último fue separado desde la porción interior hasta el borde de la concha). Una vez separados cada uno de los componentes, se sometieron a deshidratación en una estufa a 70 ºC por 48 horas a fin de obtener el peso seco en una balanza de apreciación 0.001 g. El contenido de materia orgánica de la concha (pc) y del biso (pb) se obtuvo introduciendo ambas partes previamente disecadas en una mufla a 450 ºC por dos horas (Barker-Jorgensen 1976) y obteniendo el peso seco por diferencia.
Los valores obtenidos en cada recolecta mensual para los pesos secos del tejido somático (ps), gonadal (pg), biso (pb) sé sometieron por separado a un modelo de regresión con la longitud total de cada bivalvo (Lt), ajustandose por la ecuación p=aLtb que se transformó en una ecuación lineal convirtiendo ambas variables a logaritmo según el modelo: Log10 p = Log10 a + b log10 Lt; donde Lt = longitud de la concha (mm), p es el peso seco de cada una de las variables; a y b son parámetros de las ecuaciones de regresión ajustadas para obtener el peso de los individuos.
Las ecuaciones mensuales del peso seco de cada tejido vs longitud en los bivalvos se construyeron de acuerdo a las indicaciones de Crisp (1971) y se utilizaron para predecir los pesos.
La producción total individual (P) se evaluó a partir de la suma de cada uno de los componentes: P = Ps + Pg + Pc + Pb, donde: Ps es la energía invertida en tejido somático, Pg la energía invertida en la reproducción, Pc la energía invertida en la formación de materia orgánica de la concha y Pb la energía invertida en la formación del biso. Las estimaciones del Ps, Pc y Pb se obtuvieron por los incrementos de peso entre dos clases de edades sucesivas a intervalos de dos meses (Pt+1 – Pt). La producción de gónadas Pg para cada clase de edad se calculó a partir de la pérdida de peso de la gónada predesovada según MacDonald y Bourne (1987) utilizando las ecuaciones mensuales Lt – pg a cada longitud en los dos períodos principales de desove de la especie (Carvajal 1969, Velez 1971), expresandolos en promedios mensuales. La longitud a cada edad se calculó utilizando un modelo de von Bertalanffy determinado con los datos de incrementos de longitud informados por Carvajal (1969) en la misma población de Guatapanare. Un índice gonadosomático mensual (IG) fue estimado a partir de la expresión IG = pg / pst X 100; donde pg es el peso seco de la gónada y pst es el peso seco de todos los tejidos.
En cada ocasión de muestreo se determinaron la temperatura del agua, oxígeno disuelto y salinidad con un conductímetro YSI de 0.2 ppm, 0.7 ºC y 1 %o de precisión respectivamente.
Resultados
Debido a la necesidad de disponer de un modelo de crecimiento para el cálculo de la producción individual por edades, se utilizaron datos del incremento de longitud aportados por Carvajal (1969) sobre la misma población de Guatapanare. Con los incrementos mensuales y empleando la técnica de Ford-Walford se determinó la ecuación: Lt = 126.52 [ 1 – e-0,11(t – 0,80)] , para intervalos mensuales (t = mes). De acuerdo a la misma, los mejillones alcanzaron 89.6 mm a la edad de un año, con una longevidad teórica máxima de tres años.
Las regresiones mensuales entre la longitud de la concha (Lt) y el peso seco (ps) del tejido somático fueron altamente significativas (P< 0.001) con valores de b que fluctuaron entre 1.39 y 2.47 lo que indica una sensible alometría negativa con altos valores del coeficiente de determinación (Cuadro 1). Un análisis de covarianza indicó que no existen diferencias significativas entre las pendientes (P > 0.05). Las relaciones Lt – pg también presentaron altos valores de correlación y la pendiente b presentó una variación que osciló entre 2.23 en
| | | | | | |
| Septiembre 1988 | | | | | |
| Octubre | | | | | |
| Noviembre | | | | | |
| Diciembre | | | | | |
| Enero 1989 | | | | | |
| Febrero | | | | | |
| Marzo | | | | | |
| Abril | | | | | |
| Mayo | | | | | |
| Junio | | | | | |
| Julio | | | | | |
| Agosto | | | | | |
| Septiembre | | | | | |
Log10 ps = log10 a + b log10 Lt; P<0.001
febrero de 1988 hasta 5.51 en marzo del mismo año (Cuadro 2). Un análisis de covarianza indicó que estas son significativamente diferentes (P < 0,001). En las relaciones Lt – pc se obtuvieron valores muy altos de r2 y la pendiente b osciló entre 1.94 en septiembre de 1988 y 2.46 en junio de 1989.
| | | | | |
| Septiembre 1988 | | | | |
| Octubre | | | | |
| Noviembre | | | | |
| Diciembre | | | | |
| Enero 1989 | | | | |
| Febrero | | | | |
| Marzo | | | | |
| Abril | | | | |
| Mayo | | | | |
| Junio | | | | |
| Julio | | | | |
| Agosto | | | | |
| Septiembre | | | | |
Log10 pg = log10 a + b log10 Lt; P< 0.001.
Las regresiones Lt – pb resultaron ser significativas con coeficientes de determinación que oscilaron entre 0.29 y 0.77. La pendiente máxima se observó en marzo de 1989 y la mínima en julio del mismo año.
La variación del peso seco del soma (ps) para cada clase de edad obtenido por las ecuaciones de conversión indican que las clases de edad 8, 10, 12 y 14 presentaron un descenso desde septiembre hasta octubre de 1988 seguido de un breve aumento hasta diciembre de 1988 (Fig. 1), con un fuerte aumento para abril de 1989 seguidos de breves descensos en las clases de edades máximas (8 a 14 meses) y permanecieron constantes hasta marzo de 1989.
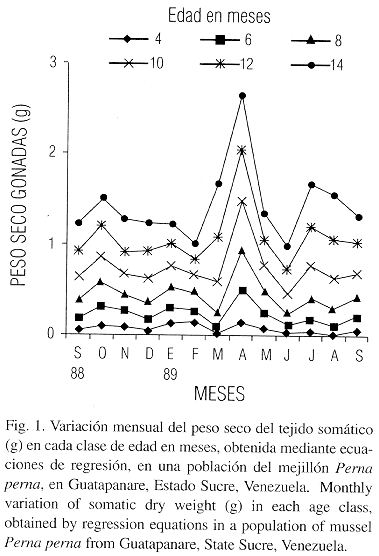
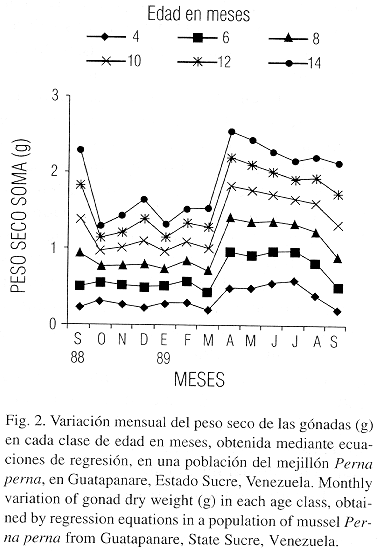
El peso seco de las gónadas (pg) registró un aumento ligero en octubre de 1988, con variaciones ligeras entre noviembre y febrero de 1989, alcanzando su máximo en abril con una disminución en marzo y junio. En julio de 1989 hay una recuperación para descender en agosto y aumentar ligeramente en septiembre de 1989, salvo la clase de edad 14 (Fig. 2).
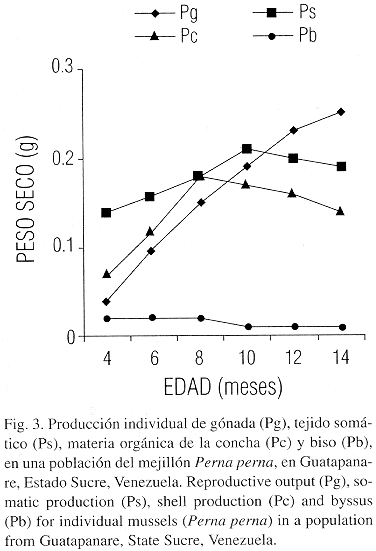
La producción de tejido somático, alcanzó su máximo a los diez meses mientras que la materia orgánica de la concha y el biso alcanzaron sus máximos valores a los ocho meses de edad, declinando a partir de entonces (Fig. 3). La producción de gametos, por el contrario, se incrementó con la edad hasta la mayor clase estudiada (Cuadro 3). Finalmente la producción total (P) se estabilizó a partir de los 10 meses.
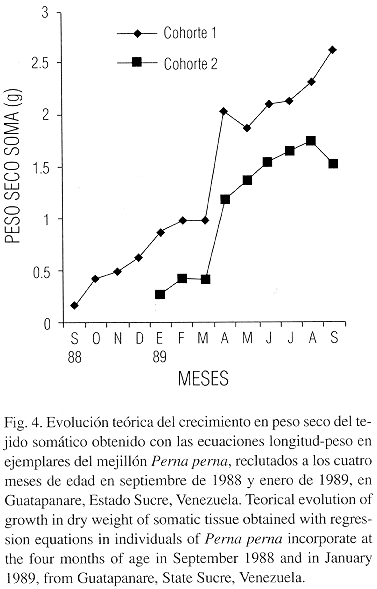
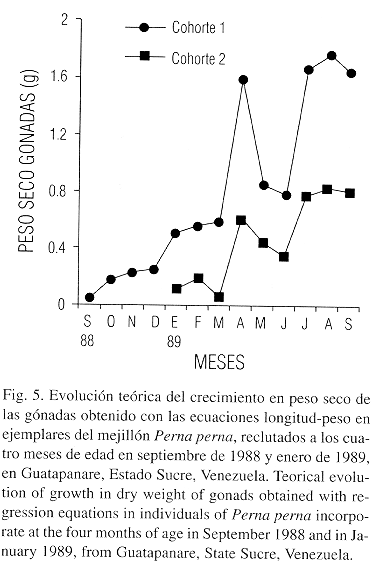
La evolución teórica del crecimiento en peso seco del tejido somático (Fig. 4) y las gónadas (Fig. 5) calculado a partir de las ecuaciones longitud-peso para mejillones reclutados a los cuatro meses en septiembre de 1988 y enero de 1989 muestran un comportamiento similar, aunque en estos últimos se observó una disminución en el peso de las gónadas en el mes de marzo de 1989.
El peso seco de la materia orgánica de la concha (pc) presentó valores constantes con muy pocas variaciones durante el período estudiado y el promedio de materia orgánica (conquiolina) representó el 6.49 ± 0.15 % del peso seco de la concha de Perna perna.
La variación del peso seco (biomasa) individual total en todas las edades indica la existencia de un aumento leve en noviembre de 1988, seguido de otro más pronunciado que se inicia en marzo de 1989 y que alcanza el máximo en el mes de abril del mismo año, para descender progresivamente hasta septiembre de 1989. En las clases menores de seis meses las biomasas mínimas se observaron en diciembre de 1988 y marzo de 1989, mientras que en diciembre de 1988 las clases mayores de 10 meses mostraron un leve aumento de biomasa.
La biomasa total y el esfuerzo reproductivo (Pg/P) en promedios mensuales guardaron una relación directamente proporcional con la edad, mientras que la tasa de renovación (P/B) disminuyó con la edad (Cuadro 3).
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
| | | | | | | | | | |
All parameter are expresed in monthly means
Las estimaciones de la producción para los meses de mayor crecimiento como fueron octubre de 1988 y abril de 1989 presentaron las mismas tendencias en términos generales con relación a las distribuciones energéticas. El crecimiento del tejido somático presentó un pico pequeño en diciembre de 1988 y otro de mayor grado en abril de 1989 (Fig. 1). Aunque el comportamiento de las clases menores de 8 meses no sigue el mismo patrón, con relación al primero. Estas tasas son observables al graficar el crecimiento de este tejido, utilizando las ecuaciones longitud – peso en individuos reclutados a los cuatro meses de edad en septiembre de 1988 y en enero de 1989 (Fig. 4). En el crecimiento de las gónadas utilizando las ecuaciones longitud – peso en individuos reclutados a los cuatro meses en los mismos períodos, se observa que en los primeros la tasa de producción de gónadas es mayor, aunque en los reclutados a partir de enero de 1989 parece ocurrir un desove parcial en marzo del mismo año (Fig. 5). De acuerdo a los resultados obtenidos un mejillón con un año de edad y una biomasa de 4.32 g, exporta anualmente como gametos la cantidad de 2.76 g que es equivalente al 63.68 % de su biomasa y al 38.33 de su producción total (Cuadro 3).
El biso, con relación a la edad, presentó bajas tasas de crecimiento en noviembre de 1988 y marzo de 1989, en cambio el contenido de materia orgánica de la concha en las diferentes edades fue constante. El índice gonadosomático presentó dos picos claramente definidos, el primero ocurrio en octubre de 1988 y el segundo, de mayor magnitud, alcanzó valores máximos en abril y mayo de 1989 disminuyendo luego (Cuadro 4).
| Mes | |
| |
| Septiembre, 1988 | | | |
| Octubre | | | |
| Noviembre | | | |
| Diciembre | | | |
| Enero, 1989 | | | |
| Febrero | | | |
| Marzo | | | |
| Abril | | | |
| Mayo | | | |
| Junio | | | |
| Julio | | | |
| Agosto | | | |
| Septiembre | | | |
Discusión
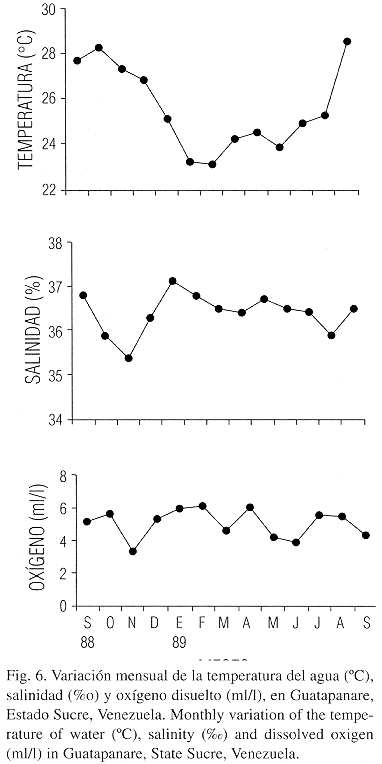
El crecimiento de Perna perna en Guatapanare determinado con datos de Carvajal (1969) es superior al informado para la misma especie en Sudáfrica por Berry (1978), lo cual indica que logran un mayor tamaño en menor tiempo, probablemente debido a las mejores condiciones del ambiente. Los valores bajos en el promedio del peso seco de la biomasa total registrados durante los primeros seis meses (septiembre de 1988 – febrero de 1989) revelan la existencia de un período pobre en cuanto a producción se refiere, mientras que el aumento de marzo de 1989 hasta abril de 1989 es originado por un incremento en la disponibilidad de alimento, relacionado con el fenómeno de surgencia que se da con regularidad en la región, causando un notable incremento de la productividad primaria debido a los nutrientes que aporta el afloramiento de aguas profundas (Griffiths y Simpson 1972, Ferraz – Reyes 1980).
En este período se registra una disminución de la temperatura, aumento de la salinidad y del oxígeno disuelto (Fig. 6) con una fuerte incidencia de vientos que aumentan la intensidad del oleaje, aportando un subsidio energético que contribuye a la formación de detritus, acelera el flujo de agua y mantienen en suspensión partículas que sirven de alimento a muchos filtradores, y en especial a los mitílidos los cuales lo utilizan como una fuente adicional de alimentación, explotando totalmente su potencial de filtración (Kiorboe et al. 1981, Lodeiros et al. 1993).
Los cambios en los pesos de la biomasa total que expresan las variaciones de la velocidad del crecimiento de los tejidos somático y gonadal, representan el comportamiento típico de algunas especies tropicales que disponen de un suministro de energía contínuo.
La productividad de las gónadas se estimó sobre la base de la disminución del peso en los dos períodos principales de desove (octubre- diciembre de 1988 y abril-julio de 1989), sin tomar en consideración otro probable desove ocurrido en febrero de 1989, los cuales han sido previamente señalados por Carvajal (1969) y Vélez (1971). En Perna perna la actividad gonadal es contínua y no ocurren desoves totales, por lo que existe una rápida capacidad de recuperación con gametogénesis y desoves prolongados que pudieran propiciar una subestimación de la producción.
La variación mensual del índice gonosomático (Cuadro 4) coincide parcialmente con la de los pesos gonadales (Fig. 2). Las diferencias observadas en la variación del peso de las gónadas para el mes de marzo de 1989 entre los mejillones de cero a 10 meses y los de mayor edad (12 y 14 meses) pueden explicarse por las siguientes razones: 1. Un error en la predicción de la ecuación de conversión longitud – peso. 2. Indicación de un desove previo o más pronunciado del primer grupo y 3. Diferencias en el comportamiento reproductivo de las edades. Esta última hipótesis parece descartarse al analizar la evolución teórica del crecimiento de las gónadas en individuos reclutados a los 4 meses en dos períodos diferentes, donde se observa un comportamiento similar (Fig. 5); aunque los mejillones reclutados en septiembre de 1988 pierden en el desove de abril de 1989 un mayor porcentaje de peso con una edad de 12 meses. Hacen falta sin embargo estudios histológicos y bioenergeticos directos para analizar en detalle este comportamiento. Berry (1978) ha señalado que las cohortes de Perna perna en Natal (Sur – Africa) pueden presentar dinámicas bioenergeticas diferentes.
La disminución del peso de las gónadas en los mejillones observado en febrero de 1989 (Fig. 2) pudiera explicarse por la baja temperatura del agua (Fig. 6), que inhibe el desarrollo de los gametos en la especie (Vélez y Epifanio 1981) o más probablemente por la ocurrencia de una marea roja observada que pudo haber debilitado a la población. En Argopecten irradians se ha informado que este fenómeno induce un agotamiento de las gónadas, con reabsorción de la energía destinada a la reproducción, aunque los organismos sobrevivientes experimentaron una notable recuperación (Bricelj et al. 1987). En el presente trabajo a partir de marzo de 1989 se observó un fuerte incremento en la generación de tejido gonádico con un máximo en abril de 1989, explotando la elevada disponibilidad de alimento y preparándose para el principal desove ocurrido hasta junio de 1989, en el cual los individuos más grandes invierten mayor cantidad de energía desarrollando un alto esfuerzo reproductivo. Diversos autores han señalado que los bivalvos adultos poseen una mayor estabilidad fisiológica basada en una cantidad superior de reservas energéticas en condiciones de ser movilizadas con mayor facilidad para soportar alteraciones orgánicas introducidas en el medio ambiente (Langton et al. 1987).
Las fluctuaciones observadas entre septiembre y diciembre de 1988 en el tejido somático (Fig. 1) con tendencias opuestas entre individuos mayores y menores de 6 meses, puede ser debido principalmente al incremento de la actividad reproductiva ocurrida en octubre; en el cual los mejillones mayores de 6 meses exhibieron esfuerzo reproductivo más elevado, restando energía para el crecimiento. El aumento del peso seco somático a partir de abril de 1989 (Fig. 1) coincide con un incremento de los sustratos energéticos informados por Benitéz (1968). En regiones templadas se ha demostrado que diversas especies de bivalvos movilizan sustratos energéticos de tejido somático para la formación de gametos (Taylor y Venn 1979, Barber y Blake 1981). También ha sido observado en el pectínido tropical Euvola (Pecten) ziczac (Brea 1986 y Marcano 1989).
Los mejillones presentaron un aumento gradual en la tasa de producción de materia orgánica de la concha hasta los 8 meses, en cambio el ligero aumento observado en los mayores de 8 meses en marzo de 1989 pudiera explicarse por la elevada disponibilidad de alimento que existe en ese lapso (Ferraz – Reyes 1980, Griffiths y Simpson 1972) lo que implicaría un mayor consumo. El incremento en el peso seco del biso observado en diciembre de 1988 probablemente ocurre como una estrategia de los individuos para fijarse en una época en la cual la dinámica del oleaje es violenta tal como ha sido informado en Mytilus edulis (Price 1982). El segundo máximo ocurrido en abril de 1989, coincide con el período de mayor producción de tejidos e igualmente con las altas tasas de productividad primaria, relacionadas normalmente con períodos previos de surgencias.
La producción de tejido somático aumenta hasta la edad de 10 meses, en cambio la producción de gónadas aumenta desde tempranas edades, representando a los seis meses mas del 20 % de la producción total (Fig. 3, Cuadro 3). Este comportamiento constituye una estratégia adecuada para una especie cuya longevidad normalmente no alcanza los 18 meses y que debe explotar su potencial reproductivo desde muy temprana edad para garantizar la viavilidad de la población, aprovechando las condiciones del medio, donde no se presentan limitaciones excesivas en el suministro de alimento. A los 12 meses de edad, el mejillón alcanzó un esfuerzo reproductivo medio de 38.33 %, lo que indica que cerca de la mitad de la energía invertida en la producción total es vertida al medio como gametos, estimación muy superior a la informada por Berry y Schleyer (1983) en una población de Perna perna de Suráfrica.
El promedio de materia orgánica determinado con relación al peso de la concha (6.5 %) es ligeramente más elevado que el de mitílidos de zonas templadas. Barker-Jorgensen (1976) reportó de 5.4 a 6.0 % en Modiolus demisus y 4.3 % en Mytilus edulis, Price et al. (1976) estimaron 5.32 % en Mytilus edulis y entre 4.6 y 6.2 en Modiolus demisus. Se ha señalado que la temperatura del agua puede influir sobre el tipo de cristal de la concha de los moluscos, debido a que origina cambios en la actividad secretora del manto, los cuales se reflejan en los componentes orgánicos e inorgánicos del fluído extrapaleal. La salinidad, otro componente del ambiente, puede también afectar la composición orgánica de la concha (Price et al. 1976). La producción de materia orgánica en este trabajo osciló entre 25 y 33 % de la producción total, disminuyendo con la edad. Este porcentaje es semejante al reportado por Kautsky (1982) en Mytilus edulis (25 %), aunque otros autores han determinado valores más altos en otras poblaciones de esta última especie (Price et al. 1976).
La tasa de producción del biso se mantuvo estable hasta los ocho meses, disminuyendo luego, y alcanzó un 3.60 % del total, superando los valores de 1.2 y 1.7 % reportados por Berry (1978) en la población de Suráfrica.
La tasa de producción total aumentó constantemente, aunque se estabilizó a los 12 meses, compensando el comportamiento reproductivo, la reducción de la tasa de producción del tejido somático a partir de los 12 meses y de la materia orgánica de la concha y biso a partir de los 10 meses (Fig. 3, cuadro 3). Tendencias similares, con relación a la evolución individual de estos compartimientos, han sido reportadas en poblaciones de bivalvos de zonas templadas (Thompson 1984); no obstante, en especies como Patinopecten caurinus la producción total puede reducirse a edades tempranas debido a que la generación de tejido somático y materia orgánica de la concha disminuyen más rapidamente que lo que se incrementa la producción de gametos (MacDonald y Bourne 1987).
La disminución de la tasa de renovación (P/B) con relación a la edad es un proceso que ocurre en todos los bivalvos y se explica debido a que individuos más viejos dedican una mayor cantidad de energía para el soporte del metabolismo que los jovenes, resultando en menos energía disponible para la producción en comparación con el tamaño del cuerpo. Por la misma razón los jóvenes son más eficientes en la utilización de energía para el crecimiento (MacDonald y Thompson 1986). En Mytilus edulis de zonas subárticas, con una alta longevidad, la tasa de renovación es independiente de la edad (Thompson 1984).
El esfuerzo reproductivo se incrementó con la edad alcanzando el 42.37 % a los 14 meses. En especies de zonas templadas el esfuerzo reproductivo alcanza valores más altos (Kautsky 1982); sin embargo, debe tenerse en cuenta que éstas tienen un crecimiento más lento y su reproducción ocurre en un lapso breve, de forma explosiva, aprovechando las condiciones ambientales. Se ha sugerido que existe una considerable variación intraespecifica en la repartición de la energía en las poblaciones que depende de los factores ambientales, así MacDonald y Thompsom (1986) señalan que la liberación de altos porcentajes de producción en gametos sea una característica de especies de agua fría y alta longevidad. En el caso de la población estudiada de Perna perna, esta se caracteriza por una corta longevidad con desoves parciales intermitentes desde edades tempranas que garantizan la viabilidad de la población.
Resumen
Se estudió la producción de biomasa en gónadas, tejido somático, materia orgánica de la concha y biso en individuos de una población explotada del mejillón Perna perna en Guatapanare, Estado Sucre, Venezuela, en muestras mensuales recolectadas desde septiembre de 1988 hasta septiembre de 1989. La variación mensual de cada componente se evaluó utilizando ecuaciones de regresión y un modelo de crecimiento en la misma población. La especie es de crecimiento rápido alcanzando 87.84 mm a los 12 meses. La producción de tejido somático fue máxima a los 10 meses de edad mientras que la producción de materia orgánica y biso alcanzaron sus máximos a los ocho meses, disminuyendo luego. La producción de gónadas evaluada por la pérdida de peso en los dos principales desoves (octubre – noviembre de 1988 y abril – junio de 1989) aumenta con la edad desde un valor de 0.4 g/mes a los cuatro meses hasta 0.25 a los 14 meses de edad. La relación P/ B disminuye con la edad mientras que el esfuerzo reproductivo (Pg/P x 100) aumenta desde 14.81 % a los cuatro meses hasta 42.37 a los 14 meses de edad, revelando la existencia de una estrategia de supervivencia poblacional con individuos de reducida longevidad y un alto potencial reproductivo desde muy joven que garantizan la viabilidad de la población.
Referencias
Barber, B. & J. Blake. 1981. Energy storage and utilization to gametogenesis in Argopecten irradians concentricus (Say). J. Exp. Mar. Biol. 52: 124 – 133. [ Links ]
Barker – Jorgensen, C. B. 1976. Growth efficiences and factors Controling size in some mylitids bivalves, especially Mytilus edulis (L): review and interpretations. Ophelia 5: 175 – 192. [ Links ]
Bayne, B. L. & C. M. Worrall. 1980. Growth and production of mussels Mytilus edulis from two populations. Mar. Ecol. Prog. Ser. 3: 313 – 328. [ Links ]
Benitez, J. 1968. Variación mensual de la composición química del mejillón Perna perna (L). Bol. Inst. Oceangr. Univ. Oriente 7: 137 – 147. [ Links ]
Berry, P.F. 1978. Reproduction Growth and production in the mussel Pena-perna (L) on the east coast of South Africa. S. Afr. Ass. Mar. Ecol. Res. Oceanogr. Res. Inst. Rep. 48: 1 – 28. [ Links ]
Berry, P. F. & M. H. Schleyer. 1983. The brown mussel, Perna perna on the Natal Coast, South Africa: utilization of available food and energy budget, Mar. Ecol. Prog. Ser. 13: 201 – 210. [ Links ]
Brea, J. 1986. Variaciones estacionales en la composición bioquimica de Pecten ziczac (L.1758) en relación al metabolismo energético, crecimiento y reproducción. Tesis de Licenciatura. Universidad de Oriente. Cumaná, Venezuela. [ Links ]
Bricelj, V. J. Epp. & R. E. Malouf. 1987. Intraspecific variation in reproductive and somatic growth cycles of bay scallops Argopecten irradians. Mar. Ecol. Prog. Ser. 356: 123 – 137. [ Links ]
Burke, M. V. & K. H. Mann. 1974. Productivity and production: biomass rations of bivalves and gastropod populations in a eastern Canadian estuary. J. Fish. Res. Bol. Can. 31: 167 – 177. [ Links ]
Carvajal, J. 1969. Fluctuación mensual de las larvas y crecimiento del mejillón Perna perna (L) y la condiciones ambientales de la Ensenada de Guatapanare, Edo. Sucre. Venezuela. Bol. Inst. Oceanogr. Univ. Oriente 8: 13 – 20. [ Links ]
Crisp, D. J. 1971. Energy flow measurements, p. 197-279. In N. A. Holmes & A. D. MacIntyre (eds). Methods for the study of marine Benthos. Blackwell. Oxford. [ Links ]
Dare, R. F. 1976. Settlement, growth and production of the mussel Mytilus edulis (L) in Morecambe Bay, England. Fish. Invest. London. Ser. III. 28: 1 – 25. [ Links ]
Ferraz – Reyes, E. 1980. Productividad primaria del Golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venezuela 26: 97 – 110. [ Links ]
Griffiths, R. C. & J. G. Simpson. 1972. Afloramiento y otras características oceanográficas de las aguas costeras del noreste de Venezuela. Serie recursos y Explotación pesquera. M.A.C./ P.N.U.D./ F.A.O. 2: 1 – 72. [ Links ]
Griffiths, R. J. 1980. Ecophysiology of the black mussel Chloromytilus meridionalis (Kr). Unpublished Ph. D. Thesis, University of Cape Town, South Africa. [ Links ]
Kautsky, N. 1982. Quantitalive studies on gonad cycle, fecundity, reproductive output and recruitment in a Baltic Mytilus edulis populations. Mar. Biol. 68: 143 – 160. [ Links ]
Kiorboe, T., F. Mohlenberg & O. Nohr. 1981. Effect of bottom material on growth and energetics in Mytilus edulis. Mar. Biol. 61: 283 – 288. [ Links ]
Langton, R. W., W. Robinson & D. Schick. 1987. Fecundity, and reproductivity effort of sea scallop Placopecten magellanicus from the Gulf of Maine. Mar. Ecol. Prog. Ser. 37: 19 – 25. [ Links ]
Lodeiros, C., L. Freites, M. Nuñez & J. Himmelman. 1993. Growth of the caribbean scallop Argopecten nucleus (Born 1780) in suspended culture. J. Shellfish Res. 12: 291-294. [ Links ]
Lunetta, J. E. 1969. Reproductive physiology of the mussel Mytilus perna. Bol. Fac. Filos. Cienc. Univ. S. Paulo 26: 33 – 111. [ Links ]
MacDonald, B. A. & F. Bourne. 1987. Growth, reproductive output, and energy partitioning in weathervane scallop, Patinopecten caurinus from British Columbia. Can. J. Fish. Aquat. Sci. 44: 152 – 160. [ Links ]
MacDonald, B. A. & R. J. Thompson. 1986. Producción, dynamic and energy partitioning in two populations of the giant scallop Placopecten magellanicus. J. Exp. Mar. Biol. Ecol. 101: 285 – 299. [ Links ]
Marcano, L. 1989. Composición Bioquímica de algunos tejidos e índice gonosomático, y capacidad oxidativa mitocondrial de la glandula digestiva de Pecten ziczac (L), bajo condiciones controladas. Tesis de Licenciatura, Universidad de Oriente, Cumaná, Venezuela. [ Links ]
Price, T. J., G. W. Thayer, M. W. LaCroiz & G. P. Montgomery. 1976. The organic content of shell and soft tissues of selected estuarine gastropods and pelecipods. Proc. Shellfish. Assoc. 85: 26 – 31. [ Links ]
Price, H. A. 1982. An analysis of factors determining seasonal variation in the bissal attachment strength of Mytilus edulis. J. Mar. Biol. Ass. U. K. 62: 147 – 155. [ Links ]
Prieto, A., R. Pereira & R. Manrique. 1985. Producción secundaria del mejillón Modiolus squamosus (Beauperthuy, 1967) en Tocuchare, Golfo de Cariaco. Venezuela. Act. Cient. Venez. 36: 258 – 264. [ Links ]
Tata, A. & A. Prieto. 1981. Producción secundaria en una población de bivalvo tropical Tivela mactroides (Veneridae) en el oriente de Venezuela. Carib. J. Sci. 21: 28 – 34. [ Links ]
Taylor, A. & T. Venn. 1979. Seasonal Variation in the weight and biochemical composition of the tissues of the queen scallop Chlamys opercularis from the Clyde Sea Area. J. Fish. Res. Bd. Can. 34: 2184- 2116. [ Links ]
Thompson, R. J. 1984. Production, reproductive effort, reproductive value and reproductive east in a population of the blue mussel Mytilus edulis from a subartic environment. Mar. Ecol. Prog. Ser. 16: 249 – 257. [ Links ]
Velez, A. & R. Martínez. 1967. Reproducción y desarrollo larval experimental del mejillón comestible de Venezuela Perne perna (L) Bol. Inst. Oceanogr. Univ. Oriente 6: 266 – 285. [ Links ]
Velez, A. 1971. Fluctuación mensual del índice de engorde del mejillón Perna-perna natural y cultivado. Bol. Inst. Oceanogr. Universidad Oriente 10: 3 – 8. [ Links ]
Velez, A. & E. Epifanio. 1981. Effects of temperature and ration on gametogenesis and growth in the tropical mussel Perna perna (L). Aquaculture 22: 21 – 26. [ Links ]
1 Laboratorio de Ecología de Poblaciones, Departamento de Biología, Escuela de Ciencias, U.D.O.
Cumaná, Estado Sucre, Venezuela, Apdo. 245. E-mail: liruiz@sucre.udo.edu.ve














