Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.47 n.1-2 San José Jun. 1999
(Dryopteridaceae)
Aniceto Mendoza Blanca Pérez-García Ramón Riba 1
Recibido 22-IV-1998. Corregido 25-X-1998. Aceptado 30-X-1998.
Sexual phase development was studied in Didymochlaena truncatula, on the basis of spores collected in Península Moreno and Tebanca, Catemaco, Veracruz, México. The spores are monolete, ellipsoid, with perine, and non-clorophyllic. The germination pattern is of the Vittaria-type and the prothallial development is of the Adiantum-type, the adult gametophytes are cordiform to reniform and without trichomes; the gametangia are typical of the leptosporangiate ferns. The first leaf of the sporophyte appears 100 days after the sowing of the spores, the lamina is spatulate-shaped, with dichotomous venation and short capitate, unicellular marginal hairs.
Key words
Didymochlaena, Dryopteridaceae, gametophyte, México, morphogenesis, prothallus, Pteridophyta.
Didymochlaena truncatula (Sw.) J. Sm., es un género monotípico de amplia distribución de la familia Dryopteridaceae, crece desde Veracruz (México) hasta el sur de Panamá, en las Grandes Antillas (excepto Jamaica), norte de Sudamérica y sureste de Brasil; en el Viejo Mundo se encuentra en regiones tropicales del este y sureste de África, India, especialmente en la región del Himalaya, China, Japón, Malasia y Australia; habita en selvas altas y en bosques húmedos, entre los 100-1000 m snm y raramente hasta 2300 m de altitud. Esta planta se caracteriza por tener hojas monomorfas, bipinnadas, el ápice conforme a las pinnas laterales, las pínnulas son dimidiadas, los soros tienen indusios alargados y redondeados en el extremo distal, distribuídos en ambos lados de la nervadura y curvados alrededor de su ápice; las esporas son monoletes; número cromosómico: n= 41 (Mickel y Beitel 1988, Moran 1995, Riba y Pérez-García 1997, Tryon y Tryon 1982).
Como resultado de la revisión bibliográfica se han encontrado estudios de la fase sexual de algunos géneros de la familia Dryopteridaceae, tales como Arachniodes, Cyrtomium, Polystichum (Atkinson 1973, Chandra y Nayar 1970), Didymochlaena (Stokey y Atkinson 1954) y Dryopteris (Atkinson y Stokey 1973, Cousens 1975 y Kaur 1977), todos ellos hechos en el Viejo Mundo, no existiendo al momento estudios para especies mexicanas que conforman la familia.
Este trabajo pretende complementar la información existente sobre la morfogénesis de la fase gametofítica de D. truncatula, esperando con ello contribuir al conocimiento de las especies mexicanas.
Materiales y Métodos
Las esporas se obtuvieron guardando en bolsas de papel pinnas fértiles obtenidas de ejemplares de D. truncatula recolectados en el campo, en las localidades de Península Moreno (Coyame) y 3.5 km al este de Tebanca, Municipio de Catemaco, Veracruz (ejemplares de respaldo AMR-142, AMR-205, depositado en UAMIZ).
Una vez liberadas las esporas, se tamizaron con una malla metálica del No. 200 con poros de 0.074 mm de diámetro para eliminar restos de esporangios e indusios. Las esporas fueron sembradas en 30 cajas de Petri de 5 cm de diámetro, que contenían medio de cultivo de Thompson previamente esterilizado (Klekowski 1969 y Pérez-García 1989). Las esporas se esparcieron con un pincel de pocas cerdas sobre la superficie del medio solidificado, con una densidad promedio de 150-200 esporas por cm2.
Los cajas se mantuvieron en condiciones de laboratorio dentro de bolsas de polietileno transparente, para evitar contaminación y desecación, con un fotoperiodo de 12 hrs luz-oscuridad con luz artificial (lámparas Solar 75 Watts, luz de día), a una temperatura de 24-28 °C; tres cajas se mantuvieron en obscuridad para determinar fotoblastismo (Mendoza et al. 1996-1997).
Los gametofitos fértiles se fijaron en FAA (5% formaldehido + 5% ácido acético + 63% alcohol + 27% agua), se deshidrataron en alcoholes graduales (30%, 50%, 70% y 100%) y fueron infiltrados en JB-4 (mezcla plástica de componente A + componente B + catalizador), los cortes de los gametofitos con un grosor de 2 µm se hicieron con un ultramicrotomo, te idos posteriormente con azul de toluidina O y montados con resina sintética (OBrien et al. 1964).
Las fotomicrografías fueron tomadas de material en vivo y preparaciones fijas.
Resultados
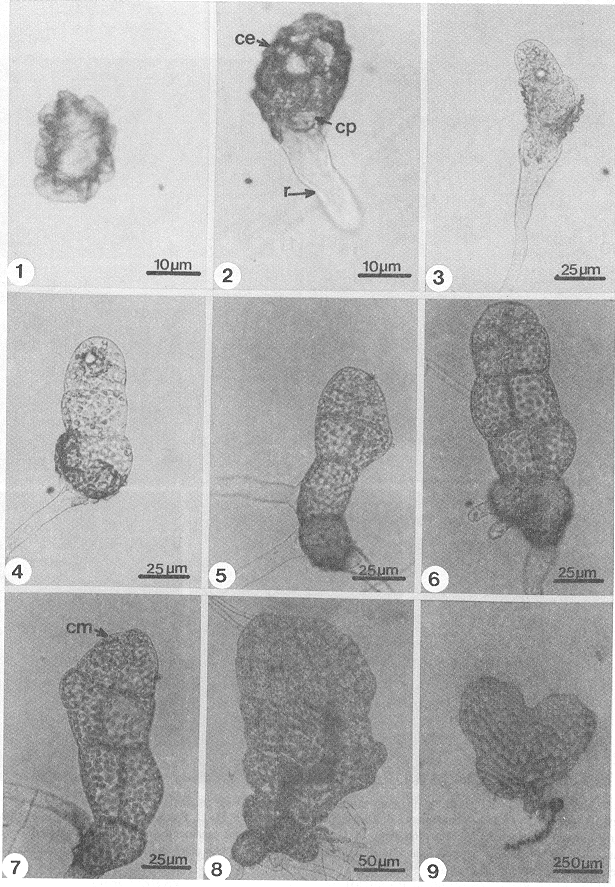
Esporas: Son monoletes de color pardo claro, miden 30-37 µm, con perina bien diferenciada, de forma elipsoidal a ligeramente esferoidal, superficie rugosa, equinulada a tuberculada y con prominentes pliegues (Fig. 1). (Tryon y Lugardon 1982, Tryon y Tryon 1991.)
- Fig 1-9. Germinación y fases láminares de Didymochlaena truncatula. 1. Espora, 2. Germinación de la espora (7 días), 3-4. Fases filamentosas (12 días), 5-7. Inicios de la fase láminar (15-18 días), 8-9. Fases láminares jovenes (28-38 días). ce= cubierta de la espora, cm= célula meristemática, cp= célula protálica, r= rizoide.
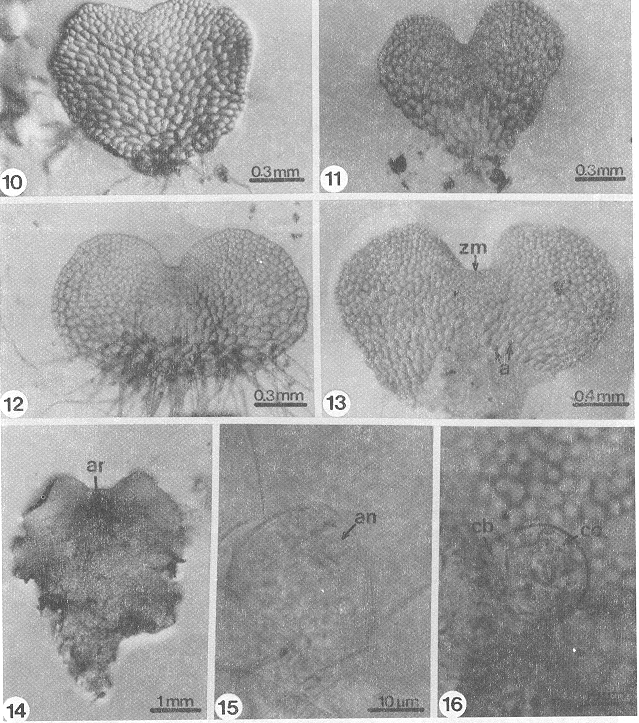
Desarrollo protálico: Es de tipo Adiantum (Nayar y Kaur, 1969) y se inicia entre los 8-12 días después de la germinación de la espora. Por divisiones paralelas de la pared de la célula protálica inicial se forma un filamento corto de 2-3 células de longitud (Figs. 3, 4), la formación de la lámina se inicia entre los 15-25 días por divisiones longitudinales y transversales de la célula terminal del filamento germinativo, delimitando una célula meristemática obcónica (Fig. 5). Por la actividad de esta célula, entre los 28-35 días se forma un protalo joven espatulado (Fig. 6), más tarde (40-50 días) el ápice del gametofito se modifica y forma un meristemo pluricelular que reemplaza a la célula meristemática inicial, formando una escotadura y finalmente se forma un protalo cordiforme-espatulado glabro (Figs. 7, 8, 9). Los protalos maduros (60 días), se caracterizan por ser cordiforme-espatulados a cordiforme-reniformes con su meristemo pluricelular de posición apical formando una escotadura, el cojinete es central con cinco a siete capas de células de grosor y en él se localizan los gametangios, los rizoides son abundantes, hialinos de color pardo claro y sin cloroplastos (Figs. 10-14). los gametofitos adultos son monoicos y glabros.
- Figs. 10-16. Fases liminares y gametangios de Didymochlaena truncatula. 10-12. Fases laminares adultas (36-46 días), 13. Gametofito cordiforme con anteridios (60 días), 14. Gametofito cordiforme espatulado con arquegonios (150 días), 15-16. Anteridios (60-70 días). a= anteridios, an=anterozoides, ar=arquegonios, cb= célula basal, cm= célula media, co= célula opercular, zm= zona meristemática.
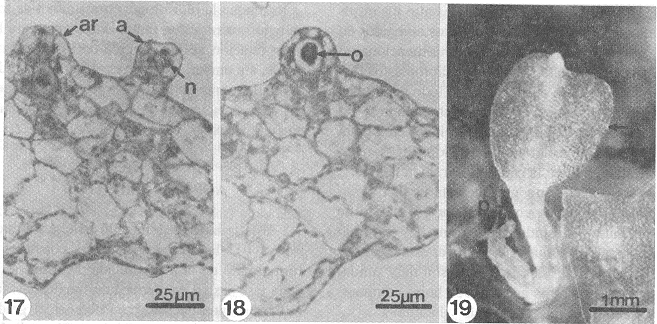
Gametangios: La formación de los arquegonios se inicia alrededor de los 45-50 días, se encuentran distribuidos en la región apical del cojinete, cercanos a la zona meristemática, el cuello del arquegonio está formado por cuatro hileras de células, la boca tiene cuatro células, éstos están orientados hacia la región basal del protalo (Figs. 14 , 17, 18).
Los anteridios se forman de manera simultánea que los arquegonios, se encuentran distribuidos en la región media inferior del gametofito, sobre el cojinete y entre los rizoides (Fig. 13); están formados por 3 células, una célula basal, una célula media y una opercular que rodean a la célula espermatógena (Figs. 15, 16, 17), el mecanismo de dehiscencia y liberación de los anterozoides es por la apertura de un poro en la pared expuesta de la célula espermatógena, después del desprendimiento de la célula opercular.
Esporofito: Las primeras hojas se forman después de 100 días de haber sido sembradas las esporas, son de forma espatulada con venación dicotómica, tricomas marginales unicelulares, cortos y capitados (Fig. 19). Los estomas son del tipo anomocítico por no tener células subsidiarias (Van Cotthem 1973), las paredes laterales de las células epidérmicas de las caras adaxial y abaxial de la lámina son onduladas.
- Figs. 17-19. Gametangios y primeras hojas del esporofito de Didymochlaena truncatula. 17. Corte longitudinal de arquegonio y anteridio, 18. Corte longitudinal del cuello de arquegonio con la oosfera, 19. Primeras hojas del esporofito (100 días). a= anteridio, ar=arquegonio, l= lámina, n= núcleos de las células del anteridio, o= oosfera, p=pecíolo.
DIiscusión
Stokey y Atkinson (1954) describieron la morfología del protalo de Didymochlaena sinuata Desv. (= D. truncatula (Sw.) J. Sm.). Sin embargo es importante resaltar que el trabajo fue realizado con esporas procedentes del Jardín Botánico de Bruselas, sin mencionar ejemplares de respaldo, por lo que se desconoce su procedencia silvestre, razón por la cual se estudió el material proveniente de México.
Nuestros resultados concuerdan con los descritos por las autoras en lo siguiente: las esporas son monoletes con perina, de color pardo y miden en promedio de 30 a 37 m, la germinación se inicia después de cinco-siete días de la siembra, el patrón de germinación es tipo Vittaria y el desarrollo protálico tipo Adiantum, los talos maduros son glabros y varían de cordiforme-espatulados a cordiforme-reniformes; los gametangios son del tipo común de los helechos leptosporangiados; los anteridios tienen una célula basal, una célula media y una célula opercular que rodean a la célula espermatógena. La dehiscencia se da por el desprendimiento de la célula opercular y la liberación de los anterozoides es a través de un poro que se forma en la pared expuesta de la célula espermatógena. Los cuellos de los arquegonios están formados por cuatro hileras de células, cada hilera tiene de 4 a 5 células.
Una diferencia importante entre los resultados de Stokey y Atkinson y los obtenidos en este estudio es que dichas autoras mencionaron haber observado rizoides con cloroplastos (los que se pierden después) sobre todo en el margen de la lámina de gametofitos adultos; sin embargo, en nuestras observaciones en ningún caso se encontraron rizoides clorofílicos, ni en el margen ni en la cara inferior de la lámina.
Se puede suponer que esta es una variación relacionada con el origen geográfico de las muestras estudiadas, pero no hay información adicional que pueda apoyar esta idea. Las primeras hojas del esporofito son muy similares a las de otros géneros con hojas compuestas, con tricomas en pecíolo y lámina.
Finalmente, comparando los gametofitos de esta especie con los gametofitos de los géneros Arachniodes, Cyrtomium (Chandra y Nayar 1970), Dryopteris (Cousens 1975, Kaur 1977), Phanerophlebia, Polystichum y Olfersia (Mendoza, obs. p.) que están considerados dentro de la familia Dryopteridaceae y que crecen en México, observamos que los gametofitos de Didymochlaena son totalmente desnudos (carecen de tricomas), en comparación con los protalos de los géneros mencionados anteriormente, los que presentan numerosos tricomas tanto marginales como superficiales, lo cual los hacen diferentes del resto de los géneros pertenecientes a esta familia. Pero a nivel de gametangios, encontramos que los anteridios son similares, presentan tres células: una célula basal, una media y una opercular que estan rodeando la célula espermatógena y cuellos de los arquegonios estan formados por 4 hileras de células.
Por lo observado en este estudio la consideración del género Didymochlaena dentro de la familia Dryopteridaceae sigue estando basada en las características del esporofito, pero los protalos son glabros a diferencia de los gametofitos de los otros géneros pertenecientes a la familia Dryopteridaceae que presentan tricomas marginales y superficiales y según Stokey y Atkinson, son del tipo primitivo y no aportan datos adicionales para debatir la taxonomía del género.
Aunque la morfología comparativa de los gametofitos no es un factor dominante para la interpretación de la filogenia de los helechos puede, sin embargo, ser de considerable ayuda particularmente en lo que respecta a los géneros cuya posición en una familia se encuentra aun en discusión.
Agradecimientos
Este trabajo se desarrolló en el Laboratorio AS-102, bajo la asesoría de los coautores y forma parte de la tesis titulada: Morfogénesis de la fase sexual de pteridofitas mexicanas: familia Dryopteridaceae, para obtener el grado de Maestro en Ciencias (Biología Vegetal) del primer autor. Se agradece a Judith Márquez su asesoría en la parte anatómica, así como también a Jacqueline Ceja Romero su revisión y comentarios hechos a este trabajo y a los revisores externos por las críticas y sugerencias al manuscrito.
Resumen
En este trabajo se presenta el estudio de la fase sexual de Didymochlaena truncatula. Las espora son monoletes con perina, elipsoidales, no clorofílicas. Su germinación es tipo Vittaria y su desarrollo protálico es tipo Adiantum, el gametofito adulto es cordiforme-espatulado a cordiforme-reniforme, no presentan ningún tipo de tricoma, los rizoides no tienen cloroplastos, sus gametangios son del tipo común de los helechos leptosporangiados, las primeras hojas del esporofito se forman después de 100 días de haber sido sembradas las esporas, son de forma espatulada con venación dicotómica y tricomas unicelulares marginales, cortos y capitados.
Referencias
Atkinson, L.M. 1973. The gametophyte and family relationships. In: A.C. Jermy, J.A. Crabbe & B.A. Thomas (Eds.). The phylogeny and classification of the ferns. Bot. J. Linn. Soc. 67 (Suppl.1): 73-90. [ Links ]
Atkinson, L.R. & A.G. Stokey. 1964. Comparative morphology of the gametophyte of homosporous ferns. Phytomorphology 14: 51-70. [ Links ]
Chandra, P. & B.K. Nayar. 1970. Morphology of some polystichoid ferns. I. The gametophytes of Arachniodes, Cyrtomium and Polystichum. J. Linn. Soc.Bot. 63: 265-276. [ Links ]
Cousens, M.I. 1975. Gametophyte sex expression in some species of Dryopteris. Amer. Fern J. 60: 13-27. [ Links ]
Kaur, S. 1977. Morphology of the prothallus and juvenile sporophytes of some species of Dryopteris. Proc. Indian Acad. Sci. 85: 163-171. [ Links ]
Klekowski, E.J. 1969. Reproductive biology of the pteridophyta III. A study of the Blechnaceae. J. Linn. Soc. 62: 360-377. [ Links ]
Mendoza, A., B. Pérez-García, I. Reyes & M. Ricci. 1996-1997. Desarrollo del gametofito de Pteris berteroana C. Agardh (Pteridaceae: Pteridae). Rev. Biol. Trop. 44-45: 51-57. [ Links ]
Mickel, J.T. & J.M. Beitel. 1988. Pteridophyte flora of Oaxaca, Mexico. Mem. Nueva York Bot. Gard. 46:1-568. [ Links ]
Moran, R.C. 1995. Dryopteridaceae, p. 210-226. In R.C. Moran. y R. Riba (Eds.). Flora Mesoamericana. Instituto de Biología, Jardín Botánico de Missouri y Museo de Historia Natural de Londres. [ Links ]
Nayar, B.K. & S. Kaur. 1969. Types of prothallial development in homosporous ferns. Phytomorphology 19: 179-188. [ Links ]
Nayar, B.K. & S. Kaur. 1971. Gametophytes of homosporous ferns. Bot. Rev. 37: 295-396. [ Links ]
OBrien, T.P., N. Feder & M.E. McCully. 1964. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma 59: 367-373. [ Links ]
Pérez-García, B. 1989. Morfogénesis de gametofitos de Cyatheaceae (Pterophyta: Filicales). Tesis Doctoral, Facultad de Ciencias, UNAM, México. [ Links ]
Riba, R. & B. Pérez-García. 1997. Dryopteridaceae. Consejo Nacional de la Flora de México, A. C. 6: 1-85. (En prensa.) [ Links ]
Stokey, A.G. & L.R. Atkinson. 1954. The gametophyte of Didymochlaena sinuata Desv. Phytomorphology 4: 310-315. [ Links ]
Tryon, A.F. & B. Lugardon. 1991. Spores of the Pteridophyta: surface, wall structure, and diversity based on electron microscope studies: i-x. Springer-Verlag, Nueva York. p. 440 - 441. [ Links ]
Tryon, R.M. & A.F. Tryon. 1982. Ferns and allied plants with special reference to tropical America. Springer-Verlag, Nueva York. p. 515-518. [ Links ]
Van Cotthem, W.R.J. 1973. Stomatal types and systematic, p. 57-71. In A.C. Jermy, J.A. Crabbe & B.A. Thomas (Eds.). The phylogeny and classification of the ferns. Academic, Nueva York. [ Links ]
1 Departamento de Biología-Área de Botánica, C. B. S. Universidad Autónoma Metropolitana, Iztapalapa. Apartado Postal 55-535, 09340 México, D. F. Fax: (52-5) 724 4688, amr@xanum.uam.mx