Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.46 n.3 San José Sep. 1998
Abstract
The development of the gametophytic phase of Microgramma nitida is described based on spore samples that was obtained of fertil specimens gathered on Veracruz State, Mexico. The spore sowing density was 40 spores/cm2 ; it is characterized by Vittaria-type germination of the spore, a germinal filament of six cells; young gametophytes are naked, spathulated and later are transformed in cordate-elongated adult gametophytes with wavy borders; marginal, superficial capitated, unicellular hairs; the meristematic cell is wedge-shaped and is quickly replaced by a pluricellular meristem. The antheridia and archegonia are of the usual Polypodiaceae s. str.type. Prothallial developmentis thus of the Drynaria-type. The first leaf of the sporophyte appeared eight months after spore sowing. The leaf is spathulated, with smooth borders and the margin has a row of cells without chlorophyll; bifurcated and pluricellular hairs; anomocytic stomata; the epidermic cells of the sporophyte have wavy walls on upper and lower surfaces.
Key words
Gametophyte, México, Microgramma, morphogenesis, Polypodiaceae s. str.
El género Microgramma pertenece a la familia Polypodiaceae s. str.; está ampliamente distribuído en los trópicos americanos, donde cuenta con aproximadamente 13 especies. En México crece desde Tamaulipas y Veracruz hasta Chiapas en tierras bajas, generalmente desde 0 a 600 m snm en bosques tropicales húmedos, bosques mesófilos de montaña y también es frecuente su aparición a lo largo de riberas y arroyos (Mickel & Beitel 1988).
El género Microgramma es prácticamente desconocido desde el punto de vista de la morfogénesis de la fase sexual, sin embargo, existen algunos trabajos referentes a la fase gametofítica de otros géneros de Polypodiaceae s. str. como Arthromeris, Crypsinus, Lepisorus, Colysis, Lemmaphyllum, Polypodium, Campyloneurum y Pleopeltis. Entre ellos podemos mencionar los estudios de Hartman 1931, Davie 1951, Stokey 1959, Nayar 1962, Nayar & Kaur 1969, Nayar & Raza 1970, Atkinson & Stokey 1970, Pérez-García & Reyes 1994, Reyes et al. 1996 y Pérez-García et al. (1998). Gametophytes and sugars of Mexican species of Phlebodium (Polypodiaceae). En arbitraje).
De acuerdo con las características del esporofito, Microgramma parece estar más íntimamente relacionado con Campyloneurum y quizá también con Pleopeltis (Tryon & Tryon 1982).
Microgramma nitida es un helecho epífito, con rizoma delgado, trepador, escamas blanquecinas y ligera a fuertemente aplanado. Hojas estériles y fértiles subdimorfas; lámina entera y ligeramente pubescente. Esporangios con parafisos pardo claro (Moran 1995).
El presente trabajo es una contribución al estudio morfogenético de la fase gametofítica de M. nitida.
Materiales y Métodos
La recolección de ejemplares fértiles de M. nitida con esporangios maduros se realizó a 8 km al norte de Minatitlán, México. Los ejemplares de respaldo son AMR-143, 144, 146 y se encuentran depositados en el herbario Metropolitano-UAMIZ. Para la obtención de esporas, se colocaron las pinnas fértiles en bolsas de papel selladas a fin de evitar contaminación y favorecer la apertura de los esporangios a temperatura ambiente. El material obtenido fue pasado a través de un tamiz de malla con poros de 0.074 mm de diámetro para recolectar exclusivamente esporas y eliminar impurezas. Sin esterilización previa de las esporas, se realizó la siembra en 30 cajas de Petri de 5 cm de diámetro utilizando como sustrato el medio de Thompson (Klekowski l969) esterilizado. Seis cajas se cubrieron completamente con papel estaño a fin de determinar fotoblastismo. La densidad de siembra promedio fue de 40 esporas por cm2. Todas las cajas sembradas se colocaron en bolsas de polietileno y se mantuvieron iluminadas con luz artificial mediante lámparas solares de 75 watts/F96T12/ D, luz de día, a una temperatura de 20-28°C y fotoperíodo de 10 hr. Los cultivos se humedecieron cada semana con 5 gotas de agua destilada. Las primeras observaciones fueron realizadas cada tercer día para determinar el inicio de la germinación; posteriormente, las observaciones se efectuaron a intervalos de cinco días a siete días conforme avanzaba el desarrollo.
Las cajas mantenidas en oscuridad se abrieron 150 días después de la siembra. Las ilustraciones fotográficas se obtuvieron directamente de las esporas y gametofitos vivos mediante un fotomicroscopio American Optical y un microscopio estereoscópico American Optical Stereo Star ZOOM con cámara integrada, utilizando película b/n T MAX Kodak 100 de 35 mm.
Resultados
Esporas y germinación: Las esporas de M. nitida son monoletes, color amarillo oro, no clorofílicas, sin perina, aunque con ornamentaciones tuberculadas y granulares en la superficie; miden en promedio 20 x 35 mm (Figs. 1 y 2). La germinación ocurre entre el sexto al décimo día después de la siembra tomando como criterio la emergencia de las primeras células rizoidal y protálica (Figs. 3 y 4). Cabe destacar que la cubierta de la espora permanece unida al gametofito hasta fases muy avanzadas del desarrollo. También se observan grandes glóbulos de aceite en la primera célula protálica, característica que comparte con muchas otras Polypodiaceae s.str. A los 150 días posteriores a la siembra se observó que las esporas mantenidas en oscuridad no germinaron, por lo tanto, son fotoblásticas positivas. El patrón de germinación es del tipo Vittaria (Nayar & Kaur 1969), pues la emergencia de la primera célula protálica es perpendicular con respecto a la rizoidal (Figs. 4 y 5).
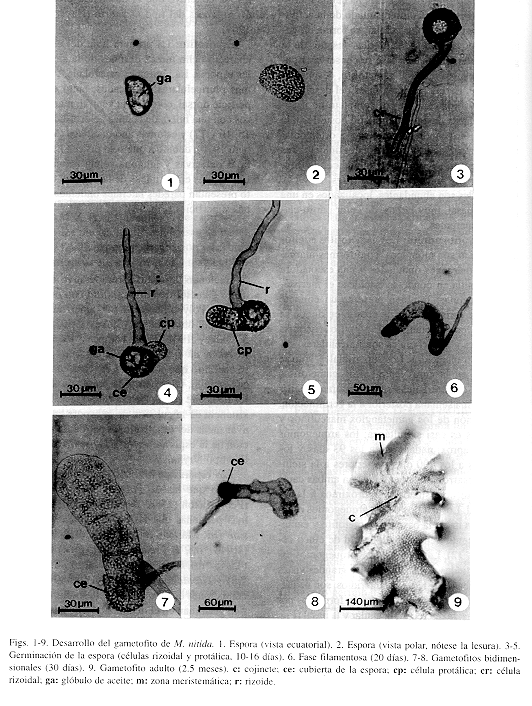
Fase filamentosa: Después de 16 a 20 días posteriores a la siembra se forma un filamento de 6 células protálicas con abundantes cloroplastos. La cubierta de la espora se mantiene unida todavía al gametofito filamentoso y el rizoide que ha aparecido hasta esta fase es de color pardo-oscuro, hialino. También se empieza a diferenciar otro rizoide en la primera célula protálica (Fig. 6).
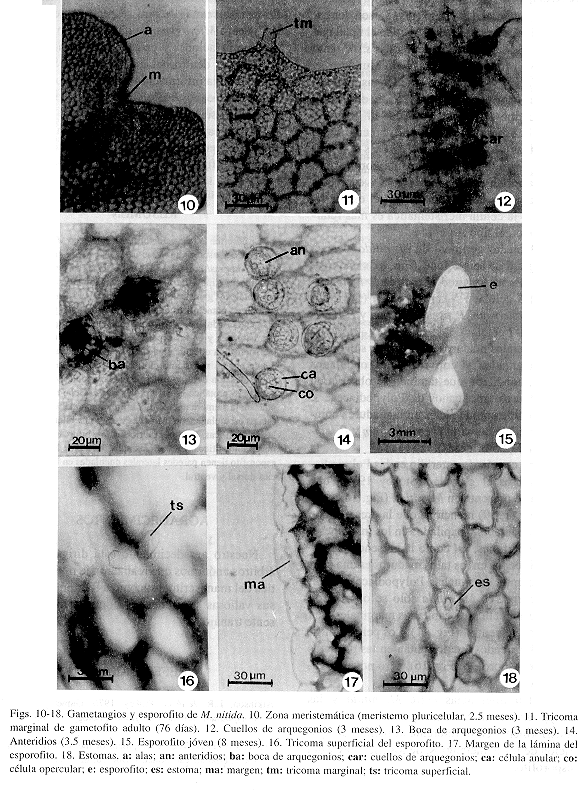
Fase laminar: A los 20 días después de la germinación, la célula inicial se divide longitudinalmente y después el resto de las células del filamento germinal hacen lo mismo produciendo un protalo de 1 a 4 células de ancho en la base y en el ápice respectivamente (Figs. 7 y 8). Posteriormente aparece la célula meristemática apical en forma de cuña mediante una división en sentido oblicuo de una de las células terminales. Esta célula es reemplazada rápidamente por un meristemo pluricelular que se establece en una posición central, apical, a los 8-12 días posteriores a la aparición de dicha célula meristemática (Fig. 10). Como resultado de la actividad del meristemo pluricelular, se forma un gametofito espatulado a los 30 días después de la germinación. Hasta esta fase se conserva la pared de la espora unida al gametofito, después se desprende. En las primeras fases del desarrollo los gametofitos carecen por completo de tricomas y es hasta después del día 60 posterior a la germinación cuando se empiezan a diferenciar tricomas marginales y superficiales unicelulares y translúcidos, evento que coincide con la diferenciación del ápice cordiforme (Figs. 10 y 11). Los rizoides son abundantes, localizados en una posición basal, muy largos, de color pardo-claro y transparentes.
Gametofito adulto: Los gametofitos adultos de M. nitida son monoicos, cordiformes-alargados, con márgenes ondulados y una escotadura bien definida en donde se establece el meristemo pluricelular. También presenta un cojinete central de varias células de grosor, en donde se localizan los gametangios (Fig 9). Los tricomas marginales y superficiales son unicelulares, capitados y translúcidos. Los superficiales, sólo se observan en la cara ventral. Los gametofitos con estas características se diferencian a partir de la décima semana posterior a la germinación. La aparición de los gametangios masculinos y femeninos es casi simultánea; los arquegonios aparecen aproximadamente a los 93 días y los anteridios a los 100 días posteriores a la siembra. Se desarrollan gametangios en ambas caras del gametofito, estando más próximos a la región basal. Los cuellos de los arquegonios están orientados hacia la base del gametofito y característicamente tienen una longitud de cinco células (Fig. 12). Las bocas de los arquegonios están constituídas por cuatro células grandes vistas desde arriba (Fig. 13). Los anteridios, son pequeños, tienen forma de barril y están formados por tres células: la opercular, la anular y la basal (Fig. 14). Tomando en cuenta que la germinación de las esporas de M. nitida resulta en un filamento corto,uniseriado, formación de protalos jóvenes espatulados, que posteriormente se transforman en gametofitos adultos cordiformes-alargados y desarrollo de tricomas marginales y superficiales, se concluye que el desarrollo protálico de M. nitida es del tipo Drynaria (Nayar & Kaur 1969).
Esporofito: La primera hoja del esporofito apareció ocho meses después de la siembra de las esporas. La lámina es espatulada, con tricomas pluricelulares, bifurcados, tanto en la superficie dorsal, como en la ventral, margenes lisos con una hilera de células aclorofílicas (Figs. 15, 16 y 17) y estomas anomocíticos (Van Cotthem 1970), debido a que sólo poseen las dos células oclusivas y ninguna célula acompañante. Las células epidérmicas de la hoja del esporofito presentan paredes laterales onduladas en ambas superficies (Fig. 18).
Discusión
Haciendo un análisis comparativo del desarrollo gametofítico de M. nitida con respecto a algunas Polypodiaceae s. str. americanas estudiadas por otros autores (Stokey 1959, Atkinson & Stokey 1970, Pérez-García y Reyes 1994, Reyes et al. 1996, Pérez-García et al.(en arb.), se encontró que comparten muchas características entre sí, tales como: la presencia de glóbulos de aceite en la primera célula protálica, persistencia de la cubierta de la espora hasta fases avanzadas del desarrollo, el patrón de germinación de la espora tipo Vittaria, desarrollo protálico tipo Drynaria.
Las esporas de M. nitida son casi del mismo tamaño que las de Polypodium lepidotrichum (Feé) Maxon (25 X 36 *m) (Feé), pero mucho más pequeñas que las de Phlebodium araneosum (M. Martens & Galeotti) Mickel y Beitel (40-48 *m), P. pseudoaureum (Cav.) Lellinger (45-48 *m), P. decumanum (Willd.) J.Sm.(36-40 *m) y Niphidium crassifolium (60-80 *m). En condiciones de laboratorio, las esporas de M. nitida germinan en el mismo lapso de tiempo citado para N. crassifolium (10 días). Nayar (1962) menciona que las Polypodiaceas s.str. del Viejo Mundo requieren hasta de un mes para germinar.
La presencia de un gran glóbulo de aceite en la primera célula protálica (Figs. 1-5) y la persistencia de la cubierta de la espora hasta fases avanzadas del desarrollo (Fig. 8), son dos características observadas en M. nitida al igual que en otras especies de Polypodiaceae s.str, tanto del Nuevo Mundo, como del Viejo Mundo.
M. nitida y las especies americanas mencionadas anteriormente comparten un desarrollo protálico tipo Drynaria, es decir, la germinación de la espora resulta en un filamento corto (2-7 células), los gametofitos jóvenes son desnudos y los adultos generalmente cordiformes que desarrollan pelos unicelulares y capitados en el margen y en las superficies, el establecimiento de la célula meristemática es más retardado que en el tipo Adiantum.
El filamento germinal de M. nitida alcanza una longitud de seis células (Fig. 6), siendo casi de la misma longitud que el de P. lepidotrichum (4-5 células), N. crassifolium (5-7 células), P. araneosum, P. pseudoaureum y P. decumanum (4-7 células).
Los protalos maduros de M. nitida son cordiformes-alargados y con márgenes ondulados (Fig. 9), condición que también se observa en otros géneros americanos de Polypodiaceae s. str. El tiempo en que alcanzan la madurez coincide con el citado para N. crassifolium y P. lepidotrichum (2.5-3 meses).
El tipo común de anteridio en las Polypodiaceae s.str. es el globular (Stokey 1959), que también se presenta en M. nitida (Fig. 14).
Stokey (1959) menciona que la presencia de pelos glandulares y papilados en los margenes y en las superficies, así como la presencia de pelos ramificados en los talos maduros es una condición común en muchas Polypodiaceae s.str.; sin embargo, en M. nitida sólo se observaron tricomas unicelulares-capitados marginales y en la superficie ventral (Fig. 11). Los pelos ramificados (bifurcados) se presentan en las primeras hojas del esporofito (Fig. 16), pero no en el gametofito.
Existen diferencias entre M. nitida y las Polypodiaceae americanas que se mencionaron anteriormente en lo referente al tiempo de aparición de los gametangios, de los tricomas y del esporofito.
No se cuenta con información morfogenética de la fase sexual de otras especies americanas del género Microgramma que nos permitan hacer comparaciones y establecer diferencias y/o semejanzas dentro del mismo género. Sin embargo, con la información existente de otros géneros americanos de Polypodiaceae y con la obtenida en este estudio, se confirma que M. nitida es una especie íntimamente relacionada con dichos géneros con base en las características del gametofito.
Resumen
Se describe la fase gametofítica del helecho Microgramma nitid con esporas de Veracruz, México (siembra promedio 40 esporas/ cm2). La morfogénesis se caracteriza por: germinación tipo Vittaria, un filamento inicial de seis células protálicas; gametofitos jóvenes espatulados que se transforman en gametofitos adultos cordiformes-alargados, con márgenes ondulados y tricomas unicelulares-capitados en los margenes y en las superficies; aparición de una célula meristemática obcónica apical, que es reemplazada rápidamente por un meristemo pluricelular. Los anteridios y arquegonios son del tipo usual de las Polypodiaceae s.str. El desarrollo protálico es del tipo Drynaria. Ocho meses después de la siembra apareció la primera hoja del esporofito; ésta es espatulada, con márgenes lisos y una hilera de células aclorofílicas, tricomas pluricelulares, bifurcados y estomas anomocíticos. Las células epidérmicas de la hoja del esporofito tienen paredes laterales onduladas en las superficies dorsal y ventral.
Agradecimientos
Nuestro agradecimiento está dirigido a los árbitros anónimos que realizaron la revisión crítica del manuscrito, así como a Ramón Riba por sus valiosas sugerencias y comentarios al presente trabajo.
References
Atkinson, L.R. & A.G. Stokey. 1970. Gametophyte of Polypodium chnoodes. Phytomorphology 20: 363-367. [ Links ]
Davie, J.H. 1951. The development of the antheridium in the Polypodiaceae. Amer. J. Bot. 38: 621-628. [ Links ]
Hartman, M.E. 1931. Antheridial dehiscence in the Polypodiaceae. Bot. Gaz. (Crawfordsville) 91: 252-276. [ Links ]
Klekowsi, E.J. 1969. Reproductive biology of the Pteridophyta. III. A study of Blechnaceae. Bot. J. Linn. Soc. 62: 361-377. [ Links ]
Mickel, J.T. & J.M. Beitel. 1988. Pteridophyte flora of Oaxaca, Mexico. Mem. Nueva York. Bot. Gard. 46: 1-568. [ Links ]
Moran, R.C. 1995. Microgramma, p. 339-340. In: R.C. Moran & R. Riba (eds.). Flora Mesoamericana Vol. 1: Psilotaceae a Salviniaceae. Univ. Nal. Autón. Méx., Misuri Bot. Garden, Museo de Historia Natural (Londres), México. [ Links ]
Nayar, B.K. 1962. Morphology of spores and prothalli of some species of Polypodiaceae. Bot. Gaz. 123: 223-232. [ Links ]
Nayar, B.K. & S. Kaur. 1969. Types of prothallial development in homosporous ferns. Phytomorphology 19: 171-188. [ Links ]
Nayar, B.K. & F. Raza. 1970. Morphology of the prothalli of some species of the Polypodiaceae - II: Lepisorus loriformis, L. thunbergianus, Polypodium vulgare and Weatherbya accedens. J. Indian Bot. Soc. 49: 81-86. [ Links ]
Pérez-García, B. e I. Reyes Jaramillo. 1994. Morfología y estrategias reproductivas en Polypodium lepidotrichum (Feé) Maxon (Polypodiaceae). Acta Bot. Mex. 28: 71-78. [ Links ]
Reyes Jaramillo, I., B. Pérez-García & A. Mendoza. 1996. Desarrollo del gametofito y del esporofito jóven de Niphidium crassifolium (Filicales: Polypodiaceae s.str.). Rev. Biol. Trop. 44: 485-490. [ Links ]
Stokey, A.G. 1959 Polypodium pectinatum and P. plumula -Polypodiaceae or Grammitidaceae?. Amer. Fern J. 49: 142-146. [ Links ]
Tryon, R.M. & A.F. Tryon. 1982. Ferns and allied plants with special reference to tropical America. Springer-Verlag, Nueva York. p. 715-722. [ Links ]
Van Cotthem, W.R.J. 1970. A classification of stomatal types. Bot. J. Linn. Soc. 63: 235-246. [ Links ]
1Universidad Autónoma Metropolitana-Iztapalapa. Depto. de Biología, Apdo. Postal 55-535 C.P. 09340 México, D.F. e-mail: bpg@xanum.uam.mx; Fax: 7-24-46-88.














