Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.46 n.3 San José Sep. 1998
AbstractGerminación, dispersión y establecimiento de plántulas de Mimosa tenuiflora (Leguminosae) en México Sara L. Camargo-Ricalde, Rosaura Grether 1 Recibido 24-IV-1998. Corregido 9-VI-1998. Aceptado 24-VI-1998.
Mimosa tenuiflora (Willd.) Poir. is an important natural resource in Mexico, due to its diverse uses. However, seed germination, dissemination and seedling establishment of this species had not been studied up to date. Fruits and seeds were collected in the State of Chiapas, Mexico (S. L. Camargo et al. 118, UAMIZ). Germination experiments were carried out after four years of seed storage; 1 935 seeds were sown in Petri dishes containing moistened Wathman filter paper. Optimum temperatures were determined in a gradient 5-40°C, with continuous light for mechanically scarified and non scarified seeds. Three photoperiod experiments were made: a) continuous light, b) constant darkness and c) 12 hr light/12 hr darkness. Three germinate pretreatments were applied: a) mechanical scarification, b) sulfuric acid scarification, c) fire scarification and d) control. Three replicates of 15 seeds each were made for each variable and pretreatment. Standard deviations (S) were determined, a one-way analysis of variance (ANOVA) and media comparison (Scheffés test) were applied (p<0.05). Analysis of fruit and seed dissemination and seedling establishment was made qualitatively on the basis of field and laboratory observations; radius of dissemination of the fruits from the mother plant was measured; development of laboratory grown seedlings was followed during three months. Seeds germinated at 10-30°C; however, the highest percentages of germination were obtained at 20°C (84.44%) and 25°C (95.55%); seeds are indistinctly photoblastic and percentages of germination, after the three germinate pretreatments, were: control (24.44-35.55%), mechanical scarification (84.44-88.88%), sulfuric acid scarification (73.33-91.11%) and fire scarification (0%). Fruits and seeds are disseminated by the wind in a radius of 5-8 m from the mother plant; rain carries them from slopes to lower plains and human activities contribute to their dissemination. Growth of seedlings is fast; they develop a paripinnate protophyll and ten biparipinnate pronomophylls; the first nomophyll develops during the weeks 12 to 14. It is concluded that optimum temperatures for seed germination of M. tenuiflora are 20°C and 25°C; seeds are indistinctly photoblastic; percentage and rate of germination are highly increased by coat scarification. This species has certain advantages for its establishment in open areas, given by the abundant production of seeds, their small size, the rate of germination and the fast growth, as well as by its seedling characters: the tap root system, the hypocotyl-epicotyl axis woody at the base and, the compound leaves with linear-oblong leaflets having changes in orientation in response to light. Our results confirm the invasive and typically secondary character of this species.
Key words
dissemination, establishment, germination, invasive species, Mimosa tenuiflora, seed.
Mimosa tenuiflora (Willd.) Poir. es un arbusto o árbol de hasta 8 m de altura con una amplia distribución en América, desde Brasil hasta los estados de Oaxaca y Chiapas en México (Grether 1988, Barneby 1991, Camargo-Ricalde et al. 1994, 1995, Camargo-Ricalde 1997). El uso agroforestal de esta especie en Guatemala, Nicaragua, El Salvador, Honduras y Brasil ha sido registrado por Nolasco y Landaverde (1988), Landaverde (1989), Kass et al. (1993) y Sampaio et al. (1993). Es un recurso de interés cultural y económico importante a nivel regional en los estados de Oaxaca y Chiapas en México; destaca su uso en el tratamiento de quemaduras y heridas superficiales de la piel y problemas gastro-intestinales, en la construcción de cercas y postería, como combustible y para la recuperación de suelos y vegetación (Genis 1987, Sánchez-León 1987, Lozoya 1988, Domínguez et al. 1989, Camargo-Ricalde et al. 1994, 1995, Camargo-Ricalde 1997).
El presente estudio tiene como objetivos establecer los parámetros de temperatura, fotoperíodo y pretratamientos que favorecen la germinación de las semillas de M. tenuiflora, así como el análisis de los mecanismos de dispersión de éstas y la emergencia y establecimiento de plántulas, con fines de propagación y conservación.
La viabilidad y la longevidad de las semillas del género Mimosa fueron estudiadas por primera vez por Ewart (1908), quien encontró que éstas eran viables aun después de 50 años de almacenamiento, incluyéndolas dentro de su clasificación como semillas macrobióticas; por su parte, Crocker (1938) señala que las semillas de leguminosas, incluyendo al género Mimosa, se caracterizan por la persistencia de su viabilidad durante largo tiempo.
Otra característica importante de las semillas de Mimosa es la presencia de una testa dura, impermeable, resistente a la abrasión y cubierta de una capa de cera brillante, por lo que es necesaria la escarificación, ya sea química, por inmersión en agua hirviendo o mecánica para romper la latencia (Compton 1912, Becquerel 1934, Crocker 1938, Dent 1942, López-Quiles 1974, Nava-Rodríguez 1974, Parra 1984, Creager 1992, Ferreira et al. 1992). En el campo, la latencia se rompe por el efecto de abrasión del suelo o la acción de agentes microbianos, por el jugo digestivo de animales, por ácidos orgánicos o por fluctuaciones de temperatura (Van Staden et al. 1989, Creager 1992).
La germinación en las Mimosoideae generalmente es epigea, mientras que la hipogea sólo ocurre en algunos casos (Compton 1912); según Duke (1969), la germinación en esta subfamilia varía de fanerocotilar a criptocotilar. En el género Mimosa, Parra (1984) ha observado la germinación fanerocotilar de M. albida Humb. et Bonpl. ex Willd., M. arenosa (Willd.) Poir., M. camporum Benth. y M. tenuiflora.
En particular, se han realizado estudios ecofisiológicos en M. pudica L. y M. pigra L. por ser malezas importantes en regiones tropicales. Las semillas de M. pudica son viables después de diez años de almacenamiento; asimismo, esta especie presenta un carácter oportunista y colonizador de sitios perturbados (Juliano 1940, Moreno-Casasola 1973, López-Quiles 1974, Nava-Rodríguez 1974, López-Quiles y Vázquez-Yanes 1976, López y Vázquez 1990). M. pigra es reconocida por su gran capacidad de colonización y/o invasión con implicaciones devastadoras para la flora y fauna de Australia (Lonsdale y Braithwaite 1988), de Africa, del sureste de Asia, Tailandia, Malasia, Indonesia y, más recientemente, de la Península de la Florida en Estados Unidos (Creager 1992); por lo anterior, se ha estudiado la rapidez de germinación y crecimiento, su dispersión, la sobrevivencia y el establecimiento de sus plántulas, su capacidad de regeneración y el control por fuego, tala y herbicidas (Janzen 1983, Lonsdale 1988, Lonsdale y Braithwaite 1988, Lonsdale y Abrecht 1989, Creager 1992, Cowie y Werner 1993).
Sin embargo, los mecanismos de dispersión de frutos y semillas, así como los factores (pH, tipo de suelo, etc.) que influyen en el desarrollo y establecimiento de las plántulas han sido poco estudiados en el género. Para las zonas áridas y semiáridas se conoce el caso de M. biuncifera Benth. y M. monancistra Benth. (Grether 1982) y para las regiones tropicales el caso de M. bahamensis Benth. (Grether y Camargo-Ricalde 1993) en México y M. bimucronata (DC.) Kuntze en Brasil (Ferreira et al. 1992).
Materiales y Métodos
Se recolectaron frutos y semillas de M. tenuiflora en el estado de Chiapas, México, en el mes de marzo de 1991, en matorral espinoso, sobre suelo de tipo regosol y con clima Aw0 (cálido subhúmedo con temperatura media anual de 18°C, régimen pluvial en verano y con una precipitación anual de 800- 1000 mm (García 1987)).
Las pruebas de germinación se hicieron con un lote único de semillas (S. L. Camargo-Ricalde et al. 118 (UAMIZ)), después de cuatro años de almacenamiento. Las semillas se lavaron con agua destilada y después con detergente comercial (tres g de detergente/100 ml de agua destilada), enjuagándose dos veces con agua destilada estéril; posteriormente se lavaron en una solución de hipoclorito de sodio al 10% durante diez min y se enjuagaron dos veces más con agua destilada estéril. Se sembraron en cajas de Petri de nueve cm de diámetro, con dos hojas de papel filtro humedecidas con agua destilada estéril; cada caja se selló con una envoltura de plástico autoadherible y se introdujo en una bolsa de plástico transparente sellada herméticamente. Las cajas se revisaron diariamente.
Se determinaron las temperaturas óptimas con base en el método de Vázquez-Yanes (1975), estableciendo un gradiente con temperaturas de 5°, 10°, 15°, 20°, 25°, 30°, 35° y 40°C y se usó luz continua, tanto para semillas no escarificadas como para semillas escarificadas mecánicamente. Se utilizaron dos germinadoras Conviron, con lámparas de luz de día (foco solar 20 watts/T 38/Lb/AP), localizadas a 30 cm de altura sobre las cajas de Petri, así como una estufa Ríos, S.A. Una vez determinadas las temperaturas óptimas, se eligió al azar una de éstas (20°C) para determinar el fotoperíodo óptimo; se realizaron tres pruebas de fotoperíodo: a) luz continua, b) oscuridad constante y c) luz 12 hr/oscuridad 12 hr.
Se procedió a la evaluación del efecto de tres tratamientos pregerminativos sobre la viabilidad y germinación de las semillas, una vez determinado el fotoblastismo indistinto de las mismas: a) escarificación mecánica (pequeño corte opuesto a la radícula), b) ácido sulfúrico concentrado durante 15 min, c) fuego directo y d) ningún tratamiento. Se aplicaron los tres fotoperíodos y las temperaturas óptimas (20° y 25°C) en todos los tratamientos.
Para cada variable y pretratamiento se llevaron a cabo tres repeticiones, cada una con 15 semillas, haciendo un total de 1 935 semillas para todo el experimento. Las pruebas estadísticas realizadas fueron Desviación Estandar (S), Análisis de Varianza de una vía (ANOVA) y comparación de medias (Prueba de Scheffé) (Winer 1971).
El análisis de la dispersión de los frutos y semillas y de la emergencia y establecimiento de las plántulas de M. tenuiflora fue cualitativo, a partir de la observación directa en el campo y en el laboratorio. Se revisaron los frutos diseminados para establecer el radio de distribución a partir de la planta madre; asimismo, se localizaron frutos y semillas arrastrados por el agua en la época de lluvias. Se revisaron las plántulas establecidas en áreas de vegetación primaria y de vegetación secundaria; además, se siguió el desarrollo de 20 plántulas cultivadas en el laboratorio, a temperatura ambiente en la Ciudad de México (18-20°C) durante tres meses.
Resultados
Germinación: El tipo de germinación observada en las semillas de M. tenuiflora es fanerocotilar. La mayor parte de las semillas escarificadas mecánicamente germinaron al segundo día después de la siembra; no obstante, se puede considerar que el mayor porcentaje de germinación se alcanzó entre el día uno y el cuatro (Fig. 1).
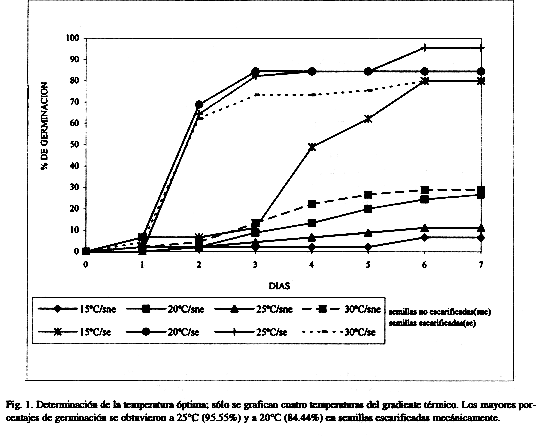
Con respecto al gradiente térmico utilizado, se observó que, tanto las semillas escarificadas mecánicamente como las no escarificadas tienen la capacidad de germinar entre 10 y 30°C (Cuadro 1 y Fig. 1); sin embargo, existe una diferencia significativa (p<0.05) entre los porcentajes de germinación de las semillas no escarificadas y los de las escarificadas; en este último caso, se presentaron los porcentajes más altos, alcanzando hasta un 95.55% a 25°C (Cuadro 1 y Fig. 1).
| 5°C | 10°C | 15°C | 20°C | 25°C | 30°C | 35°C | 40°C |
| 0% | 4.44% | 6.66% | 26.66% | 11.11% | 28.88% | 0% | 0% |
| S=0 | S=1.88 | S=2.98 | S=4.39 | S=2.76 | S=4.80 | S=0 | S=0 |
| 5°C | 10°C | 15°C | 20°C | 25°C | 30°C | 35°C | 40°C |
| 0% | 71.11% | 80% | 84.44% | 95.55% | 80% | 0% | 0% |
| S=0 | S=10.15 | S=13.61 | S=20.88 | S=22.06 | S=19.1 | S=0 | S=0 |
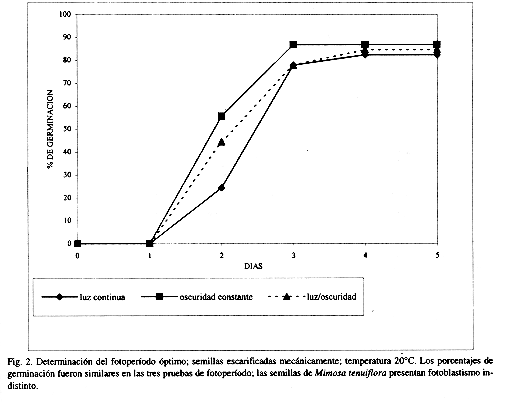
Los porcentajes de germinación obtenidos en los distintos fotoperíodos estudiados muestran que no existe una diferencia significativa entre estos (p<0.05) (Cuadro 2 y Fig. 2).
| | | |
| | | |
| | | |
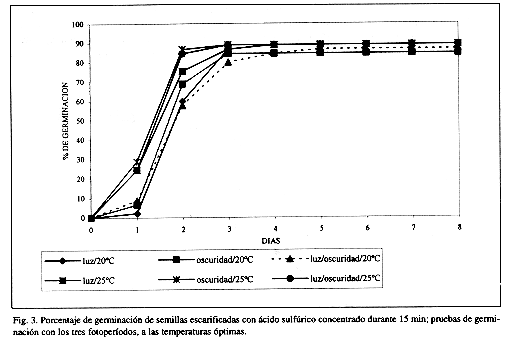
Con relación a los tres tratamientos pregerminativos (Cuadro 3), los mayores porcentajes de germinación se obtuvieron a 20°C con fotoperíodos de oscuridad constante (91.11%) y luz/oscuridad (88.88%), en semillas escarificadas con ácido sulfúrico (Fig. 3). Sin embargo, porcentajes similares también se obtuvieron con escarificación mecánica, tanto con temperaturas de 20°C (84.44-88.88%) como de 25°C (88.88%) en los tres fotoperíodos utilizados (Cuadro 3 y Fig. 4). En el caso de la escarificación por fuego directo, a diferencia de lo observado por Creager (1992) para M. pigra, las semillas de M. tenuiflora no germinaron.
| | | | |
| | | | |
| | | | |
| Temperatura | |||
| | | | |
| | | |
| | Oscuridad constante . . | | |
| | | | |
| | | | |
| Temperatura | |||
| | | | |
| | | |
| Luz continua . | Oscuridad constante . | | |
| | | | |
| | | | |
| Temperatura | |||
| | | | |
| | | |
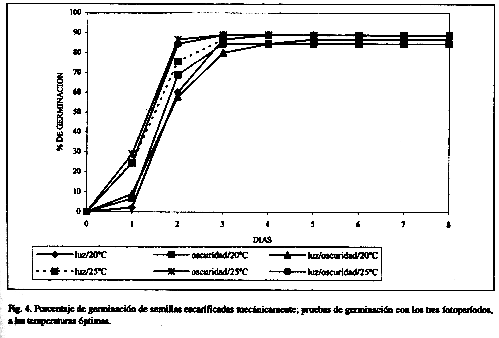
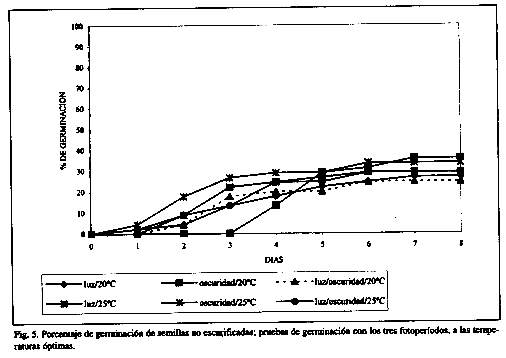
Las semillas que no fueron escarificadas presentan los porcentajes de germinación más bajos (Cuadro 3, Fig. 5), significativamente diferentes (p<0.05) a los obtenidos con escarificación mecánica y con ácido sulfúrico, como se observó en el ensayo del gradiente térmico (Cuadro 1 y Fig. 1). Entre ambos tratamientos pregerminativos, escarificación mecánica y con ácido sulfúrico, las diferencias en porcentajes de germinación no fueron significativas (p<0.05), considerando además, el fotoperíodo y las dos temperaturas empleadas (20°C y 25°C) (Cuadro 3, Figs. 3, 4 y 5).
Dispersión y establecimiento de plántulas: El viento dispersa los frutos de M. tenuiflora que, por su textura papirácea, son ligeros y se han encontrado diseminados hasta 5 m a partir de la planta madre en áreas con vegetación densa, como selvas y matorrales y hasta 8 m en áreas abiertas, taladas o terrenos de cultivo. La lluvia facilita el desprendimiento de los frutos y de los artejos, actuando en conjunto con el viento; también, se ha observado el arrastre de los frutos y semillas que se encuentran en el suelo, desde las partes más altas de cerros y lomeríos hacia los terrenos planos y más bajos. La dispersión por animales no ha sido detectada, mientras que la antropocoria es un mecanismo frecuente de dispersión de esta especie, debido a las actividades humanas en la región.
La emergencia de las plántulas de M. tenuiflora en el campo ocurre a partir del inicio de la época de lluvias (mayo-junio). Se estima que germinan principalmente las semillas producidas en años anteriores, debido a la latencia impuesta por la testa dura e impermeable. Las plántulas emergen y se establecen preferentemente en áreas abiertas expuestas a la luz.
Las plántulas cultivadas en el laboratorio tuvieron un crecimiento rápido (2-5 mm diarios). Los cotiledones son foliares y persisten después de la aparición de la primera pronomófila. En la primera etapa (diez días) la radícula es recta, el hipocótilo se desarrolla rápidamente, el epicótilo está reducido a la plúmula y los cotiledones se expanden. En la segunda etapa (seis días) continúa el crecimiento del hipocótilo con tricomas glandulares, el epicótilo empieza a alargarse y se desarrolla la primera eófila (protófila, según Parra 1984), paripinnada, con 4-6 pares de folíolos linear-oblongos, 2-3 x 1 mm, con tricomas glandulares en el margen. En la tercera etapa (a partir de los 17-20 días después de la siembra) se desarrolla la primera pronomófila, alterna, biparipinnada, con un par de pinnas y 6-8 pares de folíolos linear-oblongos, 1-2 x 1 mm, con tricomas glandulares en el margen. La tercera pronomófila se desarrolla 35-40 días después de la siembra. En total se forman hasta diez pronomófilas en un intervalo de 11-12 semanas. El sistema radical es axonomorfo y cuando el hipocótilo se pone en contacto con el suelo, desarrolla raíces adventicias. La fase de plántula concluye en la semana 12 a 14, cuando se desarrolla la primera nomófila con 4-5 pares de pinnas y 7-14 pares de folíolos linear-oblongos, 1-3 x 1 mm, semejante a las hojas de la planta adulta.
Discusión
Germinación: Los resultados de las pruebas de germinación en el gradiente térmico sugieren un amplio ámbito de tolerancia a la temperatura (10-30º C). La ruptura de la testa permite que la mayor parte de las semillas germinen en un período de cuatro días (Cuadro 1 y Fig. 1). Además, los fotoperíodos empleados indican que M. tenuiflora es una especie con semillas fotoblásticas indistintas (Cuadro 2 y Fig. 2), lo que amplía sus posibilidades de germinación en sitios diversos.
Las semillas de M. tenuiflora escarificadas por fuego directo no germinaron, pero si se considera el sistema tradicional agroforestal de roza-tumba-quema, característico de la zona en que crece, el fuego posiblemente elimina a las especies competidoras ya establecidas (otras semillas, plántulas y/o plantas, parásitos, etc.), por lo que una vez abierta el área, se favorece la colonización a partir de semillas, tocones, ramas y raíces parcialmente quemadas de M. tenuiflora; Sampaio et al. (1993) registran un comportamiento similar de esta especie en los bosques de Caatinga del Brasil.
En las semillas de esta especie es evidente la testa dura e impermeable, lo que sugiere la necesidad de escarificación, ya sea mecánica o química, para romper la latencia y obtener un mayor porcentaje de germinación. La latencia impuesta es muy frecuente en hábitats en los que la lluvia presenta una marcada distribución estacional (Vázquez-Yanes y Pérez-García 1977), como ocurre en el caso de M. tenuiflora, en la que la testa dura e impermeable hace suponer un contenido bajo de humedad, tratándose de semillas ortodoxas con un período largo de latencia. La impermeabilidad de la testa está asociada con la desecación de las semillas durante la maduración (Van Staden et al. 1989). Las semillas de M. tenuiflora son lenticulares y pequeñas (4.1-4.7 mm de largo x 3.1-3.8 mm de ancho x 1.6-2.3 mm de grosor en la parte media), lo que las hace menos susceptibles a la desecación y es más probable que germinen en hábitats abiertos. Asimismo, sus semillas pueden considerarse como mesobiótcas con base en los resultados de esta investigación. La germinación fanerocotilar observada en esta especie coincide con los resultados de Parra (1984) para otras especies del género.
Dispersión y establecimiento de plántulas: El tamaño pequeño de las semillas, asociado a la producción de un alto número de éstas por individuo, favorecen la invasión de áreas abiertas con mayor facilidad para M. tenuiflora que para otras especies que producen semillas más grandes.
El viento y el inicio de la época de lluvias coinciden con la etapa final de fructificación y con el inicio de la germinación de las semillas producidas principalmente en años anteriores, debido a la latencia impuesta.
El viento, la lluvia y las actividades humanas son los principales factores de dispersión de esta especie. Dado que sus frutos no presentan ningún tipo de derivado epidérmico y tienen el margen inerme, no es factible su adherencia al pelo del ganado vacuno, bovino o caprino. Sin embargo, el hombre actúa a dos niveles: 1) diseminando, intencional o accidentalmente, los frutos y semillas a través de los vehículos de transporte, al cultivar y cosechar, al cortar y al comercializar la madera, principalmente y 2) al abrir espacios favorables para el establecimiento de nuevos individuos, como consecuencia de las prácticas agrícolas (roza-tumba-quema), ganaderas y de comunicación terrestre.
M. tenuiflora tiene ciertas ventajas para su establecimiento en áreas abiertas, expuestas a la luz solar y con bajo contenido de humedad del suelo, dadas por las características de sus plántulas: el sistema radical axonomorfo que les permite captar el agua del suelo a mayor profundidad, el eje hipocótilo-epicótilo lignificado en la base, así como la formación de raíces adventicias cuando el hipocótilo se pone en contacto con el suelo y la lámina dividida de las hojas protófila y pronomófilas, con folíolos pequeños, linear-oblongos, que contribuyen a evitar la desecación. Estas son características importantes para el establecimiento de otras especies en terrenos de cultivo en descanso (Cid-Benevento y Werner 1986).
Las semillas de M. tenuiflora son fotoblásticas indistintas; sin embargo, la luz es un factor importante para la emergencia y el establecimiento de plántulas en otras especies (Cid-Benevento y Werner 1986) y en las plántulas de M. tenuiflora se han observado cambios en la orientación de los cotiledones foliares y de las hojas y folíolos, en respuesta a la luz y el cierre de los mismos al anochecer y ante estímulos mecánicos, probablemente por un mecanismo similar al de los pulvínulos de M. pudica (Campbell y Thomson 1977). La orientación de las hojas contribuye a optimizar la captación de luz, como ocurre en otras leguminosas (Rundel 1989) y posiblemente los tricomas glandulares funcionen como un mecanismo de defensa contra herbívoros.
Además, la germinación, el establecimiento, el crecimiento y la rápida expansión de plántulas son favorecidos por diversos factores: 1) la producción abundante de semillas, 2) el tamaño pequeño de éstas, 3) la velocidad de germinación y 4) el rápido crecimiento de las plántulas. En los terrenos de cultivo abandonados o en descanso y en potreros, el establecimiento de M. tenuiflora es favorecido por: 1) la producción abundante de semillas en áreas cercanas con vegetación primaria o secundaria, 2) el descanso de los terrenos de cultivo durante un período largo de tiempo y 3) la resistencia de las plantas jóvenes al ramoneo y al pisoteo de los animales; dada la gran cantidad de semillas que se producen, muchas de las plántulas logran establecerse a pesar del pisoteo. El amplio ámbito de condiciones climáticas y edáficas, en las que se establece esta especie, sugiere su plasticidad genética (Camargo-Ricalde 1997).
Por otra parte, esta especie presenta gran resistencia a la tala y a las quemas; los individuos se regeneran con facilidad a partir de tocones o raíces, además de propagarse por el desarrollo de brotes a partir de ramas y de raíces expuestas y aún parcialmente quemadas, como ocurre con M. biuncifera, M. monanciastra (Grether 1982), M. pigra (Londsdale y Abrecht 1989, Creager 1992) y M. bahamensis (Grether y Camargo-Ricalde 1993). M. tenuiflora se comporta de manera similar en los bosques de Caatinga del Brasil (Sampaio et al. 1993).
La suma de las características antes mencionadas, en conjunto con los tipos de vegetación en los que se establece esta especie (selvas bajas caducifolias y subcaducifolias, bosques de Pinus y de Pinus-Quercus perturbados, matorrales altos y medianos espinosos y subinermes, y matorrales casi puros de M. tenuiflora), su ocurrencia a la orilla de caminos y en terrenos de cultivo en descanso o abandonados, así como su germinación y crecimiento rápido en la etapa de plántula confirman el carácter oportunista y típicamente secundario de esta especie. Por lo anterior, esta planta podría ser aprovechada ecológicamente para la reforestación y regeneración de áreas perturbadas en zonas cálidas y muy cálidas, húmedas y subhúmedas, con un rango altitudinal de 0-1 110 msnm y preferentemente, con suelos ácidos y drenaje eficiente.
Resumen
Mimosa tenuiflora (Willd.) Poir. es un recurso natural importante para México debido a sus diversos usos. Sin embargo, hasta ahora no se había estudiado la germinación, la dispersión y el establecimiento de plántulas de esta especie. Se recolectaron frutos y semillas de esta planta en el estado de Chiapas, México (S. L. Camargo et al. 118, UAMIZ). Las pruebas de germinación se hicieron después de cuatro años de almacenamiento; se sembraron en total 1 935 semillas en cajas de Petri con papel filtro Wathman humedecido. Se determinaron las temperaturas óptimas usando un gradiente de 5-40°C, con luz continua, para semillas escarificadas mecánicamente y no escarificadas. Se realizaron tres pruebas de fotoperíodo: a) luz continua, b) oscuridad constante y c) luz 12hr/oscuridad 12 hr. Se aplicaron tres tratamientos pregerminativos: a) escarificación mecánica, b) ácido sulfúrico concentrado, c) fuego directo y d) ningún tratamiento. Para cada variable y pretratamiento se hicieron tres repeticiones, cada una con 15 semillas. Se aplicaron las pruebas estadísticas correspondientes: desviación estandar (S), análisis de varianza de una vía (ANOVA) y comparación de medias (Prueba de Scheffé) (p<0.05). Se hizo un análisis cualitativo de la dispersión de semillas y del establecimiento de plántulas, a partir de la observación directa en el campo y en el laboratorio; se midió el radio de dispersión de los frutos, respecto a la planta madre; se siguió el desarrollo de plántulas cultivadas en el laboratorio durante tres meses. Las semillas germinaron a temperaturas de 10-30°C; sin embargo, el mayor porcentaje de germinación se obtuvo a 20°C (84.44%) y 25°C (95.55%); presentan un fotoblastismo indistinto y al aplicárseles tres tratamientos pregerminativos, los porcentajes de germinación fueron los siguientes: grupo testigo (24.44-35.55%), escarificación mecánica (84.44-88.88%), escarificación con ácido sulfúrico (73.33-91.11%) y fuego directo (0%). Los frutos y semillas se dispersan por el viento en un radio de 5-8 m a partir de la planta madre, la lluvia los arratra de los cerros a las planicies más bajas y las actividades humanas contribuyen a su diseminación. El crecimiento de las plántulas es rápido; se desarrollan una protófila paripinnada y diez pronomófilas biparipinnadas, la primera nomófila se forma en la semana 12 a 14. Se concluye que las temperaturas óptimas para la germinación de las semillas de M. tenuiflora son 20°C y 25°C; estas semillas son fotoblásticas indistintas y el porcentaje y velocidad de germinación se incrementan notablemente por escarificación de la testa. Esta especie tiene ciertas ventajas para su establecimiento en áreas abiertas, dadas por la producción abundante de semillas, su tamaño pequeño, la velocidad de germinación y el crecimiento rápido, así como por las características de sus plántulas: el sistema radical axonomorfo, el eje hipocótilo-epicótilo lignificado en la base y las hojas compuestas con folíolos linear-oblongos que cambian de orientación en respuesta a la luz. Los resultados confirman el carácter oportunista y típicamente secundario de esta especie.
Agradecimientos
Agradecemos a Fernando Díaz de León Sánchez, Carlos Kerbel Lifshitz, Laura J. Pérez Flores y Miguel Angel Armella de la División de Ciencias Biológicas y de la Salud, Universidad Autónoma Metropolitana-Iztapalapa y a Carlos Vázquez Yanes del Instituto de Ecología, Universidad Nacional Autónoma de México, por la revisión crítica del manuscrito. Este trabajo fue financiado en parte por el Consejo Nacional de Ciencia y Tecnología, convenio D112-903774 y por la Dirección General de Investigación Científica y Superación Académica, Secretaría de Educación Pública, convenio C90-01-0282 y forma parte de la Tesis de Maestría de Sara L. Camargo-Ricalde.
Referencias
Barneby, R. C. 1991. Sensitivae Censitae. A description of the genus Mimosa L. (Mimosaceae) in the New World. Mem. New York Bot. Gard. 65: 1-835. [ Links ]
Becquerel, P. 1934. La longévité des graines macrobiotiques. Compt. Rend. Acad. Sci. (Paris) 199: 1662-1664. [ Links ]
Camargo-Ricalde, S. L. 1997. Aspectos de la biología del "tepescohuite", Mimosa tenuiflora (Leguminosae), en México. Tesis de Maestría, Universidad Nacional Autónoma de México, México, D. F., México. [ Links ]
Camargo-Ricalde, S. L., R. Grether & A. Martínez-Bernal. 1994. Uso medicinal del "tepescohuite" Mimosa tenuiflora (Leguminosae) en México. ContactoS 5: 29-34. [ Links ]
Camargo-Ricalde, S. L., R. Grether & A. Martínez-Bernal. 1995. Cuatro especies oportunistas del género Mimosa (Leguminosae) en México. ContactoS 10: 5-15. [ Links ]
Campbell, N. A. & W. W. Thomson. 1977. Multivacuolate motor cells in Mimosa pudica L. Ann. Bot. 41: 1361-1362. [ Links ]
Cid-Benevento, C. R. & P. A. Werner. 1986. Local distributions of old-field and woodland annual plant species: demography, physiological tolerances and allocation of biomass of five species grown in experimental light and soil moisture gradients. J. Ecol. 74: 857-880. [ Links ]
Compton, R. A. 1912. Investigation of the seedling structure in the Leguminoses. J. Linn. Soc. London Bot. 41: 1-122. [ Links ]
Cowie, I. D. & P. A. Werner. 1993. Alien plant species invasive in Kakadu National Park, tropical Northern Australia. Biol. Conserv. 63: 127-135. [ Links ]
Creager, R. A. 1992. Seed germination, physical and chemical control of catclaw mimosa (Mimosa pigra var. pigra). Weed Technol. 6: 884-891. [ Links ]
Crocker, W. 1938. Life-span of seeds. Bot. Rev. 4: 235-274. [ Links ]
Dent, T. V. 1942. Some records of extreme longevity of seeds of Indian forest plants. Indian Forest. 68: 617-631. [ Links ]
Dominguez, X. A., S. García, H. J. Williams, C. Ortiz, A. I. Scott & J. H. Reibenspies. 1989. Kukulkanins A and B, new chalcones from Mimosa tenuefolia. J. Natur. Prod. 52: 864-867. [ Links ]
Duke, J. A. 1969. On tropical tree seedlings. I. Seeds, seedlings, systems and systematics. Ann. Missouri Bot. Gard. 56: 125-165. [ Links ]
Ewart, A. J. 1908. On the longevity of seeds. Proc. Roy. Soc. Victoria 21: 1-210. [ Links ]
Ferreira, A. G., K. H. Lipp Joao & E. D. Heuser. 1992. Efeitos de escarificaçao sobre a germinaçao e do pH no crescimento de Acacia bonariensis Gill e Mimosa bimucronata (DC.) Kuntze. R. Bras. Fisiol. Veg. 4: 63-65. [ Links ]
García, E. 1987. Modificaciones al sistema de clasificación climática de Köppen (para adaptarlo a las condiciones de la República Mexicana). Instituto de Geeografía, UNAM, México. 217 p. [ Links ]
Genis, M. E. 1987. El árbol de la piel. Inf. Cient. y Tecnol. 9(135): 12-14. [ Links ]
Grether, R. 1982. Aspectos ecológicos de Mimosa biuncifera y M. monancistra en el noroeste del estado de Guanajuato. Bol. Soc. Bot. México 43: 43-60. [ Links ]
Grether, R. 1988. Nota sobre la identidad del tepescohuite en México. Bol. Soc. Bot. México 48: 151-152. [ Links ]
Grether, R. & S. L. Camargo-Ricalde. 1993. Mimosa bahamensis (Leguminosae) en la Península de Yucatán, México. Bol. Soc. Bot. México 53: 55-72. [ Links ]
Janzen, D. H. 1983. Mimosa pigra, p. 277-278. In D. H. Janzen (ed.). Costa Rican Natural History. University of Chicago, Chicago. [ Links ]
Juliano, J. B. 1940. Viability of some philippine weed seeds. The Philippine Agr. Series A 29: 313-326. [ Links ]
Kass, D. C. L., C. Foletti, L. T. Szott, R. Landaverde & R. Nolasco. 1993. Traditional fallow systems of the Americas. Agroforest. Syst. 23: 207-218. [ Links ]
Landaverde, R. 1989. Observaciones ecológicas y usos de Mimosa tenuiflora Willd. en la zona sur de Honduras. Programa Marcala-Goascoran. Subregión Goascoran. Subprograma Bosque. Secretaría de Recursos Naturales. Goascoran, Honduras. 13 p. [ Links ]
Lonsdale, W. M. 1988. Litterfall in an Australian population of Mimosa pigra, an invasive tropical shrub. J. Trop. Ecol. 4: 381-391. [ Links ]
Lonsdale, W. M. & D. G. Abrecht. 1989. Seedling mortality in Mimosa pigra, an invasive tropical shrub. J. Ecol. 77: 371-385. [ Links ]
Lonsdale, W. M. & R. Braithwaite. 1988. The shrub that conquered the bush. New Scien.(October): 52-55. [ Links ]
López, I. & M. Vázquez. 1990. Estudio poblacional comparativo de Mimosa pudica L. y Melampodium divaricatum (Rich) DC. en la sucesión secundaria en la región de Catemaco, Veracruz, México. XI Congreso Mexicano de Botánica. Soc. Bot. México, Oaxtepec, Morelos, México. p. 191. [ Links ]
López-Quiles, M. M. 1974. Estudio ecofisiológico de doce especies de plantas de la región de Los Tuxtlas, Veracruz. Tesis de Licenciatura, Universidad Nacional Autónoma de México, México, D. F., México. [ Links ]
López-Quiles, M. M. & C. Vázquez-Yanez. 1976. Estudio sobre germinación de semillas en condiciones naturales controladas, p. 250-262. In A. Gómez-Pompa, C. Vázquez-Yanez, S. Del Amo & A. Butanda (eds.). Investigaciones sobre la regeneración de selvas altas en Veracruz, México. Continental, México, D. F. [ Links ]
Lozoya, X. 1988. El tepescohuite: charlatanería y veracidad. Inf. Cient. y Tecnol. 10(139): 9-11. [ Links ]
Moreno-Casasola, P. 1973. Estudio sobre viabilidad y latencia de semillas tropicales. Tesis de Licenciatura, Universidad Nacional Autónoma de México, México, D. F., México. [ Links ]
Nava-Rodríguez, V. 1974. Estudios sobre la ecofisiología de la germinación de tres especies de leguminosas ruderales. Tesis de Licenciatura, Universidad Nacional Autónoma de México, México, D. F., México. [ Links ]
Nolasco, R. & R. Landaverde. 1988. Diagnóstico del sistema agroforestal tradicional maíz-maicillo-carbón negro (Mimosa tenuiflora). Programa Marcala-Goascoran (Margoas). Secretaría de Recursos Naturales. Tegucigalpa, Honduras, 25 p. [ Links ]
Parra G., P. 1984. Estudio de la morfología externa de plántulas de Calliandra gracilis, Mimosa albida, Mimosa arenosa, Mimosa camporum y Mimosa tenuiflora. Rev. Fac. Agron. (Maracay) 13(1-4): 311-350. [ Links ]
Rudel, P. W. 1989. Ecological success in relation to plant form and function in the woody legumes. In C. H. Stirton & J. L. Zarucchi (eds.). Advances in Legume Biology. Monogr. Syst. Bot. Missouri Bot. Gard. 29: 377-398. [ Links ]
Sampaio, E. V. S. B., I. H. Salcedo & J. B. Kauffman. 1993. Effect of different fire severities on coppicing of Caatinga vegetation in Serra Talhada, PE, Brazil. Biotropica 25: 452-460. [ Links ]
Sánchez-León, V. 1987. Yashté. Plantas de Chiapas, sus usos, valores e importancia: el tepescohuite. Instituto de Historia Natural, Depto. de Botánica, Tuxtla Gutiérrez, México. 4 p. [ Links ]
Van Staden, J., J. C. Manning & K. M. Kelly. 1989. Legume seeds, the structure:function equation. In C. H. Stirton & J. L. Zarucchi (eds.). Advances in Legume Biology. Monogr. Syst. Bot. Missouri Bot. Gard. 29: 417-450. [ Links ]
Vázquez-Yanes, C. 1975. The use of a thermogradient bar in the study of seed germination in Ochroma lagopus SW. Turrialba 25: 328-330. [ Links ]
Vázquez-Yanes, C. & B. Pérez-García. 1977. Notas sobre la morfología, la anatomía de la testa y la fisiología de las semillas de Enterolobium cyclocarpum. Turrialba 27: 427-430. [ Links ]
Winer, B.J. 1971. Statistical principles in experimental design. McGraw-Hill. Nueva York.
1Universidad Autónoma Metropolitana-Iztapalapa; Div. Ciencias Biológicas y de la Salud; Depto. Biología; Apdo. Postal 55-535; 09340, México, D.F. México. e-mail slcr@xanum.uam.mx y rogg@xanum.uam.mx














