Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.46 n.2 San José Jun. 1998
Abstract
The gastrointestinal activity of an aqueous extract of the dry wood of Quassia amara was investigated using animal models. Oral administration of the extract to mice produces an increase of gastrointestinal transit at doses of 500 and 1000 mg/kg. The antiulcerogenic activity was measured inducing ulcers on Sprague-Dowly rats with indomethacin or ethanol and by the induction of stress. The experimental group was treated orally with the extract, using doses of 250, 500 and 1000 mg/kg before inducing the ulcers. Animals treated orally with 0.5 ml of water and ranitidine (50 mg/kg) were used as controls. All the animals treated with the extract at doses of 500 and 1000 mg/kg showed important protection against ulcer generation. Piloric ligation was used to stablish the activity on total acidity, peptic activity, non-protein sulfhydryl groups, and mucus production. Animals treated with 1000 mg/kg showed a reduction on acidity and peptic activity. No activity was detected on mucus production and non-protein sulfhydryl groups at these dosis but with 1500 mg/kg they showed an increase non-protein sulfhydryl groups producction.
Key words
Quassia amara, Phytopharmacology, medicinal plants, gastrointestinal activity, anti-ulcerogenic activity.
La Quassia amara es una planta conocida por los principios amargos de la corteza del tallo usados por su propiedad tónica por los indígenas de Sur América (Morton 1981) y de Costa Rica (Nuñez 1986) contra calenturas palúdicas y para el dolor de estómago acompañado de cólico. Frecuentemente se usa en maceración en agua fría o en infusión como tónico amargo estimulante del apetito (Ocampo 1994). Pittier refiere que en Costa Rica es uno de los principales remedios indígenas. Estos dividen el tronco en trozos de 30-60 cm, uno de los que siempre llevan en sus viajes (Pittier 1957). Esta planta deriva su nombre de un habitante de Surinam llamado Quassi que a mediados del siglo XVIII adquirió fama tratando fiebres malignas. En 1756 se investigaron muestras de esta planta en Estocolmo y en 1764 apareció la primera referencia de Blom como Lignum quassie, convirtiéndose en una medicina febrífuga, antidisentérica y tónica muy popular (Cáceres 1996).
En Costa Rica, de acuerdo con los datos suministrados por las compañías productoras nacionales, se consumen 675 kg de la madera de esta planta, en forma de extracto de Quassia amara, llamado también "gotas amargas", para el tratamiento de problemas gastrointestinales inespecíficos. El uso de esta planta ha motivado la presente investigación en la que se estudia la actividad antiulcerosa, la actividad antisecretora ácida, la gastroprotectora y la actividad sobre el tránsito intestinal del extracto acuoso de Quassia amara.
Materiales y Métodos
Preparación del extracto de Quassia amara: La corteza de Q. amara fue recolectada por el personal del Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), en Puerto Viejo, Provincia de Limón, en octubre de 1995. La planta se identificó por comparación con la muestra No.USJ 49307 del Herbario de la Universidad de Costa Rica.
El material recolectado fue picado, secado, y molido en un molino Wiley hasta obtener un polvo homogéneo. Con este material se hizo una extracción acuosa al 10 %, calentando durante 30 minutos a 72°C El filtrado fue evaporado en un rotavapor cuidando que la temperatura no pasara de un máximo de 40°C, hasta llevarlo a un volumen de 100 ml. El material resultante fue liofilizado obteniéndose un rendimiento de 11.5 g de liofilizado por cada 500 g de corteza. El liofilizado fue mantenido en refrigeración en un envase sellado y protegido de la luz.
Animales: Se usaron ratones Mus musculus adultos, machos y hembras, con un peso entre 25 a 35 g y ratas Rattus norvegicus, variedad Sprague-Dowly, machos, con un peso entre 250 y 300 g, nacidos en la Unidad de Bioterios de la Universidad de Costa Rica. Todos los animales fueron mantenidos en condiciones controladas de luz y temperatura, con comida y acceso libre al agua. Antes de la administración de los tratamientos, los animales permanecieron en ayuno por un período no mayor de 12 horas, a excepción de los animales usados en la prueba de ligadura de píloro, que permanecieron en ayuno por 24 horas.
Pruebas biológicas
Actividad sobre el tránsito intestinal: Se pesaron y marcaron cinco grupos de seis ratones que, después de seis horas de ayuno, fueron tratados de la siguiente manera : un grupo con neostigmina 1 g/kg vía subcutánea (s.c.), otro grupo con atropina 1 mg/kg vía intramuscular (i.m.) y a los tres grupos restantes se les administró el extracto acuoso bruto de Q. amara vía oral (v.o.) en dosis de 250, 500 y 1000 mg/kg, respectivamente. Transcurridos treinta minutos del tratamiento, se procedió a administrar carbón activado al 10% en agua, a una dosis de 0.1 ml/10 g de peso v.o. Pasados treinta minutos de la administración del carbón, los animales fueron sacrificados con anestesia etérea profunda. Se extrajo el estómago y el intestino y se midió la distancia recorrida por el carbón desde el píloro hasta la última porción del intestino que contuvo por lo menos 1 cm contínuo de carbón. La distancia se expresa como la media del porcentaje de la longitud total del intestino recorrida por el carbón
error estandar de seis animales (Arbos et al. 1993).
Determinación de la actividad antiúlcera. Inducción de lesiones gástricas: Se utilizaron 5 grupos de 6 ratas cada uno por cada modelo de inducción de úlceras. Cada modelo tuvo su propio grupo control (agua) y su control positivo (ranitidina). Las lesiones gástricas fueron inducidas por la aplicación de indometacina a dosis de 10 mg/kg vía s.c. (Aguwa y Mittal 1981), por la administración de 0.5 ml v.o. de etanol al 75 % (Aguwa y Mittal 1981) y, en el grupo de estudio de úlceras inducidas por estrés, los animales fueron anestesiados ligeramente con éter e introducidos en un tubo de restricción de movimiento (18cm de largo x 6cm de diámetro) fabricado de cloruro de polivinilo y se mantuvieron por dos horas a una temperatura de 4°C (Glavin y Szabo 1992). Las ratas fueron mantenidas en ayuno por doce horas con acceso libre al agua antes de la inducción de las úlceras. Sesenta minutos antes de la aplicación del agente inductor de úlceras, el grupo control fue tratado con 0.5 ml de agua v.o., el grupo control positivo con 50 mg/kg v.o. de ranitidina y los tres grupos restantes fueron tratados v.o. con el extracto acuoso bruto de Q. amara a dosis de 250, 500 y 1000 mg/kg. Seis horas después de inducir las lesiones gástricas, se sacrificaron los animales con anestesia etérea profunda y se removieron los estómagos a los que se les practicó una incisión en la curvatura menor, se expuso la mucosa y se determinó la severidad de las lesiones (índice de lesión) de acuerdo con los criterios previamente establecidos (Fischman et al. 1991,Gamberini et al. 1991).
Método de la ligadura de píloro: Seis grupos de seis animales se mantuvieron en ayuno de 24 horas con libre acceso a agua con glucosa al 5%. A los animales. previamente anestesiados con éter, se les realizó una incisión de cerca de 2 cm en la pared abdominal a través de la que se localizó el estómago y se ligó el píloro. A los animales del grupo control se les administró 0.5 ml de agua por cada 100 g de peso por vía intraduodenal (i.d.), el grupo control positivo fue tratado con ranitidina (50 mg/kg i.d.) y el resto de los animales fueron tratados con el extracto acuoso de Quassia amara a dosis de 250, 500, 1000 y 1500 mg/kg i.d.. Los animales fueron suturados y transcurridas cuatro horas después de la cirugía, se sacrificaron con anestesia etérea profunda y se removieron los estómagos pinzando el esófago para evitar la pérdida del material secretado. El estómago fue mantenido sobre una placa de hielo, se abrió a lo largo de la curvatura menor y se lavó la mucosa con 3 ml de agua destilada. El jugo gástrico recogido y los lavados fueron centrifugados (1500 rpm/30 min) y se retiraron 200 ml de sobrenadante para la determinación de la actividad péptica. El resto del jugo gástrico se reservó para determinar la acidez (Lapa 1994).
Al tejido muscular estomacal se le descartó la región del cardias y del antro pilórico. La parte del cuerpo glandular fue dividida en dos segmentos aproximadamente iguales. Uno de los segmentos fue colocado en trypan blue para la determinación del moco adherido a la barrera gástrica. El otro segmento se incubó en solución de EDTA 0.02 M para la determinación de grupos sulfhidrilo no proteícos (Lapa 1994).
La acidez total fue determinada por titulación con NaOH 0.1 N utilizando fenoftaleína como indicador, y la acidez libre fue determinada con un potenciómetro. El resultado de la acidez se expresa como la media de la concentración en meq/ml error estandar. La actividad péptica en el jugo gástrico fue determinada por el método modificado de Anson (Anson 1938) y la determinación de los grupos sulfhidrilo no proteicos se realizó mediante el método de Sedlak y Lindsay (1988).
Tratamiento estadístico: Las diferencias estadísticas entre los grupos experimentales y controles fueron determinadas por medio de la prueba de Kruskcal-Wallis, considerándose como significativos los valores de p < 0.05.
Resultados
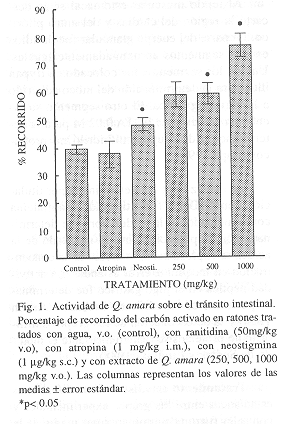
Actividad sobre el tránsito intestinal: Los animales tratados con atropina i.m. (1 mg/kg) presentaron un porcentaje de recorrido de carbón de 37.67 4.90. Los tratados con neostigmina s.c (1 mg/kg) presentaron un valor de 48.33
.39 mostrando una diferencia estadísticamente significativa (p< 0.05) con respecto al control, cuyo recorrido fue de 39.33
1.73. Los animales tratados con Quassia amara a dosis de 250, 500 y 1000 mg/kg mostraron un recorrido de 59.33 ±
4.60, 59.67
3.84 y 76.83
4.25 respectivamente. Estos dos últimos valores fueron estadísticamente significativos con respecto al control (p< 0.05), (Fig. 1)
 |  |
Determinación de la actividad antiulcerosa
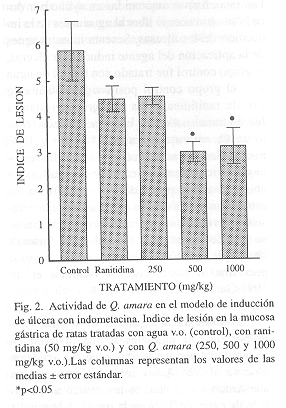
Lesiones gástricas inducidas por indometacina: Los animales del grupo control presentanron un índice de lesión de 5.83 0.83 y los tratados con ranitidina (50 mg/kg, v.o.) presentaron un valor de 4.50
0.34. Los animales tratados con con el extracto de Q. amara v.o. a dosis de 250 mg/kg presentaron un índice de lesión de 4.55
0.23 , de 3.00
0.26 a la dosis de 500 mg/kg y de 3.17
0.48 con la dosis de 1000 mg/kg, mostrando estos dos últimos grupos una diferencia estadísticamente significativa con respecto al control (p< 0.05), (Fig. 2).
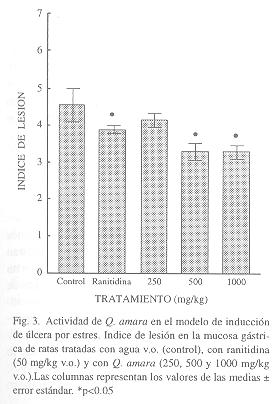
Lesiones gástricas inducidas por estrés: Los animales del grupo control presentaron un índice de lesión de 4.55 0.44, los tratados con ranitidina (50 mg/kg, v.o.) presentaron un valor de 3.90
0.09 los tratados con el extracto de Q. amara mostraron un índice de lesión de 4.17
0.17 para la dosis de 250 mg/kg v.o.,de 3.33
0.23 para la dosis de de 500 mg/kg v.o. y de 3.33
0.18 para la dosis de 1000 mg/kg.. Estos dos últimos datos presentan diferencia estadísticamente significativa con respecto al control (p< 0.05), (Fig. 3).
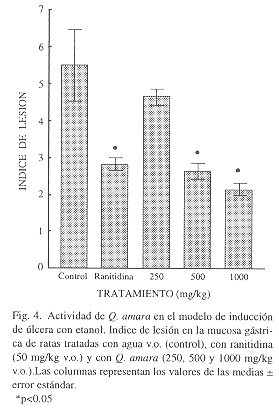
Lesiones gástricas inducidas por etanol: Los animales del grupo control presentaron un índice de lesión de 5.50 0.96. Los tratados con ranitidina (50 mg/kg v.o.) presentaron un índice de 2.83
0.17. Los animales tratados con el extracto de Q. amara mostraron un valor de 4.67
0.21 cuando fueron tratados con 250 mg/kg v.o. Cuando se usó la dosis de 500 mg/kg v.o. presentaron un valor de 2.67
0.21 y de 2.17
0.17 en la dosis de 100 mg/kg v.o. Estos dos últimos datos presentaron diferencia estadísticamente significativa con respecto al control (p< 0.05),(Fig. 4).
Método de ligadura de píloro: Los grupos tratados con Q. amara a dosis de 250 y 500 mg/kg no mostraron ningún efecto sobre el modelo de ligadura de píloro, razón por la que se aumentó la dosis y se usaron dos grupos experimentales con dosis de 1000 y de 1500 mg/kg.
Determinación de la acidez total: El jugo gástrico de los animales del grupo control presentó una acidez total de 46.00 8.75 meq/l y los tratados con ranitidina (50 mg/kg v.o.) una acidez de 7.27
0.96 meq/l. El jugo gástrico de los animales tratados con Q. amara a dosis de 1000 mg/kg v.o. presentó una acidez de 8.43
0.84, siendo este dato estadísticamente diferente del control (p< 0.05). Los estómagos de los animales tratados con 1500 mg/kg produjeron un volumen muy pequeño de líquido lo que impidió la determinación de la acidez total.
El jugo gástrico de los animales del grupo control presentó un pH con un valor de 1.36 0.08. Los animales tratados con ranitidina (50 mg/kg v.o.) presentaron un valor de 5.70
0.54. Los tratados con el extracto de Q. amara (1000 mg/kg) presentaron un valor de 2.78
0.07 sin ser estadísticamente significativa al compararla con el control.
Determinación de la actividad péptica en el jugo gástrico: El jugo gástrico de los animales del grupo control presentó una actividad péptica de 66.07 2.04 mg/ml/4 horas. Los animales tratados con ranitidina (50 mg/kg v.o.) presentaron un valor de 56.67
10.01 mg/ml/4 horas. Los animales tratados con el extracto de Q. amara (1000 mg/kg) presentaron un valor de 53.09
6.47 m /ml/4 horas que muestra una diferencia estadísticamente significativa con respecto al control (p < 0.05).
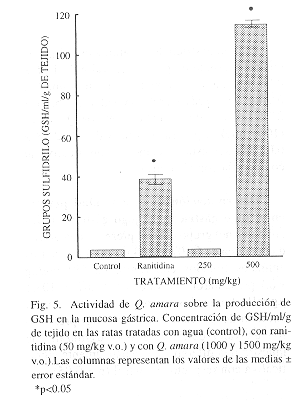
Determinación de los grupos sulfhidrilo no-proteicos de la mucosa gástrica: Los estómagos de los animales del grupo control presentaron 3.74 0.20 mg de GSH/ml/g de tejido. Los animales tratados con ranitidina (50 mg/kg v.o.) presentaron un valor de 38.54
2.04 mg de GSH/ml/g de tejido. Los animales tratados con Q. amara presentaron un valor de 3.89
0.09 mg de GSH/ ml/g de tejido a una dosis de 1000 mg/kg y de 114.94
1.63 mg de GSH/ ml/g de tejido a una dosis de 1500 mg/kg. Los animales tratados con 1500 mg/kg produjeron resultados estadísticamente significativos con respecto al control (p<0.05),(Fig. 5).
Determinación de moco en la barrera gastroprotectora: Los estómagos de los animales del grupo control presentaron un valor, en la cantidad de moco, de 31.42 2.21 m g de alcial blue/ ml/g de tejido. Los animales tratados con ranitidina (50 mg/kg v.o.) presentaron un valor de 45.12
1.29 mg alcial blue/ml/g de tejido. Los animales tratados con el extracto de Q. amara presentaron un valor de 30.08
.24 mg de alcial blue/ml/g de tejido a una dosis de 100 mg/kg y 30.51
2.38 a una dosis de 1500 mg/kg. Ni la dosis de 1000 mg/kg ni la de 1500 mg/kg presentaron diferencias estadísticamente significativa con respecto al control.
Discusión
Los resultados obtenidos en los animales tratados con 500 y 1000 mg/kg v.o. muestran que el extracto acuoso de Q. amara produce un aumento del tránsito intestinal dependiente de la dosis, probablemente mediado por una acción muscarínica directa a nivel de los receptores M1 y M2 o por una acción anticolinesterásica. Este hallazgo, difiere un poco de lo reportado en la literatura (García et al. 1997), en donde no se encuentra aumento del tránsito intestinal con la dosis de 500 mg.
El extracto de Q. amara presenta una importante actividad protectora de las lesiones gástricas inducidas por indometacina, etanol y estrés, que son modelos representativos de la enfermedad ulcerosa gástrica en el humano (Silen 1988). En el caso del modelo de inducción de úlceras por indometacina, los resultados sugieren una estimulación de la producción de prostaglandinas endógenas (Wallace 1992), concordante con el efecto protector que muestran las prostaglandinas contra los efectos ulcerogénicos causados por los analgésicos antiinflamatorios no esteroideos (Brunton 1996); esto último es compatible con el efecto producido en el modelo de estrés en el que se muestra una protección que también podría ser mediada por un aumento del flujo sanguíneo de la mucosa, que evita la hipoxia tisular producida por el estrés (Ko et al. 1991,Mosnier et al. 1993). Los efectos que se presentaron en el modelo de etanol, apoyan aún mas el posible mecanismo de citoprotección mediado por prostaglandinas (Miller 1983, Robert 1979).
Salvo por la producción de mucus, la disminución de la actividad péptica y el efecto sobre la acidez total, parecen indicar que el extracto podría tener un efecto similar al que se encuentra con las prostaglandinas tal como se ha reportado con los análogos de las prostaglandinas de la serie E 1 (Brunton 1996). La protección brindada por este extracto se encuentra mediada por la producción de grupos sulfhidrilo no proteicos, solamente en dosis altas.
El extracto de Quassia amara se comporta como un agente que, de forma dependiente de la dosis, proteje la mucosa gástrica contra estímulos inductores de lesiones, además de producir un su efecto procinético intestinal Estos resultados no pueden ser atribuídos a ninguna de las sustancias presentes en el extracto hasta no llevar a cabo fraccionamientos biodirigidos que permitan hacer esta afirmación. Por otro lado, los resultados avalan el uso tradicional de esta planta como protectora de la mucosa gástrica y plantean la necesidad de continuar con estudios clínicos, pues los mecanismos planteados hacen su uso prometedor.
Agradecimientos
El presente estudio se llevó a cabo con el apoyo del Instituto de Investigaciones Farmacéuticas (INIFAR) de la Facultad de Farmacia y del Centro de Investigación en Productos Naturales (CIPRONA). Nuestro agradecimiento al Programa Iberoamericano para la Ciencia y Tecnología para el Desarrollo (CYTED), Subprograma X Química Fina Farmacéutica el apoyo técnico.
Resumen
En este estudio se ha investigado el efecto del extracto acuoso bruto de Q. amara a nivel gastrointestinal utilizando varios modelos experimentales en animales. Los resultados muestran que este extracto a dosis de 500 y 1000 mg/kg produce un aumento del tránsito gastrointestinal y que es capaz de inhibir las lesiones inducidas por la indometacina, el alcohol y el estrés. Los animales tratados con dosis de 1000 mg/kg mostraron disminución de la acidez de los contenidos estomacales y de la actividad péptica y un incremento en la cantidad del moco protector de la mucosa.
REFERENCIAS
Aguwa, C.N. & G.C. Mittal. 1981. Study of antiulcer activity of aqueous extract of leaves of Pyrenacantha standii (Icacinaceae) using various models of experimental gastric ulcer in rats. Eur.J. Pharmacol. 74: 215-219. [ Links ]
Anson, M.L. 1938. The estimation of pepsin, trypsin, papain and catepsin with hemoglobin. J. Gen. Physiol. 22: 78-89. [ Links ]
Arbos, J., A. Zegri, F.R.J. Lopez-Soriano & J.M. Argiles. 1993. A simple method for determining the rate of gastrointestinal transit in the rat. Arch. Intern. Physiol. Bioch. Biophys. 101: 113-115. [ Links ]
Brunton, L. 1996. Agents for control of gastric acicity and treatment of peptic ulcers. In Goodman A. The Pharmacological Basisi of Therapeutics. Mac Graw-Hill, Nueva York, p. 901-915. [ Links ]
Cáceres, A. 1996. Plantas de uso medicinal en Guatemala. Universidad de San Carlos de Guatemala. Guatemala. 145 p. [ Links ]
Fischman, L., L.A. Skorupa, C. Souccar & A.J. Lapa. 1991. The water extract of Coleus barbatus (Benth) decreases gastric secretion in rats. Mem. Inst. Oswaldo Cruz. 86 : 141-143. [ Links ]
Gamberini, M.T., L.A. Skorupa, C. Souccar & A.J. Lapa. 1991. Inhibition of gastric secretion by a water extract from Baccharis triptera. Mem. Inst. Oswaldo Cruz. 86 : 137-139. [ Links ]
Garcia, M.S. Gonzalez & Pazoz 1997. Actividad farmacológicadel extracto acuosos de la madera de Quassia amara (Simarubaceae) en ratas y ratones albinos. Rev. Biol. Trop. 44/45. 47-50.
Glavin, G. B.& S. Szabo. 1992. Experimetal gastric mucosal injury: laboratory models reveal mechanisms of pathogenesis and new strategies. FASEB 6: 82-830. [ Links ]
Ko, J.K.S., C.H. Cho & C.W. Ogif. 1991. The vagus nerve and its non-cholinergic mechanism in the modulation of ethanol induced gastric mucosal damage in rats. J. Pharm. Pharmacol. 46: 29-33 [ Links ]
Lapa, A.J. 1994. Manual Curso Iberoamericano de Validacão de Plantas Medicinais com atividade gastrointestinal. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo (CYTED) Subprograma X, Sao Paulo, Brasil, p. 10-12. [ Links ]
Miller, T.A. 1983. Mechanisms of stress releated mucosal damage Am. J. Med. 83 : 10-12. [ Links ]
Morton, J.F. 1981. Atlas of Medicinal Plants of Middle America. Charles Thomas, Springfield,. Illinois. 339 p. [ Links ]
Mosnier, P.,. Rayssiguier Y, C. Molta, E. Pelissier & G. Bommelaer. 1993. Effect of ethanol on rat gastric surfactant. Gastroenterology 104: 179. [ Links ]
Nuñez, E. 1986. Plantas medicinales de Costa Rica y su Folclore. San José, Universidad de Costa Rica. 241 p. [ Links ]
Ocampo, R.A. 1994. Estado de la Investigación en Hombre grande (Quassia amara) en Centroamérica. Centro Agronómico Tropical de Investigación y Enseñanza (CATIE). Turrialba, Costa Rica. p. 1-2. [ Links ]
Pittier, H. 1957. Ensayo sobre Plantas Usuales de Costa Rica. Publicaciones de la Universidad de Costa Rica, San José Costa Rica. 135 p. [ Links ]
Robert A., J. Adezamis, C. Lancater & A. Hanchar. 1979. Cytoprotection by prostaglandins in rats. Gastroenterology 77: 433-443. [ Links ]
Sedlak, J. & R.H. Lindsay. 1988. Estimation of total protein bound and non protein sulfhydril groups in tissues with Ellman's reagent. Anal. Biochem. 25: 192-205. [ Links ]
Silen, W. 1988. Experimental models of gastric ulceration and injury. Am.J. Physiol. 255, G395-G402. [ Links ]
Wallace, J.L. 1992. Prostaglandins, NSAIDs and cytoprotection. Gastroenterology. 21: 631-633. [ Links ]
1 Instituto de Investigaciones Farmacéuticas (INIFAR), Facultad de Farmacia, Universidad de Costa Rica.,2060 San José, Costa Rica.
2 Centro de Investigación en Productos Naturales (CIPRONA) y Facultad de Farmacia, Universidad de Costa Rica.,2060 San José, Costa Rica