Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de Biología Tropical
On-line version ISSN 0034-7744Print version ISSN 0034-7744
Rev. biol. trop vol.46 n.1 San José Mar. 1998
Abstract
Adults of soursop seed borer Bephratelloides pomorum (Hymenoptera: Eurytomidae) were collected from fruits in Maceió, State of Alagoas, Brazil. The courtship and copulation behaviours of B. pomorum were described under 27.6 + 0.1 °C, R.H. of 77.50 + 0.8%. A virgin couple of B. pomorum was placed daily in a glass cage for observing the courtship and copulation behaviour during a period of 12 days. This procedure was repeated ten times by using groups of 10 to 12 virgin couples per replicate. The observations for each replicate were ended after the first copulation. In general, males emerged first and newly emerged females elicited male courtship and mating behaviours. The behavioural patterns of males consisted of well-defined sequences such as approaching to female, wing fanning, regulatory body movements, copulation, rubbing aedeago on female abdome, antennae and mouthparts grooming.
Key words
Mating behaviour, seed borer, courtship, soursop, pheromone.
La descripción de los comportamientos de cortejo y cópula en himenópteros chalcidoideos, se limita a especies parasitoides o hiperparasitoides, existiendo pocos estudios sobre insectos fitófagos en esta superfamilia.
El cortejo y cópula de muchos himenópteros consiste en movimiento de alas, patas, antenas y piezas bucales del insecto macho. La secuencia de estos movimientos es variable dependiendo de la especie, y es repetida hasta que la hembra esté apta para el acto copulatorio (Assem 1986). A pesar de que los estímulos responsables de la atracción sexual de muchos insectos son específicos, generalmente se requiere de un reconocimiento prolongado por parte de ambos sexos, hasta que lleguen a un estado de disposición fisiológica adecuado, en el cual pueda realizarse la cópula (Carthy & Howse 1980, Chapman 1982).
Los estudios de comportamiento en Chalcidoidea son pocos, principalmente en Eurytomidae, donde algunas especies se destacan como plagas agrícolas de importancia económica. Batiste (1967), describió de manera resumida el comportamiento de cortejo y cópula de Bruchophagus kolobovae (Hymenoptera: Eurytomidae).
La broca de la semilla de guanábana Bephratelloides pomorum (Hymenoptera: Eurytomidae), se destaca como una de las principales plagas de este cultivo en Brasil. Los métodos de control actualmente utilizados son ineficientes, debido a que el ciclo del insecto, ocurre prácticamente dentro de la semilla del fruto. Al emerger el adulto deja una puerta de entrada para el ingreso de otros organismos, dejándolo en estado inadecuado para su comercialización (Pereira 1996). El presente artículo describe los comportamientos de cortejo y de cópula de B. pomorum.
Esta investigación fue realizada en el laboratorio de Recursos Naturales de la Universidad Federal de Alagoas, a temperatura de 27.60.1 °C y humedad relativa de 77.50
0.8%. Frutos de guanábana (Annona muricata L.) próximos al estado de maduración fueron cosechados en una plantación ubicada en Maceió, Alagoas, Brasil, y llevados al laboratorio para obtener diariamente una pareja virgen de B. pomorum. Hembra y macho fueron colocados en jaulas de vidrio con un fruto pequeño para su oviposición. Jaulas: 18 x 17 x 17 cm, dos lados con malla fina para ventilación. Las observaciones se hicieron una hora por la mañana y una hora por la tarde, en cada una de las 12 parejas de insectos. Hembras y machos fueron separados entre observaciones. Después de realizar la descripción del comportamiento de parejas aisladas, se realizaron las mismas observaciones sobre 10 a 12 parejas vírgenes por jaula, con diez repeticiones, totalizando 110 insectos. Cada repetición fue finalizada después de la primera cópula.
Cuando se utilizó una pareja de B. pomorum por repetición, se verificó que solo el macho realiza el preámbulo de cortejo, sin embargo no hubo ninguna cópula, debido a que la hembra se alejaba volando en dirección opuesta. No obstante, el macho continuaba con el comportamiento de cortejo en el lugar donde la hembra estaba anteriormente. Probablemente, en el lugar había quedado impregnado la feromona sexual de la hembra. Cuando el macho conseguía montar la hembra, ésta lo apartaba con la patas posteriores o curvaba el abdomen en sentido ventral y perpendicularmente hacia bajo, impidiendo la cópula. Esta demora de la hembra para seleccionar la pareja adecuada para la cópula, representa una ventaja selectiva, pues los machos de insectos en general son capaces de copular muchas veces, mientras muchas hembras realizan solo una cópula (Manning 1979). En la mayoría de los himenópteros, la disponibilidad de hembras para más de una cópula no es viable, debido a que existe um mayor gasto de energía para la producción de la progenie, sendo esta compensada por medio del sistema de reproducción haplo-diploide (Price 1975). Tal processo fue relatado en los himenópteros B. kolobovae, Brachymeria ovata, Chelonus kellieae y C. phthorimaeae (Batiste 1967, Ohashi 1984, Powers y Oatman 1984). Sin embargo, en Chryseida bennetti, una especie monogámica, hay hasta cuatro cópulas de una hembra con el mismo macho (Pérez 1987, Perez-Lachaud y Campan 1994). Las cópulas múltiples en insectos monogámicos podrían relacionarse con el suplemento de espermatozoides en la espermateca, producción de la glándula accesoria masculina y transferencia de espermatóforo (Thornhill y Alcock 1983).
Cuando se utilizó de 10 a 12 parejas por repetición si hubo cópulas. Probablemente, la competición estimuló a la hembra a aceptar al macho para la cópula, pues siempre tuvo varios cortejantes.
Después de liberar los insectos en la jaula se movían en varias direcciones y poco tiempo después los machos comenzaban a caminar en dirección de las hembras, las cuales no manisfestaron ninguna receptividad. En la especie fitófaga Eurytoma amygdali, hembras vírgenes atraían a los machos, posiblemente, debido a la feromona liberada por ellas (Pittara y Katsoyannos 1985). Generalmente son las fuentes de feromona que orientan al macho para la cópula (Powers y Oatman 1984, Tagawa et al. 1985).
Además, se observó que los machos de B. pomorum emergían antes que las hembras y ambos fueron aptos para copular inmediatamente al salir del fruto, tal como fue observado por Pittara y Katsoyannos (1985) en E. amygdali. Esta disposición para la cópula puede deberse a que el tiempo en que el insecto permanece dentro del fruto hasta salir al exterior es suficiente para madura sexualmente.
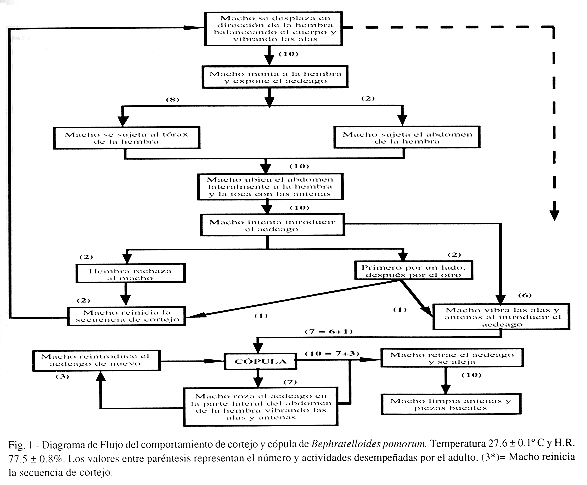
El cortejo en B. pomorum presentó una secuencia de eventos definidos (Fig. 1). Inicalmente los machos se movían en dirección de las hembras, balanceaban el cuerpo de un lado hacia outro y vibraban las alas. Usando las patas delanteras, el macho sujeta a la hembra por el tórax. La posición final del macho sobre la hembra, con la cabeza de ambos volteada en el mismo sentido, caracterizó la monta. El mismo movimiento de vibración de las alas fue observado durante la descripción de comportamiento del cortejo, en Brachymeria intermedia (Leonard y Ringo 1978), B. lasus (Simser y Coppel 1980), Apanteles glomeratus (Tagawa et al. 1985), Ascogaster reticulatus (Kainoh 1986) y Nasonia vitripennis, N. longicornis y N. giralti (Assem y Werren 1994).
Durante la "monta", la hembra en la mayoría de las veces permaneció pasiva, pero hubo casos en que por medio de las patas evitaba al macho (Fig. 1). Después de la monta, el macho expuso el aedeago, tocó a la hembra con las antenas, se ubicó lateralmente, curvó la extremidad del abdomen y vibrando las alas y antenas en movimientos rítmicos sincronizados, efectuó la cópula. Comportamiento similar fue descrito por Batiste (1967) para B. kolobovae y por Kouloussis y Katsoyannos (1995) los cuales observaron cortejo y cópula de E. amygdali en fruto a nivel de campo. Al final de la cópula, se observó que el macho restregaba el aedeago a ambos lados del abdomen de la hembra. Este comportamiento puede estar relacionado con la marcación de la hembra para demostrar que ella ya fue copulada. Sin embargo, mayores observaciones deben ser realizadas para la comprobación de la feromona de marcación. En algunos casos, el macho efectuó nuevamente la cópula. Al final de la cópula, el macho se alejaba de la hembra, contraía el aedeago e iniciaba la limpieza de las antenas y piezas bucales.
Agradecimientos
Los autores agradecen a Fernando Mendonça su ayuda en la elaboracion del diagrama y a Adrian José Molina Rugama y Yuri Zurita por la traducción y revisión del presente artículo.
Referencias
Assem, J. van den. 1986. Mating behavior in parasitc wasps, p. 125-157. In J.D. Waage Greathead, (ed.). Insect parasitoids. Academic, Nueva York. [ Links ]
Assem, J. van den & J.H. Werren. 1994. A comparison of the courtship and mating behavior of tree species of Nasonia (Hymenoptera: Pteromalidae). J. Insect Behav. 7: 53-66. [ Links ]
Batiste, W.C. 1967. Biology the trefoil seed chalcid. Bruchophagus kolobovae Fedoseeva (Hymenoptera : Eurytomidae). Hilgardia 38: 427-469. [ Links ]
Chapman, R.F. 1982. The insects-structure and functions. Chapman & Hall, Nueva York. 919p. [ Links ]
Carthy, J.D. & P.E. Howse. 1980. Comportamento animal. EDUSP, São Paulo, 79p. [ Links ]
Kainoh, Y. 1986. Mating behavior of Ascogaster reticulatus Watanabe (Hymenoptera: Braconidae), an egg-larval parasitoid of the smaller tea tortrix moth, Adoxophyes sp. (Lepidoptera: Tortricidae) I. Diel patterns of emergence and mating, and some conditions for mating. Appl. Ent. Zool. 21: 1-7. [ Links ]
Kouloussis, N.A. & B.I. Katsoyannos. 1995. Distribution and Activitiesof Eurytoma amygdali (Hymenoptera: Eurytomidae) wasp on almond trees. Ann. Entomol. Soc. Amer. 88: 547-553. [ Links ]
Leonard, S.H. & J.M. Ringo. 1978. Analysis of male courtship patterns and mating behavior of Brachymeria intermedia. Ann. Entomol. Soc. Amer. 71: 817-826. [ Links ]
Manning, A. 1979. A Introdução ao comportamento animal. Livros Técnicos Científicos, Rio de Janeiro, 354p. [ Links ]
Ohashi, O.S. 1984. Biologia e aspectos morfológicos de Brachymeria (Brachymeria) ovata (Say. 1824) (Hymenoptera: Chalcididae). endoparasito de pupas de Lepidoptera. Tese de Mestrado em Entomologia, Escola Superior de Agricultura, Luiz de Queiroz, Piracicaba, São Paulo, Brasil. [ Links ]
Pereira, M.J.B. 1996. Biologia de Bephratelloides pomorum (Fab.) (Hymenoptera: Eurytomidae), broca da semente de graviola. Tese de Mestrado em Entomologia, Universidade Federal de Viçosa, Viçosa, Minas Gerais, Brasil. [ Links ]
Perez-Lachaud & G. M. Campan. 1994. Sexual behaviour and reproductive strategy in Chryseida bennetti Burks (Hymenoptera: Eurytomidae). J. Can. Zool, 72: 126-134. [ Links ]
Pittara, I.S. & B.I. Katsoyannos. 1985. Male attraction to virgin females in the almond seed wasp. Eurytoma amygdali Enderlein (Hymenoptera: Eurytomidae). Ent. Hellen. 3: 43-46. [ Links ]
Powers, N.R. & E.R. Oatman. 1984. Biology and temperature responses of Chelonus kellieae and Chelonus phthorimaeae (Hymenoptera: Braconidae) and their host the potato tuberworm. Phthorimaea operculella (Lepidoptera: Gelechiidae). Hilgardia 52: 1-32. [ Links ]
Price, P.W. 1975. Evolutionary strategies of parasitc insects and Mites. Plenum, Nueva York, 224p. [ Links ]
Simser, D.H. & H.C. Coppel. 1980. Courtship and mating behavior of Brachymeria lasus (Hymenoptera: Chalcididae), an imported gypsy moth parasitoid. Entomophaga 25: 349-356. [ Links ]
Tagawa, J. S. Asano. T. Ohtsubo, M. Kamomae & T. Gotoh. 1985. Influence of age on the mating behavior of the braconid wasp. Apanteles glomeratus L. Appl. Ent. Zool. 20: 227-230. [ Links ]
Thornhill, R. J. Alcock. 1983. The evolution of insect mating systems. Harvard University, Masachusets. 547 p. [ Links ]
1 Departamento de Biologia Animal - Pós-Graduação em Entomologia - Universidade Federal de Viçosa - 36.570.000,
Viçosa, Minas Gerais, Brasil. e-mail: mjbperei@carpa.ciagri.usp.br
2 Laboratório de Controle Biológico, Universidade Estadual do Norte Fluminense - 2000, Horto - Campus, RJ.














