La lepra, también conocida como enfermedad de Hansen (EH), es una infección granulomatosa crónica causada por el bacilo Mycobacterium leprae o M. lepromatosis.1 Esta enfermedad desencadena diversas respuestas inmunitarias2 que, en algunos casos, pueden evolucionar hacia la neuropatía periférica, con posibles consecuencias a largo plazo. Además de sus manifestaciones clínicas, los efectos sociales y psicológicos y las secuelas visibles han resultado en un estigma histórico asociado a la EH.3
En este contexto, el año 2023 adquiere una importancia especial, pues se conmemora el 150º aniversario del descubrimiento del bacilo de la EH por el Dr. Gerhard Armauer Hansen.4 Fue el 28 de febrero de 1873 cuando el Dr. Hansen realizó la observación inicial del agente causante de la lepra en su laboratorio en Bergen, Noruega.5 Este descubrimiento marcó un hito en la historia, al ser la primera vez que se identificó una bacteria como un patógeno humano, lo que contribuyó a la transformación de la comprensión y el enfoque de las enfermedades infecciosas.6
En la década de 1990, la Organización Mundial de la Salud (OMS) lanzó una campaña para eliminar la EH como problema de salud pública para el año 2000.7 La eliminación de la EH, según la definición de la OMS, significó una reducción del número de personas con la enfermedad a menos de 1 por cada 10000 habitantes por medio de la poliquimioterapia.8
Si bien es cierto esta meta se cumplió a nivel mundial, la eliminación de la EH como problema de salud pública no se ha logrado en algunos países endémicos, en particular en el ámbito subnacional.9
En abril de 2021, la OMS lanzó su estrategia mundial contra la lepra 2021-2030, “Hacia cero lepra”. (Organización Mundial de la Salud. Hacia cero lepra. Estrategia mundial contra la lepra (enfermedad de Hansen) 2021-2030. Ginebra: OMS; 2018. (accesado 02-05-2023). Disponible en: https://www.who.int/es/ publications/i/item/9789290228509. El objetivo de esta estrategia es la erradicación de la EH y se centra en cuatro pilares: implementar hojas de ruta integradas y nacionales en todos los países endémicos; ampliar la prevención de la enfermedad junto con la detección activa integrada de casos; controlar la EH y sus complicaciones, prevenir nuevas discapacidades y combatir el estigma y garantizar que se respeten los derechos humanos.
No obstante, estos esfuerzos se enfrentan a grandes desafíos debido al largo período de incubación del patógeno, que puede ser de 2 a 12 años,10 así como a las brechas en el conocimiento sobre la susceptibilidad individual a la infección y al desarrollo de la enfermedad. Estos factores dificultan el avance en la erradicación de la EH.11
A nivel mundial, debido a la pandemia de COVID-19 (enero 2020- 5 mayo 2023), se ha observado una disminución en el diagnóstico de la EH en la población general y en niños menores de 15 años; no obstante, de forma paralela, se ha registrado un preocupante aumento en el diagnóstico de los casos de lepra multibacilar (MB).1, 2
A pesar de que en Costa Rica la prevalencia de esta enfermedad es baja y no se reportan casos en niños desde 1995, aún representa un reto para el sistema de salud y la sociedad en general. Investigaciones recientes revelan demoras diagnósticas de años de evolución, la existencia de núcleos familiares con al menos tres generaciones afectadas documentadas con la enfermedad y discapacidad física en el 33% de la población participante.12-14 Aunado a ello, en 2016, se reportó el primer caso de Mycobacterium lepromatosis en el país. 15
Por tanto, el propósito de este estudio fue describir el comportamiento epidemiológico de la EH en Costa Rica durante el período 2018 al 2022.
Métodos
El presente es un análisis observacional descriptivo retrospectivo de los casos reportados al Sistema de Vigilancia Epidemiológica mediante el instrumento de notificación obligatoria, la boleta VE01, y bajo el código CIE-10 A30 - A309 (A30 Lepra, A300 Lepra indeterminada, A301 Lepra tuberculoide, A302 Lepra tuberculoide limítrofe, A303 Lepra limítrofe, A304 Lepra lepromatosa limítrofe, A305 Lepra lepromatosa, A308 Otras formas de lepra y A309 Lepra no especificada) de caso confirmado para EH durante el periodo de 2018-2022. Se solicitó la información de acceso público a la Unidad de Epidemiología de la CCSS y a la Unidad de Epidemiología de la Dirección de Vigilancia de la Salud del Ministerio de Salud, así como las proyecciones de población Instituto Nacional de Estadísticas y Censo (INEC) para el cálculo de prevalencias por año, por provincia y por cantón. La información cumple con la descripción de tiempo, lugar y persona. Los datos utilizados fueron no nominales.
Variables
Las variables analizadas incluyeron: edad al momento del diagnóstico, sexo, año de diagnóstico, ocupación, nacionalidad, provincia, cantón de residencia, establecimiento de salud que notifica, características clínicas de la discapacidad (grado) al momento del diagnóstico y la clasificación del grado de urbanización del distrito de residencia, según el INEC. (Instituto Nacional de Estadísticas y Censo: Clasificación de distritos según grado de urbanización: Metodología. San José: INEC; 2018. (accesado29-06-2023). Disponible en: https://inec.cr/busqueda?searchtext=Clasificaci%25C3%25B-3n%2520de%2520distritos%2520seg%25C3%25BAn%-2520grado%2520de%2520urbanizaci%25C3%25B3n).
La categorización de la EH se basó en la clasificación CIE-10, que comprende las siguientes categorías: A30 Lepra, A300 Lepra indeterminada, A301 Lepra tuberculoide, A302 Lepra tuberculoide limítrofe, A303 Lepra limítrofe, A304 Lepra lepromatosa limítrofe, A305 Lepra lepromatosa, A308 Otras formas de lepra y A309 Lepra no especificada.
Asimismo, se consideró la clasificación recomendada por la OMS, la cual es de carácter operativo y agrupa a los pacientes según sus baciloscopias y número de lesiones, con lo que ofrece orientación sobre el esquema terapéutico a utilizar. (Ministerio de Salud. Norma para la atención integral y control de la enfermedad de Hansen en Costa Rica. San José: OPS, 2013. (accesado29-05-2023). Disponible en: https://www.binasss.sa.cr/protocolos/hansen.pdf)
Los pacientes se dividieron en dos grupos principales: lepra paucibacilar (PB), que comprende aquellos pacientes con 5 o menos lesiones cutáneas y baciloscopia negativa, y lepra MB, que incluye a aquellos pacientes con 6 o más lesiones cutáneas o baciloscopia positiva. 16
Los datos poblacionales fueron obtenidos del INEC mediante estimaciones de población basadas en las estadísticas demográficas para los años 2011-2050, proyecciones nacionales y población total por años calendario, según sexo, grupos quinquenales de edades y edades simples. Todos los análisis se llevaron a cabo utilizando el programa SPSS versión 21.
Plan de análisis
Se calcularon frecuencias, razones, proporciones y prevalencia de EH por 10000 habitantes a en el país y para los cantones donde se reportaron casos para la cohorte de tratamiento hasta el 31 de diciembre de 2022. De acuerdo con la Norma para la atención integral y control de la enfermedad de Hansen en Costa Rica, se clasificó como “niños”, a los menores de 15 años y como “adultos” a los mayores de esa edad. La clasificación como “adulto” de individuos de 15 años en adelante, obedece a que ambos grupos comparten el mismo esquema terapéutico. (Ministerio de Salud. Norma para la atención integral y control de la enfermedad de Hansen en Costa Rica. San José: OPS,2013. (accesado29-05-2023). Disponible en: https://www.binasss.sa.cr/protocolos/hansen.pdf)
Los principales indicadores de EH se determinaron según las recomendaciones formuladas por la OMS.17 De acuerdo con estos criterios de calidad de detección, y con base en los datos disponibles, estos indicadores fueron determinados por año:
El número y la tasa de nuevos casos por 100000 habitantes.
El porcentaje de casos de lepra MB entre todos los nuevos casos detectados.
El porcentaje de casos de lepra femenina entre todos los casos nuevos casos detectados.
El porcentaje de casos pediátricos (niños menores de 15 años) entre todos los nuevos casos detectados.
La proporción de casos de EH con discapacidad grado 2 (G2D).
El porcentaje de personas nacidas en el extranjero con EH entre todos los nuevos casos detectados.
El presente estudio se encuentra fuera del ámbito de la investigación biomédica regulada por la legislación vigente. Su enfoque se basa en el análisis de datos provenientes de fuentes públicas y anónimas, los cuales no permiten la identificación de individuos específicos. En consecuencia, no se requirió de la aprobación de un Comité Ético Científico para llevar a cabo esta investigación.
Resultados
Durante el periodo 2018 a 2022, se notificaron 50 nuevos casos de EH en Costa Rica. De estos, el 27,6% (15 casos) correspondieron a pacientes del sexo femenino. Por cada caso del sexo femenino, se reportaron aproximadamente dos casos del sexo masculino (razón 2,33).
Cuadro 1 Características sociodemográficas de casos con diagnóstico confirmado de enfermedad de Hansen en Costa Rica durante el periodo 2018-2022
| Variables | Casos | |||
|---|---|---|---|---|
| n | % | Total | ||
| Sexo | ||||
| Masculino | 15 | 30 | ||
| Femenino | 35 | 70 | 100(50) | |
| Grupo de edad | ||||
| 15-22 | 4 | 8 | ||
| 23-30 | 6 | 12 | ||
| 31-38 | 6 | 12 | ||
| 39-46 | 4 | 8 | ||
| 47-54 | 10 | 20 | ||
| 55-62 | 7 | 14 | ||
| 63-70 | 8 | 16 | ||
| 71-78 | 5 | 10 | 100(50) | |
| Residencia según grado de urbanización | ||||
| Urbano | 15 | 30 | ||
| Predominante urbano | 23 | 46 | ||
| Predominante rural | 12 | 24 | 100(50) | |
| Clasificación de EH | ||||
| Paucibacilar | 3 | 6 | ||
| Multibacilar | 47 | 94 | 100(50) |
Fuente: Elaboración propia con datos del Ministerio de Salud y de la CCSS.
El promedio de edad al diagnóstico fue de 48,46 ± 17,88 para el grupo en general, con un rango de edad al diagnóstico de entre 15 a 78 años. El promedio de edad al diagnóstico para el sexo masculino fue de 45,93 ± 20,26 años. El promedio de edad al diagnóstico para el sexo femenino fue de 49,54 ± 17 años.
El grupo, en general, presentó un promedio de edad al momento del diagnóstico de 48,46 ± 17,88 años, con un rango que abarcó desde los 15 hasta los 78 años. Los individuos de sexo masculino registraron un promedio de edad al diagnóstico de 45,93 ± 20,26 años, mientras que el sexo femenino registró un promedio de 49,54 ± 17 años.
En relación con la ocupación laboral y la nacionalidad, se observó que el 84% de las personas no especificó el tipo de trabajo que desempeñan y que el 100% correspondía a costarricenses. En cuanto a la provincia de residencia, Puntarenas registra el mayor número de casos, con un total de 26; seguida por Guanacaste y Cartago, con 8 y 5 casos respectivamente para este periodo. (Ver Figura 1)
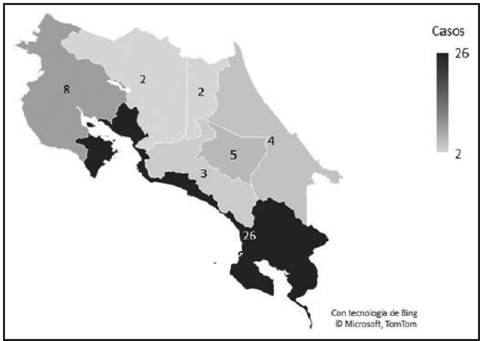
Figura 1 Distribución de casos de Enfermedad de Hansen en Costa Rica por provincia durante el período 2018-2022, Costa Rica. Fuente: elaboración propia con datos del Ministerio de Salud y de la CCSS.
En relación con las manifestaciones clínicas de la discapacidad al momento del diagnóstico, es relevante destacar que la información está disponible sólo para 20 casos (60%), y en ninguno de ellos se reporta G2D.
Al finalizar el año 2022, un total de 22 personas se encontraba bajo tratamiento, lo que representa una prevalencia a nivel nacional de 0.04 (22/5, 213, 362) casos por cada 10000 habitantes. En cuanto a la prevalencia por cantón en el mismo período, se observó que Garabito, Puntarenas, reportó una tasa de prevalencia de 1,09 (3/27404) por cada 10000 habitantes.
La distribución de la notificación de casos durante el período de estudio según el establecimiento de salud es la siguiente: 37 casos (74%) fueron reportados por hospitales nacionales, mientras que 13 casos (26%) fueron reportados por un Equipo Básico de Atención Primaria.
El Cuadro 2 presenta los casos reportados según clasificación CIE-10, siendo 2020 y 2022 (de confinamiento por COVID 19) el periodo con menor número (8 casos). El 86% del total de los enfermos fue reportado como lepra no especificada (A 30.9).
Cuadro 2 Casos reportados de Enfermedad de Hansen en Costa Rica según clasificación CIE-10 durante el periodo 2018-2022
| Clasificación CIE-10 | Años | Casos | % | ||||
| 2018 | 2019 | 2020 | 2021 | 2022 | n | % | |
| 3 | 0 | 0 | 0 | 0 | 3 | 6 | |
| 1 | 0 | 0 | 0 | 0 | 1 | 2 | |
| 0 | 0 | 1 | 0 | 2 | 3 | 6 | |
| 9 | 12 | 7 | 9 | 6 | 43 | 86 | |
| Total | 50 | 100 |
Fuente: elaboración propia con datos de Ministerio de Salud y de la CCSS.
Indicadores de detección de casos:
La tasa media global de detección de EH durante el período de estudio fue de 0,2 (50/25 549 059) por 100000 habitantes. La tasa de detección de EH disminuyó de 0,26 (13/5 003 402) a 0,249 (8/5213374) por 100000 habitantes entre 2018 y 2022 (Figura 2, a). La proporción de casos clasificados como MB aumentó a 100% a partir del año 2019.
La proporción de casos de EH femenina disminuyó de 38,46 a 12,5% para el periodo de estudio (Figura 2, b).
No se reportaron casos en niños, ni en personas nacidas en el extranjero ni G2D.

Figura 2 Indicadores de detección de 2018-2022, Costa Rica. (a) Tasa de detección de casos nuevos de enfermedad de Hansen por 100000 habitantes; (b) Proporción de mujeres afectadas con enfermedad de Hansen entre los casos nuevos.Fuente: elaboración propia con datos del Ministerio de Salud y de la CCSS.
Discusión
Nuestro estudio ha permitido describir el comportamiento epidemiológico de EH durante el periodo 2018-2022. En el país, la prevalencia de la patología mantiene los niveles de eliminación. No obstante, a nivel subnacional, aún persisten cantones con niveles superiores a 1 por 10000 habitantes. La prevalencia de la enfermedad mostró tendencia a la baja con respecto a periodos anteriores. 14
Durante el periodo de estudio, se reportó un total de 50 casos y se observó una proporción de 2,33 hombres por cada mujer. Este resultado es similar al análisis de tendencias en estudios previos realizados en Costa Rica.14, 18 Los pacientes masculinos todavía representan una proporción relativamente alta de los casos recién diagnosticados, lo que puede estar relacionado con diferentes susceptibilidades genéticas entre los sexos.19
Los hombres generalmente están más expuestos a la enfermedad y tienen un contacto reducido con la atención médica, lo que puede retrasar el diagnóstico y aumentar el riesgo de desarrollar discapacidad física.20
La edad promedio de los pacientes para el período de estudio fue de 48.46 años. El 94% de ellos presentaba la forma MB, caracterizada por síntomas más graves, más complicaciones y un curso más largo de poliquimioterapia (PQT) en comparación con la forma PB.11 En un estudio realizado en el norte de la India, que analizó la edad de aparición de EH en 1012 pacientes, se observó un mayor porcentaje de casos de lepra MB en el grupo de mayor edad.21 Un estudio adicional investigó la incidencia de la enfermedad entre los individuos en contacto con pacientes de EH en Agra, India. Los resultados indicaron un aumento progresivo y significativo en la tasa de incidencia conforme aumentaba la edad.22 Sin embargo, esta tendencia también puede estar relacionada con una demora diagnóstica14, lo que sugiere que nuestro país debe seguir monitoreando la EH y fortaleciendo la detección y el diagnóstico oportuno.
Aunque los casos de enfermedad se están registrando en todo el país, es importante resaltar que la provincia de Puntarenas concentró aproximadamente el 52% de estos casos durante el periodo de estudio. Además, al analizar los datos de los distritos de residencia, se observó que la tendencia predominante corresponde a distritos de predominio urbano según la clasificación del INEC. Estudios recientes indican que variables como la urbanización y el hacinamiento en los hogares reflejan un mayor riesgo de exposición al contacto y niveles más altos de privación, lo cual se ha asociado con un mayor riesgo de padecer la EH.23
El grado de discapacidad es un indicador para diagnosticar y monitorear la evolución de la EH. La asociación entre la proporción de lepra MB y la presentación de G2D se ha demostrado en el pasado.24 Estudios previos han demostrado que la G2D puede indicar demora diagnóstica y un sistema de vigilancia subóptimo.25
Aunque los casos en mujeres parecieran ir en descenso, la literatura indica que existen problemas comunes de exposición para todas las mujeres, especialmente para los grupos socioeconómicos más desfavorecidos.26 Los grupos socioeconómicos más bajos tienen a habitar en viviendas precarias, con ventilación inadecuada, presentar bajo estado nutricional y un mayor riesgo de contactos con EH. Una nutrición deficiente, en particular, puede comprometer el estado inmunológico.
La exposición femenina a la EH no puede ofrecer, por sí sola, una explicación completa de la incidencia y prevalencia de la enfermedad en este grupo; no obstante, constituye un indicador de riesgo recomendado por la OMS debido al mayor tiempo que las mujeres pasan con los niños, lo cual podría aumentar el riesgo de transmisión en este grupo.26
La detección de la EH en los niños es un indicador de la transmisión continua de la infección en la comunidad.27 Desde 1995 no se reportan casos en personas menores de 15 años en el país.14,18 Sin embargo, nuestro estudio muestra que personas con edades entre los 15 y los 22 años están siendo diagnosticadas. El diagnóstico tardío de la enfermedad es un factor potencial para la generación de discapacidad física y daño emocional, lo que afecta la calidad de vida del paciente. Por lo tanto, es esencial el diagnóstico precoz, especialmente en individuos menores de 15 años.28
Una limitación de este estudio radicó en el uso de bases de datos de acceso público, las cuales pueden contener subregistros
En resumen, en nuestro país se está llevando a cabo un proceso de erradicación de la EH. Este estudio ha permitido identificar las zonas geográficas con mayor prevalencia de la enfermedad, así como algunas características sociodemográficas comunes en las personas afectadas por EH. Para lograr una erradicación efectiva de esta enfermedad, es crucial profundizar en nuestra comprensión de las características sociodemográficas de las personas afectadas, así como en las tendencias de la patología. De esta manera, podremos dirigir nuestros esfuerzos hacia el sector de la población con mayor riesgo de contagio y asegurar que se implementen las medidas adecuadas para prevenir y tratar la EH de manera eficaz.















