La glucosa es el principal carbohidrato metabólico en humanos.1 Los monosacáridos como la glucosa y la galactosa generalmente existen en equilibrio entre una cadena abierta y un anillo cerrado; la forma de cadena abierta expone un grupo aldehído (carbonilo) que normalmente es reactivo en condiciones fisiológicas, lo que hace que estos azúcares se clasifiquen como azúcares “reductores”.1 El grupo aldehído es particularmente reactivo frente a grupos amino libres, como los presentes en proteínas con residuos de lisina y arginina.1 Cuando un grupo carbonilo de un azúcar reductor interactúa con una amina libre, forma una aldimina (también conocida como base de Schiff), que es reversible.1 Este es el primer paso hacia un producto final e irreversible de azúcar- amino conocido como glicación.1, 2 La química involucrada ha sido particularmente bien estudiada en proteínas, con la hemoglobina glicada (HbA1c) como un marcador clásico de diabetes, pero cualquier grupo amino libre (-NH2) podría en teoría provocar una reacción de glicación inespecífica.1
Los productos de glicación avanzada (Advanced Glycation Endproducts, AGEs), definidos por su composición química (figura 1), son parte de un conjunto de moléculas con funciones biológicas potencialmente alteradas como resultado de este cambio estructural.1
La generación de AGEs se describió por primera vez como parte del envejecimiento y poco después, durante la progresión de diabetes.3, 4 En ambos casos, los AGEs fueron asociados a la degradación de estructuras tisulares y al deterioro de la capacidad funcional. Se propuso que el incremento de los niveles de lipoproteínas modificadas en pacientes diabéticos era la causa del desarrollo acelerado de complicaciones macrovasculares.4 Esto se atribuyó a la fuerte unión de AGEs con proteínas de vida-media larga y también se identificaron en la sangre y los tejidos de pacientes con enfermedad renal terminal.3
El objetivo de la presente revisión es resumir los avances en la biología involucrada en la respuesta a los productos de glicación avanzada.
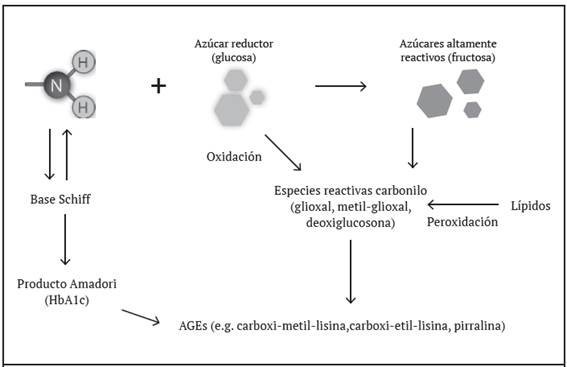
Figura 1 Reacciones determinantes en la generación de productos finales de glicación avanzada (AGEs). Los grupos amino libres (-NH2) pueden dar como resultado final la producción de mediadores proinflamatorios, como la carboxi-metil-lisina, carboxi-etil-lisina y pirralina, al generarse un enlace covalente irreversible.
Biología del receptor para productos finales de glicación avanzada (RAGE)
El receptor para productos finales de glicación avanzada (RAGE) es un miembro de la superfamilia de inmunoglobulinas y genéticamente el gen respectivo RAGE (también conocido como AGER) se encuentra en el cromosoma 6, cerca del complejo mayor de histocompatibilidad tipo III.2, 5-7 Fue descubierto originalmente en células endoteliales de aorta y su expresión está incrementada en diversas condiciones, por ejemplo diabetes, estrés oxidativo, fallo renal, inflamación, obesidad, aterosclerosis y enfermedad de Alzheimer.4, 8-12 Se ha descrito la expresión de RAGE en células endoteliales y músculo liso de la vasculatura, neuronas y microglía del sistema nervioso central, probablemente condicionada a ambientes inflamatorios, así como en ciertas células inmunes, como células T y B, monocitos, células dendríticas y granulocitos, sin embargo, su expresión es particularmente elevada en células de epitelio alveolar tipo I.13 RAGE forma multímeros en la membrana citoplasmática, con variaciones en la conformación de sus subunidades, dándole la capacidad de reconocer diversas estructuras, incluyendo una isoforma que es secretada a la circulación (RAGE soluble o sRAGE).5 Esta característica le permite interactuar con una gran cantidad de ligandos, independientemente de su secuencia de aminoácidos, pues lo que reconoce son estructuras conformacionales o cargas negativas.5, 13, 14 El dominio intracelular del receptor RAGE inicia la cascada de señalización una vez que un ligando es reconocido y no posee actividad tirosina kinasa sino que recluta moléculas adaptadoras de la vía TLR (Receptores tipo Toll).15, 16 Comprender la manera en que el receptor RAGE responde a la interacción con sus blancos es de suma importancia debido a su papel en varias patologías, como se ha mencionado previamente, y se ha propuesto que existe convergencia y amplificación entre la señalización por RAGE y los TLR.15, 17-19
Los tipos de moléculas reconocidas por RAGE son un grupo heterogéneo e incluyen proteínas, lípidos y ácidos nucleicos.1, 2, 5, 20 Un importante ligando proinflamatorio es HMGB1, una proteína nuclear altamente conservada que es liberada tras lesiones celulares.18, 21 Otro grupo de ligandos incluye la familia de proteínas con capacidad de unión a calcio denominada calgranulinas S100, las cuales se acumulan en el espacio extracelular en condiciones de inflamación crónica y en fibrillas de amiloide beta (Aβ).22, 23 Por tanto, se considera que RAGE es un receptor de reconocimiento de patrones (Pattern Recognition Receptor, PRR), pues reconoce diversos blancos moleculares, tanto infecciosos como endógenos; esta diversidad de interacciones ha vinculado a RAGE como un modulador clave en el desarrollo de múltiples patologías, como diabetes, enfermedad de Alzheimer, lupus y cáncer.13, 21, 24, 25
Con base en lo expuesto, es posible afirmar que las modificaciones provocadas por la glicación no enzimática causan cambios estructurales que interfieren con la función y la vida media de diversas moléculas biológicas y esto se encuentra vinculado a la activación de vías de señalización proinflamatorias mediadas por el receptor RAGE.26- 28 En el contexto de la diabetes, se han estudiado varias moléculas por su papel en la patogénesis, por ejemplo, albúmina, colágeno, lipoproteínas de baja densidad e insulina.29
Productos finales de glicación avanzada (AGEs) y su papel en la activación de la inmunidad
A principios de la década de los noventa, se consideró que las lipoproteínas modificadas inducían la transformación de los macrófagos en células espumosas y, en algunos casos, también inducían el daño de las células endoteliales.3, 4 Además, se partió del principio que las lipoproteínas modificadas desencadenan una respuesta inmune que conduce a la formación de anticuerpos y luego a la formación de complejos inmunes que contienen LDL, lo cual establece una relación con la alta frecuencia de aterogénesis en la población diabética.4 Muchos de los efectos fisiopatológicos en las complicaciones del envejecimiento, la diabetes o la uremia, se atribuyeron en las últimas dos décadas a los AGEs y compuestos relacionados, por su capacidad de inducir reacciones inmunológicas prolongadas.3
Según los hallazgos mencionados, la interacción AGE/RAGE activa de manera sostenida vías de señalización celulares centrales en la respuesta inflamatoria, por ejemplo NF-κB, lo cual conlleva a una generación de especies reactivas de oxígeno y microambientes atrayentes y activadores de macrófagos.30 La prolongada e inapropiada detección de ácidos nucleicos endógenos por RAGE sugiere que estas moléculas también actúan como productos de glicación inespecífica, lo cual desencadena procesos inflamatorios crónicos dañinos o respuestas autoinmunes, como las observadas en pacientes con lupus eritematoso sistémico (LES).25
Uno de los mecanismos de tolerancia inmune para evitar el reconocimiento de ácidos nucleicos endógenos implica el secuestro de PRR específicos en compartimentos citoplasmáticos o endolisosomales, a diferencia de patógenos como virus que típicamente ingresan a las células a través de la endocitosis o fagocitosis mediada por receptores.25 Esta compartimentación asegura que los PRR sólo se activen cuando los ligandos logran acceder al compartimento subcelular correcto, es decir, bajo condiciones de infección o daño tisular, lo esperable es que el huésped active mecanismos que propicien el inicio de una respuesta inmune. Por lo tanto, la presencia de sensores de ácido nucleico o moléculas de suministro de ácido nucleico en la superficie celular sensibiliza las células y permite una disminución en el umbral de activación, esto permite una respuesta más rápida o más pronunciada contra los ácidos nucleicos derivados de agentes infecciosos o extraños para el organismo.25 RAGE es expresado en la superficie celular de diversos linajes celulares, como endotelio, microglía, linfocitos, células dendríticas, polimorfonucleares, monocitos, entre otras, donde las moléculas glicadas pueden interactuar con estos receptores.13 Sin embargo, lo más notorio es la relación positiva que se ha observado en cuanto a expresión de RAGE en condiciones proinflamatorias, donde su expresión puede incrementarse en patologías en las que se acumulan ligandos de RAGE como en condiciones de sepsis o lesiones estériles, así como en enfermedades autoinflamatorias, como diabetes y aterosclerosis.25, 29, 31
En muchas de las patologías mencionadas se ha encontrado al ARN extracelular implicado en gran variedad de procesos, como el reclutamiento de leucocitos y la polarización celular, así como en el desarrollo de diabetes y más ampliamente conocido en neurodegeneración.32-37
RAGE asociado a neurodegeneración
La presencia de reacciones inflamatorias crónicas son un hallazgo común en enfermedades neurodegenerativas como el Alzheimer, y se consideran un factor importante que acelera la patogénesis.22 Dentro de los tipos de receptores que promueven las respuestas inmunes crónicas se incluyen los TLR y RAGE, los cuales actúan de manera sinergística en condiciones oxidativas.23
Una de las principales causas de la neuroinflamación crónica es la formación persistente y deposición de agregados de amiloide beta (Aβ), lo cual lleva a una activación crónica del sistema inmune. 38, 39 Se ha documentado la presencia de AGEs en placas amiloides en concentraciones que duplican y hasta triplican las estudiadas en pacientes control, lo cual sugiere que Aβ podría ser también clasificado como un producto de glicación.40, 41
Más allá del ambiente proinflamatorio observado en pacientes con demencia tipo Alzheimer, se han determinado niveles de RAGE significativamente aumentados en la zona de la microglía y redes neuronales; esto vincula la unión de Aβ o Aβ-AGE a RAGE asociado a esta patología.42 Adicionalmente, el uso de anticuerpos contra RAGE atenúa significativamente el daño neuronal inducido por Aβ-AGE en modelos animales.41 Sin embargo, los mecanismos celulares que mantienen una activación inmunológica crónica que conlleva a un ciclo de neurodegeneración en el Alzheimer aún son inciertos. En este sentido, se ha postulado que los receptores RAGE podrían jugar un papel relevante en la activación neuroinflamatoria crónica.38
RAGE asociado a Diabetes Mellitus y Enfermedad Cardiovascular
La diabetes es un estado proinflamatorio generalizado dado por una regulación positiva de múltiples mediadores inflamatorios y se encuentra asociada a factores de riesgo tales como nivel elevado de HbA1c,lipoproteínasde baja densidad ycolesterol, albuminuria, tabaquismo y presión arterial, los cuales se encuentran estrechamente relacionados a la predisposición de padecer enfermedades cardiovasculares (ECV).29 Particularmente, la elevación de la HbA1c sobre el rango de referencia ha resultado ser el predictor más fuerte de accidente cerebrovascular e infarto agudo de miocardio.29 Niveles elevados de la hsCRP (proteína C reactiva de alta sensibilidad) como biomarcador asociado a futuros eventos cardiovasculares patológicos tanto en DM1 como en DM2, se han vinculado con niveles significativamente más elevados de AGEs y su receptor soluble en plasma, aunado a un constante estrés oxidativo y activación de NF-κB.29, 43-46
Una comparación de pacientes con DM2 y controles normo-glicémicos reveló que en diabetes existe un incremento significativo en la expresión de TLR2 y TLR4 en monocitos aislados de sangre periférica (a nivel de ARN y proteína).44 Este incremento en la expresión de TLR2 y TLR4 correlaciona con varios parámetros clínicos, como el índice de masa corporal, índice de resistencia a la insulina, glucosa, HbA1C, carboxi-metil-lisina y ácidos grasos libres.44 Además, ligandos endógenos de TLR2 y TLR4, por ejemplo, HSP60, HSP70 y HMGB1, también se encuentran elevados, lo cual indica un tipo de proceso inflamatorio estéril, como consecuencia de la producción acelerada de AGEs en hiperglicemia.44, 47
En particular, se ha observado diabetes complicada asociada a muerte por ECV en pacientes que presentaron niveles más altos de la proteína S100/calgranulina (S100A12).48 Se trata de una proteína de bajo peso molecular con capacidad de unión a calcio que se expresa en gran variedad de células, desde células epiteliales hasta neutrófilos.29 Existe la posibilidad de que RAGE interactúe con muchos más tipos de proteínas de la familia S100 de las que actualmente se encuentran documentadas debido a la naturaleza multi-ligando en la interacción de RAGE y S100/ calgranulina, fibrillas amiloides y los otros tipos de AGEs descritos previamente.29
Resulta interesante notar la aparente ubicación de RAGE en sitios donde sus ligandos tienden a estar acumulándose. Ejemplo de ello son las notorias elevaciones de S100A12 y otros polipéptidos AGEs anteriormente mencionados en tejidos de pacientes diabéticos y lesiones vasculares.29 Esto favorece la unión de RAGE a múltiples ligandos dada su naturaleza y la identificación consecuentemente más elevada de RAGE debido a una probable regulación positiva de la expresión a causa de la presencia de sus ligandos. Esto finalmente conlleva a una activación celular exacerbada mediada por RAGE debido a que funciona como un receptor de transducción de señales para sus ligandos, en lugar de ser solo un sitio de unión a AGEs en la superficie celular.29
RAGE y la enfermedad por Coronavirus SARS- CoV-2 (COVID-19)
Se ha demostrado que la vía de señalización por RAGE juega un papel importante en la patogénesis de enfermedades pulmonares como la enfermedad pulmonar obstructiva crónica (EPOC), la enfermedad pulmonar intersticial y el síndrome respiratorio agudo severo (SRAS, o SARS por sus siglas en inglés).49-52 Al compararse los niveles séricos de sRAGE en pacientes con COVID-19 versus controles sanos, los niveles de sRAGE fueron más altos en el grupo asintomático, lo cual sugiere algún tipo de relación con el grado de afectación pulmonar.53 Después de ajustar por edad, el nivel de sRAGE en suero fue mayor en los pacientes con afectación pulmonar en comparación con el grupo de control y el grupo de COVID-19 asintomático.53
Se ha planteado que la edad se ha considerado el factor de riesgo más importante asociado con la morbilidad y la mortalidad en COVID-19, mientras otros factores de riesgo incluyen EPOC, tabaquismo, aterosclerosis, insuficiencia cardíaca e hipertensión. 53-57 Con el envejecimiento, la expresión de RAGE y sus ligandos relacionados con la edad aumentan. 58-60 Es posible que la activación proinflamatoria concomitante de RAGE pueda explicar la respuesta inmune exacerbada ante el COVID-19 en pacientes de edad avanzada con comorbilidades y enfermedades crónicas. RAGE se expresa en gran medida en las mismas células alveolares tipo 1 (AT1) que expresan el receptor enzima convertidora de la angiotensina 2 (ECA-2) identificado como el sitio de unión inicial para el virus SARS-CoV-2. 52, 61 Estas observaciones apoyan la teoría de que la vía RAGE podría jugar un papel en las complicaciones por COVID-19. El potencial protrombótico de las células endoteliales puede incrementarse en pacientes con COVID-19 al generarse mediadores inflamatorios que promueven un estado de hipercoagulabilidad resultando en trombosis pulmonar. 52, 62 Tras hallazgos que han sugerido que los ligandos proinflamatorios que se unen a RAGE están regulados positivamente en humanos y ratones con obesidad, se ha planteado la hipótesis de que la unión de RAGE a ligandos en circulación, algunos aún desconocidos, podrían causar una inflamación de bajo grado en múltiples órganos, incluidos los pulmones. 51, 63, 64
Se ha sugerido que la vía RAGE puede exacerbar la neumonía y el síndrome de dificultad respiratoria aguda.65 Es interesante resaltar que en este estudio, el uso de un anticuerpo monoclonal contra RAGE así como sRAGE (la forma soluble del receptor) redujeron tanto la lesión pulmonar, la inflamación alveolar y mejoraron la oxigenación arterial.65 Otros estudios donde se ha analizado lavado broncoalveolar han detectado la presencia de sRAGE.66, 67 Esta evidencia no sólo apoya el concepto de que RAGE está involucrado en inflamación, sino que puede ser un potencial marcador de lesión pulmonar. Además, plantea la posibilidad de que parte de la inflamación pulmonar severa observada en pacientes con COVID-19 pueda atribuirse a la vía RAGE. 52, 62 Este hallazgo sugiere una posible aplicación de RAGE soluble como marcador pronóstico.
Recientemente se ha demostrado niveles elevados de calgranulinas (ligandos conocidos de RAGE) en tejido pulmonar y suero de pacientes graves de COVID-19; esto se ha asociado con riesgo incrementado de ingreso a unidad de cuidados intensivos y muerte.68, 69 Adicionalmente, los niveles plasmáticos de calgranulinas correlacionan con la severidad de la enfermedad.70, 71 Otro ligando de RAGE, HMGB1, ha sido identificado por su capacidad de producir NETosis (neutrophil extracellular traps o trampas extracelulares de neutrófilos) y de inducir la expresión de ECA2, facilitando el ingreso de COVID-19 a la célula.72, 73 Al compararse con sujetos saludables, se observó que 32 pacientes hospitalizados con COVID-19 presentaban una concentración de NETs elevada en plasma, aspirado traqueal y tejido pulmonar.74
RAGE asociado a la Enzima Convertidora de la Angiotensina 2 (ECA2)
A inicios de la pandemia por COVID-19, se consideró que el ingreso del virus en la célula mediado por los receptores epiteliales de la enzima convertidora de la angiotensina (ECA) tenía un papel patogénico al inducir una regulación negativa de la ECA2.75, 76 La ECA2 juega un papel importante en el sistema renina-angiotensina, y el desequilibrio entre la vía que involucra ECA, la angiotensina II y el receptor de angiotensina 2 tipo 1 (AT1R) puede potencialmente desencadenar inflamación multisistémica.77 Se encuentra documentado que el aumento de la ECA y la angiotensina II son factores de mal pronóstico para la neumonía grave, a causa de la inducción exacerbada de la vía NF-κB, y subsecuente inflamación a través de vías que median la señalización clásica.78-81 Múltiples estudios sistemáticos y de meta-análisis, han demostrado que los inhibidores de la ECA y bloqueadores del receptor de angiotensina II tienen una función protectora y su uso hospitalario en pacientes hipertensos hospitalizados con COVID-19 ha sido recientemente asociado con un menor riesgo de mortalidad.82-84
A diferencia de otros tejidos adultos sanos que expresan un nivel bajo de RAGE y su expresión se encuentra regulada ante el incremento de procesos patológicos, los tejidos pulmonares expresan niveles basales notablemente altos de RAGE, donde parece desempeñar un papel fisiológico homeostático en la morfología tisular.85 A raíz de esto, se ha sugerido que ante la abundancia de expresión de AT1R y RAGE en pulmones, la transactivación de RAGE producida por la activación de AT1R mediada por angiotensina II podrían provocar no sólo un perfil de expresión génica inflamatoria, sino también un mecanismo de retroalimentación positiva, en el que los estímulos inflamatorios activan de manera sostenida a NF-κB.83 Ante este panorama, el desequilibrio mediado por la vía ECA / angiotensina II / AT1R podría generarse por la unión del virus a las proteínas ECA2, limitando su función como contrarregulador del sistema renina-angiotensina.83
Es importante mencionar que en el adulto mayor, en hipertensos y en obesidad, se presentan niveles reducidos de ECA2 respecto a personas jóvenes y con mejor estado de salud basal.86, 87 Sin embargo, respecto a los factores de riesgo de COVID-19, los síndromes metabólicos se exacerban en el proceso de envejecimiento y con comorbilidades presentes, por lo tanto, pueden estar estrechamente asociados con el deterioro de las condiciones clínicas de los pacientes, causadas por la progresión de la enfermedad causada por el SARS-CoV-2.83 Una acumulación gradual de AGEs puede a su vez resultar en una respuesta exacerbada ante la infección.62 Así mismo, se ha demostrado una relación entre la obesidad en humanos y en animales de experimentación con un desequilibrio en el sistema renina angiotensina que resulta en una sobreexpresión de angiotensina II y AT1R a nivel sistémico y a nivel del tejido adiposo.88, 89 También, hallazgos en modelos de ratones obesos han demostrado que sin ejercicio y dieta adecuada, el eje deletéreo angiotensina II y AT1R predomina a pesar del aumento de la cantidad de ECA2, lo cual es indicativo de que individuos obesos, especialmente
aquellos con exceso de tejido adiposo visceral, podrían desarrollar una respuesta sistémica en el eje angiotensina II y AT1R, posiblemente contribuyendo al desarrollo de una forma más grave de COVID-19. 90-92
Discusión
La presencia de AGEs es un fenómeno fisiológico, producto de la adaptación evolutiva al uso de carbohidratos como principal fuente de energía. El estudio de este tipo de moléculas podría potencialmente llevar a la identificación de nuevos marcadores biológicos en una diversa cantidad de condiciones patológicas, en particular neurodegeneración, y el desarrollo de aplicaciones farmacológicas para su regulación podría generar nuevas terapias como resultado. El incremento en la expresión de RAGE en diversas patologías apunta a su función como mediador de la respuesta a cambios estructurales en prácticamente todo tipo de moléculas biológicas (proteínas, lípidos, ácidos nucleicos). La convergencia en la respuesta intracelular apunta a mecanismos de señalización comunes a los receptores tipo Toll (asociados principalmente a reconocimiento de patógenos) y los receptores de reconocimiento de patrones (asociados a estímulos endógenos).
Las cascadas de señalización desencadenadas por RAGE generan procesos inmunológicos complejos y diversos. Las proteínas de unión a RAGE ubicadas en el citoplasma o en la membrana plasmática pueden modular la diversidad de señalización mediada por RAGE. También, es preciso considerar la flexibilidad conformacional adquirida después de la unión, la cual va desde la homo-dimerización, homo-multimerización y hetero-dimerización de estas proteínas, que debe ser estudiada a mayor profundidad en diferentes contextos inmunológicos.
Hasta la fecha, no existe evidencia concreta del papel de RAGE o AGE en la infección por COVID-19. Sin embargo, dado que las enfermedades metabólicas son frecuentes en poblaciones vulnerables que envejecen, y la diabetes e hipertensión son comorbilidades asociadas con altas tasas de mortalidad por COVID- 19, deberían ser el foco de más investigaciones sobre la compleja vía de infección por este virus.
En conclusión, comprender a mayor profundidad estos mecanismos podría favorecer el desarrollo de nuevas rutas de acción para medicamentos antivirales; en tanto que la presencia elevada de ligandos de RAGE en el contexto de la enfermedad por COVID-19, podría ser la clave para explicar la patología exacerbada en pacientes diabéticos.















