El contagio familiar de la lepra o Enfermedad de Hansen (EH) es un hecho bien establecido.1 La dinámica de transmisión para el Mycobacterium leprae y el Mycobacterium lepromatosis (los agentes causantes de la lepra) es compleja. El tracto respiratorio superior se considera el portal principal para la entrada y salida de M. leprae y las personas con enfermedad activa son las principales fuentes de infección.2 Para el M. Lepromatosis los mecanismos son desconocidos y se podrían presentar interacciones con reservorios desconocidos en áreas no endémicas.3
En comparación con la población general, los contactos intradomiciliares de pacientes con EH son un grupo de alto riesgo de contraer la enfermedad y sufrir los efectos de la EH.4 Numerosos estudios han demostrado que la mayoría de los pacientes nuevos con EH poseen el antedecente de haber tenido contacto con otro paciente.5,6
Debido a su amplio espectro de manifestaciones clínicas, la clasificación de la EH es compleja y puede incluir características clínicas, histopatológicas, microbiológicas e inmunológicas propuestas por la clasificación de Ridley y Jopling.7,8 Para facilitar su manejo, la Organización Panamericana de la Salud (OPS) / Organización Mundial de la Salud (OMS) clasificó la EH según cantidad de lesiones, cantidad de nervios afectados, y su carga bacilar en multibacilar(MB) y paucibacilar.7 El riesgo de desarrollar la enfermedad entre los contactos paucibacilares es 2-3 veces mayor que en la población general, mientras que el riesgo aumenta a 5-10 veces entre los contactos MB.9
Para infectarse con el bacilo de Hansen y desarrollar la enfermedad, hay entonces mayores posibilidades cuando existe un contacto íntimo y repetido, muy evidente en los casos de EH infantil, especialmente, el contacto madrehijo y el contagio entre parejas.10,11 La predisposición innata a la infección parece ser particularmente crucial para la EH: se estima que solo una pequeña fracción (del 5 al 12%) de las personas expuestas a M. leprae se infecta con éxito.12
Durante el periodo 2012-2017, se registraron en Costa Rica 51 casos nuevos de EH con prevalencia a nivel nacional de 0,06 casos por diez mil habitantes.13 La detección anual en la última década es de 9 individuos por año.13 Las provincias con mayor prevalencia de EH son Puntarenas, Limón y San José (20, 10 y 9 casos, respectivamente). Según el registro de retiro del medicamento para EH un 90 % corresponden a EH MB.13 Desde la década de los noventa no se han reportado casos de lepra infantil en el país.14 A pesar de la baja prevalencia de EH a nivel nacional, se registran demoras diagnósticas15 las cuales implican consecuencias físicas, psíquicas y económicas para el paciente y su familia.
El objetivo es identificar las características sociodemográficas, culturales y clínicas comunes en grupos familiares con antecedente de EH, como insumo para mejorar el tratamiento de la EH como parte del estudio principal llamado “Factores asociados con la administración de tratamiento con lepra en Costa Rica”.
Métodos
Se realizó un estudio cualitativo, empleando la técnica de entrevista en profundidad semi-estructurada, la cual exploró los factores relacionados con la búsqueda del tratamiento de la EH. Se seleccionaron 25 personas adultas entre 23 y 88 años de edad, de ambos sexos y quienes fueron atendidos por el sistema de salud público costarricense. La selección de los informantes se hizo por medio de una selección intencional y por oportunidad, según los siguientes criterios de inclusión: mayor de 18 años, de ambos sexos, haber padecido lepra o padecer lepra y que estuvieran anuentes a participar en el estudio por medio de la firma del consentimiento informado.
La recolección de los datos se realizó a través de la técnica de entrevista en profundidad, para explorar con base en una guía de entrevista elaborada de antemano y tomando como referencia factores sociodemográficos, sociales y culturales relacionados con el diagnóstico de la EH y su tratamiento; aplicada por la antropóloga social del equipo, en un periodo comprendido entre julio de 2016 a julio de 2018.
Para complementar los datos obtenidos en la entrevista en profundidad, se revisaron los expedientes clínicos de cada participante, para ello se elaboró una hoja de recolección de datos que incluyó factores sociodemográficos, sociales y clínicos de la primera consulta y consultas subsecuentes. Para identificar el grado de discapacidad se consultaron los expedientes de acuerdo con la nota médica donde se podía inferir el grado de discapacidad según el sistema de clasificación de la discapacidad de la OMS en 3 grados: 0, 1,2 (Disability in people affected by leprosy: the role of impairment, activity, social participation, stigma and discrimination,Van Brakel WH et al , Global Health to action, 2012).
Las transcripciones textuales de las entrevistas constituyeron la unidad de análisis, se clasificaron y codificaron según los objetivos del estudio y las dimensiones abordadas. Los análisis se llevaron a cabo utilizando el programa Ethnograph (Versión 6 Qualis Research) combinado con la técnica manual de codificación de información. El análisis consistió en: 1) codificación de nodos amplios (dimensiones), 2) distinción de información específica para identificar elementos comunes, divergentes y emergentes, 3) comparación y condensación de la información.
Para garantizar la validez interna del estudio, se revisaron las transcripciones en cuatro ocasiones (una por cada investigador y una vez por el equipo de trabajo).
Además, se seleccionaron las frases textuales para ilustrar el contenido central de cada categoría manteniendo la confidencialidad.
Los datos de los expedientes fueron codificados, analizados y comparados con los datos arrojados por las transcripciones a nivel tanto individual como grupal, mediante el programa Excel.
El genograma es un instrumento que permite una comprensión más amplia del entorno familiar en donde surgen y se desenvuelven los participantes. En su ejecución se requiere el uso de símbolos y figuras con las cuales se representan: miembros, estructura, sucesos importantes como el diagnóstico y la edad al diagnóstico de EH.16
Para la recolección de datos se utilizó la siguiente información de los participantes con su respectivo grupo familiar: datos de identidad de la familia( sexo, edad, integrantes de la familia, como padres hijos, hermanos, abuelos, matrimonios y fallecimientos); datos sobre el caso índice (corresponde al primer caso notificado a la autoridad sanitaria que da lugar a la atención del investigador y origina una serie de acciones necesarios para conocer un foco de infección17) ; datos sobre casos en la familia ( corresponde a los casos de EH subsecuentes al caso índice); EH en el núcleo familiar( corresponde a los casos de EH documentados en la familia).
El estudio contó con la aprobación del Consejo Nacional de Investigación en Salud (CONIS) por considerarlo del quehacer institucional del Ministerio de Salud, con fundamento en lo establecido en el Artículo 7 inciso a) de la Ley de Investigación Biomédica (Ley 9234). Además, previa autorización del Comité Bioético del Centro de Desarrollo Estratégico e información en Salud y Seguridad Social de la Caja Costarricense de Seguro Social (CENDEISSS, CCSS), se obtuvo acceso al expediente clínico de los participantes, de manera que, los resultados obtenidos de la entrevista se complementaran con los datos registrados en el expediente en relación con el uso de los servicios y cumplimiento con el tratamiento.
Debido a la participación de investigadores del Inciensa, se contó con la aprobación del Comité Ético Científico de Inciensa. Los entrevistados consintieron su participación a través de la firma del consentimiento informado. Con la finalidad de garantizar la confidencialidad de los relatos, se identificaron a los participantes como E1, E2, E3... E25.
Resultados
Se realizaron 25 entrevistas, a un total de 25 participantes. Un participante tuvo que ser excluido del estudio al ser descartado como informante por el especialista en dermatología.
El tiempo promedio de las entrevistas para este estudio fue de 67 minutos. Los 24 participantes se encuentran en un rango de edad entre 23 a 88 años de edad y 7 de ellos eran mujeres. Con respecto al estado civil: 7 eran solteros, 13 casados, y 4 en unión libre y 18 participantes practican el cristianismo.
Se revisaron 28 expedientes provenientes de centros hospitalarios de segundo y tercer nivel de atención de la CCSS, esto debido a que 4 informantes tenían duplicados sus expedientes clínicos.
De los 24 participantes, 18 individuos poseían el antecedente familiar positivo por EH documentado. A su vez, 12 participantes provenían de tres grupos familiares; dos grupos familiares con tres generaciones afectadas. En un grupo familiar se identificó un caso en donde la pareja estaba infectada. A continuación, se describen los tres grupos familiares:
Descripción de la familia #1
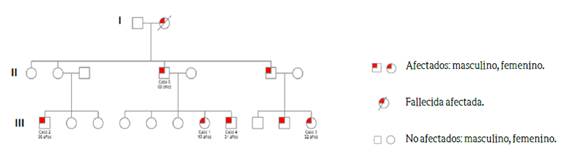
Se describe a la familia #1, como un núcleo en la cual se logran identificar al menos 3 generaciones con miembros de ambos sexos con EH, cinco de ellos participantes del estudio (ver figura 1). Las características clínicas de la familia # 1 se describen en el cuadro 1.
El caso índice (caso 1) de la familia # 1, corresponde a una femenina de 15 años de edad al diagnóstico, procedente de Cartago, católica, soltera, secundaria incompleta, ama de casa, quien consultó en el año de 1995 en la clínica local, por presentar lesiones cutáneas en miembros inferiores. Durante la entrevista se pudo establecer que la abuela, padre, tíos, hermano, y algunos primos eran portadores de EH. El dato pudo ser corroborado por las entrevistas en profundidad a los participantes y la revisión de los expedientes. Así lo describe la participante: “Es que la enfermedad la tuvo abuelita, la enfermedad de papi y de abuelita creo que la abuela de ella, pues ahí (…) eso tiene que ir algo como en la genética o algo de papi”. (E 23, femenina 37 años).
En febrero de 2012, participante masculino de 32 años (caso 2) al diagnóstico, residente en Limón, católico, jardinero, primaria completa, casado, es referido a un hospital de tercer nivel por un cuadro de tres años de evolución de lesiones en piel; primo hermano del caso índice. Por recomendación del caso 1, el participante informa al médico tratante el antecedente familiar. Así lo manifiesta después de haber consultado en múltiples ocasiones en el primer nivel de atención y recibir distintos tratamientos sin un diagnóstico adecuado: “Vea doctor, en la familia tenemos un problema, le digo en la familia, mi hermana, mi prima, tengo 2 primos le digo yo, 3 primos, y 2 tíos míos que han padecido una enfermedad que se llama Hansen”. (E14, masculino 37 años).
Cuadro 1 Características Clínicas EH de la familia # 1
| No. Caso | Sexo | Edad (diagnóstico) | Evolución | Tipo de EH* | Grado de discapacidad** |
| 1 | Femenino | 15 | 2 | LLD, MB | G1 |
| 2 | Masculino | 32 | 3 | LLN, MB | G1 |
| 3 | Femenino | 33 | 2 | LL, MB | G2 |
| 4 | Masculino | 31 | 2 | LLD, MB | G2 |
| 5 | Masculino | 60 | 33 | LLD, MB | G1 |
*LLD: Lepra Lepromatosa Difusa, LLN: Lepra Lepromatosa Nodular, LL: Lepra Lepromatosa, MB:- Multibacilar. **: G= Grado.
Femenina 33 años de edad (caso 3), prima hermana de caso 1, 2, cristiana, peón agrícola, soltera, primaria completa, residente en Limón, diagnosticada en el año 2015. Refiere un año de evolución de lesiones en piel en miembros inferiores, tórax, abdomen anterior y brazos.
La participante no tenía conocimiento del antecedente en su familia, fue en una consulta posterior con el médico especialista en dermatología en donde descubre que su padre, hermano, tío paterno y abuela paterna padecían de EH. Así lo indica en su relato: “Le pregunté a mi papá y mi papá me dijo que sí que cuando yo tenía 4 años fue dado de alta de esa enfermedad (…) Ajá, la abuela, la mamá de él (el padre). Mi hermano. También el hermano de mi papá”. (E20, femenina 37 años).
En 2016, el participante masculino de 31 años de edad (caso 4) al diagnóstico, en unión libre, primaria completa, trabajador de fábrica, hermano del caso 1, residente en Cartago, primo hermano del caso 2 y caso 3, fue referido a un hospital de tercer nivel con lesiones en piel en miembros inferiores máculas, cicatrices y úlceras. En su relato hace mención al antecedente familiar: “Hay como diez o nueve. Diez, diez: la abuelita (mi abuela comenzó), el papá de él, un tío, la hermana de él, él, una prima (…) un primo”. (E4, masculino 31 años).
Masculino 60 años de edad al diagnóstico (caso 5), católico, casado, peón agrícola, residente en Cartago, padre del caso índice y caso 4; tío paterno del caso 2 y 3 con 60 años de edad al diagnóstico, fue re-captado en estudio de contactos del caso 4 en el año 2016 (diagnosticado con EH en el año de 1983 pero abandonó el tratamiento). Así lo relata en su discurso: “La finada mi mamá, estuvo yendo al hospital, él(hermano) también estuvo yendo, después a los diitas, comencé yo a viajar con ellos, a ellos les dieron de alta y yo seguí, fue cuando hubo ese problemilla que entonces yo ya no volví”. (E13, masculino 60 años).
Descripción de la familia # 2:
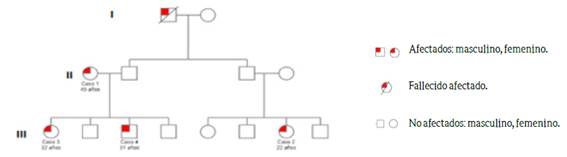
Se describe a la familia #2 como un núcleo en la cual se logran identificar tres generaciones con miembros de ambos sexos con EH, 4 de ellos participantes del estudio (Figura 2). Las entrevistas a los participantes y la revisión de expedientes revelan que el suegro del caso 1 y abuelo paterno de los casos 2, 3 y 4 padecían de EH. Las características clínicas de la familia # 2 se describen en el cuadro 2.
El caso índice (caso 1) de la familia # 2 corresponde a una femenina de 45 años de edad, residente en la provincia de Alajuela, casada, ama de casa, católica, quien consulta en hospital nacional nivel 3, en el año de 1996, por úlceras en miembros inferiores. En su discurso hace referencia a otros miembros de la familia con la enfermedad: “Más bien cuando, esta sobrina mía me dijo que, que estaba, yo recuerdo que yo estaba en casa cuando me llamaron, me dijo la mamá ¿Sabe qué tiene mi hija? Y le digo ¿Qué, con qué salió? Me dice, tiene lepra (...) porque según nos dicen a nosotros, los doctores, que eso (causa de la lepra) es falta de defensas que están los güilas, entonces yo pienso, entonces mis dos hijos estaban sin defensa, pocas defensas, y los otros si tienen más”. (E24, femenina, 56 años)
Cuadro 2 Características Clínicas EH de la familia # 2
| No. Caso | Sexo | Edad (diagnóstico) | Evolución | Tipo de EH* | Grado de discapacidad** |
| 1 | Femenino | 45 | 2 | LLD, MB | G2 |
| 2 | Femenino | 22 | 3 | LLD, MB | G1 |
| 3 | Femenino | 32 | 2 | LLD, MB | G1 |
| 4 | Masculino | 31 | 1 | LLD, MB | G1 |
*LLD: Lepra Lepromatosa Difusa, LLN: Lepra Lepromatosa Nodular, LL: Lepra Lepromatosa, MB:- Multibacilar. **: G= Grado.
Participante femenina, de 22 años de edad al diagnóstico de la EH (caso 2). En 2012 (22 años después del caso índice), casada, residente en la provincia de Alajuela,
católica, ama de casa, consulta a médico privado por infertilidad, manchas en los pies, y anemia. Así relata el antecedente familiar: “Sí, en ese momento nosotros le contamos (al médico), cuando él nos dijo, él no hallaba como decirnos que podía ser esa enfermedad, y entonces nosotros le dijimos que podía ser, porque yo tenía una tía, y que mi mamá la había cuidado cuando ella estuvo así, y ella se había brotado toda de llagas y todo, mi mamá era la que la curaba y yo estaba chiquitilla, entonces podía ser que de ahí me hubiera contagiado”. (E3, femenina, 26 años).
El caso 3 corresponde a una participante femenina de 32 años de edad al diagnóstico (en diciembre de 2015), residente en la provincia de Alajuela, hija del caso 1, soltera, primaria completa, operaria en una empacadora, católica, quien, en consulta en hospital del tercer nivel por presentar cuadro de 2 años de evolución de vasculitis cutánea, en miembros inferiores, madarosis, anestesia y anhidrosis. En su discurso describe el antecedente y contactos en el núcleo familiar de la siguiente manera: “De mi casa somos dos, ya están todos revisados y todos están (…) No le voy a mentir que sólo hay uno que no se lo hemos podido hacer porque no hemos tenido la oportunidad de llevarlo, pero el doctor ya me dijo allá, si él la hubiera tenido, ya le hubiera dado algo”. (E25, femenina, 34 años).
El caso 4 corresponde a un masculino de 31 años de edad al diagnóstico, residente en la provincia de Alajuela, primaria completa, comerciante, casado, católico, quien en septiembre de 2015 inicia con ulceraciones en miembros inferiores sugestivas de proceso vasculíticas referido a hospital del tercer nivel y edema de seis meses de evolución. Con nexo epidemiológico positivo (madre, hermana y prima). “Porque la tuvo mi mamá, la tuvo una prima, que siempre estuvo en contacto con nosotros la tuvo mi hermana, y ahora la tengo yo”. (E2, masculino, 32 años).
Descripción de la familia # 3
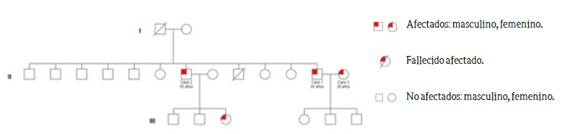
Se describe a la familia # 3 como un núcleo en la que se identifican dos generaciones con miembros de ambos sexos con EH, tres de ellos participantes del estudio (Figura 3). Las características clínicas de los miembros de la familia #3 se describen en el cuadro 3.
Cuadro 3 Características Clínicas EH de la familia # 3
| No. Caso | Sexo | Edad (diagnóstico) | Evolución | Tipo de EH* | Grado de discapacidad** |
| 1 | Masculino | 43 | 5 | LLD, MB | G2 |
| 2 | Masculino | 55 | 3 | LLN, MB | G2 |
| 3 | Femenino | 38 | SD | LL, MB | SD |
*LLD: Lepra Lepromatosa Difusa, LLN: Lepra Lepromatosa Nodular, LL: Lepra Lepromatosa, MB:- Multibacilar. **: G= Grado. SD:sin datos.
El caso índice de la familia # 3 corresponde a un masculino de 43 años de edad, diagnosticado en 2008, residente en Puntarenas, casado, primaria completa, cristiano, chofer de taxi, con 5 años de evolución de disestesias, anestesias en extremidades, episodios de úlceras en miembros inferiores y pérdida de vello en extremidades, tronco, cejas y pestañas. En relación con los antecedentes familiares el participante refiere lo siguiente: “Solamente uno ha aparecido y mi esposa. Mi hermano fue después de mí. Sin embargo, él si está bastante afectado, porque como le digo, él fue otros síntomas, le afectó en los huesos, sin embargo, él trabaja, él anda trabajando”. (E8, masculino, 43 años).
El caso 2 de la Familia 3 corresponde a un masculino de 55 años de edad al diagnóstico, en el año 2012, residente en Puntarenas, agricultor, casado, católico, secundaria incompleta, con historia de 3 años de evolución de parestesias y disestesias. El participante es hermano del caso índice de la familia # 3. Menciona de la siguiente manera a los integrantes enfermos con EH en la familia: “Resulta que el primero que salió fue el hermano menor, sí, el menor. Unos 5 o 6 años antes (…) sí, y ya la esposa de él recibió tratamiento para la misma enfermedad”. (E21, masculino, 55 años).
Participante femenina de 38 años de edad al diagnóstico (caso 3), residente en Puntarenas, casada, cristiana, camarera, secundaria completa, con lesiones maculares, hipoestésicas de meses de evolución, en el año 2014. La participante es esposa del caso 1 de la familia # 3. Describe en su relato a los miembros de su familia política afectados con la enfermedad: “El hermano y una sobrina. Una hija del hermano. Ellos sí, pero ya ellos terminaron tratamiento”. (E22, femenina, 38 años).
Discusión
El análisis identificó características sociodemográficas, culturales y clínicas comunes en los tres grupos familiares de los participantes con antecedente de EH, similares a los hallazgos en países con alta prevalencia.1,2 Las características comunes identificadas constituyen un insumo para mejorar el tratamiento y diagnóstico oportuno a nivel nacional.
Del análisis de los datos sociodemográficos se observa que los participantes con antecedentes familiares positivos de EH fueron diagnosticados durante los periodos económicamente más activos de sus vidas acorde con la bibliografía publicada en el Brasil.18,19 También destaca una participante quien fue diagnosticada a los 15 años de edad, lo que refleja transmisión activa y un estado de hiperendemicidad dentro del grupo familiar.20 Cabe señalar que, desde 1998 no se tiene reporte de casos en personas menores de 15 años a nivel nacional.13,14
Estudios sobre EH y su posible asociación con el sexo, han reportado una alta prevalencia en el sexo masculino.21 Un reciente estudio publicado por Alvarenga et al, mostró que el genotipo heterocigoto del gen TLR1 es un factor de protección específico para el sexo femenino, sin embargo, los mecanismos y vías de señalización que guían este efecto, así como el papel de las hormonas sexuales en la protección de EH, todavía no están claros y requieren más investigación.22
La mayoría de los integrantes de las familias realiza ocupaciones manuales, poseen un nivel educativo bajo y son contactos familiares de un paciente con EH lo que según un meta análisis recientemente publicado son factores de riesgo para padecer la EH.21
La religión ha probado jugar un papel importante en otras enfermedades estigmatizantes como es la infección por el virus de inmunodeficiencia humana.23 En el caso específico de la EH los temores e ideas erróneas de antaño sobre la enfermedad han proliferado durante siglos y la afección sigue siendo un problema de estigmatización social por lo que, campañas de educación sanitaria deben informar sobre la EH a través de mensajes que traten con sensibilidad las creencias y conceptos erróneos en la comunidad local.24
Del análisis de los datos cualitativos se desprende que en cada grupo familiar se pueden identificar entre 4 y 8 casos. Todos los participantes al momento de la entrevista conocían el antecedente familiar. Sin embargo, al momento del diagnóstico la mayoría no sospechó que podría estar padeciendo esta enfermedad (excepto en dos participantes). Lo anterior, pudo contribuir a un diagnóstico tardío y a complicaciones.
Las discapacidades físicas representan el principal desafío de la EH; el número de casos con discapacidad grado 2 al momento del diagnóstico sugiere que los esfuerzos realizados para lograr la detección temprana de EH aún no son suficientes, esta situación se describe países con alta endemicidad como en los que se han alcanzado las cifras de eliminación de la enfermedad, por lo que existe riesgo de revertir los avances logrados en el caso específico de Costa Rica. 22-24
Es importante resaltar que algunos participantes indicaron al médico tratante el antecedente familiar de EH. En algunos casos, a los participantes los persuadieron otros familiares para que le indicaran al médico tratante que poseían el antecedente de EH en la familia. Otros aun cuando conocían el antecedente lo ocultaron al médico por temor a que se les confirmara el diagnóstico. Lo anterior contribuyó a un diagnóstico tardío. Por otra parte, debido a que la EH fue declarada eliminada de Costa Rica en 199512 y la baja prevalencia de la enfermedad, probablemente contribuya al sesgo cognitivo del personal médico;25 razón por la cual no se ha incluido como un probable diagnóstico y tampoco se interrogue el tema en los antecedentes familiares, ni se da seguimiento a largo plazo a los miembros de la familia. Aunado a ello, la declaratoria de eliminación de la EH ha resultado en una desviación de atención a otros problemas de salud pública. En consecuencia, los recursos humanos y materiales dedicados al control de EH han disminuido, junto con el interés público en la enfermedad y el apoyo financiero interno y externo para el control de la EH.26
La bibliografía sugiere que la lepra lepromatosa (LL) (la forma de clasificación clínica en los tres grupos familiares mostrados en el artículo) posee periodos de incubación prolongados o largos periodos de exposición que favorecen el riesgo de contagio entre los contactos27 (cuadros 1, 2, 3). A los casos índices mencionados en los tres grupos familiares les fue diagnosticada LL hace más de 30 años y otro caso índice hace 16 años, a partir de esos periodos se registran casos recientes en los tres grupos familiares, lo que indica que el riesgo de desarrollar la enfermedad no solo depende de la forma bacilar del caso índice , sino que también de la cercanía con él ; ya que el riesgo aumenta en los contactos domiciliarios y la consanguineidad con el paciente índice, por la susceptibilidad genética para desarrollar la EH.28 Debido a los periodos de incubación prolongados e imprecisos de la EH, no se puede determinar qué contacto desarrollará la enfermedad en última instancia.4 Es importante el estricto apego a las Normas de Atención Integral y Control de la EH, así como, fortalecer los esfuerzos de vigilancia de contactos en familias con casos nuevos, como es sugerido en países como Brasil.29 El antecedente familiar debe ser consignado y registrado para el adecuado seguimiento en el Expediente Digital Único en Salud (EDUS), de manera tal, que la información por el tiempo transcurrido no quede relegada y esté disponible cuando se requiera.
A pesar del contacto continuo y prolongado, la lepra conyugal no es frecuente y requiere varios años para desarrollarse en la segunda persona,30 el estudio identifica un caso de transmisión conyugal. Coincidentemente con la bibliografía, el estudio muestra a la LL como forma clínica de presentación en el caso índice de la familia # 3, constituyéndose en un posible factor predisponente para que la cónyuge desarrollara la EH8 entre otras posibles variables.
La limitante de este estudio es que algunos participantes hablaron sobre un evento que sucedió en el pasado, lo que podría haber llevado a un sesgo de recuerdo. Se requieren estudios con enfoque cualitativo y cuantitativo sobre sesgos del conocimiento de la EH en grupos familiares con EH y en el personal de salud, factores de riesgo, así como, el rol de algunos actores sociales y la oportunidad de cooperación con los servicios de salud.
En conclusión, los resultados de este estudio muestran que el seguimiento de los contactos en los servicios de salud es desafío permanente debido a su largo período de incubación y el estigma asociado con la enfermedad. Dentro de este contexto, a nivel nacional está vigente una norma de atención que establece la identificación y seguimiento por un periodo determinado de tiempo tanto para la persona con EH como para sus contactos, sin embargo, según lo identificado en el análisis, esta norma no siempre se cumplió lo que contribuyó a que los participantes no conocieran el antecedente familiar para facilitar un diagnóstico oportuno. La búsqueda intencionada de posibles casos entre los contactos debería incorporarse como un método eficaz para el diagnóstico temprano de la EH en los grupos familiares lo que podría reducir las fuentes de infección y romper la cadena de transmisión.
Todos los miembros de la familia deberían estar informados sobre la EH para evitar que alguno de ellos lo mantenga oculto. Esto contribuiría además a manejar el estigma de la enfermedad.
Agradecimientos y colaboraciones: a los participantes del estudio por haber facilitado su tiempo,experiencias y compartirlo con los investigadores. Al personal de Vigilancia de la Salud del Ministerio de Salud, Sub-área de Vigilancia Epidemiológica y personal de Salud de la CCSS, quienes colaboraron con el estudio.