La uveítis es un conglomerado de entidades clínicas que constituye una de las principales causas de ceguera a nivel mundial y ocupa el tercer lugar en los países desarrollados.1 Las uveítis se clasifican según la localización anatómica de la inflamación2 y la temporalidad de la enfermedad, definidos por el Grupo de Trabajo Internacional de Normalización de la Nomenclatura de Uveítis (SUN por sus siglas en inglés).3 Anatómicamente, la uveítis puede ser descrita como anterior, intermedia, posterior o panuveitis, cada una con manifestaciones características (Figura 1).4
La uveítis anterior es la forma más común, en Occidente corresponde al 90 % de los casos de atención primaria y al 50 - 60 % de los casos en centros terciarios. La uveítis intermedia es la menos frecuente (15 % de los casos). Usualmente, la etiología de estas entidades es idiopática.5En un reporte de Costa Rica, la media de edad para estos casos fue 42,6 años; la uveítis anterior correspondió al 63,8 % de los casos, con predominio del origen idiopático.6
La estandarización de SUN permitió desarrollar un sistema de clasificación anatómica en 2005, el cual se utiliza de forma frecuente en la actualidad (Cuadro 1).7
Manifestaciones clínicas
Los síntomas y signos dependen de la localización anatómica del proceso inflamatorio (Figura 1). Durante la anamnesis, es importante tomar en cuenta la presencia de dolor ocular persistente, el cual aumenta con la exposición a la luz, la pérdida de agudeza visual, la presencia de hiperemia, hipotonía ocular, deformidad pupilar, opacidad corneal y atenuación del reflejo rojo (Cuadro 2).7-9
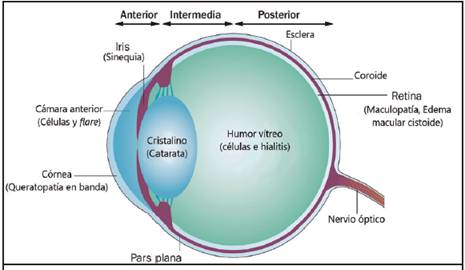
Figura 1 Anatómicamente, la uveítis se clasifica según el sitio de inflamaciónocular. Las manifestaciones visibles en el examen oftalmológico dependen de las estructuras afectadas. Por ejemplo, son características de la uveítis anterior la presencia de células y flare en la cámara anterior y las sinequias del iris.
Las diferentes complicaciones varían su pronóstico según la posibilidad de recuperar la pérdida de agudeza visual y las opciones de intervención oftalmológica disponibles. Existen complicaciones con buen pronóstico y otras con pronóstico visual variable a pobre si la respuesta al tratamiento es parcial o refractaria. Por consiguiente, entre las complicaciones con opción de corrección visual inicial efectiva se encuentran la queratopatía en banda (cuando involucra eje visual o si hay dolor persistente), las cataratas, el glaucoma, la hipotonía, el edema macular cistoide (EMC) y la neovascularización en diferentes sitios (retiniana y coroidal). Estas dos últimas complicaciones podrían tener mal pronóstico visual cuando son refractarias a la terapia inicial. Finalmente, el desprendimiento de retina presenta posibilidades de intervención limitadas y una respuesta parcial a la terapia.10-12
Valoración oftalmológica
La valoración inicial del paciente con sospecha de uveítis debe incluir la referencia a oftalmología para su posterior evaluación. El abordaje del especialista en oftalmología debe abarcar una revisión sistemática (Cuadro 3). Además, deben considerarse los diagnósticos diferenciales y descartar causas infecciosas de uveítis.
Cuadro 1 Clasificación SUN de uveítis de acuerdo con la localización anatómica
| Tipo | Sitio primario | Incluye |
| • Iritis | ||
| Uveítis anterior | Cámara anterior | • Iridociclitis |
| • Ciclitis anterior | ||
| • Pars planitis | ||
| Uveítis intermedia | Vítreo | • Ciclitis posterior |
| • Hialitis | ||
| • Coroiditis focal, multifocal o difuso | ||
| Uveítis posterior | Retina y coroides | • Coriorretinitis |
| • Retinocoroiditis | ||
| • Retinitis | ||
| • Neuroretinitis | ||
| Panuveítis | Cámara anterior, vítreo, retina y coroides |
SUN: Standardization of Uveitis Nomenclature. Tomado de Jabs DA et al., 20055
Cuadro 2 Hallazgos clínicos y oftalmológicos de la uveítis, según localización anatómica
| Localización anatómica de la uveítis | Síntomas | Valoracion oftalmológica |
| • Fotofobia | • Hiperemia iridiana | |
| • Dolor | • Inyección ciliar | |
| • Ojo rojo | • Miosis | |
| • Disminución de la agudeza | • Hipopion | |
| Anterior aguda | visual y lagrimeo | • Celularidad |
| • Flare | ||
| • Fenómeno de Tyndall | ||
| •Precipitados retroqueráticos | ||
| • Sinequias | ||
| • Pérdida visual inespecífica • Miodesopsias | • Inflamación reducida en cámara anterior • Fondo de ojo con lesión inflamatoria focal | |
| Intermedia | • Pérdida de visión central* | • Vitreítis con copos de nieve y bancos de nieve |
| • Miodesopsias | • Vitreítis variable | |
| Posterior | • Disminución de la agudeza | • Exudados focales en coroides y retina |
| visual | • Vasculitis | |
| • Desprendimiento retiniano exudativo |
Miodesopsias: flotadores. Presencia de sinequias es proporcional al grado de inflamación, entidad y el retardo en diagnóstico apropiado. *Debido a edema macular cistoide crónico14
Cuadro 3 Resumen sistemático de pasos en la valoración oftalmológica de uveítis no infecciosas
| Valoración | Propósito |
|---|---|
| 1. Periodicidad | • Clasificación aguda, crónica o recurrente |
| 2. Agudeza visual | • Grado de afectación inicial y recuperación posterior a tratamiento |
| 3. Conjuntiva, espiesclera, esclera y pupila | • Descartar otras causas de ojo rojo diferentes a uveítis, incluyendo la epiescleritis y escleritis. |
| 4. Examen con lámpara de hendidura | • Clasificación de severidad según hallazgos en cámara anterior (células, flare, sinequias, depósitos queráticos) |
| • Angulo de cámara anterior por riesgo de aumento de PIO • Cristalino para descartar cataratas | |
| 5. PIO | • La hipotonía es frecuente en uveítis. |
| • La elevación de la PIO puede suceder en presentaciones más crónicas o uso persistente de corticoesteroides. | |
| 6. Oftalmoscopía indirecta | • Reflejo rojo alterado en caso de coriorretinitis en un cuadrante |
| • Vítreo: buscar células inflamatorias y su distribución | |
| • Pars plana: buscar alteraciones como bolas de nieve, exudados, banda fibroglial y revascularización. | |
| • Retina: detectar hemorragias, exudados, compromiso focal o multifocal, vasculitis u otros patrones asociados con virus. | |
| • Coroides: determinar afección focal o multifocal, presencia de granulomas, alteraciones que causan desprendimiento de retina. | |
| • Disco óptico: descartar edema papilar, neovascularización o infiltración. | |
| • Mácula: descartar EMC |
EMC: edema macular cistoide. PIO: presión intraocular. Modificado de: 92
Dentro del espectro de uveítis no infecciosas, se recomienda utilizar la SUN y orientar el diagnóstico hacia alguna de las etiologías descritas.7 Asimismo, se debe valorar la asociación con entidades sistémicas, tales como: síndrome de Vogt- Koyanagi-Harada (VKH), espondiloartropatías, artritis idiopática juvenil (AIJ), Behçet, enfermedad inflamatoria intestinal. Por otro lado, es preciso considerar la evaluación de complicaciones secundarias a la uveítis.13
Exámenes iniciales y para diagnóstico diferencial de uveítis no infecciosas
La historia clínica y los hallazgos oftalmológicos serán determinantes para realizar un abordaje diagnóstico inicial, tomando en cuenta factores como: sexo, edad, tiempo de evolución y localización de la uveítis, así como síntomas sistémicos asociados.14
En la primera valoración se deberá solicitar: un hemograma completo, bioquímica general, pruebas de coagulación, cuantificación de proteínas totales y fraccionadas y examen general de orina. De manera adicional, se deben solicitar: velocidad de eritrosedimentación (VES) y proteína C reactiva (PCR). Conviene realizar tamizaje de infecciones latentes como parte del diagnóstico diferencial y por el tratamiento al que eventualmente se pueden someter estos pacientes: tuberculosis (radiografía de tórax, tuberculina o métodos de cuantificación de interferón gamma), lúes (Venereal Disease Research Laboratory, VDRL), virus de inmunodeficiencia humana (VIH), virus de hepatitis B y C, citomegalovirus y toxoplasmosis.15
De acuerdo con los hallazgos en el examen físico oftalmológico y la sospecha diagnóstica, se puede complementar el estudio con: tipificación de HLA (HLA-B27 para sospecha de espondiloartropatías, HLA-B5/51 para enfermedad de Behcet, HLA-B29 para enfermedad de birdshot, HLA-A1 para sarcoidosis, HLA-A11 para oftalmia simpática y HLA-B53 para VKH). 14 La Figura 2 contiene un flujograma de abordaje diagnóstico de uveítis.
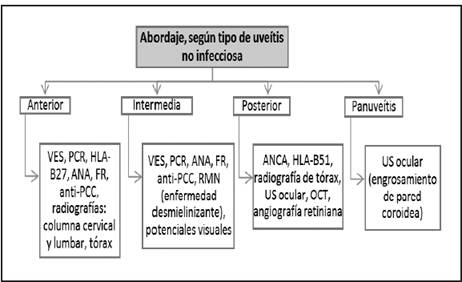
Figura 2 Algoritmo diagnóstico de las uveítis no infecciosas, según sulocalización anatómica. ANA: anticuerpos antinucleares, ANCA: anticuerpos contra citoplasma de neutrófilo, FR: factor reumatoide, HLA: antígeno leucocitario humano, OCT: tomografía de coherencia óptica, PCC: péptido cíclico citrulinado, PCR: proteína C reactiva, RMN: resonancia magnética nuclear, US: ultrasonido, VES: velocidad de eritrosedimentación
Criterios de actividad, remisión y reactivación
Con base en la clasificación del grupo SUN, se han propuesto definiciones para unificar los criterios validados de actividad, remisión, duración y reactivación de acuerdo con actividad en cámara anterior. En cuanto a la duración, se describen formas limitadas (3 o menos meses de duración) y formas persistentes (más de 3 meses de duración). Según el grado de inflamación, se valora la cámara anterior respecto de presencia de células en 1 mm x 1 mm a través de la lámpara de hendidura y de acuerdo con la presencia de proteínas (flare). Según el número de células se describen 6 grados: grado 0 (menos de 1 célula), grado 0,5+ (de 1 a 5 células), grado 1+ (entre 6-15 células), grado 2+ (entre 16-25 células), grado 3+ (entre 26-50 células), grado 4+ (más de 50 células). Según la presencia de proteínas en la cámara anterior se clasifica en 5 grados: grado 0 (ninguna), grado 1+ (débil), grado 2+ (moderada, donde el iris y los detalles del cristalino están claros), grado 3+ (marcada, donde los detalles en el iris y el cristalino son borrosos), grado 4+ (intensa, donde hay depósitos de fibrina). Dicha estratificación en la práctica suele ser subjetiva y dependiente del observador.
A partir de los hallazgos en cámara anterior, el grado de actividad se puede clasificar en inactiva (sin células en cámara anterior), con empeoramiento de actividad, lo que significa un aumento en 2 grados del nivel de inflamación (células en cámara anterior, turbidez vítrea) o cambio del grado 3+ al 4+, con mejoría de actividad, que confiere una disminución de 2 grados en el nivel de inflamación o descenso al grado 0 y con remisión de actividad, que consiste en inactividad de la enfermedad posterior a la suspensión del tratamiento por 3 meses o más.7 El término agudo o crónico describe el curso clínico de la uveítis y no el inicio de la enfermedad, ya que este se describe como súbito o insidioso.16 El curso de la enfermedad se diferencia entonces en agudo (episodio de inicio súbito con duración limitada), recurrente (nuevo episodio de actividad separado de un periodo de inactividad estando ya sin tratamiento por al menos 3 meses) y crónico (cuando aparecen recaídas a menos de 3 meses de suspendido el tratamiento).7
No existen criterios validados de actividad en cámara posterior o intermedia, pero existen esfuerzos para validar escalas que incluyan compromiso de cámara anterior, intermedia y posterior.17
Esquema secuencial de las fases terapéuticas: de tratamiento tópico a biológico
Las uveítis no infecciosas corresponden a un grupo aproximado de unas 30 patologías (Cuadro 4), caracterizadas por inflamación intraocular.18 La evolución y características clínicas son variables según la etiología de estas y de igual manera el manejo será distinto.19
Algunos pacientes con uveítis podrán manejarse únicamente con esteroides tópicos, mientras que otros necesitarán de inmunosupresión con esteroides sistémicos. Además, un grupo significativo de pacientes requerirá terapias inmunomoduladoras, que pueden ser biológicas y no biológicas.
Tratamiento tópico
Glucocorticoides tópicos en gotas: se utilizan en el manejo de los brotes agudos de uveítis anterior. Se emplean preparados de acetato de prednisolona al 1 %, dexametasona, betametasona y fluorometalona. La dosificación irá en relación con la severidad y el tiempo durante el que se mantiene en contacto con la superficie ocular y la penetración en la córnea de cada fármaco. En este caso, ningún fármaco ha demostrado ser superior a otro.20
Agentes midriáticos/ciclopléjicos: ampliamente utilizados para manejo de síntomas y con la intención de prevenir la aparición de sinequias. No hay estudios que comparen eficacia entre los disponibles (atropina, ciclopléjico, tropicamida, fenilefrina), y tampoco existen datos que apoyen su eficacia con grados de evidencia alta.20
Inyecciones perioculares: se han utilizado en uveítis intermedias y ocasionalmente para uveítis posteriores, uveítis anterior grave y uveítis anterior crónica. La duración del efecto es variable y ocasionalmente requiere reinyección, en cada episodio de actividad entre inyecciones hay un riesgo de daño residual y con cada aplicación aumenta el daño acumulado derivado de su uso.18
Implante intravítreo: se ha demostrado la eficacia de los implantes a 54 meses en comparación con glucocorticoides sistémicos en uveítis posteriores, intermedias y panuveítis.21 Sin embargo, estudios a 7 años sugieren inferioridad al compararlos con glucocorticoides sistémicos.22,23En Costa Rica no existe aún este tipo de terapia.
Cuadro 4 Etiologías no infecciosas de uveítis
| Clase anatómica | Enfermedad sistémica | Enfermedad no sistémica |
| Anterior | espondilitis/ HLA-B27 | • Síndrome uveítico de Fuchs |
| • Uveítis asociada a artritis idiopática juvenil | ||
| • Enfermedad de Behcet | ||
| • Sarcoidosis | ||
| • Nefritis tubulointersticial (TINU) | ||
| Intermedia | • Uveitis asociada a esclerosis múltiple | • Pars planitis |
| • Sarcoidosis | ||
| Posterior | • Sarcoidosis | • Corioretinitis de Birdshot |
| • Síndrome de punto blanco | ||
| evanescente múltiple | ||
| • Panuveitis con coroiditis multifocal | ||
| • Coroiditis interna punteada | ||
| • Coroiditis por pénfigo | ||
| Panuveitis | • Enfermedad de Behcet | • Oftalmia simpática |
| • Enfermedad de VKH |
TINU: tubulointersticial nephritis with uveitis (uveítis con nefritis tubulointersticial), VKH: enfermedad Vogt-Koyanagi-Harada. Modificado de: 18
Cuadro 5 Inmunomoduladores convencionales en el manejo de la uveítis no infecciosa
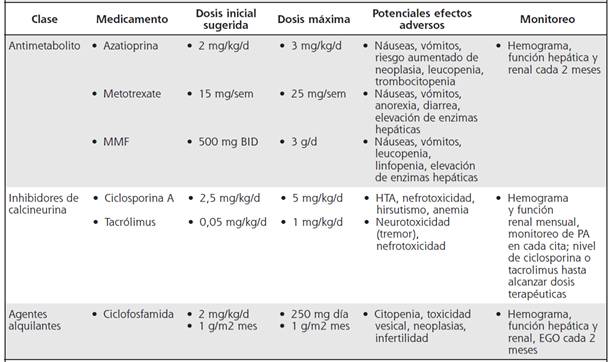
HTA: hipertensión arterial, PA: Presión arterial, EGO: examen general de orina, d: día, BID: dos veces al día, HTA: hipertensión arterial, MMF: micofenolato mofetilo. Modificado de:18
Glucocorticoides sistémicos
Se utilizan para el control de la inflamación severa o que ha sido refractaria a glucocorticoides tópicos. En consideración a la severidad de la enfermedad en casos de uveítis intermedias, uveítis posteriores, panuveítis o la presencia de síntomas sistémicos asociados se pueden iniciar pulsos de glucocorticoides seguidos por dosis orales altas (hasta 1mg/ kg/día de prednisona o su equivalente con dosis máxima de 60 mg/día por 1 mes).18Se recomienda hacer un descenso de la dosis esteroidal según la respuesta clínica con la intención de suspender el tratamiento o llevarlo a dosis de 5-7,5 mg/ día de prednisona oral o su equivalente en un periodo de aproximadamente 3 meses.14
Inmunomoduladores de síntesis química
En pacientes que presenten uveítis con evolución severa o tengan pobre respuesta o mala tolerancia a esteroides, se deben utilizar inmunomoduladores como parte del tratamiento antiinflamatorio, los cuales en términos generales han demostrado ser efectivos.16 Entre las distintas terapias inmunomoduladoras no biológicas o también llamadas terapias convencionales para el manejo de uveítis no infecciosas, se encuentran tres grupos de fármacos: los antimetabolitos, como el metotrexate, la azatioprina y el micofenolato de mofetilo; los inhibidores de calcineurina, como la ciclosporina A y el tacrolimus, y los agentes alquilantes como la ciclofosfamida (Cuadro 5).
Metotrexate: si bien no se cuenta con estudios aleatorizados, sí se ha demostrado su eficacia a través de series de casos y estudios de revisión, principalmente. Se puede utilizar tanto por vía oral como parenteral, la dosis recomendada va desde 7,5 hasta 25 mg por semana, aunque las dosis más frecuentemente utilizadas van desde 15 a 25 mg por semana.24-26Se describen efectos adversos en aproximadamente un 18 % de casos (alrededor del 8 % severos), los cuales en su mayoría corresponden a náuseas, vómitos, diarrea, hiporexia y pérdida de peso. Hasta un 15 % de pacientes puede presentar elevación de transaminasas. Estos efectos suelen mejorar con la disminución de la dosis del medicamento. El fármaco está contraindicado durante el embarazo.27
Azatioprina: se ha probado en diversas patologías uveales con resultados variables, aunque ha demostrado ser particularmente efectiva en uveítis intermedias, logrando control de la inflamación hasta en un 90 % de los pacientes.28 Es un medicamento poco efectivo como monoterapia y suele combinarse con otros agentes inmunomoduladores.29 Se sugiere una dosis de 2-3 mg/kg/día, iniciando con dosis de 1 mg/kg/ día. Entre los eventos adversos más comunes se encuentran problemas de tolerancia oral como náuseas y vómitos. Otros efectos adversos más severos son alopecia y mielosupresión, esta última más frecuente en pacientes que presentan deficiencia en la actividad de la enzima tiopurina metiltransferasa.24
Micofenolato de mofetilo (MMF): este medicamento ha sido ampliamente utilizado en casos refractarios de uveítis y en escleritis severa, logrando un control completo de inflamación en un 53 % y un 73 % de los casos, a 6 y 12 meses de tratamiento, respectivamente.29 En fecha reciente, Deuter et al. realizaron un estudio prospectivo, aleatorizado y multicéntrico en 41 pacientes con uveítis intermedia, en el que se determinó que recibir MMF asociado a prednisona es mejor que la monoterapia con esteroide. La recaída se presentó en el 40,9 % de los pacientes con MMF, mientras que fue de un 78,9 % para los pacientes que no lo recibía; de igual manera, el tiempo libre de actividad fue de 15 meses ante 2,8 meses y la probabilidad de sobrevida libre de recaída a los 15 meses fue del 52,9 % en el grupo que recibió MMF ante el 19,8 %, en el grupo que no lo recibió.30-33En general, la dosis recomendada es de 2-3 g/día.
Ciclosporina A: suele utilizarse en ciertos tipos particulares de uveítis como Behcet, sarcoidosis ocular, VKH, síndrome de uveítis con nefritis tubulointersticial y pars planitis. Sin embargo, no se le considera por algunos autores como primera línea de manejo en uveítis primarias y se suele utilizar en forma combinada con otros inmunomoduladores. En 2010, Kacmaz et al. reportaron una efectividad moderada en el control de la patología ocular inflamatoria, logrando en una cohorte retrospectiva de 373 pacientes un control completo de la inflamación en el 33,4 % y el 51,9 % a los 6 y 12 meses, respectivamente, además en el 22,1 % y el 36,1 % de los casos, se pudo reducir la dosis de prednisona a menos de 10 mg/día a los 6 y 12 meses de tratamiento. En este estudio se recomendó utilizar otra terapia inmunomoduladora en personas mayores de 55 años, debido a que presentaron mayor prevalencia de efectos adversos como nefrotoxicidad e hipertensión arterial. La dosis recomendada para uveítis es de 2,5- 5 mg/kg/día, generalmente dividido en 2 tomas al día. No existe evidencia en cuanto a niveles terapéuticos meta de ciclosporina en uveítis. No obstante, basados en la evidencia disponible en trasplante de órganos sólidos, los autores de esta guía consideran relevante la medición periódica de concentraciones séricas de inhibidores de calcineurina, con el fin de prevenir toxicidad.16,29,34
Tacrólimus: ha demostrado ser efectivo en el manejo de las uveítis no infecciosas. La dosis recomendada es de 0,1-0,15 mg/kg/día.35 Un estudio aleatorizado prospectivo que comparó ciclosporina A con tacrólimus en 2 centros de referencia en Inglaterra y Escocia, no demostró diferencias estadísticas significativas entre ambos medicamentos. Los pacientes presentaban uveítis intermedia y posterior. 36 Otros estudios han demostrado la efectividad del medicamento e incluso su capacidad de mantener el control de la inflamación ocular en ausencia de esteroides.37 Al igual que en el caso de la ciclosporina, no existe evidencia en cuanto a niveles meta de tacrólimus en estas entidades.
Ciclofosfamida: se encuentra recomendada para uveítis posterior con compromiso severo y en casos de uveítis que cursan con enfermedad sistémica de fondo como granulomatosis con poliangeitis, poliarteritis nodosa y queratitis ulcerativa necrotizante asociada a artritis reumatoide, entre otras.24,38Existen estudios que han comparado la eficacia de distintas drogas inmunomoduladoras en el manejo de las uveítis no infecciosas39,40Galor et al., compararon la eficacia de metotrexate, azatioprina y MMF en enfermedades oculares inflamatorias no infecciosas, principalmente uveítis.
De 257 pacientes, 223 presentaban uveítis intermedia, posterior, panuveítis y escleritis. Este estudio demostró que la efectividad en el control de la uveítis no infecciosa se lograba en un mayor número en pacientes que recibía azatioprina y MMF en comparación con metotrexate, mientras que la tasa de suspensión de tratamiento por problemas de tolerancia o efecto adverso fue mayor en pacientes con azatioprina. Knickelbein et al. Compararon en 2017. No solamente entre antimetabolitos, sino que incluyeron pacientes que recibían terapia biológica e inhibidores de calcineurina, valorando la efectividad para controlar la inflamación, lograr el descenso o suspensión de esteroides y llevar el paciente a baja actividad clínica o inactividad. En relación con los inhibidores de calcineurina, la ciclosporina A y el tacrolimus mostraron una eficacia comparable, mientras que sí hubo una mayor tolerancia y menores efectos adversos entre los pacientes que utilizaban tacrolimus. Jabs et al publicaron otro estudio que realizó una comparación entra las distintas terapias inmunomoduladoras no biológicas incluyendo la ciclofosfamida (Cuadro 6).18
Medicamentos biológicos en el tratamiento de uveítis no infecciosas refractarias a terapia esteroidal o inmunomoduladora
La indicación de inmunoterapia biológica dirigida se reserva para casos de inflamación ocular refractaria, donde exista falla terapéutica documentada a esquemas previos de inmunosupresores químicos utilizados correctamente por el paciente y en situaciones donde a pesar de un control adecuado de la enfermedad, se presenten efectos adversos que obliguen a suspender el inmunosupresor.1,41
Infliximab: los estudios iniciales con infliximab se enfocaron en el tratamiento de uveítis asociada con artritis idiopática juvenil y enfermedad inflamatoria intestinal.42-44La efectividad de infliximab ha sido igualmente reportada en el tratamiento de uveítis asociada con múltiples enfermedades, incluyendo la sarcoidosis, VKH, psoriasis, artritis psoriásica y enfermedad de Takayasu.45,46Así mismo, en uveítis anterior relacionada con positividad de HLA-B27, pars planitis, coroiditis multifocal y uveítis idiopática. 47 El infliximab es considerado como un fármaco con baja toxicidad, aunque son frecuentes las reacciones durante la infusión, generalmente tratadas sin consecuencias con antihistamínicos y analgésicos. Es conveniente asociar metotrexate al tratamiento a fin de disminuir la producción de autoanticuerpos asociada con las infusiones múltiples.
Adalimumab: en niños y adolescentes con AIJ, es el primer agente biológico recomendado.48,50En el caso de uveítis asociada con enfermedad inflamatoria intestinal, adalimumab puede ser utilizado como primera línea de terapia biológica o como una alternativa en pacientes que se encuentran bien controlados con infliximab, pero que desean cambiar de la vía intravenosa a la subcutánea.51 Adalimumab ha mostrado reducir exitosamente las reactivaciones de uveítis anterior en pacientes con espondilitis anquilosante y además se ha reportado su uso en uveítis asociada a sarcoidosis, VKH, enfermedad de Crohn y uveítis idiopática.52
Tocilizumab: este anticuerpo monoclonal parece ser efectivo en el manejo de uveítis, información que proviene principalmente de series de casos.53-56Incluso hay casos con efectividad en el control de edema macular cístico secundario a uveítis no infecciosa, esto en pacientes que han presentado respuesta fallida a inmunomoduladores convencionales e incluso a biológicos.57
Cuadro 6 Eficacia de las terapias convencionales en el manejo de la uveítis no infecciosa
| Medicamento | Número de pacientes | Control 6 meses (%) | Control 12 meses (%) | PDN <10 mg (%) | Tasa de remisión sostenida libre de medicamento | Tasa de descontinuación o interrupción por efecto adverso |
| Azatioprina | 145 | 28,3 | 42,8 | 32,4 | 0,09 | 0,16 |
| Metotrexate | 384 | 12,8 | 17,2 | 15,1 | 0,09 | 0,13 |
| MMF | 236 | 22,5 | 30,9 | 23,3 | 0,05 | 0,08 |
| Ciclosporina | 373 | 8,8 | 13,9 | 9,6 | 0,08 | 0,04 |
| Ciclofosfamida | 215 | 22,8 | 35,3 | 28,4 | 0,32 | 0,39 |
%: porcentaje. PDN: prednisona, MMF: micofenolato de mofetil. Modificado de: 18
Rituximab: la evidencia que apoya el uso de rituximab en el manejo de uveítis se basa en pequeños estudios y series de casos. Ciertos estudios sugieren su efectividad en casos seleccionados de artritis idiopática juvenil, enfermedad de Behçet, vasculitis retiniana asociada con enfermedad autoinmune, vasculitis ANCA y VKH, fundamentalmente en pacientes que han sido refractarios a otras terapias biológicas.58,59
Golimumab: si bien es el más reciente de los medicamentos antiTNF, ya ha logrado presentar evidencia robusta para el manejo de uveítis por distintas etiologías.60-64Este anticuerpo monoclonal se aplica de manera mensual por vía subcutánea. A dosis de 50 mg por mes se le considera un buen medicamento de primera línea y en dosis mensual de 100 mg constituye una opción adecuada para pacientes multirefractarios.
El Cuadro 7 concatena los medicamentos disponibles para el tratamiento de uveítis no infecciosa agrupados según el nivel de evidencia actual.
Cuadro 7 Medicamentos para uveítis no infecciosas, según nivel de evidencia
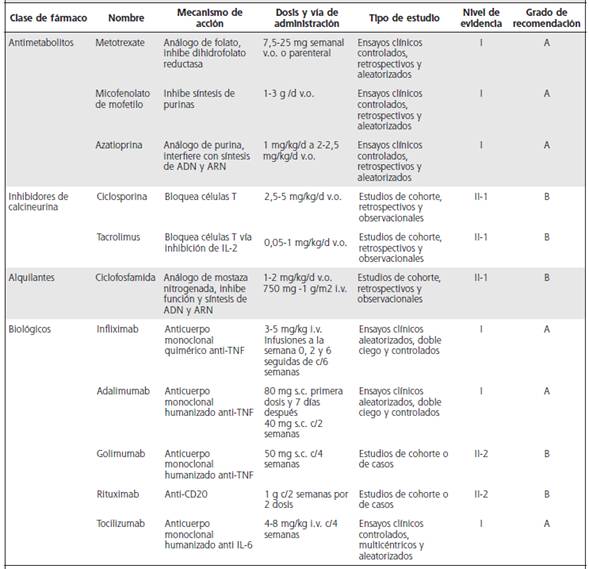
d: día. v.o.: vía oral. i.v.: vía intravenosa. s.c.: vía subcutánea. c/: cada. TNF: factor de necrosis tumoral alfa. IL-2: interleukina 2. CD20: cluster of differentiation. IL-6: interleukina 6. Tocilizumab cuenta con evidencia en uveítis asociada con artritis idiopática juvenil. Basado en: 19, 29, 32, 91, 93-96
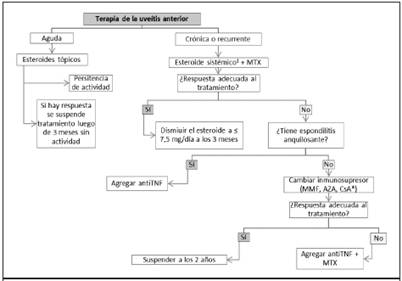
Figura 3 Algoritmo terapéutico de uveítis anterior no infecciosa. AZA: azatioprina, CsA: ciclosporina A, MMF: micofenolato de mofetilo, MTX: metotrexate, TNF: factor de necrosis tumoral. 1Metilprednisolona
Consideraciones terapéuticas para entidades específicas
Síndrome de Vogt-Koyanagi-Harada (VKH): en esta enfermedad se reconocen fases clínicamente distintas 65 que requieren consideraciones especiales. El manejo de la fase uveítica precisa tratamiento con esteroides sistémicos con dosis de 1 mg/kg/día de prednisona o más por 2 a 4 semanas, seguido por descenso gradual de la dosis a lo largo de varios meses.66 La suspensión del esteroide antes de completar 6 meses de tratamiento se asocia con riesgo aumentado de recurrencia y peor pronóstico.67 A pesar de un tratamiento temprano y agresivo muchos pacientes progresan a la fase crónica. En este escenario, existe evidencia que apoya el uso de ciclosporina A como el agente inmunosupresor de primera línea,66,68y azatioprina como segunda línea.68,69Algunos datos recientes sugieren que pacientes con pobre respuesta al esteroide pueden beneficiarse de un inicio temprano del inmunosupresor.70,71
Enfermedad de Behçet: las recomendaciones EULAR72 indican que para el tratamiento del compromiso ocular se consideran agentes inmunosupresores efectivos: azatioprina, ciclosporina A, interferón alfa y anticuerpos monoclonales anti-TNF. No obstante, el uso de ciclosporina está limitado si existe compromiso neurológico, dado que estudios observacionales sugieren que el agente aumenta la lesión neurológica inicial.73,74Además, aunque solo adalimumab tiene aprobación por EMA y FDA para uveítis no infecciosa, existe mayor experiencia acumulada sobre el uso de infliximab en enfermedad de Behcet, por lo que ambos agentes deben ser considerados.75-78Por lo anterior, pacientes con manifestaciones vasculares y oftálmicas son candidatos para terapia inicial con agentes anti-TNF para abarcar todo el espectro de manifestaciones de la enfermedad.78
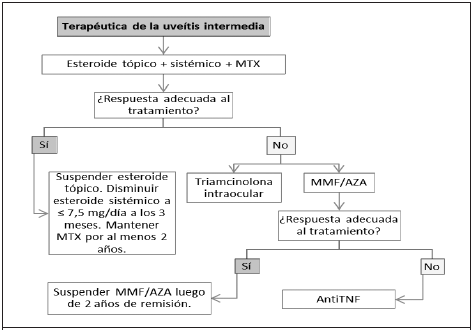
Figura 4 Algoritmo terapéutico de uveítis intermedia no infecciosa. AZA:azatioprina, MMF: micofenolato de mofetilo, MTX: metotrexate, TNF: factor de necrosis tumoral
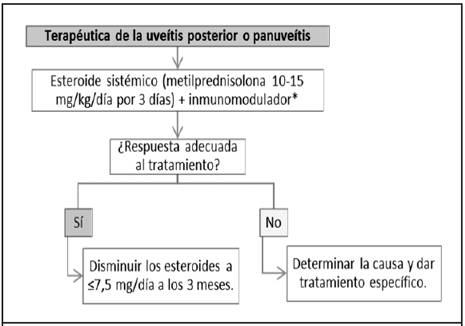
Figura 5 Algoritmo terapéutico de uveítis posterior no infecciosa y panuveítis. *Ciclofosfamida preferida en vasculitis sistémica (máximo por 6 meses), ciclosporina A preferida ante sospecha de VKH, metotrexate en caso de sarcoidosis
Sarcoidosis: a pesar de que la uveítis en sarcoidosis puede presentarse como anterior, intermedia, posterior o panuveitis,79 su pronóstico es bueno y la mayoría de los pacientes logran una mejoría visual significativa con el tratamiento.80 Los esteroides se consideran la primera línea terapéutica y solo la mitad de los pacientes requieren su uso sistémico para el control de la uveítis.81 Alrededor del 5 al 15 % de los casos requerirán un agente inmunosupresor, escenario en el cual metotrexate es considerado por expertos como el agente de elección.82,83
Vasculitis asociadas con ANCA: las decisiones terapéuticas se basan en la severidad del compromiso multiorgánico, con esquemas revisados en las recomendaciones vigentes de EULAR/ ERA-EDTA.84 La uveítis es poco frecuente, se ha reportado hasta un 10 % en granulomatosis con poliangeítis y su manejo debe apegarse a dichas recomendaciones. El tratamiento se basa en esteroides en dosis altas, en combinación con ciclofosfamida o rituximab. La inducción de remisión dura de 4 a 6 meses y, en caso de falla a esta fase, debe cambiarse de ciclofosfamida a rituximab o de rituximab a ciclofosfamida. Otros inmunosupresores como metotrexate, azatioprina o micofenolato se reservan para la fase de mantenimiento. También es posible utilizar rituximab como mantenimiento. La evidencia actual no apoya el uso de terapia biológica anti-TNF en estas entidades.84-87
Los flujogramas resumen las recomendaciones de manejo farmacológico de las uveítis infecciosas según su clasificación anatómica (figuras 3 a 5).
Seguimiento y monitoreo de complicaciones
En términos generales, los pacientes durante la fase aguda de uveítis deberían ser monitorizados semanalmente mediante la determinación de la agudeza visual, de la presión intraocular y la examinación con lámpara de hendidura por parte de oftalmología.88 El uso de esteroides tópicos, implantes vítreos y ciclopléjicos debe ser monitoreado y disminuido en estas mismas valoraciones, en tanto que el manejo de esteroides e inmunosupresores y sus efectos secundarios debe ser efectuado por un reumatólogo o inmunólogo. En cada consulta médica se deberá valorar las posibles complicaciones propias de la patología ocular de fondo, desarrollo de cataratas, edema macular cistoide, glaucoma, neovascularización, coroiditis o hemorragias vítreas, así como la presentación de efectos adversos de los medicamentos.19
El seguimiento de la terapia sistémica depende del medicamento elegido. Se debe completar los estudios indicados antes de la administración de los fármacos, así como ofrecer seguimiento periódico de parámetros de toxicidad, a fin de disminuir al mínimo posible los efectos secundarios y complicaciones medicamentosas más severas. Por ejemplo, es mandatorio efectuar hemograma, test de enzimas hepáticas y función renal previo al inicio de metotrexate ante el riesgo de mielosupresión, nefropatía y hepatotoxicidad relacionadas con este fármaco (Cuadro 5). Antes de comenzar cualquier esquema de inmunosupresión, es necesario actualizar el esquema de inmunizaciones del paciente, sobre todo si se trata terapia biológica. En el caso de que el paciente sea tributario de recibir anticuerpos monoclonales antiTNF, debe excluirse primero la posibilidad de tuberculosis latente.89,90Una vez iniciada la inmunomodulación farmacológica, se recomienda realizar un hemograma y pruebas de función renal y hepática a las 2 semanas, con el fin de descartar trastornos orgánicos tempranos o leucopenia.91 De la misma forma, se recomienda el empleo de los inmunosupresores por al menos 2 años después de que el paciente se encuentre libre de actividad para asegurar una adecuada remisión,1,24salvo en el caso de ciclofosfamida. El objetivo del tratamiento con este fármaco es utilizarlo como máximo por 1 año, empleando posteriormente otro inmunomodulador como azatioprina, metotrexate o micofenolato por al menos 2 años más, con el fin de buscar la remisión completa y disminuir la posibilidad de neoplasias secundarias al medicamento.32
En condiciones estables, la recomendación general de seguimiento es una valoración al mes de inicio de tratamiento, luego de 1 a 3 meses según se amerite y posteriormente mantener la monitorización cada 6 meses.88 La meta final es mantener al paciente libre de inflamación, sin el uso de esteroides tópicos o sistémicos y eventualmente sin requerimiento de inmunosupresión.
Conflictos de intereses: los autores declaran no presentar conflictos de interés en la realización de estas guías y no existió ningún tipo de financiamiento externo. Los doctores Antillón, Espinoza Mora y Evans Tinoco, han recibido apoyos por actividades educativas médicas por parte de la compañía Abbvie. La Dra. Espinoza Mora ha fungido como conferencista para Abbvie, Pfizer y Sanofi y actualmente labora en Roche Centroamérica y Caribe, como gerente médico de las áreas Nefrología y Trasplante, Productos Establecidos y Foundation Medicine, y como responsable local de Publicaciones, en dicha afiliada














