Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Costarricense
On-line version ISSN 0001-6002Print version ISSN 0001-6012
Acta méd. costarric vol.48 n.3 San José Sep. 2006
Tumor gástrico estromal como causa de sangrado digestivo.
Laura Arroyo-Martínez1, Humberto Álvarez-Pertuz2, Jorge Acuña-Calvo3
Resumen
Los tumores gastrointestinales de la mesénquima (llamado tumores del músculo liso) se han clasificado como benignos (leiomiomas) o malignos (leiomiosarcomas). Más recientemente se les ha denominado Tumores Gástricos Estromales o GIST (Gastrointestinal Stromal Tumors). En estos tumores pueden abarcar desde la faringe hasta el canal anal, ya que comparten su origen embriológico.
Los GIST muestran una gran variedad de manifestaciones clínicas, como lo son: sangrado digestivo, obstrucción o perforación intestinal, anemia, dolor abdominal, masa abdominal, pérdida de peso, entre otras, de las cuales el sangrado digestivo es la presentación más común.
La incidencia de estos tumores es infrecuente, oscila entre el 0,1% y el a 3% de las neoplasias malignas gastrointestinalesi y son notables por la dificultad con la cual se puede realizar un diagnóstico patológico contundente de malignidad, ya que su histología es muy variable.
Aquellos con metástasis a otros órganos o invasión por continuidad a órganos vecinos son claramente malignos; pero entre los otros tumores estromales, solo aquellos con 2 ó más características de alto riesgo, como lo son: presencia de un alto conteo de mitosis por campo, pleomorfismo nuclear marcado, margen infiltrativo, coagulación espontánea, necrosis del tumor y gran tamaño, son considerados como malignos. Aquellos con una sola característica son clasificados como potencialmente malignos.
El diagnóstico preoperatorio puede resultar difícil y a menudo se realiza transoperatoriamente. Los estudios de imágenes, estudios con contraste y endoscópicos pueden ayudar en el diagnóstico de la masa tumoral. La resección quirúrgica con propósito curativo es el tratamiento de elección.
Se presenta aquí el caso de una paciente de 39 años, sin antecedentes personales patológicos de importancia, quien ingresa al Servicio de Emergencias del Hospital San Rafael de Alajuela con historia de hematemesis, dolor abdominal y melena a repetición. Se le realizan varias gastroscopías, en donde se documenta un levantamiento de la submucosa subcardial, la cual, luego de varios estudios, se llega a diagnosticar como un GIST gástrico. La tumoración requirió resección quirúrgica. Tuvo un postoperatorio satisfactorio y la paciente egresó con control en la Consulta Externa de Cirugía.
Descriptores: leiomiomas, leiomiosarcomas, muscular de la mucosa, sangrado digestivo, tumor estromal gastrointestinal, ultrasonido endoscópico.
Key words: leiomyomas, leiomyosarcomas, muscularis mucosae, gi fleending, gastrointestinal stromal tumor, endoscopic ultrasomal.
Recibido: 28 de octubre de 2005 Aceptado: 28 de marzo de 2006
Caso clínico
Paciente femenina de 39 años, sin antecedentes personales patológicos de importancia, ingresa al Servicio de Emergencias del Hospital San Rafael de Alajuela en 2004 con cuadro clínico de 24 horas de evolución caracterizado por: hematemesis, dolor abdominal y melena. Ingresa consciente, orientada, pálida y taquicárdica. Se aborda con el protocolo de sangrado digestivo alto, presenta signos vitales: presión arterial 100/60, frecuencia cardiaca 100/min; el lavado gástrico fue negativo y el tacto rectal fue positivo por melena. La hemoglobina era de 7,7 g/dl y el hematocrito del 25%. Se transfundió con 500 cc glóbulos rojos empacados, se ingresa a observación y se le coordina endoscopía alto (EA) en el Hospital México, para determinar la causa del sangrado. La gastroscopía se reporta dentro de límites normales, excepto por un levantamiento aparente submucoso subcardial. Egresó 3 días después con tratamiento ambulatorio y referencia a la consulta externa de gastroenterología.
En mayo se le realiza endoscopía control, que reporta en la curvatura mayor a los 45 cm y llegando a los 60 cm, una masa elevada con úlcera crónica de fondo sucio, profunda de 2-3 cm de franco aspecto neoplásico (probable adenocarcinoma del cuerpo gástrico Bormann I – II). Se le realiza biopsia endoscópica y es referida a la consulta externa de cirugía general. Es valorada en ese servicio días más tarde, con el reporte de la biopsia, mas en él no se logra demostrar patología neoplásica, salvo gastritis crónica no atrófica con Helicobacter pylori +++, razón por la cual se le da tratamiento con omeprazole, claritromicina y amoxicilina, y nueva cita control en gastroenterología.
Diez meses más tarde se ingresa y se comenta en sesión conjunta por tener una biopsia negativa por malignidad, pero con características macroscópicas sugestivas de neoplasia; es entonces referida al Centro de detección del Cáncer Gástrico en el Hospital Max Peralta, en marzo de 2005.
Ahí se realiza una nueva EA y se documenta la misma gran tumoración submucosa en la curvatura mayor, se toman biopsias que reportan mucosa gástrica con cambios de gastropatía reactiva, asociada a áreas en donde la lámina propia se convierte en un área edematosa con proliferación de vasos sanguíneos y fibras colágenas.
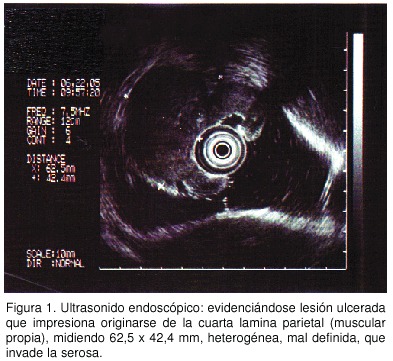
Además de exámenes de laboratorio, se practica un US de abdomen general, que documenta en la cámara gástrica una masa sólida en la curvatura mayor, cuerpo superior y medio, hipoecoica, recubierta por mucosa bien definida, probable leiomioma gástrico, sin evidencia de adenopatías o metástasis. Además, se le realiza un US endoscópico con transductores de 7,5 y 12 MHz, evidenciándose lesión ulcerada que impresionaba originarse de la cuarta lámina parietal (muscular propia) midiendo 62,5 x 42,4 mm, heterogénea, con áreas sólidas y otras líquidas, mal definida (invadiendo la serosa) y asociada con adenopatías perilesionales ovoides, homogéneas, sugestivas de actividad inflamatoria (Figura 1).
En junio de 2005 la paciente reingresa al servicio de emergencias por un nuevo episodio de sangrado digestivo alto, ameritando trasfusión sanguínea. Una EA de emergencias reporta masa ulcerada con sangrado reciente, a descartar mioma ulcerado vs. neoplasia.
Se decide llevarla a la sala de operaciones con el diagnóstico de tumoración gástrica ulcerada, probable leiomioma.
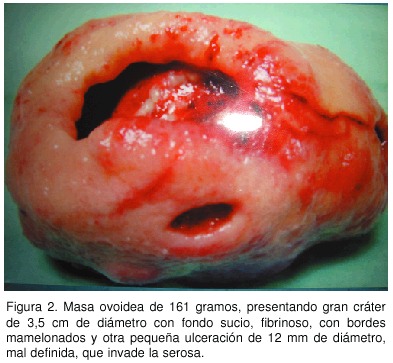
Bajo anestesia general, se le realizó una laparotomía media supraumbilical. Se exploró la cavidad, sin encontrarse lesiones metastásicas hepáticas ni adenopatías sugestivas de malignidad. Se palpó en el cuerpo gástrico hacia la curvatura mayor una gran masa tumoral (Figura 2) sin compromiso de la serosa ni órganos adyacentes. Se realizó una gastrostomía anterior y resección en cuña de la masa ulcerada, dejando bordes de pared gástrica sana; luego se reparó la cámara gástrica en 2 planos. Su evolución fue satisfactoria y se egresó al 6º día postoperatorio con control en la consulta externa. El reporte histopatológico con estudios de inmunohistoquímica, CD 34 y CD 117, tipificó las células de "Cajal" y se hizo el diagnóstico de tumor estromal gastrointestinal fusocelular.
Discusión
En 1962 Stout reportó por primera vez 69 casos de pacientes con tumores no epiteliales gástricos originados del músculo liso, y se refirió a estos como "leiomioblastomas". La OMS, en 1969, introdujo leiomioma epitelioide, para aludir a todos aquellos tumores mesenquimatosos del TGI2.
Sin embargo, con los avances tecnológicos en los marcadores inmunohistoquímicos y estudios ultraestructurales histológicos, esta terminología se ha visto desplazada por una más adecuada. Los GIST no necesariamente implican potencial de malignidad, ya que tanto los tumores benignos como los malignos se incluyen en esta terminología. La incidencia de malignidad de estos es rara; representan aproximadamente del 0,1% al 3% de las neoplasias malignas del tracto gástrico intestinal. Su interés clínico no es tan importante para el pronóstico como la observación de evolución del leiomioma, según sus características histológicas y grados de mitosis3.
Los tumores gástricos ocurren predominantemente en el sexo masculino, aunque en el femenino tienden a desarrollar leiomioma y en los del sexo masculino, leiomiosarcoma, en los caucásicos; es en esencial una patología de los adultos, entre la cuarta y séptima década de vida. El leiomioma sucede entre los 50 y los 59 años, y los leiomiosarcomas entre los 60-69 años. En cuanto al patrón de crecimiento, los leiomiomas tienden a ser intraluminales (endogástricos) y los leiomiosarcomas, exogástricos.
Anatómicamente se distribuyen así: 47-66% en el estómago, 19-35% en el intestino delgado, 2-12% en colon y recto, y 5-9% en el esófago4.
El porcentaje de metástasis es bajo al momento del diagnóstico y el hígado, el bazo y los ganglios regionales son sus ubicaciones más comunes.
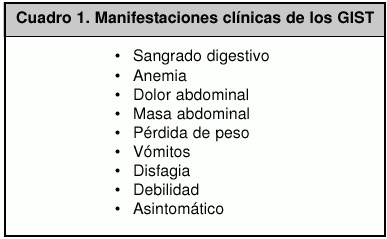
Las manifestaciones clínicas varían, pero las más frecuentas son el sangrado digestivo (86%) y la anemia (80%), y la mayoría de los pacientes requieren transfusiones sanguíneas (Cuadro 1).
Histológicamente, el leiomioma gástrico es un tumor circunscrito de color gris, blanco o rosado, que se origina en la capa muscular longitudinal y circular del estómago y rara vez de la mucosa, siendo intramural. Los tumores benignos miden de 0,4 a 2 cms de diámetro y los malignos 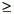 5 cm, muestran células bien definidas de músculo liso con tejidos conectivos. Con frecuencia hay celularidad extrema, con células gigantes de núcleo hipercromático, con aspecto bizarro, y células tumorales redondas en lugar de ser en huso.
5 cm, muestran células bien definidas de músculo liso con tejidos conectivos. Con frecuencia hay celularidad extrema, con células gigantes de núcleo hipercromático, con aspecto bizarro, y células tumorales redondas en lugar de ser en huso.
La mayoría de las células son redondas en vez de elongadas, sin microfibrillas, y el citoplasma es levemente claro, algunas veces con apariencia vacuolada o una zona clara perinuclear.
En un 10% pueden ser múltiples, con nódulos bien diferenciados; el 33% son pediculados o intramurales. Pueden pasar a la serosa y al exterior en un 30-33%, llegando a tener grandes proporciones. Se distribuyen así: cuerpo un 40%, antro un 25% y cerca del píloro un 20%. Son submucosos en un 60% y se ulceran en ocasiones formando un cráter profundo. La forma circular se localiza en el cardias o en el píloro.
Puede ser difícil y algunas veces imposible establecer si este tumor se comportará como benigno o maligno, ya que la hipercromía y el pleomorfismo no son tan relevantes como el número de mitosis y la infiltración de los tejidos vecinos.
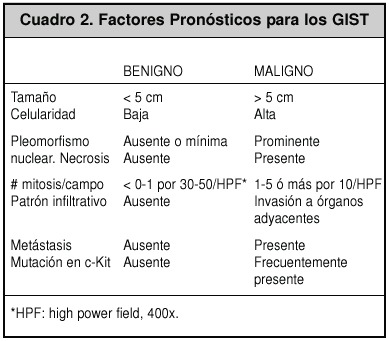
Los factores pronósticos convencionales para este tipo de tumores son poco útiles y no siempre ayudarán a predecir su malignidad, ya que son únicos. Las características morfológicas y el tamaño y el índice de mitosis/campo han demostrado ser de gran ayuda para conocer el comportamiento maligno (Cuadro 2). Los GIST pueden dividirse en los de bajo (<10 mitosis/10 HPF) y los de alto grado (>10 mitosis/10HPF)5.
Desde el punto de vista diagnóstico, clínicamente el leiomioma se puede sospechar en caso de larga evolución con una masa abdominal palpable. En un 80% la radiografía simple de abdomen presenta defecto de llenado con ulceración central; en un 13%, deformidad en "reloj de arena" o zona de estrechez. El TAC de abdomen permite documentar los tumores. Con el endoscopio se logra diagnosticar los tumores macro y microscópicamente, ya que se pueden tomar biopsias. La angiografía selectiva es muy útil para distinguir el leiomioma gástrico de tumores pancreáticos o retroperitoneales. El US de abdomen permite ubicar el tumor en general, pero se cuenta con el US endoscópico, el cual es superior a cualquier otro método de diagnóstico, por su especificidad, eficacia y seguridad. Este combina la función endoscópica y ultrasónica y de esta forma se logra no solo inspeccionar la superficie de la lesión gastrointestinal, sino también definir la capa de donde se origina, la invasión y la estructura de la lesión en sí6.
Los recientes estudios de inmunohistoquímica han demostrado tener relevancia en este tema, ya que se ha evidenciado que el 94% de los GIST son altamente reactivos a los anticuerpos CD 117 ( c-kit), una membrana receptora con un componente tirosino quinasa interno. El CD 117 es un marcador sensible que podría utilizarse para esclarecer el diagnóstico tan ambiguo en aquellos tumores que son noinmunoreactivos. Cabe recalcar que el CD 117 identifica las células intersticiales de "Cajal", encargada de la peristalsis. Al encontrarse una mutación en c-kit, se está ante un GIST maligno. La mayoría de los GIST son positivos ante el CD 117 y el CD 34.
La resección quirúrgica completa y de forma agresiva es el tratamiento de elección para esta neoplasia; si la biopsia por congelación es sugestiva de GIST, se debe tratar como si fuera maligno, ya que de no tener una cápsula verdadera, la enucleación no dará un adecuado margen de resección.
Los tumores estromales generalmente no invaden tejidos adyacentes, por lo tanto, las resecciones con márgenes amplios no son necesarias. Pero si los órganos adyacentes son afectados, de ser factible se debe practicar una resección en bloque. Como la metástasis a nódulos linfáticos se da en < 10% de los casos, no se requiere realizar linfadenectomía extensa. En cuanto al abordaje laparoscópico de los GIST, aún se debate, ya que la integridad del tumor al momento de la resección es cuestionable7.
La radioterapia y quimioterapia no han demostrado tener beneficio significativo ante estos tumores, siendo la resección quirúrgica completa del tumor, el tratamiento de elección8.
En vista de la dificultad para predecir la manera como se comportan los GIST, se debe brindar un seguimiento eficaz a los pacientes para lograr la detección temprana de cualquier probable metástasis.
Abstract
Gastrointestinal Stromal tumors (GIST) are rare neoplasias of the gastrointestinal tract that arise from primitive mesenchymal cells. They are located throughout the gastrointestinal tract but are usually located in the stomach and small intestine. The majority are immunohistochemically positive for CD 117 and CD 34. Their clinical course is not easily predicted by standard means. Gastrointestinal bleeding and anemia are the most common clinical presentations. Surgical resection remains the mainstay of treatment, as chemotherapy and radiation are ineffective. Long-term follow-up is imperative, since recurrence rates are high.
We present here the case of a 39 y-o female who came in with haemathemesis and black stools. After several upper endoscopies and an endoscopic ultrasonography, she underwent surgical removal of a gastrointestinal stromal tumor from her stomach. She did well after surgery and remains asymptomatic
Referencias
1. Abramson, Daniel J., M.D., Gastric Leiomyoblastoma: report o three cases, one malignant. Ann Surg. 1973;178: 625-630. [ Links ]
2. J. Kim, Christina M.D., Day, Scott M.D., Yeh, Karen M.D., Gastrointestinal stromal tumors: analysis of clinical and pathologic factors. Am Surg. 2001; 67:135-137. [ Links ]
3. Gregory B. Davis, M.D., Blanchard, Kay, M.D., Hatch, George, M.D., Wertheimer-Hatch, Laura, M.D., Hatch, Kathryn, B.S., Foster, Roger Jr., M.D., Skandalakis, John E., M.D. Tumors of the stomach. World J Surg. 2000; 24: 412-420. [ Links ]
4. Ruiz, Atenodoro, M.D., Nassar, Aziza J.,M.D., Fromm, Hans, M.D., Multiple malignant gastric stromal tumors presenting with GI bleeding a case report and a review or the literature. Gastrointest endosc. 2000; 51: 225-228. [ Links ]
5. Pidhorecky, Ihor, M.D., Cheney, Richard T., M.D., Kraybill, William G., M.D., Gibbs, John F., M.D. Gastrointestinal stromal tumors: current diagnosis, biologic behavior and management. Ann Surg Oncol. 2000; 7: 705-712. [ Links ]
6. Xu, Guo-Qiang, Zhang, Bing-Ling, Li, You-Ming, Chen, Li-Hua, Ji, Feng, Chen, Wei-Xing, Cai, Shu-Ping. Diagnostic value of endoscopic ultrasonography for Gastrointestinal leiomioma. World J Gastroenterol. 2003; 9:2088-2091. [ Links ]
7. Pollack, Ng E-H, Munsell, MF., Atkinson, EN., Romsdahl MM. Prognostic factors influencing survival in gastrointestinal sarcomas: implications for surgical management and staging. Ann Surg. 1992; 215: 68-77 [ Links ]
8. Skandalakis, John E., Gray, S.W. Smooth Muscle Tumors of the Gastrointestinal Tract Introduction. World J Surg. 2000; 24: 389-394 [ Links ]
Servicio de cirugía. Hospital San Rafael de Alajuela. Caja Costarricense de Seguro Social.
Abreviaturas: EA, endoscopía alta; GIST, gastrointestinal stromal tumors; HPF, high power field; OMS, organización mundial de la salud; TAC, tomografía axial computarizada; US; ultrasonido.
Correspondencia: Dra Laura Arroyo Martínez, Servicio de Emergencias, Hospital San Juan de Dios