Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Costarricense
On-line version ISSN 0001-6002Print version ISSN 0001-6012
Acta méd. costarric vol.46 suppl.1 San José Oct. 2004
obesidad y su relación con el ejercicio
Manuel Wong- On 1, Gerardo Murillo-Cuzza 2.
Resumen
La obesidad constituye uno de los mayores problemas que sufre el mundo actual, y muy unido al crecimiento económico y tecnológico está el sedentarismo (inactividad física). Si bien el aumento en la ingesta calórica es un factor determinante en la patogenia de la obesidad, la importancia de los factores genéticos, como predisponentes en ella, es innegable. El papel de la leptina y su asociación con el neuropeptido Y y la insulina como reguladores del centro de la saciedad, parecen tener gran relevancia en la patogenia de la obesidad, así como también el papel de la adiponectina y la resistencia a la insulina. El ejercicio físico en sinergismo con la restricción calórica llevan a una disminución del peso graso con un aumento de la masa muscular; una mejora de la resistencia a la insulina produce cambios en el perfil lipídico, aún sin que haya pérdida de peso y disminución en la presión arterial, sin olvidar, por supuesto, las mejorías a nivel psicosocial. El ejercicio aeróbico, su intensidad y volumen, son los determinantes principales en la prescripción del ejercicio y los que producen mejores resultados en nuestro organismo; no obstante, para lograr cumplir las metas de un programa de este tipo hay que lograr consistencia, adherencia y disfrute del ejercicio.
Descriptores: Indice de Masa Corporal, ejercicio aeróbico, restricción calórica, porcentaje de grasa, termogénesis, obesidad.
Recibido: 17 de febrero de 2004 Aceptado: 20 de julio de 2004
La obesidad es considerada como un problema de salud pública que afecta a cientos de miles de personas del todo el mundo, sobre todo en la civilización occidental, y que genera gastos de millones de dólares en su tratamiento y en el de sus consecuencias. Así, por ejemplo, en Estados Unidos el manejo de la obesidad, que padecen alrededor de 100 millones de personas, (aproximadamente el 35 % de las mujeres y el 31 % de los hombres mayores de 19 años son obesos o con sobrepeso), conlleva gastos cercanos a los 100 billones de dólares anuales, sin mencionar la disminución de la productividad, que se calcula que llega a los 3.9 billones de dólares, mientras que otros 33 billones se invierten anualmente en programas dedicados a la pérdida de peso y servicios relacionados 1.
Definición y clasificación
En la bibliografía encontraremos varias definiciones para sobrepeso y obesidad 2,3,4, 5,6, con diferentes parámetros y límites. Los tipos de obesidad se definen de acuerdo con la distribución de grasa en el organismo: tipo 1: grasa/peso excesivo distribuido en todas las regiones corporales; tipo 2: excesiva grasa subcutánea en la región abdominal, o adiposidad androide; tipo 3: excesiva grasa abdominal profunda, y tipo 4: exceso de grasa en regiones del glúteo y femoral, o adiposidad ginecoide.
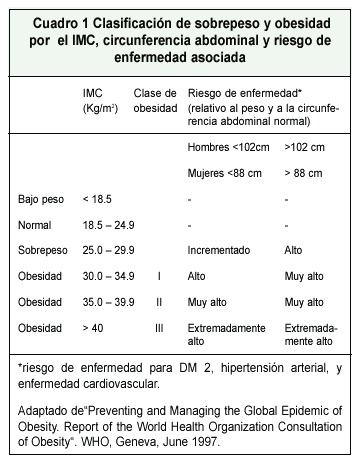
Actualmente, para clasificar la obesidad nos basamos primordialmente en el Indice de Masa Corporal (IMC), que es una relación entre el peso y la estatura de la persona (peso en kg, dividido por la altura en metros al cuadrado: Kg/m2) (Cuadro 1); si bien este índice es un parámetro muy útil y sencillo de utilizar, se emplea principalmente para estudios poblacionales, y no es efectivo a nivel individual, donde lo más importante es en realidad el porcentaje de grasa y de músculo que una persona tiene. Así, por ejemplo, al aplicar el IMC, a un fisicoculturista o un levantador de pesas, muy probablemente se ubiquen en la categoría de sobrepeso, o incluso obesos, cuando en realidad poseen un porcentaje de músculo muy alto y uno de grasa corporal relativamente bajo. En términos generales, el porcentaje de grasa es del 10 al 20% en hombres, y del 20 al 30%, en mujeres 7.
Otro punto importante es la distribución de la grasa corporal, ya que la presencia de una distribución androide de la grasa, u obesidad centrípeta en comparación con una ginecoide, conlleva una mayor morbilidad. La obesidad centrípeta refleja altos niveles de grasa visceral o intraabdominal, patrón que se asocia a mayor riesgo cardiovascular (hiperlipidemia e intolerancia a la glucosa). La obesidad centrípeta tiene un valor agregado al IMC para la determinación del riesgo cardiovascular, de DM tipo 2 e hipertensión arterial, en donde se han definido los límites: para hombre 102 cm y para mujer 88 cm; y a partir de ahí, aumenta el riesgo 6, 8 (Cuadro 1).
Según la ISAK, la medición de la circunferencia de la cintura se efectúa nivel del punto más angosto entre el reborde costal inferior y la cresta iliaca, y en caso de no presentarse un punto más angosto, debe realizarse en el medio de estas dos referencias 5.
Las implicaciones que tiene la obesidad sobre la salud son múltiples:
* Enfermedades vasculares: hipertensión arterial, cardiopatía isquémica, accidentes cerebrovasculares y enfermedades venosas (insuficiencia venosa de la extremidades inferiores y tromboflebitis.
* Enfermedades metabólicas: diabetes mellitus tipo II, hiperlipemia e hiperuricemia.
* Enfermedades digestivas: litiasis biliar, esteatosis hepática y hernia hiatol.
* Enfermedades respiratorias: la mayoría de los obesos aún con pruebas de función respiratoria y concentraciones de CO2 normales, tienen sutiles alteraciones de la mecánica ventilatoria, del volumen plasmático circulante y del costo energético que representa respirar. Algunos pueden presentar síntomas de hipoventilación, hipercapnia, hipersomnia e insuficiencia cardiaca derecha (síndrome de obesidad-hipoventilación: SOH), síndrome de apneas del sueño o síndrome de apneas obstructivas del sueño también llamado Síndrome de Pickwick.
* Enfemedades osteoarticulares: se agravan las lesiones características de la artropatía degenerativa de tipo artrósico y, por lo tanto, aumentan las molestias secundarias a este tipo de patología osteoarticular.
* Enfermedades neoplásicas: más frecuentes del endometrio, mama, ovario, próstata, colon, recto y vesícula biliar.
* Otras: alteraciones de la piel como forunculosis, hiperqueratosis plantar y acantosis nigricans, sin olvidar los problemas psicosociales que envuelve esta patología.
Etiopatogenia de la obesidad
A pesar de que la obesidad se observa en múltiples síndromes genéticos, lesiones hipotalámicas y otras enfermedades como el hipotiroidismo, se trata de un problema de salud pública y actualmente hay que tener claro que no es solo un desbalance entre la ingesta calórica y el gasto energético, y que está más allá del simple hecho de comer mucho y hacer poco ejercicio. Con el avance tecnológico se ha descubierto el tan importante papel que los genes desempeñan en la obesidad.
No obstante, no hay que restarle importancia al hecho de que, por ejemplo, en Estados Unidos acerca del 22% de los adultos y el 25 % de los adolescentes reportan actividad física regular, el 25% de los adultos no realizan ninguna actividad física (son sedentarios) y aproximadamente el 14% de los adolescentes presentan reportes similares de inactividad 1.
El aumento de la ingesta calórica tiene un papel muy importante en su etiopatogenia. Los tipos de comidas y fácil acceso a estas, el incremento del consumo de grasas y de azúcares simples, la disminución en el consumo de vegetales, frutas y carbohidratos complejos, son factores que se suman a la prevalencia de la obesidad en el mundo.
Además de los factores ya mencionados, la regulación del balance energético se ve influenciado por otros elementos: tales como hormonas gastrointestinales, neurohormonas, vías nerviosas a través del nervio vago, neurotransmisores como la serotonina, neuropétidos que actúan tanto a nivel del sistema nervioso central como periférico, elementos bioquímicos como la glucosa y los ácidos grasos libres, las aferencias del tubo digestivo y la distensión gástrica.
Bases genéticas de la obesidad
Es evidente que los factores genéticos son fundamentales en la patogenia de la obesidad. Los antecedentes familiares de obesidad son muy frecuentes en los pacientes obesos. Así, si el padre y la madre son obesos, el 80% de los hijos lo serán también, mientras que solo presentan obesidad el 10 % de los hijos cuyos padres no son obesos 4. No obstante, muchos autores piensan que lo que se hereda en estas familias de obesos, más que las alteraciones metabólicas, son los hábitos de mesa.
Los trabajos clínicos realizados por Stunkard et al, en 1986, y Bouchard et al, en 1990 con gemelos homocigotos criados en ambientes distintos, nos hacen tener en cuenta la existencia de una predisposición genética a la obesidad, sobre la que actuarían factores sociales, educativos o nutricionales.
Hay que considerar que la presencia de un defecto monogénico en la obesidad humana es excepcional. Solo algunos casos dismórficos muy concretos (síndromes de Prader-Willi, Bardet-Bield, Alstrom, Cohen, etc.), en los que existe una agregación familiar de obesidad y aparición de esta en la primera infancia, son susceptibles de ser portadores de algún defecto genético aislado. Es preciso recordar que hablar de cada uno de los defectos genéticos conocidos no es el objetivo de esta revisión, sin embargo, cabe mencionar la importancia de los genes ob, db y UCP-2, que son aquellos que han propiciado un mayor avance en la comprensión fisiopatológica de la obesidad, y los más prometedores en cuanto a posibles aplicaciones terapéuticas.
La distribución del tejido adiposo, el gasto metabólico basal, la respuesta energética a la sobrealimentación, la actividad de la lipoproteínlipasa, la tasa lipolítica basal y las preferencias alimentarias dependen en un 30-40% de la carga genética de nuestros antepasados 1, 4. Y entre los genes estudiados encontramos los cromosomas 2p, 5p, 7q, 10p, 11q, 20q, 1, 11.
La leptina
La leptina es un péptido de 167 aminoácidos, que se sintetiza en exclusividad en los adipocitos maduros del tejido adiposo blanco (principalmente subcutáneo), para ser liberada en el torrente sanguíneo. Su síntesis depende del porcentaje de grasa corporal, del sexo (mayor en mujeres), de la edad y de varios factores hormonales. El frío (por estimulación B3-adrenérgica), el AMPc y la somatostatina inhiben la síntesis de leptina, mientras que la insulina (hiperinsulinismo crónico), los glucocorticoides, el TNF-alfa, y la IL-1 la aumentan.
La deficiencia de leptina por una mutación en el gen ob en el ratón obeso ob/ob donde fue descubierta, es la causante de la obesidad, dislipidemia y diabetes 4, 12,13; al inyectar leptina a los ratones se corregían estos problemas, sin embargo, el modelo no es aplicable a la mayoría de los humanos obesos, puesto que contrariamente a lo esperado, existe una hiperexpresión del gen ob y las concentraciones circulantes de leptina son muy elevadas. Dentro de las otras posibilidades que se han planteado, existen: una dificultad de paso a través de la barrera hematoencefálica, la presencia de un menor número de receptores para la leptina obR, así como la existencia de un receptor anómalo y, finalmente, existe también la hipótesis de un defecto a nivel posreceptor 4.
La leptina parece ejercer un efecto anorexiante indirecto sobre el centro de la saciedad hipotalámica, a través de segundos mensajeros dentro de los que destaca el neuropéptido Y (NPY). Este péptido, además de ser sintetizado y liberado en la glándula suprarrenal y los nervios simpáticos, es secretado por los cuerpos celulares en el núcleo arqueado, y es transportado por vía axonal al núcleo paraventricular. El neuropéptido Y elevado es un potente estimulante central del apetito, disminuye el gasto energético con la inhibición del sistema simpático. El aumento en los niveles de NPY ocasiona obesidad hiperinsulinémica, marcadamente hiperfágica.
El aumento del NPY produce un incremento de insulina, que induce un aumento en las concentraciones circulantes de leptina. La leptina, que es sintetizada por el tejido adiposo blanco, actúa a nivel hipotalámico (receptor obR) induciendo un descenso de NPY y por lo tanto disminuyendo el estímulo de apetito. En los obesos, al existir una alteración estructural en los receptores obR, la leptina no disminuirá el NPY, y persistirán la sensación de hambre y compulsión 4.
Todo esto hace considerar la existencia de una "triada"constituida por tres péptidos: leptina, NPY e insulina.
PPAR (Peroxisome Proliferator – Activated Receptor)
Los PPAR son receptores hormonales nucleares de la subfamilia o clase II (a la que pertenece el receptor de la hormona tiroidea, del ácido retinoico y de la vit D) que se unen al ADN y regulan la transcripción de genes de una manera ligando dependiente 14,15; en el caso de los PPAR gamma (hetero dímero obligado del receptor de retinoide X que está involucrado en el metabolismo de los triglicéridos), al ser activados incrementan la transcripción de genes de enzimas que normalmente son inducidos por la insulina e intervienen en el metabolismo lipídico y en el balance energético, como la leptina 12. La mayor expresión de los PPAR gamma es en tejido adiposo, pero también es detectable en otros órganos como riñón e hígado. Dentro de las funciones que tienen estos receptores están la diferenciación del adipocito 16,17. Los PPAR gamma activan la transcripción en asociación con coactivadores, incluyendo el gen Src-1 y el gen Tif2. Aunque estos coactivadores actúan para múltiples miembros de los PPAR, los coactivadores tienen funciones específicas en algunas ocasiones y un papel aún en estudio con la patogenia de la obesidad.
Los ligandos de los PPAR gamma son los ácidos grasos y las tiazolidinedionas. Se ha mencionado que ciertos ácidos grasos poliinsaturados, como el linoleico y AINES como el ibuprofeno, activan los PPAR gamma 16, y que también son activados por prostaglandinas, leucotrienos y afectan la expresión de genes involucrados en el almacenaje de los ácidos grasos. La activación de los PPAR gamma por las tiazolidinedionas mejora la sensibilidad a la insulina 18.
Todos los humanos con mutaciones de este receptor describen obesidad severa (banda 3p25) 1. Además, promueven la diferenciación de monocitos/macrófagos, lo que tiene una importancia en la aterogénesis y el consumo de LDL oxidadas 16.
En un estudio de Knoblauch et al, de 1999, demuestran que los PPAR gamma son importantes en los casos de obesidad mórbida, pero también sugieren que variaciones sutiles en el locus del gen de los PPAR gamma son importantes en el IMC y en el valor de lípidos (HDL, LDL) en personas no obesas 16.
La adiponectina
Proteína producida por el adipocito, parece tener relación con la obesidad y las otras adipocinas de idéntico origen; como lo son el TNF alpha, la IL-6 y la resistina 19, fundamentales en la resistencia a la insulina. Parece que la adiponectina está disminuída en la obesidad y en la resistencia a la insulina, aún en personas no obesas, y se acompaña de disminución de lípidos a nivel de hígado y en músculo 19,20. No se cree que se relacionen adiponectina y la leptina plasmática.
Las tiazolidinedionas y otros agonistas de los PPAR gamma aumentan la adiponectina, la cual tiene una relación inversa con la resistencia a la insulina y la obesidad. Se supone que el aumento del TNF alpha en el tejido adiposo está envuelto en la resistencia a la insulina, asociada con la obesidad 21.
Kern et al, en 2003, examinaron la expresión de la adiponectina y el TNF alpha en el tejido adiposo humano encontraron una asociación significativa entre la adiponectina y la expresión del TNF alpha. Es posible que al disminuir la expresión de la adiponectina se provoque a un aumento en la secreción del TNF por el tejido adiposo; esta última elevaría la IL-6 plasmática que también se asocia con la resistencia a la insulina, independiente de la obesidad 21. Los datos sugieren que el TNF y la adiponectina son puntos de control en el tejido adiposo que producen la expresión de otras citocinas (como la IL-6) y el vínculo con el desarrollo de la acumulación de lípidos en los tejidos, y el "síndrome de resistencia a la insulina".
Resistencia a la insulina
Los mecanismos responsables por la resistencia a la insulina incluyen defectos genéticos a nivel de la célula blanco, anticuerpos a la insulina y a su degradación acelerada.
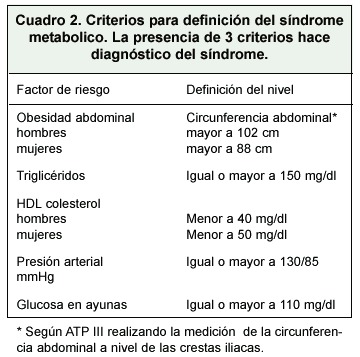
La obesidad, que es la causa más común de resistencia a la insulina, está asociada a una disminución del número de receptores y a una falla del posrreceptor para activar la tirosínquinasa, e incapacidad de la autofosforilación de la tirosínquinasa. La resistencia a la insulina es muy importante en la patogenia del desarrollo del "síndrome metabólico" (Cuadro 2), que incluye una o todas de las siguientes: hiperinsulinemia, intolerancia a la glucosa o DM tipo 2, obesidad centrípeta, hipertensión arterial, dislipidemia (que incluye trigliceridos altos), disminución de las HDL-C, LDL pequeñas y densas, e hipercoagulabilidad caracterizada por una aumento del PAI-1(plasminogen activator inhibitor- 1.) 1, 22.
La inactividad física, el sobrepeso/obesidad y los factores genéticos, son los causantes del síndrome metabólico 8, mientras que el ejercicio en fases tempranas reduce el riesgo de su progresión 23, 24, 25.
En el músculo esquelético, la resistencia a la insulina puede ser causada por varias anormalidades, incluyendo defectos en el transportador de la glucosa GLUT-4 (transportador mediado por la insulina más importante) 1, 22.
Dentro de los factores que afectan la sensibilidad insulínica, diferentes al tipo de fibra muscular, los ácidos grasos libres son considerados entre los principales. Se han formulado diferentes hipótesis para explicar el mecanismo por el cual los AGL producen insulinorresistencia: a) ciclo de Randle o ciclo glucosa-ácido graso, b)sobrerreactividad de la vía hexosamina, c) aumento de TG intramiocelular, d) alteración de las propiedades fisicoquímicas de la membrana plasmática, y e) incremento intracelular de malonil-CoA.
Gracias a la resonancia magnética nuclear por espectroscopia, se ha podido identificar con bastante precisión el contenido intramiocelular de lípidos, determinándose que estos se relacionan directamente con el grado de insulinorresistencia. No obstante, existe cierta contrariedad, pues los atletas entrenados tienen una mayor cantidad de triglicéridos dentro de sus fibras musculares y, sin embargo, presentar sensibilidad a la insulina normal o aumentada, lo cual probablemente puede deberse a una mayor capacidad enzimática oxidativa, secundaria a su predominio de fibras musculares tipo I, las cuales tienen una mayor captación de ácidos grasos y más sensibilidad insulínica que las fibras musculares tipo IIb, propias del sedentarismo y la obesidad 26.
Por lo tanto, es probable que los TG puedan no manifestar consecuencias adversas en músculos que tienen la capacidad para utilizarlos eficientemente. Los TG intramiocitos son otra fuente de ácidos grasos de que dispone la fibra muscular para su metabolismo, y es posible que su aporte interfiera con la captación de glucosa, generando insulinorresistencia. Otro mecanismo potencial de producción de insulinorresistencia por los TG intramiocelulares, pudiese ser el incremento en las concentraciones citoplasmáticas de acil-CoA de cadena larga (LC- CoA), el cual está asociado con la lipólisis de los TG intramiocelulares y produce un incremento del diacilglicerol y PKC. La PKC ha demostrado ser capaz de inhibir la vía de señalamiento de la insulina, al fosforilar los residuos de serina y treonina del sustrato para el receptor de insulina-1 (IRS-1) 27. El contenido de TG intramusculares ha sido señalado como un mejor predictor de sensibilidad insulínica, que el índice de masa corporal o el porcentaje de grasa corporal 28,29,30.
El ejercicio y la relación con la resistencia a la insulina
Después del ejercicio, el consumo de glucosa es en parte elevado por mecanismos independientes de la insulina, que probablemente involucra un aumento de la migración de GLUT 4 a la membrana plasmática, relacionado a los túbulos T 31. Sin embargo, una vez que se realiza ejercicio se puede incrementar la sensibilidad a la insulina al menos por 16 horas en personas sanas y en sujetos con DM tipo 2. Estudios recientes han demostrado que el ejercicio agudo mejora la translocación de GLUT 4 mediada por insulina 32. Incrementos en la concentración de GLUT 4 secundario, al aumento de la actividad enzimática oxidativa por el entrenamiento 33, contribuyen a este efecto, incluso han propuesto que la depleción del glucógeno muscular por ejercicio tendría también alguna relación. El entrenamiento físico potencia los efectos del ejercicio en la sensibilidad a la insulina por medio de múltiples adaptaciones en el transporte de la glucosa y su metabolismo 31, 34.
El patrón de resíntesis del glucógeno muscular, posterior a su depleción inducida por el ejercicio, es bifásico. Después del cese del ejercicio y con el adecuado consumo de carbohidratos, el glucógeno muscular es resintetizado, independientemente del requerimiento de insulina que dura de 30-60 min 35, y luego la sensibilidad a la insulina, se ve aumentada mediante la activación de la AMP kinasa y la proteínkinasa B (PKB), mejorando el transporte de glucosa a la célula 36, 32; el glucógeno llega cerca de valores pre-ejercicio dentro de las primeras 24 horas. Además, se incrementa gradualmente a niveles sobre lo normal, en los próximos días. A esta fase rápida de resíntesis contribuyen el incremento en el porcentaje de glucógeno sintasa I, y en la permeabilidad de la célula muscular a la glucosa y un aumento de la sensibilidad a la insulina del músculo. La fase lenta parece estar en control de una forma intermedia de glucógeno sintasa que es muy sensible a la activación de la glucosa-6-fosfato 37. (La conversión de esta enzima a su forma intermedia se debe a la constante exposición del músculo a concentraciones elevadas de insulina plasmática subsecuentes al consumo alto de carbohidratos). El ejercicio mejora la sensibilidad a la insulina inclusive más que la metformina y las tiazolidinedionas 34.
Utilización de los ácidos grasos durante el ejercicio 38.
El tejido adiposo blanco se encarga de la manufactura de la grasa, de su almacenaje y liberación. Almacenaje en respuesta a la insulina y liberación en respuesta a la restricción calórica cuando no hay insulina.
El tejido adiposo pardo o gris disipa la energía vía procesos de respiración mitocondrial. Tiene inervación simpática y el estímulo adrenérgico activa la lipólisis de los adipocitos, así como el gasto de energía en el tejido adiposo y esquelético, a través de receptores b1, b2 y b3. Los ácidos grasos se almacenan como triglicéridos y la glucosa como glucógeno, y son fuentes de energía cuantitativamente importantes durante el ejercicio. De estos, el glucógeno es vital para el ejercicio de moderada y alta intensidad, pues se requiere en un rango de cerca del 65% al 100% del VO2 máx. El glucógeno hepático es fundamental porque es la mayor fuente de glucosa, que es el sustrato primario para el SNC. Es preciso recordar que la oxidación de carbohidratos solo da 4 kcal/g , de proteínas 4 kcal/g, mientas que 1g de grasa da 9 kcal.
Aunque las reservas de glucógeno se pueden depletar durante el ejercicio agudo, la cantidad de energía almacenada como triglicéridos puede exceder enormemente el gasto calórico durante una sesión de ejercicio. Los ácidos grasos derivados de la lipólisis de los TG tienen dos funciones como sustratos durante el ejercicio. Primero, en el ejercicio prolongado de alta intensidad, para el cual el glucógeno muscular es esencial, los ácidos grasos sirven como una fuente importante de combustible, ya que el glucógeno es limitado, entonces los ácidos grasos prolongan el tiempo del ejercicio antes de la depleción del glucógeno y de que el individuo quede exhausto. Segundo, en el ejercicio de intensidad leve y moderada, los ácidos grasos sirven de combustible principal, haciendo posibles las actividades muy prolongadas como caminar, aún en un estado de ayuno. Esto sucede a partir de los 30 min. de la realización de ejercicio aeróbico de leve o moderada intensidad, como caminar.
En lo que respecta a diferencias de género en la utilización del glucógeno durante el ejercicio, M. Esbjörnsson-Liljedahl et al, en 1999, realizaron un estudio donde analizaron la respuesta metabólica aguda al ejercicio de carrera corta y rápida (sprint) para determinar el consumo de ATP, fosfocreatina y glucógeno durante el ejercicio intenso. La diferencia se presentaba en la utilización del glucógeno, pues existe una reducción inducida por el ejercicio en el contenido de glucógeno en las fibras tipo I, un 50% menor en mujeres que en hombres. La reducción del glucógeno inducida por el ejercicio fue atenuada en mujeres en comparación con los hombres, pero las diferencias de género fueron vistas en las fibras I más que en las fibras II 39.
Muchos estudios recientes han concluido que la mujer oxida proporcionalmente más lípidos y menos carbohidratos durante el ejercicio submáximo de resistencia, en comparación con el hombre 40. No está claro si estas diferencias de género obedecen a las hormonas sexuales per se, o si son relacionadas con las ya conocidas características de género en el contenido de grasa corporal y consumo de energía, aunque estos dos son expresados relativos a la masa magra corporal.
El mayor sitio de almacenaje de triglicéridos es el citoplasma de los adipocitos. Los TG almacenados en el tejido adiposo y en el músculo proveen la mayor cantidad de ácidos grasos libres oxidados durante el ejercicio. Las catecolaminas estimulan los receptores b-adrenérgicos y aumentan la lipólisis vía aumento del AMPc, activando la lipasa del adipocito para la producción de los ácidos grasos, a partir de los TG almacenados. En el ejercicio prolongado, por la estimulación b-adrenérgica del adiposito, se produce un aumento de los ácidos grasos, libre en plasma.
Según Arner P. et al, la actividad lipolílica in vitro durante el ejercicio es significativamente mayor en el tejido adiposo abdominal, que en el tejido adiposo glúteo, y más aún en mujeres que en hombres. In vivo, la lipólisis en el tejido subcutáneo es regulada por distintos mecanismos adrenérgicos durante el reposo y el ejercicio. Efectos alfaadrenérgicos inhibitorios modulan la lipólisis durante el reposo, mientras que los de estimulación betaadrenérgica regulan la lipólisis durante el ejercicio 41.
Ejercicio y lipoproteínas 7
Uno de los beneficios del ejercicio regular, es el efecto a largo plazo sobre el metabolismo lipídico. Ocurren muchas adaptaciones en el ejercicio al realizar una sola y prolongada sesión.
Los efectos principales del ejercicio en las lipoproteínas son la disminución de los TG y el aumento de las HDL 7, 42. Cuarenta y cinco minutos de ejercicio aeróbico diario disminuyen los TG substancialmente.
Un descenso de los TG plasmáticos es un efecto consistente del ejercicio aeróbico agudo, sin embargo, puede ser retrasado por varias horas después de las cuales los TG permanecen disminuidos por 24-48 horas. El aumento en la actividad de la lipoproteínlipasa inducida por el ejercicio puede estimular el descenso en los TG rompiendo la unión VLDL-TG y aumentando el consumo de TG, y su uso por el músculo esquelético. El resultante incremento en los remanentes de VLDL estimula la síntesis de HDL.
Aunque ocurran muchos cambios en las lipoproteínas, con solo una vez que se realice ejercicio estas adaptaciones son transitorias y no se hacen crónicas hasta que se establezca un programa de ejercicios por varios meses. Las HDL normalmente se elevan posteriores al ejercicio crónico. Esto se debe a un aumento de las HDL2 que aumentan la excreción de colesterol por el hígado. El mínimo gasto calórico semanal para aumentar las HDL debe ser de 1000 a 1200 kcals. Se habla de que a menor HDL previo al inicio de ejercicio, mayor aumento con el ejercicio crónico. Pueden pasar varios meses de gasto calórico semanal mayor a 1000 kcals, para que los resultados sean evidentes.
El colesterol y las LDL disminuyen en las siguientes 24 horas al ejercicio aeróbico vigoroso, pero esto no es consistente y su importancia fisiológica se desconoce. No obstante, el colesterol total y las LDL no cambian con el ejercicio, a menos de que haya una restricción calórica y pérdida de peso en acción sinérgica con la dieta. Sin embargo, el ejercicio puede disminuirlos en ciertos casos.
Con el ejercicio aeróbico pueden ocurrir cambios en las subfracciones de LDL. Se ha demostrado que personas entrenadas presentan altos niveles de LDL1 y bajos de LDL3 moléculas que son más pequeñas y densas (más aterogénicas) que los individuos sedentarios. Esto pueden suceder aún sin que se modifique la concentración plasmática de las LDL 43.
Al ejercicio aeróbico crónico se han asociado también cambios enzimáticos. La lipoproteinlipasa (LPL), lecitin-colesterol-acil-transferasa (LCAT) y TG lipasa aumentan, mientras que la lipasa hepática generalmente disminuye. Es posible que los receptores de LDL se incrementen como resultado de un programa de ejercicio aeróbico. La lipoproteína (a) también disminuye con el entrenamiento. Parece que enzimas antioxidantes se incrementan y la oxidación celular disminuye con el ejercicio aeróbico crónico.
No se conoce la intensidad, ni la duración específica del ejercicio con las que se dan estos cambios, pero se sabe que la cantidad de ejercicio aeróbico es determinante. Tras un período de 8 a 16 semanas estos cambios se revierten secundario a la inactividad.
Kraus et al, compararon los efectos de diferentes cantidades e intensidades de ejercicio en las lipoproteínas, en una manera prospectiva, al azar y controlada. Los resultados mostraron que la cantidad de ejercicio ejerce mayores cambios en las lipoproteínas y sus subfracciones, que su intensidad; también indicaron que una relativa alta cantidad de ejercicio, aún en ausencia de pérdida significativa de peso, puede mejorar significativamente el perfil lipídico. La cantidad de ejercicio aumenta además la concentración total de HDL, las de HDL grandes y las HDL tamaño promedio, y disminuye las concentraciones de TG y VLDL-TG totales, con descensos en la concentración de IDL, la concentración de las VLDL grandes y el tamaño promedio de las VLDL.
Acción de los lípidos sobre la utilización de la glucosa
Los lípidos empeoran la tolerancia a la glucosa, disminuyen su utilización mediada por insulina e inhiben oxidación y almacenaje de la glucosa, sobre todo en el músculo esquelético, en reposo, en ejercicio, y posterior a este 44.
El ejercicio de resistencia aumenta la utilización de lípidos por los músculos, si es de moderada a leve intensidad, lo que incrementa la b-oxidación (se observa una ventaja de los individuos entrenados sobre los sedentarios). Aumenta también la oxidación lipídica por el músculo esquelético, mejora la lipólisis de los TG almacenados en el tejido adiposo y dentro de las fibras musculares, y el consumo de lípidos circulante por el músculo activo.
En el ejercicio de resistencia se incrementa la cantidad de AGL internalizados en la célula muscular, ya que el músculo presenta mayor vascularidad capilar; hay un incremento de la LPL, y de la actividad de la carnitina palmitoiltrans-ferasa-1(convierte los ácidos grasos de cadena larga en acil-carnitina, para que puedan atravesar al interior de la membrana mitocondrial y darse su la b-oxidación y por estimulación de transportadores de AG a nivel de la célula muscular, el más importante, el FABP 44). Todo esto lleva a un aumento de la oxidación lipídica, sin embargo, según Matzinger et al, por el efecto directo de los lípidos dentro de la célula muscular, se produce un efecto inhibitorio sobre el IRS-1(insulin receptor substrate-1) asociado con la actividad de la PI-3 Kinasa (fosfatidilinositol 3 kinasa, que al ser activada junto con otras proteínas permite que los GLUT-4 se expongan en la membrana celular), que altera la utilización de la glucosa en el ejercicio. Posteriormente hay mejoría de la resistencia a la insulina, como ya lo hemos mencionado.
Prescripción del ejercicio
Ejercicio vrs. efectos de la obesidad
El ejercicio reduce la mortalidad y la morbilidad a través de múltiples mecanismos. Según el JNC7, en lo que respecta a la pérdida de peso se habla de una reducción de la presión arterial sistólica, de 5 a 20 mmHg, por cada 10 kg de peso perdido, y con respecto a la actividad, de 4 a 9 mmHg, al realizar actividad aeróbica regular, como caminar (al menos 30 min por día, la mayoría de los días de la semana) 45. El ejercicio mejora el perfil lipídico, la composición corporal, la función cardiorrespiratoria, entre otros. Muchos de estos beneficios son independientes de la pérdida de peso; el riesgo cardiovascular disminuye tanto en el ejercicio intenso como en el leve o moderado 46.
Importancia del aspecto psicológico
Asociado al inicio de una vida físicamente activa se señalan cambios en el estado de ánimo de las personas, actitud positiva hacia la vida, actitud positiva hacia los problemas, y muchos otros efectos a nivel psicológico, a parte de los beneficios físicos y metabólicos que brinda.
Es importante recordar que junto a la historia clínica y el examen físico de todo paciente, el interrogatorio de fondo en busca de una etiología psiquiátrica o psicológica, es de gran relevancia en el manejo del paciente con obesidad. Así, por ejemplo, un evento importante en la vida de una persona marca el inicio de su inactividad y por consiguiente lo ha conducido a la obesidad, como la muerte del cónyuge; o bien, el antecedente de anorexia o bulimia en la adolescencia, que acarrea un importante trasfondo psiquiátrico. Por lo tanto, es trascendental, en el manejo multidisciplinario que conlleva la obesidad, el contexto de salud mental de las personas, para obtener resultados satisfactorios en la reducción del peso.
Definición de prioridades
Para prescribir el ejercicio, más necesario que la intensidad o el tipo son la consistencia, la adherencia y disfrute del mismo, para que la persona no abandone rápidamente el hábito.
Si bien la pérdida de peso es el objetivo que muchas personas persiguen, la valoración integral del paciente permitirá observar cuáles factores de riesgos se añaden, como lo son la dislipidemia, la hipertensión arterial, la diabetes y la presencia del síndrome metabólico, entre otros. Es preciso hablar con el paciente acerca de los riesgos, opciones y beneficios. Las metas en la obesidad tienen que estar muy definidas; si no hay comorbilidad, la meta por seguir es la pérdida de peso, pero si existe comorbilidad, hay que definir las metas apropiadamente: Hb glicosilada, valor de LDL, y presión arterial. Para estos pacientes, la meta inicial es la pérdida inicial de peso del 5%. Por otro lado, si la obesidad está causando problemas en lo que es movilidad, osteoartrosis o apnea del sueño, la pérdida del 10 al 20 % sería lo mejor 2. Se menciona que una tasa de pérdida de peso adecuada es de 0,5 kg/sem una vez iniciado un programa de ejercicio. El ejercicio facilita la pérdida de peso a largo plazo. Es más difícil perder peso y mantenerlo que perder peso rápido, pues la ganancia del mismo también ocurre de una manera rápida. El hecho de mantener el peso perdido es un parámetro de éxito para el paciente.
La utilización de las grasas como combustible principal del cuerpo durante el ejercicio se da a partir de los 30 minutos de realizar ejercicio aeróbico de leve a moderada intensidad 7, 47. No obstante, la pérdida de grasa máxima es en promedio de 4 a 6 kg utilizando solo el ejercicio, y posteriormente no se perderá más. Sin embargo, para que haya una importante y constante reducción del peso asociada al ejercicio, es necesaria la restricción calórica (dieta).
La disminución del tejido graso corporal asocia una hipertrofia del tejido muscular, por lo que las personas pueden creer que no han perdido nada de peso, sin embargo, su composición muscular ha cambiado, y se debe recordar que la grasa pesa mucho menos que el músculo. Este cambio en la composición corporal lo medimos por varias técnicas: la medición de pliegues cutáneos, o de la densidad corporal, la bioimpedancia, la absorciometría dual (DEXA), entre otros. Es conveniente decirles a los pacientes que no se desanimen si observan en una balanza que no han perdido peso y explicarles los cambios corporales que han sufrido.
Todas las personas con obesidad tienen aumentado el porcentaje corporal de grasa y presentan un déficit de tejido muscular, por lo que los programas donde se inicia con un régimen de ejercicios, sin una previa introducción, frecuentemente implican lesiones. Lo primero que hay que hacer es comenzar el ejercicio, pidiéndoles, por ejemplo caminar todos los días al menos 30 min., para producir cambios benéficos en la composición corporal: aumento del tejido muscular, disminución del tejido adiposo y mejora del depósito de calcio en los huesos, lo mismo que del nivel funcional del individuo, lo que asocia la adherencia y disfrute del ejercicio. Una vez valorados de nuevo se podrá prescribir un programa de ejercicio que tome en cuenta puntos importantes: tipo actividad, cargas específicas de trabajo, duración de la actividad o sesión (mínimo 30 min. por día, de 5 a 6 días por semana), intensidad del ejercicio y precauciones asociadas a problemas ortopédicos o de otra índole.
Gasto energético del ejercicio
Dado que la obesidad es en gran consecuencia producto del incremento en la ingesta calórica, el gasto calórico deberá incrementarse aún más para lograr la reducción del peso. Es un error pensar que realizar una actividad física permite aumentar el consumo de alimentos. El gasto calórico, también denominado Requerimiento Energético Individual (REI), tiene varios componentes:
1- Metabolismo basal (MB): que se puede calcular en forma directa o indirecta, equivale a 65 a 75% del REI.
2- Actividad física (20 al 40%)
3- Termogénesis (incluye las reacciones metabólicas del organismo, ya que todas estas producen calor.)
La actividad física es el parámetro que presenta mayor variabilidad, y durante el ejercicio de baja intensidad, el MB puede incrementarse 5-8 veces, mientras que en el de corta duración (unos pocos minutos) y mucha intensidad, el gasto calórico puede aumentar unas 10-15 veces, en personas que no han seguido entrenamiento, y hasta unas 25-30 veces, en los deportistas bien entrenados 1. Los alimentos también desarrollan termogénesis, la cual es aumentada por el ejercicio físico.
Ahora bien, la intensidad y el volumen de la actividad repercuten en el gasto calórico del individuo:
La actividad sedentaria consume menos de 2,5 kcal/min, la actividad ligera consume entre 2,5 a 5 kcal/min, la actividad moderada consume entre 5 a 7 kcal/min, la actividad intensa consume hasta 10 kcal/min.
Restricción calórica
Para instaurar una pauta dietética correcta se deben conocer las costumbres alimentarias del paciente, su forma de vivir, su historia clínica y las posibles complicaciones añadidas a la obesidad. Lo primero por tomar en cuenta es la historia dietética, para planificar una dieta tan personalizada como sea posible, adecuándola a los gustos, horarios, nivel socioeconómico y cultural. Además, hay que adecuar la dieta a las posibles complicaciones como DM, HTA, etc.
El control periódico es otro punto importante, el seguimiento semanal o quincenal del paciente es indispensable para obtener buen resultado; y, finalmente, el contacto del paciente con el terapeuta es un estímulo que le da fuerza para continuar.
Dieta equilibrada: la dieta hipocalórica debe disminuir la energía suministrada, pero no la proporción de nutrientes necesarios para mantener el estado de salud. La dieta se hará según la ingesta previa. En principio, se aconseja disminuir un 35-40% de la energía de alimentación habitual 1, 4. Mantener una dieta equilibrada consiste en un porcentaje del 50-60% del total de la energía en carbohidratos, y un 15% de proteínas, un 30-35 % de grasas, vitaminas y minerales en cantidades recomendadas, presencia de fibra en la dieta y una ingesta adecuada de agua (1,5 L por día) 4.
Un tiempo razonable para la pérdida de peso es alcanzar la reducción del 10 % del peso corporal en 6 meses de terapia. Se requiere de un balance energético negativo de 3500 kcal para disminuir 1 lb de grasa 7, 48. Para los pacientes con sobrepeso la disminución de 300 a 500 Kcal/día resulta en la pérdida de peso de media a 1 libra/semana, y un 10% de pérdida de peso en 6 meses. Cuando la obesidad es lo que predomina, el déficit de 500 a 1000 kcal/d conduce a la pérdida de 1 a 2 libras/semana, y a un 10% de peso perdido en 6 meses6. Restricciones mayores son más difíciles de cumplir por los pacientes; además, las pérdidas rápidas de peso conllevan un alto índice de fracaso y de otras complicaciones para la salud.
Abstract
Obesity constitutes one of the major problems in our days, very close to the economic and technologic growth is the sedentarism (physical inactivity). Even if the increase in caloric intake is a determinant factor in obesitys pathogenesis, the importance of genetic factors is undeniable. The role of Leptin in asociation with Neropeptide Y and insulin as regulators of the satiety center seems to have great relevance in obesity`s pathogenesis as well as the role of adiponectin in obesity and insulin resistance. Physical exercise in sinergistic action with caloric restriction, will lead to a decrease in fat weight and increase muscular mass, improves insulin resitance, leads to changes in the lipid profile even without weight loss; and decrease blood pressure, not forgetting of course, improvement psychosocial. Aerobic exercise, its intensiy and the volume of exercise are the main determinants in its prescription and the ones that produce better outcomes in our organisms, however, to accomplish this goals in an exercise program we have to achieve consistency, adherence and to enjoy exercising in the first place and then we will guarantee the succes of an exercise program prescription.
Referencias
1. www.emedicine.com/med/topic1653.htm. Obesity. January 21 2002.
2. Dipiro, J. Talbert, R. Yee, G. Matzke, G. Wells, B. Posey LM. et al. Pharmacotherapy A Pathophysiological Approach. Fourth Edition. USA: Appleton and Lange. 1999. 2334-2354. [ Links ]
3. Brukner, P. Khan, K. Clinical Sports Medicine. Segunda Edición. Australia: Mc Graw Hill. 2001.618-624. [ Links ]
4. Foz, M. Formiguera, X. Obesidad. España: Harcourt Brace. 1998. 25-109. [ Links ]
5. Norton, K. Olds, T. Anthropometrica. Australia: UNSW Press. 1996. 366-392. [ Links ]
6. Pi-Sunyer, X. NHLBI Obesity Education Iniciative Expert Panel on the Identification, Evaluation, and Treatment of Overweight ond Obesity in Adults. National Institute of Health Publication. 1998 September. No 98- 4083. [ Links ]
7. Roitman, J. American College of Sports Medicine`s Resourse Manual for Guidelines for Exercise, Testing and Prescription. Third Edition. USA: Williams and Wilkins.1998. 294-301. [ Links ]
8. Third Report of the National Cholesterol Education Program(NCEP) Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults(Adult Treatment Panel III). National Institute of Health Publication. 2002 September. No 02-5215. [ Links ]
9. Stunkard AJ, Sorensen TIA, Hanis Cl. An adoption study of human obesity, N Engl J Med 1986; 314: 193-198. [ Links ]
10. Bouchard, C. Tremblay, A. Nadeau A. Genetic effect in resting and exercise metabolic rates. Metabolism 1989; 38: 364-270. [ Links ]
11. Fang, J. Wylie-Rosett, J. Cohen, H. Kaplan, R. Alderman, M. Exercise, body mass index, caloric intake and cardiovascular mortality. Am J Prevent Med. 2003 Nov; 25(4): 283-289. [ Links ]
12. Kallen, CB. Lazar, M. Antidiabetic Thiazolinediones Inhibit Leptin (ob) Gene Expression in 3T3-L1 Adipocytes. Proc. Natl. Acad. Sci. USA. 1996 June 11; 93(12): 5793-5796. [ Links ]
13. Kieffer, TJ. Heller, RS. Leech, CA. Holz, GG. Habener, JF. .Leptin suppression of insulin secretion by activation of ATP-sensitive K+channels in pancreatic beta-cells. Diabetes. 1997 Jun;46(6): 1087-93. [ Links ]
14. Flores, J. Farmacología Humana. 3 ra edición. España: Masson. 1997. 939-940. [ Links ]
15. Muoio, DM. MacLean, P. Lang, D. Li, S. Houmard, J. Way, J. Et al. Fatty acid homeostasis and induction of lipid regulatory genes in skeletal muscles of peroxisome proliferator- activated receptor(PPAR) alpha knock-out mice. Evidence for compensatory regulation by PPAR delta. J Biol Chem. 2002 Jul 19;277(29):26089-97. [ Links ]
16. Knoblauch, H. Busjahn, A. Muller-Myhsok, B. Faulhaber, H. Schuster, H. Uhlmann, H. et al. Peroxisome Prliferator-Activated Receptor Gamma Gene Locus Is Related to Body Mass Index and Lipid Values in Healthy Nonobese Subjects. Aterioscler Thromb Vasc Biol. 1999; 19: 2940. [ Links ]
17. Ristow, M. Muller-Wieland, D. Pfeiffer, A. Krone, W. Kahn, R. Obesity Associated with a Mutation in a Genetic Regulator of Adipocyte Differentiation. N Engl J Med. 1998 Oct 1;339(14):953-959. [ Links ]
18. Zierath, JR. Ryder, JW. Duebber, T. Woods, J. Wu, M. Ventre, J. Et al. Role of Skeletal muscle in thiazolinedione insulin sensitizer(PPAR gamma agonist) action. Endocrinology. 1998 Dec; 139(12): 5034-41. [ Links ]
19. Kern, P. Gregorio, G. Lu, T. Rassouli, N. Ranganathan, G. Adiponectin expressión from humans adipose tissue: relation to obesity, insulin resitance, and tumor necrosis factor-[alpha] expressión.(Pathophysiology). Diabetes. July 2003. [ Links ]
20. Arita, Y. Kihara, S. Ouchi, N. Takahashi, M. Maeda, K. Miyagawa, J. et al. Paradoxical decrease of an adipose-specific protein, adiponectin, in obesity. Biochem Biophys Res Commun. 1999 Apr 2;257(1):79-83. [ Links ]
21. Kern P, Ranganathan S, Li C, Wood L, Ranganathan G: Adipose tissue tumor necrosis factor and interleukin-6 expression in human obesity-associated insulin resistance. Am J Physiol. 2001 280:E745-E751. [ Links ]
22. www.emedicine.com/med/topic1173.htm. Insulin Resistance. January 30 2002.
23. Katzmarzyk, PT. Leon, AS. Wilmore, JH. Skinner JS. Rao, DC. Rankinen, T. et al. Targeting th metabolic syndrome with exercise: evidence from HERITAGE Family Study. Med. Sci. Sports Exerc. 2003 Oct; 35(10): 1703-9. [ Links ]
24. Laaksonen, D. Exercise Cuts Risk of Metabolic Syndrome Even in Low-Risk Men. Diabetes Care. 2002;25:1612-1618. [ Links ]
25. Toumilehto, J. Lindstrom, J. Ericksson, J. Valle, T. Hamaleinen, H. Ilanne-Parikka, P. Et al. Prevention of Type 2 Diabetes Mellitus by Changes in Lifestyle among Subjects with Impaired Glucose Tolerance. N Engl J Med. 2001 May 3;344(18): 1343-1350. [ Links ]
26. Dick DJ, Peters SJ, Glatz J. Functional differences in lipid metabolism in resting skeletal muscle of various fiber types. J Physiolol 1997;271:E340-E351. [ Links ]
27. Prentki M, Corkey BE: Are the ß-cell signaling molecules malonyl-CoA and cytosolic long-chain acyl-CoA implicated in multiple tissue defects of obesity and NIDDM? Diabetes 1996;45:273–283. [ Links ]
28. Krssak M, Falk-Petersen K, Dresner A, DiPietro L, Vogel SM, Rothman DL, Roden M, Shulman GI: Intramyocellular lipid concentrations are correlated with insulin sensitivity in humans: a 1H NMR spectroscopy study. Diabetologia 1999;42:113–116. [ Links ]
29. Pan DA, Lillioja S, Kriketos AD, Milner MR, Baur LA, Bogardus C. Skeletal muscle triglyceride levels are inversely related to insulin action. Diabetes 1997;46:983–988 [ Links ]
30. Perseghin G, Scifo P, DeCobelli F, et al. Intramyocellular triglyceride content is a determinant of in vivo insulin resistance in humans: a 1H-13C nuclear magnetic resonance spectroscopy assessment in offspring of type 2 diabetic parents. Diabetes 1999;48:1600-1606. [ Links ]
31. Borghouts, LB. Keiser, HA. Exercise and insulin sensivity: a review. Int J Sports Med.2000. Jan;21(1):1-12. [ Links ]
32. Ryder, J. Mechanisms regulating metabolic and mitogenic events in skeletal muscle: implications for insulin resistance and exercise. Fredagen den 10 mars 2000, kl. 9.00. Abstract. [ Links ]
33. Neufer, PD. Shinebarger, MH. Dohm, GL. Effect of trainning and detrainning on skeletal muscle glucose transporte(GLUT 4) content in rats. Can J Physiol Pharmacol. 1992 Sep;70(9): 1286-90. [ Links ]
34. Perseghin, G. Price, T. Falk, K. Roden, M. Cline, G, Gerow, K. et al. Increased Glucose Transport-Phosphorylation and Muscle Glycogen synthesis after exercise Trainning in Insulin-Resistant Subjects. N Engl J Med. 1996 Oct 31;335(18):1357-1362. [ Links ]
35. Jentjens, R. Jeukendrup, A. Determinants of post-exercise glycogen synthesis during short-term recovery. Sports Med. 2003; 33(2):117-44. [ Links ]
36. Fisher, JS. Gao, J. Han, DH. Holloszy, JO. Nolte, LA. Activation of AMP Kinase enhances sensitivity of muscle glucose transport to insulin. Am J Physiol Endocrinol Metab. 2002 Jan; 282(1): E18-23. [ Links ]
37. Ivy Jl. Muscle glycogen synthesis before and after exercise. Sports Med. 1991 Jan; 11 (1):6-19 [ Links ]
38. Taylor, A. et al. Biochemistry of Exercise VII. Vol 21. USA: Human Kinetics Books. 1990. 319-327. [ Links ]
39. Esbjörnsson-Liljedahl, M. Sundberg,C. Norman,B. Jansson, E,. Metabolic response in type I and type II muscle fibers during a 30-s cycle sprint in men and women. J Appl Physiol 87: 1326-1332, 1999; 8750-7587. [ Links ]
40. Carter, S. McKenzie, S. Mourtzakis, M. Mahoney,D. and Tarnopolsky, M. Short Term 17 B -Estradiol decreases glucose Ra but not whole body metabolism during endurance exercise. J Appl Physiol 90: 139-146,2001; 8750-7587. [ Links ]
41. Arner, P. Kriegholm, E. Engfeldt, P. Bolinder, J. Adrenergic Regulation of Lipolysis In Situ at Rest and during Exercise. J Clin Invest 85: 1990; 893- 898. [ Links ]
42. Kiens, B. Lithell, H. Lipoprotein metabolism influenced by training-induced changes in human skeletal muscle. J Clin Invest. 1989 feb;83(2):558-64. [ Links ]
43. Kraus, W. Houmard, J. Duscha, B. Knetzger, K. Wharton, M. McCartney, J. et al. Effects of the Amount and Intensity of exercise on Plasma Lipoproteins. N Engl J Med. 2002 Nov 7; 347(19):1483-1492. [ Links ]
44. Matzinger, O. Schneiter, P. Tappy, L. Effects of fatty acids on exercise plus insulin-induced glucose utilization in trained and sedentary subjects. Am J Physiol Endocrinol Metab 282(1): El25-El31, January 2002. 0193-1849. [ Links ]
45. Chobanian, A. JNC 7 Express. The Seventh Report of the Joint Committe on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. National Institute of Health Publication. 2003 May No 03-5233. [ Links ]
46. Manson, J. Greenland, P. LaCroix, A. Stefanik, M. Mouton, C. Oberman, A. et al. Walking Compared with Vigorous Exercise for the Prevention of Cardiovascular Events in Women. N Engl J Med. 2002 Sep 5;347(10): 716- 725. [ Links ]
47. Micheli, L. Team Physician Manual. Hong Kong: Lippincott Williams and Wilkins Asia. 2001. 49-75. [ Links ]
48. Fox, E. Sports Physiology. Second Edition. USA: CBS College Publishing. 1984. 40-57. [ Links ]
1. Médico General. Comité Cantonal de Recreación y Deportes de San Antonio de Belén.
2. Médico Especialista en Medicina del Ejercicio Físico y Deporte, Servicio de Ortopedia y Rehabilitación, Hospital San Juan de Dios.
Abreviaturas: TG, traglicéridos; PKB: proteínkinasa B; PPAR, Peroxisome Proliferator-A Activated Receptor. SOH: Síndrome de obesidad: hipoventilación. ATPIII, Adult Treatment Panel III; IMC, índice de masa corporal; ISAK, International Society for the Advancement of Kinanthropometry; JNC7, Joint National Committee 7; NPY, neuropétido Y; MB, metabolismo basal; REI, requerimiento energético individual; TNF, factor de necrosis tumoral; VO2 max, consumo máximo de oxígeno.
Correspondencia: Unidad de Medicina del Ejercicio Físico y Deporte. Servicio de Ortopedia y Rehabilitación. Hospital San Juan de Dios. No de fax: 256-7603