Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Costarricense
On-line version ISSN 0001-6002Print version ISSN 0001-6012
Acta méd. costarric vol.45 n.4 San José Oct. 2003
Métodos: Se realizaron muestreos de agua en varios sectores de la costa pacífica de nuestro país, con el objetivo de detectar las especies de microalgas potencialmente tóxicas y nocivas, y se interrogó a los pescadores locales.
La identificación de las especies se realizó morfológicamente mediante microscopía de luz y electrónica de rastreo. Los hallazgos se compararon con la bibliografía y se propuso el potencial tóxico de estas microalgas, así como los métodos de análisis toxicológico, y la sintomatología de los afectados.
Resultados: Observamos en Costa Rica un aumento en número de especies de microalgas productoras de FAN. Se reportaron las especies tóxicas productoras de FAN descritas por varios autores y las encontradas en este estudio. En algunas muestras de floraciones algales hemos encontrado bacterias grandes intracelulares, de forma bacilar, principalmente dentro del dinoflagelado Prorocentrum micans. Esta relación podría estar asociada a la toxigenicidad del alga. Hemos descrito la presencia de 26 dinoflagelados, 8 diatomeas y 1 cianobacteria tóxica en las FAN de las costas del Océano Pacífico costarricense.
Conclusión: Se piensa que el aumento en la contaminación de las zonas costeras y el transporte de especies por medio de navíos pueden ser la causa de la aparición de estas microalgas. Estas son capaces de producir: intoxicación paralizante, amnésica, diarréica, neurotóxica, ciguatera y fiebre de Tamandré. Es importante que el personal de salud tenga un buen conocimiento de las FAN y se necesita con urgencia un adecuado programa de monitoreo y control en Costa Rica, para proteger a la población.
Descriptores: mareas rojas, floraciones algales nocivas, dinoflagelados, toxicología.
Recibido: 10 de abril de 2003
Aceptado: 23 de setiembre de 2003
Abreviaturas: AO, ácido okadaico; BR, bioensayo en ratón; FAN, floraciones algales nocivas; CLAP, cromatografía líquida de alta presión; IAM, intoxicación amnésica por marisos; IDM, intoxicación diarréica por mariscos; IPM, intoxicación paralizante por mariscos; MAG-S, ministerio de agricultura y ganadería laboratorio de sanidad; MEB, microscopio electrónico de barrido; UR, unidades ratón; VCP, veneno ciguatérico de pescado.
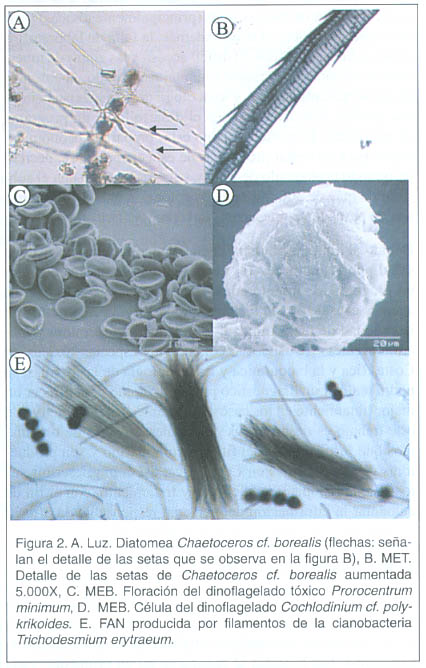
El término FAN (floraciones algales nocivas) lo designó la Comisión Oceanográfica Intergubernamental de la UNESCO 1 , y se usa para designar microalgas, bacterias y ciliados que pueden producir daños al hombre por sus efectos adversos en la salud humana, en la acuicultura, turismo y en las poblaciones naturales de organismos marinos en las zonas costeras 2 . El aumento en la concentración de microalgas pigmentadas en el mar, produce discoloraciones en el agua, debido a que pueden alcanzar concentraciones muy elevadas, en el orden de los 10 6 cel x L-1 2 Figuras. 1A y 2E . Muchas de estas microalgas son parte del fitoplancton que engloba diversas especies de tamaño microscópico, con escasa capacidad de movimiento y que, por lo tanto, son transportadas pasivamente por la masa de agua en donde viven.
El fitoplancton tiene una especial relevancia para las especies marinas, porque constituye el nivel trófico primario en los ecosistemas acuáticos, es la fuente fundamental de alimento para los organismos filtradores (mejillón, almeja, piangua, etc.) y algunas especies tienen efectos nocivos para los bivalvos y peces, lo que frena su desarrollo y las hacen tóxicas para el consumo humano.Se cree que el registro más antiguo que se tiene sobre una floración algal o marea roja, se cita en la Biblia: "…y las aguas del Nilo se convirtieron en sangre. Los peces del Nilo murieron, el río empezó a oler mal y los egipcios no podían beber de sus aguas. Todo Egipto se lleno de sangre." (Exodo 7: 20- 2, Santa Biblia). El primer informe de muertes por intoxicación paralizante (IPM) por consumo de mariscos se produjo en 1793, en la tripulación del barco Capitán George Vancouver, en la Columbia Británica 1 , y el primer caso de intoxicación amnésica (IAM) por ingestión de mariscos contaminados se documentó en la Isla Príncipe Eduardo (Canadá) en 1987, cuando más de 100 personas enfermaron y muchas murieron por la ingestión de moluscos bivalvos contaminados. Las floraciones algales en Costa Rica son fenómenos que van en aumento en los últimos años, en especial en la costa Pacífica del país 3 . Existe poco conocimiento, debido a la ausencia de registros de mareas rojas (principalmente tóxicas) y escasos estudios sobre el tema. Además, la falta de laboratorios costeros bien equipados, el difícil acceso a las zonas de muestreo, la carencia de personal regional capacitado, la ausencia de datos epidemiológicos y toxicológicos, y la inexistencia de una política adecuada impiden el desarrollo de un programa de monitoreo. El gobierno, al no estar preparado económicamente para solventar problemas de esta envergadura, decretó un periodo prolongado de veda y se complementó con el subsidio de más de 300 millones de colones a más de 600 familias de pescadores artesanales del área Pacífica.
Materiales y métodos
Desde 1997, el Centro de Investigación en Estructuras Microscópicas colectó muestras de agua, tanto en superficie como a 5 metros de profundidad, en diversos sectores de la costa pacífica. Las colectas se realizaron en un promedio cada 22 días, en la parte interna del Golfo de Nicoya, Puntarenas, estero de Puntarenas, Paquera, Puerto Caldera y Quepos. Se anotaron las observaciones de los pescadores y sus familiares acerca de los padecimientos asociados con las FAN. La muestras se colectaron con botella Niskin de 1 litro de capacidad, con el propósito de realizar conteos celulares y mediante una colecta en la superficie con una red para fitoplancton de 20 µm de grosor de poro. Las muestras se fijaron en solución de Karnovsky amortiguada en cacodilato de sodio al 0.1M, pH 7.4 5 . El procesamiento se realizó para microscopía electrónica de barrido (MEB) y para microscopía de luz. Para MEB, las muestras fueron posfijadas con tetraóxido de osmio al 1%, durante 1 h. Se deshidrataron mediante un gradiente ascendente de alcohol etílico y se infiltraron en acetato de amilo para su posterior secado en punto crítico. Luego se montaron sobre bases de aluminio y se recubrieron con una capa de platino de 30nm de grosor, en un cobertor iónico marca Hitachi, modelo IB-5. La muestras se observaron con un microscopio electrónico de barrido Hitachi S-2360N, a un voltaje de aceleración de 15KV. Las microalgas encontradas fueron fotografiadas y caracterizadas morfológicamente, para identificarlas taxonomicamente. Con el microscopio óptico se observaron las microalgas vivas y se determinó el lugar de algunas organelas importantes para su clasificación. Se prepararon láminas fijas en resina para ser fotografiadas y en algunos casos se agregó hipoclorito de sodio, con el fin de despegar las placas de dinoflagelados armados para identificar al microorganismo. Los dinoflagelados se mantuvieron en cultivos unialgales para enviar muestras a laboratorios especializados y determinar la presencia de toxinas ellas. Con el propósito de identificar y reportar las especies, las micrografías electrónicas se compararon con la información existente en bases de datos internacionales y con la ayuda de expertos extranjeros.
Resultados y discusión
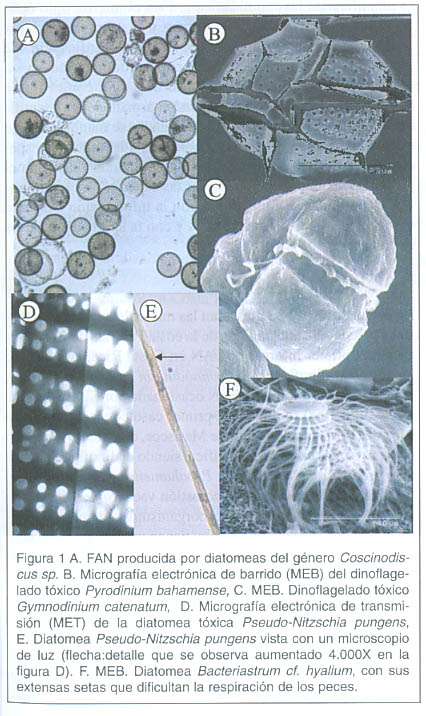
Intoxicaciones producidas por FAN Intoxicación Paralizante por Moluscos (IPM): Este tipo de intoxicación constituye la principal amenaza para la salud pública en América Latina 1 , 2 . Las toxinas que conforman la IPM están formadas por un núcleo tetrahidropurínico, siendo todas ellas análogas a la saxitoxina. Actualmente existen más de 26 derivados de la saxitoxina 17 , 18 . Desde el punto de vista técnico, la cuantificación de las toxinas de este grupo es muy difícil, debido a su complejidad y gran número de derivados químicos. Este grupo de toxinas se distribuye en el Pacífico Sudamericano y en el Atlántico 2 , 19 y es el tipo de intoxicación que se ha presentado en la costa Pacífica costarricense desde hace más de 20 años 3 , 16 , 8 . Las personas que ingieren moluscos bivalvos contaminados con toxinas de marea roja, presentan cuadros neurotóxicos en los primeros 15 min. de haber ingerido la toxina, pues esta se absorbe en la mucosa bucal y gástrica. El grado de intoxicación varía dependiendo de la cantidad de toxina ingerida. Las primeras manifestaciones son: parestesia bucal o sensación de hormigueo alrededor de la boca, que se trasmite luego a manos y pies. Luego aparecen la cefalea y náuseas, seguida por incoordinación al hablar, alteración del pulso y dificultad respiratoria. En casos graves ocurre una parálisis muscular flácida, insuficiencia respiratoria y posterior paro cardiorrespiratorio 2 ,17 ,18 . Las toxinas paralizantes alteran el transporte del ion sodio y son capaces de unirse con alta afinidad a su receptor en la membrana, que es el canal de sodio presente en células de mamíferos, aves, peces y anfibios, y también en invertebrados como los moluscos bivalvos 19 , 20 . Estas toxinas se dividen en las bloqueadoras del canal de sodio, entre las que se encuentran las saxitoxinas, tetrodotoxina y toxinas de caracoles marinos; y en las activadoras del canal de sodio, siendo estas las ciguatoxinas, brevetoxinas A y B 19 . El número de moléculas de toxina capaces de unirse al canal de sodio es muy alto bloqueo del paso de iones sodio hacia el interior de la célula, lo que causa parálisis neuromuscular 21 y paro respiratorio en mamíferos 2 . Debido a las características estructurales de estas toxinas, presentan diferencias en la potencia tóxica, la cual, por conveniencia, se expresa en Unidades Ratón (UR) por mmol de toxina. Así se puede calcular la toxicidad de las muestras de moluscos sospechosos y expresarla en unidades equivalentes (Unión Europea Norma ISO/CEI 17025 en 1999, ley 91/492/EEC de la Comunidad Económica Europea).
Las toxinas bloqueadoras inhiben los potenciales de acción, interfiriendo en las funciones de la actividad nerviosa, produciendo la muerte por parálisis flácida 2 ,17 ,18 ,19 . Las toxinas activadoras no son letales, pero pueden afectar gravemente al paciente induciendo problemas gástricos severos, parestesias, y alteraciones del equilibrio. Si el paciente presenta disnea debe hospitalizarse, realizar lavado gástrico o provocar el vómito y de inmediato se le administran medicamentos que retarden la absorción de las toxinas, como suspensiones antiácidas basadas en hidróxido de aluminio o magnesio, además de bloqueadores de la secreción gástrica y carbón activado. No existe un antídoto conocido para estas toxinas y el tratamiento está limitado a respiración asistida 17 ,20 .
Intoxicación Diarréica por Moluscos (IDM): Las toxinas del tipo diarréico son moléculas polietéreas lipofílicas 22 , como el ácido okadaico (AO), pectenotoxinas, yesotoxinas dinofisitoxina 1 (DTX1), dinofisistoxina 2 (DTX2) y las dinofisistoxina 3 (DTX3) 2 , 23 y sus derivados dinophysistoxina 1 y 2 (DTX-1, DTX-2) y otros compuestos como odularinas y caniculina A 19 .Tienen alto peso molecular y son liposolubles 24 . El mecanismo de acción es mediante la inhibición de las fosfatasas, o sea, de las enzimas que disminuyen el grado de fosforilación de proteínas que controlan la permeabilidad del epitelio intestinal. Los pacientes afectados por estas toxinas presentan náuseas, vómito, dolor abdominal y una diarrea secretoria que los lleva a la deshidratación. Este tipo de intoxicación diarréica que se produce por el consumo de mariscos contaminados, es similar al ocasionado por el cólera, por lo que, para realizar el diagnóstico diferencial, se debe investigar el tipo de alimentos ingeridos recientemente y efectuar un análisis de toxina a los moluscos, con el fin de confirmar la presencia del ácido okadaico. El tratamiento consiste en corregir el desequilibrio hidroelectrolítico. Los síntomas pueden durar 4 días, por lo que se debe evitar la muerte por deshidratación.
Intoxicación neurotóxica por moluscos (INM): Este tipo de intoxicaciones son producidas por un grupo de dinoflagelados del género Gymnodinium, el cual se denominaba Gymnodinium brevis, ahora conocido como Karenia brevi s. Se conocen 8 tipos diferentes de toxinas denominadas brevetoxinas. Estas provocan muertes masivas de peces y mamíferos marinos, mediante un mecanismo de acción todavía desconocido. En humanos, actúan en las neuronas bloqueando los canales de sodio y despolarizando la musculatura lisa del tejido bronquial 17 . La intoxicación puede ocurrir por contacto directo con la brisa marina o por la ingesta de moluscos bivalvos o peces contaminados. Los síntomas producidos por las brevetoxinas son similares a los producidos por la ciguatera, pero sin los efectos de la larga duración de la sintomatología. Incluyen náuseas, vómito, diarrea, escalofríos, mareos, parestesias en la cara, manos y pies, y esto ocurre de 3 a 4 horas después de la ingestión del marisco 17 . Este tipo de intoxicación no requiere tratamiento especializado. El método de detección de las toxinas tipo NSP, aceptado en los Estados Unidos por la American Public Health Association, es el bioensayo en ratón, el cual se basa en la aplicación intraperitoneal de 1ml de extracto acidificado de molusco a un ratón y el registro de tiempo de muerte del organismo, que convierte las unidades ratón a concentraciónes de PSP, al estandarizar del método por el uso de una solución de referencia de saxitoxina 25 .
Intoxicación amnésica por moluscos (IAM): Las toxinas que producen la intoxicación amnésica son toxinas amino- dicarboxílicas, conocidas como toxinas del ácido domóico 18 . El ácido domóico es un aminoácido soluble en agua y contiene tres residuos ácido carboxílicos que unen metales 26 . El ácido domóico produce una respuesta 100 veces más potente que el ácido glutámico 2 , que un neurotransmisor natural del sistema nervioso central y tiene la propiedad de unirse con alta afinidad a receptores de glutamato presentes en altas concentraciones en las neuronas del hipocampo, siendo las responsables del procesamiento de la memoria 19 . La intoxicación por toxinas amnésicas produce la entrada de calcio a las neuronas del hipocampo y, eventualmente causa su destrucción y la pérdida de memoria de corta duración y una neurodegeneración irreversible. Este tipo de intoxicaciones, además de alterar en los procesos de memoria y orientación, produce trastornos como náuseas, vómito, diarrea, cólicos abdominales, dolor de cabeza, secreción bronquial, dificultad respiratoria y pérdida del equilibrio 17 ,18 . La conducta a seguir es hacer un análisis químico del alimento ingerido en las últimas 24 h, para detectar el ácido domóico presente y dar tratamiento sintomático, ya que no existe uno específico 17 .
No se conoce con exactitud por qué los dinoflagelados producen toxinas que afectan al hombre. Se cree que existen varios factores ligados a estos, como son la producción de metabolitos secundarios, la simbiosis con bacterias, la ventaja selectiva que tienen estas especies, las reservas de nitrógeno, la producción de bioluminiscencia, expresión de mecanismos de defensa, o bien, como competencia con otras especies fitoplanctónicas 1 . En muestras de floraciones algales en Costa Rica, hemos encontrado bacterias grandes intracelulares, de forma bacilar, principalmente dentro del dinoflagelado Prorocentrum micans. Esta relación podría asociarse a la toxigenicidad del alga 29 . En otros estudios 33 , 34 se han observado bacterias productoras de toxinas asociadas simbióticamente con dinoflagelados y se menciona que su toxigenicidad puede influenciar los focos de toxicidad algal por los niveles de asociación entre la bacteria y el alga. Recientes estudios han demostrado que las bacterias desempeñan una función muy importante en el control de las floraciones algales, regulando el impacto y la toxicidad producida por estas 35 . Actualmente ocurren cambios climáticos globales, algunos de ellos por la actividad humana. Por ejemplo, el aumento de la radiación ultravioleta modifica la composición de las comunidades de fitoplancton en los sistemas costeros y aumenta las FAN. Los grandes navíos del transporte marítimo internacional utilizan agua como lastre para estabilización; la succionan en grandes cantidades en diversas regiones y luego la descargan en nuestras costas. De esta manera diseminan las células vegetativas y las esporas de especies tóxicas pasan a formar parte de los sedimentos marinos en un nuevo hábitat, constituyen parte de la flora tóxica endémica en la zona 1 .
Los países con experiencia y recursos para afrontar las FAN tienen rigurosos planes de manejo y monitoreo de las floraciones algales para la vigilancia de la salud 2 , 17 . En Costa Rica este tipo de programas apenas comienzan a desarrollarse 36 . El 6 de marzo de 2001 37 se instituyó el decreto No. 20359 MAG-S, que crea la Comisión Interinstitucional para el Control de la Marea Roja en Costa Rica, como órgano asesor y consultivo, adscrito al MAG con el objetivo de detectar la presencia de microorganismos y sus toxinas. Periódicamente se monitorean las costas para identificar áreas de riesgo y determinar la magnitud de su extensión, con el fin de hacer una declaratoria oportuna de veda para la extracción, expendio y consumo de moluscos. Sin embargo, la falta de recursos hace que este tipo de iniciativas no funcione adecuadamente. Mientras tanto, el peligro potencial de intoxicaciones masivas por toxinas presentes en moluscos es muy alto, y nuestra población o los turistas no cuentan con información suficiente. Por otro lado, el personal responsable de los servicios de salud no está adecuadamente educado en el diagnóstico y manejo de este tipo de intoxicaciones.
Agradecimientos
Abstract
Justification and Objectives: The first cases of intoxication due to Harmful Algae Blooms (HAB) in Costa Rica were reported in 1990. However, towards the end of 1999 a drastic increase of poisoned people was observed, especially along our pacific coast. There is lack of information regarding the problems of HAB. Due to the impact of HAB on public health, local tourism and the ecosystem, it is necessary to describe toxic species and their toxins in order to apply adequate control and preventive measures.
Methods: Water samples were taken in various locations along the costarican pacific coast with the aim of detecting potentially toxic and harmful species of microalgae. Species identification was carried out morphologically by means of light and scanning electron microscopy. These findings were compared with current literature and the potential toxin of these microalgae was proposed as well as the methods of toxico-logical analysis and the clinical findings of those affected.
Results: Recently, an increase in the number of HAB producing microalgae species has been observed in Costa Rica. This study reports these findings together with ones from those of other authors related to HAB producing species in Costa Rica. In few algal bloom samples, large intracellular bacillary bacteria were found, mainly within the dinoflagellate Prorocentrum micans. This relation may be associated with the toxicity of the algae.
Discussion: It is believed that the increase in coastal zone pollution and the transportation of species by means of ships ballast water may be the cause of the appearance of these microalgaes. The presence of 26 dinoflagellates, 8 diatoms and 1 cyanobacteria, all potentially harmful in HAB events, was currently demonstrated along the pacific coast of Costa Rica. These microalgae are capable of producing toxins which may cause: paralysis, amnesia, diarrheia, and neurotoxicity poisonings, ciguatera and Tamandré fever. It is important that health personnel be knowledgeable regarding HAB events and to implement an effective monitoring and program control in Costa Rica in order to protect the population.
Referencias
1. Hallegraeff G.M., Anderson D.M., Cembella A.D. Manual of Harmful Marine Microalgae. Intergovernmental Oceanographic Commission (UNESCO). 1995, 565pp. [ Links ]
2. Sar E.; Ferrario M.E, Reguera B. Floraciones Nocivas en el Cono Sur Americano. Instituto Español de Oceanografía, Vigo, España, 2002, 311pp. [ Links ]
3. Vargas-Montero M., Freer E. Descripción morfológica y ultraestructural de floraciones algales nocivas en el Golfo de Nicoya, Costa Rica y su impacto en la salud. Rev Cost de Ciencias Médicas. 2002 ; 23 [ Links ]
4. John U., Quilliam M.A., Medlin L., Cembella A.. Spirolide production and photoperiod dependent growth of the marine dinoflagellate Ale-xandrium ostendeldii. Proccedings of Harmful Algae Blooms, Ninth Conference Tasmania, Australia. 2000, 234pp. [ Links ]
5. Karnovsky M.J. A formaldehyde-glutaraldehyde fixative of high osmolarity for use in electrón microscopy. Jour. of Cell Biol. 1965; 27:137A. [ Links ]
6. Hargraves P., Víquez R. The dinoflagellates red tide in Golfo de Nicoya, Costa Rica. Rev. Biol. Trop. 1981; 29(1):31-38. [ Links ]
7. Hargraves P., Víquez R. Spatial and temporal distribution of phyto-plankton in the Gulf of Nicoya, Costa Rica. Bull. Mar. Sci. 1985; 37:577-585. [ Links ]
8. Mata L., Abarca G., Marranghello L., Víquez R. Intoxicación paralítica por mariscos (IPM) por Spondylus calcifer contaminado con Pyrodinium bahamense, Costa Rica, 1989-1990. Rev. Biol.Trop.1990; 38: 129-136. [ Links ]
9. Whyte J. N., Haigh N., Ginther G., Keddy J. First record of blooms of Cochlodinium sp. (Gymnodiniales, Dinophyceae) causing mortality to aquacultured salmon on the west coast of Canada. Phycologia, 2001; 40: 298-304. [ Links ]
10. Fukuyo Y, Takano H, Chihara M. et al. Red Tide Organisms in Japan. Uchida, Japan, 1990. pp.405. [ Links ]
11. Gusmán H.M., Cortés J., Glynn P.W., Richmond R.H.. Coral mortality associated with dinoflagellate blooms in the eastern Pacific (Costa Rica and Panamá). Mar. Ecol. Prog. Ser. 1990; 60:209-303. [ Links ]
12. Víquez R., Hargraves P.Annual cycle potentially harmful dinoflagellates in the Golfo de Nicoya, Costa Rica. Bull Marine Sci 1995; 57: 467-475. [ Links ]
13. Vargas-Montero M., Freer E. First Report of Pyrodinium bahamense var. compressum and bahamense (Dynophyta: Peridinae) forming togheter a red tide at the Gulf of Nicoya, Costa Rica. Proccedings of the "4th International Conference on Molluscan Shellfish Safety", Santiago de Compostela, España, Junio 2002. [ Links ]
14. Morales A., Víquez R., Rodríguez K., Vargas M. Primer registro de una marea roja producida por Lingulodinium polyedrum (Gonyaulacales: Dinophyta) en Bahía Culebra, Golfo de Papagayo, Costa Rica. Rev. Biol.Tropl. 2001; Supl.49: 19-23. [ Links ]
15. Vargas-Montero M., Freer E. Harmful Algae blooms of toxigenic diatom Pseudo-Nitzschia (Bacillariophycea e) in the Gulf of Nicoya, Costa Rica. Rev. Biol. Trop. 2002. En prensa Volumen especial Grupo ANCA.
16. Vargas-Montero M., Freer E. Floraciones Algales Nocivas de Ciano-bacterias (Oscillatoriaceae) y dinoflagelados (Gymnodiniaceae) en el Golfo de Nicoya, Costa Rica. Rev. Biol. Trop. 2002. En prensa.
17. Anderson D.M., Andersen P., Bricelj V.M., Cullen J.J., Rensel J.E. Monitoring and management Strategies for Harmful Algal Blooms in Coastal Waters, APEC ·201-MR-01.1. Asia Pacific Economic Program, Singapore, and Interguvernamental Oceanographyc Commission Technical Series, Paris. 2001; No. 59,. 268 pp. [ Links ]
18. Cortés-Altamirano R. Las Mareas Rojas. A.G.T. Editor, S. A. México, D.F. 1998, 161pp. [ Links ]
19. Suárez B., Guzmán L. Mareas Rojas y Toxinas Marinas, Floraciones Algales Nocivas. Santiago de Chile, 1999, 77 pp. [ Links ]
20. Landsberg J. The Effects of Harmful Algae Blooms on Aquatic Organisms. En: Stickney R. Reviews in Fisheries Science. New York: Fisheries Science; 2002; 10:113-390. [ Links ]
21. Herderson R., Ritchie J.M., Strichartz G.R. The binding of labelled saxitoxin to the Sodium Channel in nerve membranes. J. Physiol. 1973; 235:783-804. [ Links ]
22. Murata M, Kumagai JS, Lee JS et a l. Isolation and structure of yessotoxin, a novel polyether compound implicated in diarrhetic shellfish poisoning. Tetrahedron. 1987;28:5869-5872. [ Links ]
23. Yasumoto T., Murata M., Oshima Y., Sano M., Matsumoto G.K., Clardy J. Diarrhetic Shellfish Toxins. Tetrahedron 1985; 41:1019-1025. [ Links ]
24. Yasumoto T., Murata M., Lee J.-S., Torigoe K... Polyether toxins produced by dinoflagellates. In Natori, S., K. Hashimoto & Y. Ueno (eds), Mycotoxins and Phycotoxins. Elsevier,Amsterdam 1989; 375-382. [ Links ]
25. Cembella A.; Shumway S.E, Lewis N.I. Anatomical distribution and spatio-temporal variation of paralytic shellfish toxin composition in two bivalve species from the Gulf of Maine. Journal of Shellfish Research. 1995; 12:389-403. [ Links ]
26. Bates S.S, Léger C., Satchwell M., Boyer G.L. The effects of iron on domoic acid production by Pseudo-Nitzschia multiseries. Proccedings of Harmful Algae Blooms, Ninth Conference Tasmania, Australia. 2000
27. Román Y., Alfonso A., Louzao C., de la Rosa L.A., Leira F., Vieites J.M., Vieites M., Ofuji K., Satake M., Yasumoto T., Botana L. Azaspi-racid-1, a potent, monopoptotic new phycotoxin with several cell targets. Cellular Signallin 2002; 14: 1-14. [ Links ]
28. Cembella A., Bauder A., MacKinnon S., Quilliam M., Richard D., Walter J., Windust A. Spirolides:Emerging Phycotoxins in Plankton and Shellfish from the North Atlantic. Proccedings of the "4 th International Conference on Molluscan Shellfish Safety", Santiago de Compostela, España, Junio 2002. [ Links ]
29. Vargas-Montero M. Análisis ultraestructural de algunas especies de dinoflagelados marinos presentes en el Golfo de Nicoya, Costa Rica. Tesis. Universidad Nacional, Heredia, Costa Rica, 2001, 101pp. [ Links ]
30. James K.J, Furey A., Satake M., Yasumoto T.. Azaspiracid poisoning (AZP): a new shellfish toxic syndrome in Europe. Proccedings of Harmful Algae Blooms, Ninth Conference Tasmania, Australia. 2000 [ Links ]
31. Andrew F., John D., Kane M.. Proccedings of Harmful Algae Blooms, Ninth Conference Tasmania 2000. [ Links ]
32. Vargas-Montero M., Freer E. Paralytic Shellfish Poisoning Outbreaks in Costa Rica. Proccedings of the "X th International Conference on Harmful Algae", St. Pete Beach, Florida, Octubre 2002. [ Links ]
33. Ishida Y. I., Yoshinaga M.C., Kim, Uchima A. Possibility of bacterial control of harmful algal blooms. En M.T. Martins, M.I.Z. Sato, J.M. Tiedje, L.C.N. Hagler, J. Progress in Microbial Ecology. S.B.M/ICO-ME, Brazil, 1997, pp.495-500. [ Links ]
34. Doucette G.J., Kodama M., Franca S., Gallacher S.. Bacterial interactions with harmful algal bloom. Species bloom ecology, toxigenesis, and cytology. NATO ASI Series, Vol. G41. Physiological Ecology of Harmful Algal Blooms. 1998 [ Links ]
35. Glibert P.M., Pitcher G. Global Ecology and Oceanography of harmful algal blooms. Science Plan. An International Programme sponsored by the Scientific Committee on Oceanic Research (SCOR) and the Inter-governmental Oceanographic Commission (UNESCO). 2001, 86 pp. [ Links ]
1 Centro de Investigación en Estructuras Microscópicas, CIEMic, Universidad de Costa Rica. Correspondencia: CIEMic, Ciudad de la Investigación, Universidad de Costa Rica, CP2060, Costa Rica. Fax: 207 3182.
E-mail: efreer@cariari.ucr.ac.cr
 All the contents of this journal, except where otherwise noted, is licensed under a Creative Commons Attribution License
All the contents of this journal, except where otherwise noted, is licensed under a Creative Commons Attribution License













