Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Costarricense
On-line version ISSN 0001-6002Print version ISSN 0001-6012
Acta méd. costarric vol.44 n.3 San José Sep. 2002
Descriptores: Diagnóstico; Prevención; Plasmodium falciparum; Plasmodium vivax; Plasmodiun ovale; Tratamiento; Resistencia medicamentosa; Nuevos antimaláricos.
Recibido: 20 de junio del 2002
Aceptado: 30 de julio del 2002
El inicio del control de vectores coincidió con el final de la construcción del Canal de Panamá en 1,914 y originó con el apoyo en 1,955 de la O.M.S. la campaña de fumigación con DDT, que produjo un descenso agudo de la malaria, en las naciones que aplicaron esa estrategia 15 , el abandono de esta condujo al mantenimiento del vector en muchos otros países. A finales de los años 50 se documenta en Asia y Sudamérica, la resistencia del Plasmodium a la cloroquina y en los setentaen Africa. 16 En la última década la resistencia del P. falciparum y el P. vivax ha sido creciente a los antimaláricos habituales, como los derivados de las quinolinas. 16 , 17 Estos miles de nuevos casos con resistencia medicamentosa detectados a nivel mundial son el mayor reto a vencer en el desarrollo de un programa efectivo de control contra dicha enfermedad, en países cuyas economías no permiten enfrentar los costos de los nuevos y efectivos medicamentos. Se estima que los costos directos e indirectos de la malaria en el continente negro superan los 3,600 millones de dólares al año 7 . Costa Rica tiene un área malárica de 35,436 Km 2 , equivalente al 69.5% del territorio nacional, 5 con características de endemia desde 1992. Las dos especies frecuentes en el país son el P. vivax y el P. ovale.
Clasificación de la Malaria
La malaria clínicamente se clasifica en aguda, crónica y grave: 1 , 4 , 5
- 1. Aguda: cuadro febril de inicio reciente con tendencia a la periodicidad en individuos sanos y no inmunes, asociando escalofríos, diaforesis profusa, aumento rápido de la temperatura corporal con un descenso periódico; acompañado de cefalea intensa, náuseas y vómitos. La duración del paroxismo es de 10 a 12 horas.
Se presenta diariamente y luego cada 48 a 52 horas según la especie de Plasmodium (fiebre terciana, cuartana).
2. Crónica: como resultado de la infección repetida en individuos semi-inmunes. Presentan anemia severa, baja parasitemia (<1%), hepatoesplenomegalia, deterioro general del organismo. La fiebre es poco usual.
3. Grave: asociada al P. falciparum, puede mostrar un cuadro clínico y variado que incluye fiebre, escalofríos y cefalea. Es el responsable de la mayoría de las complicaciones derivadas de esta enfermedad.
El edema pulmonar se presenta con parasitemias de P. falciparum mayores al 5% de los eritrocitos circulantes infectados. Su causa hemodinámica no es cardiogénica, pero las presiones normales arteriales en los capilares pulmonares y la elevación de TNF- sugiere una patogénesis similar a la vista en la septicemia bacteriana 28 . La infección por P. falciparum en niños vómitos, dolor abdominal y diarrea, como resultado de la lesión de la microvasculatura gastrointestinal con esfacelación de la mucosa causando sangrado digestivo 17 .
Malaria Grave o Complicada
Suele afectar con mayor frecuencia a niños preescolares y mujeres embarazadas. Su inicio es súbito o puede ocurrir posterior a un cuadro benigno sin complicaciones que no recibió tratamiento oportuno.
Puede evolucionar a defectos de coagulación, hemoglobinuria, hemorragias espontáneas, anemia, ictericia, taquicardia, diaforesis, hepatoesplenomegalia, insuficiencia renal, encefalopatía aguda, trastornos hidroelectrolíticos y ácido-base, edema pulmonar, choque, coma y muerte 4-5 .
La complicación más grave de la infección por P. falciparum es la malaria cerebral por su alta mortalidad. El paciente convulsiona debido al bloqueo capilar por eritrocitos parasitados, hipoglucemia y los efectos de citocinas como el TNF- , 28 entra en coma profundo y muere. Se presenta en un 2.5% de los pacientes 3 y del 15-50% fallecen. 3 , 21 , 22 , 23 , 24 , 25 . De los sobrevivientes, el 5-10% quedan incapacitados por daño cerebral 26 , 2 .
El paciente preescolar es el más afectado, aunque el adulto suele presentar un cuadro sintomatológico más prolongado (Cuadro 1 ). Las secuelas neurológicas suelen observarse en más del 10% de los pacientes pediátricos, pero su proceso patológico y la resolución del estado de coma es de un máximo de 2 días, en tanto que en el adulto, el cuadro grave dura hasta 7 días y la resolución del coma tarda hasta 4 días. Las principales complicaciones de la malaria, suelen estar asociadas a estos cuadros graves de la enfermedad.

El medio más directo es el frotis teñido con Giemsa . Este permite observar las formas anulares o jóvenes del parásito, que circulan libres en la sangre periférica. Las formas maduras; trofozoítos pigmentados y esquizontes, del P. falciparum son las únicas que se adhieren al endotelio de las vénulas 31 , por lo que la observación de gametocitos (formas sexuales) es necesaria para su diagnóstico. Estos duran de 7 a 10 días para desarrollarse, por lo que no se encuentran en sangre periférica al inicio de los síntomas.
Casi el 5% de las personas con malaria tiene más de un tipo de parásito 28 , siendo el P. vivax y el P. falciparum las dos especies más extendidas, las infecciones combinadas de ambos están reportadas en la literatura 19 , 32 . La tinción de Giemsa permite observar las manchas de Schüffner típicas de esta infección, principalmente en aquellos casos de infección por P. Vivax 28 . La tinción fluorescente con naranja de acridina, detecta parásitos en sangre periférica. La menor densidad de los eritrocitos parasitados permite; mediante centrifugación, localizarlos en la parte superior de la capa eritrocítica. El examen dura de 30 a 40 segundos, siendo un método más rápido que el frotis grueso 2 .
Las sondas de DNA permiten el diagnóstico temprano del parásito en el mosquito, son específicas de especies de Plasmodium 33 pero su sensibilidad es muy limitada requiriendo de 1000 esporozoitos por mosquito para obtener una detección confiable 34 . La prueba de ELISA es útil de manera retrospectiva, en personas no inmunes tratadas en forma empírica, sin un diagnóstico microscópico 28 . Los anticuerpos monoclonales contra el Plasmodium se utilizan contra la proteína circumsporozoito 35 , 36 , 37 . Su valor es limitado al no detectar los esporozoitos inmaduros presentes en el oocisto 37 . En áreas endémicas, la mayoría de las personas tienen títulos de anticuerpos de infecciones previas, se hayan ó no infectado en fechas recientes y se requieren 3 a 4 semanas para elevar el título de anticuerpo al valor diagnóstico, en tanto que la decisión para el tratamiento se debe tomar en las primeras horas de la valoración.
La PCR no difiere en cuanto a especificidad con el ELISA, pero es relativamente más sensible que ésta en la detección de P. falciparum y P. vivax 33 .
Criterios de hospitalización 5
Tratamiento de la malaria
El tratamiento basado en los hallazgos clínicos, hace inevitable su aplicación a sujetos sanos, principalmente niños 18 , aumentando los costos, el riesgo de efectos adversos y la aparición de cepas parásitas resistentes a medicamentos 6 .
La parasitemia establece el índice de severidad de la infección y permite valorar la respuesta al tratamiento una vez finalizado 30 . El tratamiento de la malaria no complicada tiene tres objetivos 1) salvar la vida, 2) reducir la posibilidad de desarrollar complicaciones 50 y 3) lograr una rápida y sostenida eliminación del parásito de la sangre y de sus síntomas mediante una sola dosis o con un ciclo corto de tratamiento 51 . El tratamiento de elección cuando la etiología es por P. vivax, P. ovale , P. malariae o P. falciparum es la cloroquina ( Cuadro 2 ) 52 . En el P. falciparu resistente a ésta, la combinación de sulfato de quinina con tetraciclina es el tratamiento más efectivo 63 . Otras posibles elecciones incluyen quinidina, 24 , 63 quinina, pirimetamina-sulfadoxina y mefloquina. También se ha utilizado la pirimetamina-sulfadoxina como tratamiento de primera elección 52 ó en conjunto con cloroquina 53 . En pacientes en coma, el tratamiento más seguro, dada su baja cardio-toxicidad a la dosis recomendada, es la quinidina intravenosa 28 pero debe vigilarse sus efectos cardiacos como la prolongación del segmento QT 63 .
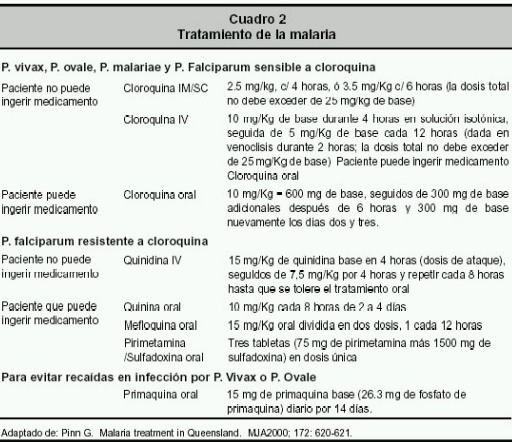
En Tailandia, Birmania y Camboya, el P. falciparum ha desarrollado una alta resistencia a la cloroquina, la pirimetamina/sulfadoxina, la quinina y a la mefloquina 54 .
Para evitar las recaídas por P. vivax ó P. ovale, la primaquina es el medicamento de elección, previa valoración de deficiencia de deshidrogenasa de glucosa-6-fosfato para evitar la hemólisis 55 .
Los medicamentos antimaláricos dihidroartemisinina, artesunato, artemether y arteether son derivados de la artemisinina; el principio activo aislado de la planta Artemisia annu a. Tienen acción gametocitocida y se utilizan en los casos de parásitos resistentes a la cloroquina 50 . Alivian los síntomas, reducen la parasitemia, aumentan las posibilidades de curación, de sobrevivencia y disminuyen los reservorios humanos 58 ,60 .
El artesunato, cuya corta vida reduce la posibilidad de desarrollar resistencia por parte del parásito, no se ha incluido en los esquemas de tratamiento, porque se han demostrado efectos adversos como disfunción cerebral temporal 61 .
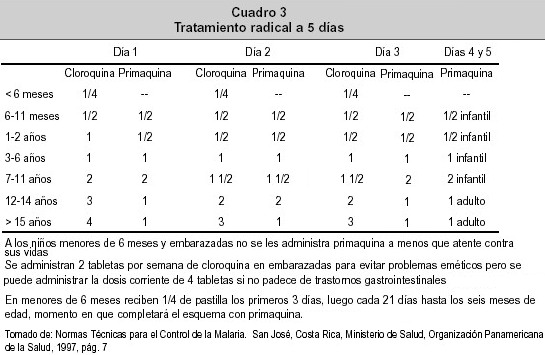
Los esquemas monoterapéuticos han dado paso a terapias combinadas de gran efectividad y que evitan el rápido desarrollo de resistencia. La mefloquina; una metanol-quinolina, fue introducida al mercado cuando los parásitos ya habían desarrollado resistencia a la quinina 54 . Al combinarlacon artesunato 56 , 57 produce una rápida reducción de la parasitemia.El tratamiento radical a 5 días ( Cuadro 3 ); un esquema combinado, es el utilizado en Costa Rica, administrándose a todo paciente enfermo, presuntamente enfermo y a los convivientes y contactos sospechosos clínica y/o epidemiológicamente de padecer malaria 5 . La quinina y la quinidina estimulan directamente la liberación de insulina de las células pancreáticas beta lo cual representa un riesgo extra de hipoglicemia; una causa común de coma. Por ello, la venoclisis de glucosa es una medida auxiliar. En los casos de malaria cerebral están contraindicados los corticoesteroides; como la dexametasona y la hidrocortisona, debido la supresión de la inmunidad del huésped a la infección a pesar de que pueden reducir los efectos nocivos del edema cerebral 5 .
Prevención de la malaria
En áreas endémicas la exposición repetida al parásito permite desarrollar una inmunidad natural a la malaria. En estas zonas las mujeres embarazadas tienen un mayor riesgo de infección por P. falciparum, disminuyendo en los embarazos subsecuentes, debido a la adquisición de anticuerpos 13 ,31 ,38 .
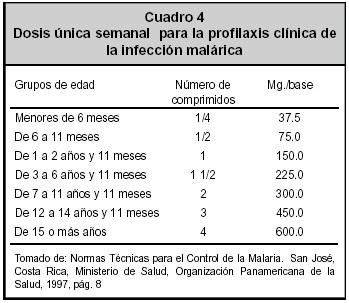
La quimioprofilaxis; consiste en la reducción del contacto con el vector a través de la administración de fármacos y el uso de repelentes de insectos para que personas no inmunes, expuestas a la malaria no la adquieran. Los fármacos deben ser seguros para las personas sanas y tener una vida media sérica prolongada, para que su administración sea poco frecuente. Ambos criterios hacen de la cloroquina el medicamento de elección en áreas sin P. falciparum resistente a la misma y el único seguro para embarazadas. En Costa Rica el esquema profiláctico está dirigido a aquellas personas que por motivo de viaje deben ingresar a zonas endémicas. Es importante explicar al usuario que este tratamiento solo previene la intensidad de la afección, ya que aún tomando este tratamiento, la enfermedad puede ser adquirida. El esquema preventivo está expuesto en la Cuadro 4
El desarrollo de la vacuna para la malaria, se han centrado en el parásito, su crecimiento y su reproducción 43 , 44 . Las tres etapas del parásito en el hombre son antigénicamente diferentes, por lo cual la vacuna debe incluir al menos tres antígenos del parásito (esporozoito, merozoito y gametocito) 28 .
En el esporozoíto se expresan tres moléculas: la proteína circumsporozoíto, 45 , 46 la proteína anónima relacionada a tromboespondina 47 y la proteína rica en treonina y asparagina del esporozoíto 48 . Las dos primeras son necesarias en el proceso infectante del parásito y su multiplicación, haciéndolas candidatas al desarrollo de la vacuna 49 . La vacuna desarrollada por el científico colombiano Manuel Elkin Patarroyo, incluye cuatro moléculas aisladas del parásito y ha mostrado índices de eficacia que oscilan entre un 60% en Ecuador a un 35% en Brasil
Control de Vectores
Referencias
2. Yang H M. Malaria transmission model for different levels of acquired immunity and temperature-dependent parameters (vector). Rev Saúde Pública 2000; 34:223-231. [ Links ]
3. Chandar V, Mehta S R, Sharma P D, Sarkar P K et al. Falciparum malaria. Indian J Pediatr 1989; 56:365-369 [ Links ]
4. Croft A. Malaria: prevention in travellers. BJM 2000; 321:154-160. [ Links ]
5. WHO Expert Committee on Malaria: twentieth report. World Health Organ Tech Rep Ser 2000. [ Links ]
6. Flessa S. Decision support for malaria-control programmes: a system dynamics model. Health Care Manag Sci 1999; 2:181-191. [ Links ]
7. Wickramasinghe S N, Abdalla S H. Blood and bone marrow changes in malaria. Bailliere’s Clinical Haematology 2000; 13:277-299. [ Links ]
8. Sharma A, Mishra N C. Inhibition of a protein tyrosine kinase activity in P. falciparum by chloroquine. Indian J Biochem Biophys 1999; 36:299-304. [ Links ]
9. World Health Organization. Malaria: waiver by Uganda of taxes and tariffs on insecticide-treated nets. Wkly Epidemiol Rec 2000; 75:233-240. [ Links ]
10. Graves P, Gelband H. Vaccines for preventing malaria review. Cochrane Database Syst Rev 2000. [ Links ]
11. World Health Organization. World malaria situation in 1994. Wkly Epidemiol Rec 1997; 69:309-314. [ Links ]
12. Plebanski M, Hill AV S. The immunology of malaria infection. Curr Opin Immunol 2000; 12:437-441. [ Links ]
13. Nosten F, van Vugt M, Price R, Luxemburger C, Thway K L, Brockman A et al. Effects of artesunate-mefloquine combination on incidence of P. falciparum malaria and mefloquine resistance in western Thailand: a prospective study. Lancet 2000; 356:297-302. [ Links ]
14. Baird J K. Resurgent malaria at the millenium: control strategies in crisis. Drugs 2000; 59:719-743. [ Links ]
15. Hastings I M, D’Alessandro U. Modelling a predictable disaster: the rise and spread of drug-resistance malaria. Parasitology Today 2000; 16:340-347. [ Links ]
16. Kulkarni A V, Kasturi L, Amin A, Mashankar V. Therapy and drug resistance in malaria. Indian J Pediatr 2000; 67:33-35. [ Links ]
17. Normas Técnicas para el Control de la Malaria. San José, Costa Rica, Ministerio de Salud, Organización Panamericana de la Salud, 1997.
18. Memoria Anual 99. País sano con un sistema de salud avanzado. Ministerio de salud. San José, Costa Rica, 1999; 21-22.
19. Krudsood S, Wilairatana P, Mason D P, Treeprasertsuk S, Singhasivanon P, Looareesuwan S. Hidden P. falciparum infections. Southeast Asian J of Trop Med Public Health 1999; 30:623-624. [ Links ]
20. Cahill J D. Malaria with a positive "monospot" test. J R Soc Med 2000; 93:336. [ Links ]
21. Agarwal V K, Agarwal S, Pathak T. Splenic infarct in falciparum malaria. Indian Pediatr 1997; 34:1050-0151. [ Links ]
22. Krogstad D J. Malaria. En: Cecil, Tratado de medicina interna, México, Interamericana-McGraw Hill, 1994:2292-2296. [ Links ]
23. Gbadoé A D. À propos des céphalées dans le paludisme. Arch Pediatr 2000; 7:569. [ Links ]
24. Warrell D A, Looareesuwan S, Warrell M J, Kasemsarn P, Intaraprasert R, Bunnag D et al. Dexamethasone proves deleterious in cerebral malaria. A double-blind trial in 100 comatose patients. N Eng J Med 1982; 306:31-39. [ Links ]
25. Looareesuwan S, Warrell D A, White N J, Sutharasamai P, Chanthavanich P, Sundaravej K et al. Do patients with cerebral malaria have cerebral oedema? A computed tomography study. Lancet 1983; 1:434-437. [ Links ]
26. Philips R E, Warrell D A, White N J, Looareesuwan S, Karbwang J. Intravenous quinidina for the treatment of severe falciparum malaria. Clinical and pharmacokinetic studies. N Eng J Med 1985; 12:1273-1278. [ Links ]
27. White N J, Looareesuwan S, Warrell D A, Warrell M J, Bunnag D, Harinasuta T. Quinine pharmacokinetics and toxicity in cerebral and uncomplicated falciparum malaria. Am J Med 1982; 73:564-572. [ Links ]
28. Valecha N, Srivastava A, Sharma V P. Rational approach to the treatment of malaria. Natl Med J India 1994; 7:281-287. [ Links ]
29. Warrell D A. Cerebral malaria: clinical features, pathophysiology and treatment. Ann Trop Med Parasitol 1997; 91:875-884. [ Links ]
30. Duffy P E, Fried M. Malaria during pregnancy: parasites, antibodies and chondroitin sulphate A. Biochem Soc Trans 1999; 27:478-482. [ Links ]
31. McKenzie F E, Bossert W H. Mixed-species Plasmodium infections of humans. Am J Trop Med Hyg 1999; 61:367-374. [ Links ]
32. Vythilingam I, Nitiavathy K, Yi P, Hugo B, Singh B, Wirtz R A et al. A Highly sensitive, nested polymerase chain reaction based method using simple DNA extraction to detect malaria sporozoites in mosquitos. Southeast Asian J Trop Med Public Health 1999; 30:631-635. [ Links ]
33. Delves C J, Goman M, Ridley R G et al. Identification of Plasmodium falciparum infected mosquitos using a probe containing repetitive DNA. Mol Biochem Parasitol 1989; 32:105-102. [ Links ]
34. Zabala F, Gwards R W, Collins F H, Nussenzweig R S, Nussenzweig V. Monoclonal antibodies to circumsporozoite proteins identify the species of malaria parasite in infected mosquitos. Nature 1982; 299:737-8. [ Links ]
35. Burkot T R, Williams J L, Schneider I. Identification of Plasmodium falciparum infected mosquitos by a double antibody enzyme-linked immunosorbent assay. Am J Trop Med Hyg 1984; 33:783-8. [ Links ]
36. Beier J C, Perkin PV, Wirtz RA, Whirtmire RE, Magumbi M, Hochmeyer M, Field W T. Evaluation of an enzymes linked immunosorbent assay (ELISA) for Plasmodium falciparum detection in anopheline mosquitos from Kenya. Am J Trop Med Hyg 1987; 17:2135-6. [ Links ]
37. Stephens J K, Phanart K, Rooney W, Barnish G. A comparison of three malaria diagnostic tests, under field conditions in northwest Thailand. Southeast Asian J Trop Med Public Health 1999; 30:625-630. [ Links ]
38. Manson-Bahr P, Bell D R. Manson´s Tropical Diseases. 19 th edn. 1987; 26-29. [ Links ]
39. McIntosh H M, Olliaro P. Artemisinin derivates for treating severe malaria. Cochrane Database Syst Rev 2000. [ Links ]
40. McIntosh H M, Olliaro P. Artemisinin derivates for treating uncomplicated malaria. Cochrane Database Syst Rev 2000. [ Links ]
41. McIntosh H M. Chloroquine or amodiaquine combined with sulfadoxina-pyrimethamine for treating uncomplicated malaria. Cochrane Database Syst Rev 2000. [ Links ]
42. Drug Information Handbook. Pocket 1999-2000. Lacy CF, Armstrong L L, Goldman M P, Lance LL. Lexi-Comp, Inc 1999, USA. [ Links ]
43. Nosten F, Luxemburger C, ter Kuile F et al. Treatment of multidrug-resistance Plasmodium falciparum malaria with 3-day artesunate-mefloquine combination. J Infect Dis 1994; 170:971-977. [ Links ]
44. Wernsdorfer W H. Epidemiology of drug resistance in malaria. Acta Tropica 1994; 56:143-56. [ Links ]
45. Pinn G. Malaria treatment in Queensland. Med J Aust 2000; 172: 620-621. [ Links ]
46. White N J. Drug resistance in malaria. Br Med Bull 1998; 54:703-715. [ Links ]
47. Hien T, White N J. Qinghaosu. Lancet 1993; 341:603-608. [ Links ]
48. Brewer T G, Peggins J O, Grate S J, Petras J M, Levine B S, Weina P J et al. Neurotoxicity in animals due to arteether and artemether. Trans R Soc Trop Med Hyg 1994; 88:33-36. [ Links ]
49. Wongsrichanalai C, Thimasarn K, Sirichaisinthop J. Antimalarial drug combination policy: a caveat. Lancet 2000; 355:2245-2247. [ Links ]
50. White N J, Nosten F, Looareesuwan S et al. Averting a malaria disaster. Lancet 1999; 353:1965-1967. [ Links ]
51. Prasad K, Garner P. Steroids for treating cerebral malaria. Cochrane Database Syst Rev 2000. [ Links ]
52. Snow R W, Craig M, Deichmann U, Marsh K. Estimating mortality, morbidity and disability due to malaria among Africa’s non-pregnant population. Bull World Health Organ 1999; 77:624-640. [ Links ]
53. van Vugt M, White N J. The treatment of chloroquine-resistant malaria. Trop Doct 1999; 29:176-9. [ Links ]
54. Croft A M J, Garner P. Mefloquine for preventing malaria in non-immune adult travelers. Cochrane Database Syst Rev 2000. [ Links ]
55. Coates C J. A mosquito transformed. Nature 2000; 405:900-901. [ Links ]
56. Birmingham K. Industry outlines its perspective on new third-world vaccine development. Nat Med 2000; 6:723-724 [ Links ]
57. Dame J B, Williams J L, McCutchan T F, Weber J L, Wirtz R A, Hockmeyer W T et al. Structure of the gene encoding the immunodominant surface antigen on the sporozoite of the human malaria parasite Plasmodium falciparum. Science 1984; 225:593-599. [ Links ]
58. Enea V,Arnot D, Schmidt E C, Cochrane A, Gwadz R, Nussenzweig R S. Circumsporozoite gene of Plasmodium cynomolgi: cDNA cloning and expression of the repetitive circumsporozoite epitope. Proc Natl Acad Sci USA1984; 81:7520-7524. [ Links ]
59. Robson K J, May J R, Jennings M W, Harris T H, Marsh K, Newbold C I et al. A highly conserved amino-acid sequence in thrombospondin, properdin, and in proteins from sporozoites and blood stages of a human malaria parasite. Nature 1988; 335:79-82. [ Links ]
60. Fidock D A, Sallenave-Sales S, Sherwood J A, Gachihi G S, De Fatima Ferreira-Da-Cruz M, Thomas A W et al. Conservation of the Plasmodium falciparum sporozoite surface protein gene, STARP, in field isolates and distinct species of Plasmodium. Mol Biochem Parasitol 1994; 67:255-267. [ Links ]
61. Ménard R. The journey of the malaria sporozoite through its host: two parasite proteins lead the way. Microbes Infec 2000; 2:633-642. [ Links ]
62. Lengeler C. Insecticide treated bednets and curtains for preventing malaria. Cochrane Database Syst Rev 2000. [ Links ]
1 Hospital Nacional de Niños, "Dr. Carlos Sáenz Herrera" Caja Costarricense de Seguro Social.
2 Intituto Nacional de Seguros.
Correspondencia: Dr. José I. Castro Sancho, Apartado Postal 31-1260
correo electrónico: joeignaz@yahoo.com
 All the contents of this journal, except where otherwise noted, is licensed under a Creative Commons Attribution License
All the contents of this journal, except where otherwise noted, is licensed under a Creative Commons Attribution License













