Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Médica Costarricense
On-line version ISSN 0001-6002Print version ISSN 0001-6012
Acta méd. costarric vol.43 n.1 San José Mar. 2001
Resumen
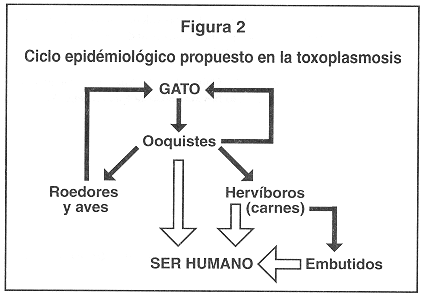
Los hallazgos más recientes en cuanto a la trasmisión del Toxoplasma gondii en Costa Rica nos indican que la ingestión de carne poco cocida, así como de algunos embutidos, en donde se ha encontrado el parásito en forma viable, son mecanismos de infección importante. Estos aspectos han hecho variar un poco la concepción anterior de que la ingestión de ooquistes del parásito era la principal, sino la única, vía de infección en nuestro país. Por ello se propone un nuevo ciclo de trasmisión para este parásito, comparándolo con el previamente establecido. Este nuevo patrón epidemiológico establece mayores posibilidades de infección con este parásito para los costarricenses.
El Toxoplasma gondii es un parásito de amplia distribución geográfica con prevalencias muy elevadas particularmente en
países de climas tropicales. En Costa Rica tal prevalencia en la población general es de 80-85% en personas de 30 años o
más.1,2
La transmisión del T. gondii se realiza por tres mecanismos principales:
ooquistes 1.
b) Un segundo mecanismo de infección es a través de la ingestión de quistes tisulares presente en las carnes 6,7 especialmente de bovinos y porcinos.8 Este mecanismo es reconocido como la principal vía de infección particularmente en países desarrollados. Prevalencias de anticuerpos de 12 a 60% en ganado vacuno y de 26 a 78% en ganado porcino han sido demostradas en diferentes países de América Latina, tales como Argentina, Brazil y Colombia. 9,10
c) La adquisición del parásito vía transplacentaria es un tercer mecanismo de infección, de enorme importancia médica11 demostrado en Costa Rica12 desde hace mucho tiempo, pero que por su naturaleza no va a presentar cambio alguno importante.
Inicialmente se demostró la presencia de anticuerpos contra T. gondii en ganado vacuno y porcino13 utilizando la técnica del Carbono Inmunoensayo (CIA)14 encontrándose una positividad de 12.4% y 26% respectivamente.
Un estudio serológico posterior utilizando las técnicas de inmunofluorescencia indirecta (IFA) y el ensayo de la enzima inmunoconjugada (ELISA) demostró una prevalencia de 34.4% en vacunos y 43.8% en ganado porcino2 (Tabla l).
| GANADO | NºSUEROS | POSIT.% | METODO | REF. |
| Bovino | 209 | 12.4 | CIA | Rodríguez et al.1990,13 |
| | 601 | 34.4 | IFA | Arias, et al. 199416 |
| Porcino | 300 | 26 | CIA | Torres et al. 199118 |
| | 496 | 43.8 | IFA | Arias et al. 19942 |
Utilizando un método biológico publicado posteriormente15 se procedió a determinar la presencia de Toxoplasma en distintos órganos y cortes de res16 . En este caso se estudiaron 10 muestras (199g) de distintos cortes de res consumidos en el país tales como posta, lomito, falda y de distintos órganos como hígado, corazón y pulmones.
La positividad varió de 30% en posta de res a 50% en hígado y algunos cortes fueron negativos. Un estudio posterior demostró una positividad de 20% en posta de cerdo17.
Por cuanto este parásito muere cuando la carne es procesada por cocción, curetaje y salteado, su detección en carnes no procesadas, no necesariamente tiene significancia epidemiológica. Por esta razón se estudió también la presencia de quistes de Toxoplasma en embutidos de producción casera y de ingestión usual en nuestro país: salchichas, salchichón, queso de cerdo y mortadela, demostrándose un 40% de positividad en salchichas y un 20% en salchichón; los embutidos restantes fueron negativos17.
Los resultados obtenidos, especialmente en lo referente a embutidos, son de relevancia epidemiológica, ya que el consumo de este tipo de productos cárnicos en nuestro país es de 12 g promedio por persona, siendo mayor en el área urbana (15 g) que en la rural (10 g)17. Además las salchichas y el salchichón, que resultaron positivos en este estudio, son consumidas con bastante frecuencia en el área urbana. Estos embutidos son ingeridos en muchos casos sin cocinar, lo que aumenta la posibilidad de trasmisión del parásito.
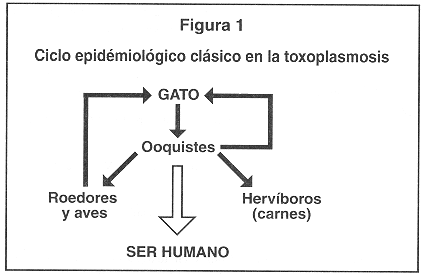
De acuerdo con las observaciones anteriores se puede establecer que el ciclo clásico epidemiológico conocido para la toxoplasmosis en Costa Rica al inicio de los años ochenta (Figura 1), ha cambiado considerablemente al ciclo que se presenta en la Figura 2 en donde la ingesta de carnes y embutidos poco cocinados cobra especial importancia.
Agradecimiento
Este trabajo se realizó con la ayuda del proyecto de investigación Nº 803-97-264 de la Vicerrectoría de Investigación de la Universidad de Costa Rica.
Abstract
Recent findings relating to the Toxoplasma gondii transmission in Costa Rica, show us that raw bovine or pork meat sausage ingestion is very important as an infection mechanism route.
Therefore the tradicional model where oocysts ingestion has been considered the principal or the only infection route, has changed. In fact a new tranmission model for this parasitosis where oocyst and cyst ingestion are possible is suggested.
Referencias
1. Frenkel J, Ruiz A. Human toxoplasmosis and cat contact in Costa Rica. Am J Trop Med Hyg 1980; 29:1167-1180. [ Links ]
2. Arias ML, Reyes L, Chinchilla M, Linder E. Seroepidemiology of Toxoplasma gondii (Apicomplexa) in meat producing animals in Costa Rica. Rev Biol Trop 1994; 42:15-20. [ Links ]
3. Wallace, GD. Serologic and epidemiologic observations on toxoplasmosis on three Pacific atolls. Am J Epid 1969; 90:103-111. [ Links ]
4. Barbier D, Ancelle T, Martin-Bouyer G. Seroepidemiological survey of toxoplasmosis in La Guadeloupe French West Indies. Am J Trop Med Hyg 1983; 32:935-942. [ Links ]
5. Ruiz A, Frenkel JK, Cerdas L. Isolation of Toxoplasma from soil. J Parasitol 1973; 59:204-206. [ Links ]
6. Feldman HA, Miller LT. Seroepidemiological study of toxoplasmosis prevalence. Am J Trop Med Hyg 1956; 64:320-335. [ Links ]
7. Walls KW, Kagan LG, Tumer A. Studies on the prevalence of antibodies to Toxoplasma gondii in US Military Recruits. Am J Epidemiol 1967; 85:87-92. [ Links ]
8. Jacobs L & Frenkel J K. Toxoplasmosis. p. 167-181. In Parasitic Zoonosis, C.R.C., Florida. 1970. [ Links ]
9. Dubey JP. A review of Toxoplasmosis in pigs. Vet Parasitol 1986; 19:181-223. [ Links ]
10. Dubey JP. A review of toxoplasmosis in cattle. Vet Parasitol 1986; 22:177-202. [ Links ]
11. Desmonts G, Couvreur J. Congenital toxoplasmosis: a prospective study of 378 pregnancies. New Engl J Med 1974; 290:1110-1116. [ Links ]
12. Ruiz A, Flores M, Kotcher E. The prevalence of Toxoplasma antibodies in Costa Rican postpartum women and their neonates. Am J Obst & Ginec 1966; 95:817-819. [ Links ]
13. Rodríguez MR, Reyes L, Chinchilla M. Análisis serológico por Toxoplasma gondii en ganado bovino de Costa Rica. Cienc Vet 1990; 12:17-19. [ Links ]
14. Chinchilla M, Reyes L, Guerrero OM, Hernández F. Specificity of the carbon immunoassay (CIA) test for the diagnosis of Toxoplasma infections. Vet Parasitol 1992; 44:315-320. [ Links ]
15. Chinchilla M, Reyes L, Guerrero OM, Abrahams E. Método sencillo para determinar la presencia de Toxoplasma gondii (Eucoccidia: Sarcocystidae) en carnes. Rev Biol. Trop 1997 445:1559-1561. [ Links ]
16. Arias ML, Chinchilla M, Reyes L, Sabah J, Guerrero OM. Determination of Toxoplasma gondii in several organs of cattle by carbon immunoassay (CIA) testing. Vet Parasitol 1994; 133-136. [ Links ]
17. Madrigal MA, Delgado MM, Reyes L, Chinchilla M. Determinación de Toxoplasma gondii en productos cárnicos de cerdos de ingestión usual en Costa Rica. Parasitol al Día 1996; 20:109-112. [ Links ]
18. Castro G, Meza N, Monge R, Rodríguez N, Rojas K. Primera encuesta nacional sobre consumo aparente de alimentos. Ministerio de Salud, San José, Costa Rica. 1991 [ Links ]
19. Torres AL, Chinchilla M, Reyes L. Anticuerpos contra Toxoplasma gondii en cerdos de Costa Rica: importancia epidemiológica. Rev Lat Amer Microbiol 1991; 33:129-133. [ Links ]
1 . Centro de Investigación en Enfermedades Tropicales (CIET), Facultad de Microbiología, Universidad de Costa Rica.
Correspondencia: Misael Chinchilla Carmona, Centro de Investigación en Enfermedades Tropicales (CIET) Facultad de Microbiología, Departamento de Parasitología, Universidad de Costa Rica.














