Introduction
La caries dental y las enfermedades infecciosas en la cavidad bucal son producidas por microorganismos, lo cual conlleva a problemas de salud que afectan a la población en general1. Se define a la caries dental como un desarrollo patológico localizado que ocasiona el reblandecimiento del tejido dental de forma irreversible2, asociado al desequilibrio del metabolismo bacteriano3 donde el microorganismo obtiene energía de los alimentos ingeridos, descomponiendo en una amplia gama de carbohidratos al presentar flexibilidad genética1, 2. Otros elementos que utiliza son la fructosa, galactosa, maltosa, almidón y sacarosa, formados por monosacáridos simples, fructosa y glucosa2, que la bacteria descompone convirtiéndolos en subproductos, ácido láctico y etanol que acidifica la boca4, y a los subproductos ácidos producidos por la fermentación de los carbohidratos consumidos en la dieta e higiene5,6, desarrollando la presencia de caries dental y con ello la disminución de la calidad de vida de quien la presenta7.
La lesión cariosa es una de las enfermedades multifactoriales más prevalente y común en los seres humanos, de tal forma que uno de los factores que desarrollan esta enfermedad son los microorganismos, y parte de ellos es el Streptococcus mutans, que se presenta por una ruptura en el ecosistema bucal, pero al probar con estas sustancias lo que se pretende es encontrar un componente natural que permita alcanzar una armonización en este ecosistema, sin afectar otros elementos, y con esto conseguir que los procesos de caries dental se detengan.
La fitoterapia asocia los compuestos fenólicos presentes en diferentes frutos rojos8,9 con efectos antioxidantes, antimicrobianos y antiadhesivos10,11, y se emplea como agente coadyuvante químico el gluconato de clorhexidina12, con limitaciones con respecto a la pigmentación asociada a largos períodos de uso13 y resistencia que el microorganismo desarrolla14.
El mortiño, (Vaccinium floribundum), conocido como agraz o arándano, pertenece a la familia Ericaceae, es una fruta nativa del Ecuador, llamada también uva de monte, que se encuentra ubicada en los páramos ecuatorianos. Sus propiedades alimenticias se encuentran asociadas a la presencia de minerales, vitaminas de complejo B, C, antioxidantes relacionados con la presencia de antocianinas como cianidina y delfinidina, también metabolitos secundarios encargados de su actividad antioxidante con efectos antiproliferativos y cardioprotectores15,16, lo que le convierte en un fruto ideal en industrias, campo médico y culinario15,17. El capulí, (Prunus serótina capuli spp (Cav) Mc. Vaug Cav), pertenece a la familia de las Rosaceae; probablemente originario de México, comercializado en mercados ecuatorianos, su fruta es de forma esférica de 1.5-2 cm de diámetro, de sabor agridulce con cáscara rojo oscuro, de textura firme y su pulpa verde pálido, empleado como alimento en la creación de bebidas y helados18. Presenta actividad antibacteriana y antioxidante con efectos sobre inflamación respiratoria o gastrointestinal19. Entre los compuestos fenólicos presentes en esta fruta están flavonoides y taninos, donde se destacan antocianinas cianuro-3-glucósido y cianuro- 3-rutinosido con gran capacidad antioxidante20,21.
Si bien de forma fisiológica, en la superficie de los dientes se produce una fina película o biofilm22,23 dentario sobre la cual se desarrollan procesos de adherencia microbiana con el subsecuente establecimiento de la caries como lesión, para cuyo control se han desarrollado diferentes agentes antiadhesivos23. Los compuestos de los frutos rojos han mostrado beneficios potenciales en la prevención de problemas infecciosos, impidiendo la propagación de bacterias en la cavidad bucal22, por sus propiedades antibióticas y antisépticas, pudiendo ser una opción adecuada en los procesos de fijación de las bacterias en la cavidad bucal por el mecanismo de antiadhesión22.
Con estos antecedentes, este estudio tiene el objetivo de evaluar la actividad antioxidante de los compuestos fenólicos presentes en el mortiño y capulí, así como mediante pruebas microbiológicas in vitro, el efecto de inhibitorio de los extractos de las frutas antes mencionadas sobre cepas de Streptococcus mutans ATCC 35668.
Materiales y métodos
Se planteó un estudio experimental, donde mortiño y capulí, obtenidos del mercado de Ambato-Ecuador, fueron separados de su cáscara como de su pulpa, obteniéndose 30g de cada uno de ellos.
De la misma manera una cantidad similar de arándano previamente deshidratado (marca Nature´s Heart Passion Cherry, supermercado “Megamaxi” de Quito), fue pesada (balanza analítica Sartorius TE6101, Germany) y mezclada con 5ml de agua destilada, de forma independiente para hacer una pasta homogénea con cada uno de ellos.
La pasta obtenida fue posteriormente triturada en un mortero y se elaboró un líquido que fue colocado en tubos de 15ml para luego ser centrifugados (Sigma 2-16p, Germany) por 5 min a 4000 rpm.
De forma conjunta las cepas puras de Streptococcus mutans ATCC 35668, obtenidas del importador MEDIBAC, fueron activadas en caldo BHI (Brain Heart Infusion Broth C5141 Criterion, USA), las cuales fueron manipuladas por personal especializado y capacitado del Laboratorio de Investigación de Ciencias de Alimentos de la Facultad de Ciencias Agropecuarias de la Universidad Laica de Eloy Alfaro de Manabí.
Se preparó 15 cajas Petri con 20 mL de medio de cultivo agar sangre de base incubadas a una temperatura de 37ºC durante un periodo 48 horas en microaerofília para su propagación. Finalmente por cada cepa se preparó una suspensión bacteriana al 0,5 Mc Farland. Para medir si las cepas se reprodujeron en el tiempo correcto, se realizaron lecturas de absorbancia (Jenway 6320D, Germany) a 625 nm de longitud de onda a 24 y 48 horas de incubación, y se verificó que la medida de absorbancia obtenida sea directamente proporcional a la concentración de los microorganismos presentes, correlacionando la medida de absorbencia con la concentración de microorganismos se utilizó un patrón 0,5 Mc Farland que representó una concentración conocida de microorganismos, la cual es de 1,5 x 108 UFC.
En las lecturas se utilizó un pozo blanco, el cual contiene caldo BHI virgen, esa lectura debe ser restada a las lecturas realizadas para eliminar la absorbancia procedente del caldo BHI. En cada una de las cajas fueron depositados 6 discos de papel filtro (FishEr Scientific Q2) de 5 mm de diámetro, embebidos con 20 μl de cada uno de los extractos mortiño en pulpa y cáscara, capulí en pulpa y cáscara, arándano deshidratado y gluconato de clorhexidina al 0,12%, estos dos últimos empleados como control. La medición de la zona de inhibición se realizó con una regla calibrada (en mm) a las 24 y 48 horas de incubación.
La actividad antioxidante de los compuestos fenólicos totales presentes en las muestras se midió por medio del ensayo TEAC modificado, usando la decoloración por el radical catión ABTS y expresada finalmente como mg Trolox/g muestra (Re et ál., 1999)24. Además se consideró A x 250,29= (uM eq)/ (peso muestra = (ugtroloxeq”” )/g y 3 repeticiones por sustancia empleado el ABTS y 3 repeticiones por sustancia sin usar el ABTS.
El radical ABTS se preparó mediante la reacción acuosa de persulfato de potasio 2,45 mM y ABTS 7 mM.
La solución se dejó reposar en la oscuridad por 16h a 20°C. La solución de ABTS obtenida es estable durante dos días y se diluye con etanol (95%) hasta obtener una absorbencia de 0,70 (± 0,1) a 734 nm 30°C. Se mezclan 2ml de la solución de radical ABTS, y se registra su absorbencia a 734 nm, luego se añade 20 μL de la muestra y se mide su absorbencia luego de 6 min. Para la cuantificación de la actividad antioxidante se utiliza la diferencia de absorbencias, un blanco de etanol y una curva de calibración usando Trolox como estándar.
Los datos estadísticos fueron tabulados en el programa SPSS 22 y se realizó pruebas de normalidad según Kolmogorov - Smirnov y Shapiro- Wilk y de Kruskal Wallis.
Resultados
El estudio consideró la capacidad inhibitoria del mortiño, capulí y de la clorhexidina como control positivo, en 15 cajas Petri con la evaluación a las 24 y 48 horas, mediante la medición de la zona de inhibición, y se mostró que mientras mayor es el diámetro de la zona de inhibición, existe un mayor efecto de la sustancia sobre la bacteria estudiada.
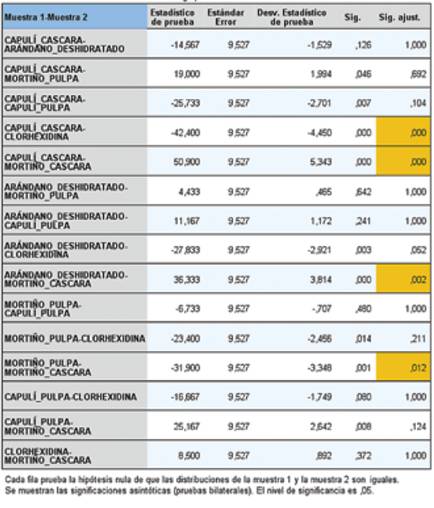
En el análisis descriptivo de los datos considerando los dos tiempos de evaluación de la capacidad de inhibición se evidencia que la cáscara de mortiño presentó el mayor halo de inhibición, seguido de la clorhexidina. (Tabla 1).
En la tabla 2, se observan diferencias entre las distintas sustancias, mayores valores en la cáscara del mortiño (13,71) y clorhexidina (11,73), entre los valores más bajos se tiene la cáscara de capulí (6,88).
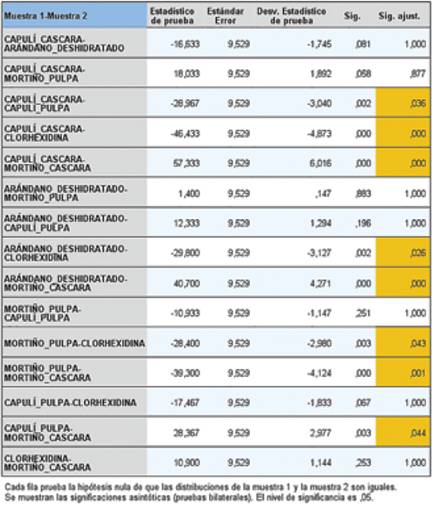
A las 48 horas de incubación, también se observa que la cáscara del mortiño tiene un mayor valor real de inhibición del microorganismo que el resto de frutos rojos evaluados, y la clorhexidina también presentó un halo de inhibición superior a los demás. (Tabla 3)
Además se muestran diferencias entre las distintas sustancias, mayores valores en la cáscara de mortiño (17,20) y clorhexidina (17,43), entre los valores más bajos se tiene la cáscara de capulí (8,54), y para verificar si existe diferencia significativa se hacen las respectivas pruebas no paramétricas, donde no se observa diferencia significativa. (Tabla 4).
Tabla 1. Valor real de halo de inhibición de los frutos rojos a las 24 horas.
| N | Media | Desviación | Valor real de halo de inhibición | ||
|---|---|---|---|---|---|
| Estándar | Mínimo | Máximo | |||
| MORTIÑO PULPA | 15 | 9,367 | 2,5581 | 6,8089 | 11,9251 |
| MORTIÑO CÁSCARA | 15 | 13,713 | 3,5292 | 10,1838 | 17,2422 |
| CAPULÍ CÁSCARA | 15 | 6,88 | 2,4249 | 4,4551 | 9,3049 |
| CAPULÍ PULPA | 15 | 9,82 | 4,1876 | 5,6324 | 14,0076 |
| ARÁNDANO DESHIDRATADO | 15 | 8,773 | 1,417 | 7,356 | 10,19 |
| CLORHEXIDINA | 15 | 11,727 | 0,9208 | 10,8062 | 12,6478 |
| Total | 90 | 10,047 | 3,4515 | 6,5955 | 13,4985 |
Tabla 2. Descriptivos en el periodo de las 24 horas.
| N | Media | Desviación estándar | Error Estándar | Mínimo | Máximo | |
|---|---|---|---|---|---|---|
| MORTIÑO PULPA | 15 | 9,367 | 2,5581 | 0,6605 | 6,3 | 15,0 |
| MORTIÑO CÁSCARA | 15 | 13,713 | 3,5292 | 0,9112 | 8,0 | 21,3 |
| CAPULÍ CÁSCARA | 15 | 6,880 | 2,4249 | 0,6261 | 0,00 | 11,7 |
| CAPULÍ PULPA | 15 | 9,820 | 4,1876 | 1,0812 | 0,0 | 15,7 |
| ARÁNDANO DESHIDRATADO | 15 | 8,773 | 1,4170 | 0,3659 | 7,0 | 11,3 |
| CLORHEXIDINA | 15 | 11,727 | 0,9208 | 0,2377 | 10,7 | 13,7 |
| Total | 90 | 10,047 | 3,4515 | 0,3638 | 0,0 | 21,3 |
Tabla 3: Estadísticos descriptivos 48 horas.
| N | Media | Desviación | Valor real de halo de inhibición | ||
|---|---|---|---|---|---|
| Estándar | Mínimo | Máximo | |||
| MORTIÑO PULPA | 15 | 11,393 | 2,5697 | 8,8233 | 13,9627 |
| MORTIÑO CÁSCARA | 15 | 17,2 | 3,2127 | 13,9873 | 20,4127 |
| CAPULÍ CÁSCARA | 15 | 8,54 | 2,869 | 5,671 | 11,409 |
| CAPULÍ PULPA | 15 | 12,22 | 4,6498 | 7,5702 | 16,8698 |
| ARÁNDANO DESHIDRATADO | 15 | 11,207 | 1,6029 | 9,6041 | 12,8099 |
| CLORHEXIDINA | 15 | 17,433 | 11,5868 | 5,8462 | 29,0198 |
| Total | 90 | 12,999 | 6,2927 | 6,7063 | 19,2917 |
Tabla 4 Descriptivos en el periodo de las 48 horas.
| N | Media | Desviación estándar | Error Estándar | Mínimo | Máximo | |
|---|---|---|---|---|---|---|
| PULPA MORTIÑO | 15 | 11,393 | 2,5697 | 0,06635 | 8,3 | 17,3 |
| CÁSCARA MORTIÑO | 15 | 17,200 | 3,2127 | 0,08295 | 11,7 | 25,3 |
| CÁSCARA CAPULÍ | 15 | 8,540 | 2,8690 | 0,07408 | 0,0 | 12,7 |
| PULPA CAPULÍ | 15 | 12,220 | 4,6498 | 0,12006 | 0,0 | 18,0 |
| ARÁNDANO DESHIDRATADO | 15 | 11,207 | 1,6029 | 0,04139 | 9,0 | 14,3 |
| CLORHEXIDINA | 15 | 17,433 | 11,5868 | 0,29917 | 13,7 | 59,3 |
| Total | 90 | 12,999 | 6,2927 | 0,06633 | 0,0 | 59,3 |
Tabla 5 Prueba de normalidad de Kolmogorov-Smirnov.
| Kolmogorov-Smirnov | |||
|---|---|---|---|
| Estadístico | Gl | Sig. | |
| MORTIÑO PULPA 24 horas | 0,1900 | 15 | 0,1480 |
| MORTIÑO PULPA 48 horas | 0,1450 | 15 | 0,2000 |
| MORTIÑO CÁSCARA 24 horas | 0,1680 | 15 | 0,2000 |
| MORTIÑO CÁSCARA 48 horas | 0,1350 | 15 | 0,2000 |
| CAPULÍ CÁSCARA 24 horas | 0,2920 | 15 | 0,0010 |
| CAPULÍ CÁSCARA 48 horas | 0,2560 | 15 | 0,0090 |
| CAPULÍ PULPA 24 horas | 0,1260 | 15 | 0,2000 |
| CAPULÍ PULPA 48 horas | 0,1820 | 15 | 0,1920 |
| ARÁNDANO DESHIDRATADO 24 horas | 0,2420 | 15 | 0,0180 |
| ARÁNDANO DESHIDRATADO 48 horas | 0,1810 | 15 | 0,2000 |
| CLORHEXIDINA 24 horas | 0,1340 | 15 | 0,2000 |
| CLORHEXIDINA 48 horas | 0,5270 | 15 | 0,0000 |
Los datos sometidos a la prueba de normalidad de Kolmogorov- Smirnov, (tabla 5), evidencian que la distribución de datos no es normal y, por lo tanto, se someten a análisis mediante la prueba no paramétrica de Kruskall Wallis.
La prueba de Kruskal-Wallis reveló que no todas las medias de las muestras son similares, por lo cual se realizó la prueba dos a dos, considerando los dos tiempos de evaluación, por separado. (Tabla 6 - 7).
En este análisis realizado resultó evidente que las cáscaras de capulí y de mortiño, son las sustancias que difieren en relación con las otras en los dos tiempos de evaluación ejecutados (p=0,00).
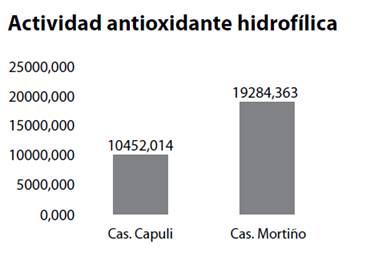
Para completar el análisis, tanto mortiño como capulí fueron sometidos a análisis de la cantidad de antioxidantes de los compuestos fenólicos presentes en los dos frutos rojos. Los datos fueron evaluados mediante un análisis estadístico descriptivo, que reveló mayores valores de actividad antioxidante para la cáscara del mortiño (19284 ug trolox eq/g) seguido por la cáscara de capulí (10452 ug trolox eq/g). (Gráfico 1).
Discusión
Los frutos rojos mortiño y capulí en cascara, obtuvieron valores de inhibición sobre el crecimiento de cepas de Streptococcus mutans ATCC 35668, semejantes a gluconato de clorhexidina al 0.12% empleada como control tanto a las 24 y 48 horas, coincidiendo con estudios previos que refieren que los frutos rojos empleados por su capacidad antioxidante muestran un destacado efecto anticancerígeno25, antienvejecimiento26, antimicrobiano, lo que ha llevado a pensar en su capacidad de actuar sobre cepas de microorganismos que producen enfermedades a nivel bucal como caries dental, lo que guarda relación con el hecho de que los frutos rojos tienen una elevada capacidad antimicrobiana27.
De los frutos evaluados, el mortiño (vaccinium meridionale)28 resulta muy semejante al arándano, el cual reporta en la literatura un efecto antioxidante importante29 asociado a la presencia de flavonoides30, ya ha sido empleado a nivel odontológico31 con resultados
interesantes corroborados en este estudio, sin embargo el capulí perteneciente a la familia Prunus serótina subsp capulí28, es un fruto típico de la zona andina del Ecuador sobre el cual no existen estudios, sin embargo como evidencia este estudio, merece ser considerado al encontrar un desempeño muy semejante a la clorhexidina empleada como control, resultados que estarían asociados a los compuestos fenólicos presentes, y que deben ser investigados en estudios futuros.
Si bien los resultados muestran una acción in vitro, positiva de estas sustancias es necesario resaltar que estas fueron trituradas buscando simular lo que ocurre en boca al mezclar con saliva, considerando todos los elementos obtenidos en un solo extracto sin evaluarlos de forma separada, lo que consideramos merece realizarse y complementarse con lo ejecutado y reportado32 sobre todo en lo referente a la capacidad antioxidante del mortiño33, esta ausencia de diferencia significativa entre las dos sustancias probadas, mortiño y capulí con la clorhexidina al 0,12% tras diluirla en agua destilada, empleada como control, vale la pena evaluar a lo largo del tiempo así como las consecuencias de su empleo, buscando siempre el más alto beneficio para el paciente.