Presentación del caso
Se trata de un paciente masculino de 63 años, comerciante, exetilista y extabaquista importante. Como antecedentes patológicos se documentó: hipertensión arterial crónica, enfermedad renal crónica estadio III, secundaria a amiloidosis tipo AL (previamente diagnosticada). Adicionalmente, se había realizado un diagnóstico reciente de mieloma múltiple de cadena liviana Kappa ISSIII, en ese momento en tratamiento con Bortezomib.
El paciente se presentó con un cuadro de disnea de 3 meses de evolución asociado a edemas podálicos, ortopnea y disnea paroxística nocturna. Se tomó niveles de NT-proBNP, los cuales resultaron elevados en el rango de 35,000 pg/mL.
Se realizó un electrocardiograma (EKG) (figura 1.) que mostró voltajes muy disminuidos en las derivaciones periféricas; con preservación estos en las derivaciones precordiales. Además de un bloqueo atrio-ventricular (BAV) de primer grado.
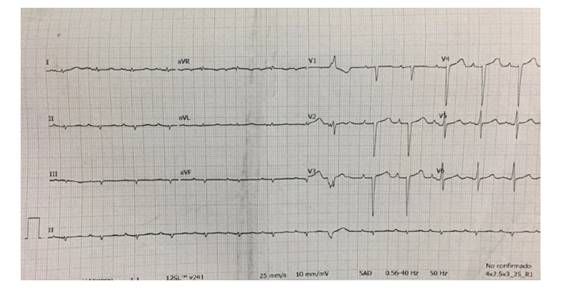
Figura 1 Se muestra un EKG de 12 derivaciones realizado a dicho paciente en donde llama la atención la diferencia de voltajes entre las derivaciones de las extremidades (bajo voltajes <5mm) y las precordiales, con pobre progresión de R. Además, puede observarse un PR de 220ms consistente con un BAV de 1er grado.
Se realizó un ecocardiograma transtorácico que evidenció un grosor parietal aumentado, con criterios para hipertrofia concéntrica, además de una ecogenicidad que mostró un aspecto granular a lo largo de todo el miocardio. La función sistólica biventricular disminuida y disfunción diastólica con elevación de presiones de llenado de la aurícula izquierda. (Figura 2.)
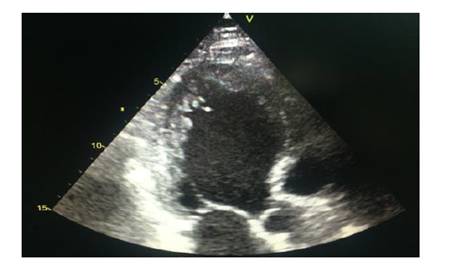
Figura 2 Se puede observar en las siguientes imágenes ecocardiográficas: el engrosamiento difuso del miocardio y su aspecto granular llamativo.
Se le realizó strain 2D por método de Speckle-Tracking que evidenció una caída significativa de la deformación a nivel de segmentos basales y medios, con preservación de los segmentos apicales. Se observó el signo de Bandera de Japón, con relación entre segmentos apicales y basales en 1,2. (figura 3.)
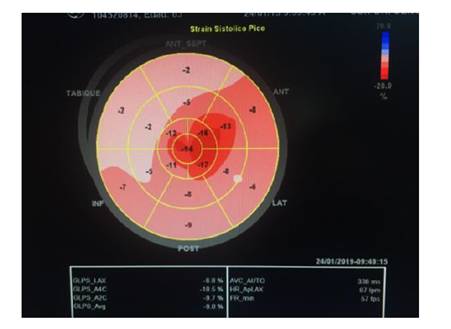
Figura 3 Vista de Ojo de Buey del Speckle-Tracking realizado mediante técnica AFI de GE® y post-procesado en ECO-pack®. Se puede apreciar la caída difusa del strain en segmentos basales y medios con preservación de los segmentos apicales, con una relación apical/basal de 1,2 (Signo de Bandera de Japón) característico, aunque no patognomónico de la Amiloidosis Cardiaca.
Discusión
El amiloide está formado, en su mayoría, por agregados de proteínas insolubles de bajo peso molecular. La fisiopatología implica la desnaturalización, escisión o una producción en exceso de proteína anormal, que finalmente adopta la conformación en lámina β-antiparalela, creando las fibras de amiloide.
El depósito se puede dar en diferentes órganos del cuerpo, incluido el tejido cardiaco, lo cual se denomina amiloidosis cardíaca (1).
Clasificación
La amiloidosis se puede clasificar en sistémica, cuando existe depósito de amiloide en múltiples tejidos; o localizada cuando solo hay un tejido u órgano involucrado (1).
También se clasifica según la etiología de la enfermedad. En esta se encuentra: la amiloidosis primaria, la secundaria (o reactiva), familiar (o hereditaria), sistémica senil y asociada a diálisis. La frecuencia de la afectación cardíaca varía según el tipo. Siendo más frecuente en la primaria, la senil y la familiar (2).
Amiloidosis primaria
Caracterizada por fibras amiloideas compuestas por cadenas ligeras monoclonales. Afecta a personas entre 50 y 60 años, con leve predominancia en hombres. En un 69% de los casos presenta afectación sistémica y en un 20% hay compromiso cardíaco. Este último provee una alta mortalidad y un pronóstico reservado. Como dato adicional, este tipo de amiloidosis se asocia a enfermedades como mieloma múltiple u otros desórdenes linfoproliferativos (2).
Amiloidosis secundaria
Puede ser una complicación, aunque infrecuente, de enfermedades inflamatorias. Por ejemplo: artritis reumatoide, enfermedades intestinales inflamatorias e infecciones crónicas como tuberculosis. Con frecuencia hay daño renal, mientras que solo un 2% presenta compromiso cardíaco (2).
Amiloidosis familiar (hereditaria)
Este tipo de amiloidosis se produce gracias a una mutación en el gen codificante para la proteína trasntiretina (TTR). Con un patrón hereditario tipo autosómico dominante y penetrancia variable. Afecta a hombres y mujeres en una relación 1:1 (2).
Se han descrito más de cien diferentes mutaciones, de las cuales alrededor de 44 comprometen al corazón. En poblaciones estadounidenses (especialmente en afroamericanos) es común encontrar manifestaciones cardiacas; mientras que, en Europa y Japón, es más esperable el compromiso del sistema nervioso(1).
Amiloidosis senil
La proteína amiloidea en esta enfermedad es conocida como transtiretina de tipo salvaje (TTRwt, por sus siglas en inglés). Afecta en su mayoría a hombres mayores de 70 años. Puede tener afectación sistémica y frecuentemente afecta al corazón. Su progresión es lenta comparada con la amiloidosis primaria, por lo que presenta un mejor pronóstico.
Clínica de la amiloidosis cardíaca
El depósito de amiloide crea un engrosamiento de la pared del ventrículo, lo que da paso a una disminución de su distensibilidad y por ende un aumento de presión (disfunción diastólica). Por otro lado, el efecto citotóxico de las fibrillas de amiloide produce apoptosis de los miocitos y sustitución por tejido fibroso (1). Lo anterior, a largo plazo, resulta en afectación de la función sistólica.
Estos mecanismos llevarán a la aparición de síntomas y signos de insuficiencia cardíaca (1), como son la disnea de esfuerzo, el dolor torácico, la fatiga, síncope y datos de sobrecarga de volumen (tercer ruido, edemas, ingurgitación yugular, dolor en hipocondrio derecho, entre otros).
El depósito también puede afectar el sistema de conducción cardiaco, provocando la aparición de arritmias. La fibrilación atrial (FA) afecta entre un 10-20% de los pacientes (1). Se han descrito también BAV y arritmias ventriculares complejas.
Otras manifestaciones cardíacas pueden incluir: muerte súbita, angina e infarto (por depósito en arterias coronarias) y derrame pericárdico (1).
Las manifestaciones extra cardiacas pueden ayudar a elevar la sospecha del diagnóstico y además orientan al tipo de amiloidosis. La macroglosia es casi patognomónica de la amiloidosis primaria, pero solo se haya en el 10% de los pacientes. La neuropatía y cardiopatía son frecuentes en la amiloidosis familiar. Por otro lado, el síndrome de túnel carpal puede elevar la sospecha de amiloidosis senil. La secundaria se asocia a enfermedades inflamatorias crónicas, pero rara vez tiene afectación cardíaca (2).
Diagnóstico
El diagnóstico inicia con la sospecha basada en la historia clínica y el examen físico. Posteriormente, se puede elegir entre distintos exámenes, tanto de laboratorio como de imagen; que ayudarán a aclarar la sospecha. En este artículo nos enfocaremos en las técnicas de imagen utilizadas actualmente.
Electrocardiograma
En un estudio realizado en la clínica Mayo, que incluía 127 pacientes con amiloidosis primaria (demostrada por biopsia), se concluyó que los dos hallazgos electrocardiográficos más comunes fueron el bajo voltaje (en derivaciones de extremidades) y el patrón de pseudo-infarto (3), presentándose hasta en un 47% de los pacientes, lo cual concuerda con estudios anteriores. Se debe recordar que en otros tipos de amiloidosis la frecuencia de estos hallazgos es menor.
En este mismo estudio se observaron otras alteraciones electrocardiográficas mencionadas anteriormente. Como son: el bloqueo A-V de primer grado (21%), FA y aleteo auricular (20%) BAV completo (3%) y taquicardia ventricular (5%) (3).
Ecocardiografía
Ante la sospecha de amiloidosis cardíaca, se recomienda siempre el uso de ecocardiografía, ya que no solo brinda información morfológica, sino también funcional.
Hallazgos morfológicos clásicos como: engrosamiento ventricular izquierdo simétrico, dilatación atrial, engrosamiento de la pared interatrial, engrosamiento valvular, derrame pericárdico y la apariencia de granulado brillante; son muy sugestivos de la enfermedad, particularmente cuando se asocia a la ausencia de datos de hipertrofia ventricular en el electrocardiograma (4).
Sin embargo, el ecocardiograma tradicional tiene sus limitaciones: los hallazgos son más comunes en estadios avanzados de la enfermedad. El aspecto granulado no es diagnóstico por sí solo, ya que otras patologías pueden producir un efecto similar. Asimismo, este estudio no permite distinguir entre los tipos de amiloidosis (5).
Ahora bien, la aparición del Doppler tisular y la medición de la deformación y velocidad de deformación (strain y strain rate, respectivamente), han tomado un papel importante en el diagnóstico temprano y el pronóstico de la amiloidosis cardiaca (4).
En estudios realizados por Sun et al. y Di Bella et al. (4), se ha observado que la deformidad longitudinal y circunferencial está significativamente disminuida en comparación con la cardiomiopatía hipertrófica (CMH) y en pacientes con hipertrofia ventricular por hipertensión arterial.
Phelan, et al. describieron un patrón en los pacientes con amiloidosis cardíaca, donde la deformidad longitudinal se ve afectada en la región media y basal del ventrículo izquierdo. Respetando el segmento apical. A partir de esto se desarrolló una formula dividiendo el promedio de deformidad longitudinal apical entre la suma de la deformidad longitudinal basal y media. Dando una especificidad del 82% y sensibilidad del 93% para el diagnóstico de amiloidosis, cuanto este era >1 (5).
Quarta et al., en otro estudio, compararon pacientes con amiloidosis primaria y pacientes con amiloidosis familiar. Llegaron a la conclusión de que, sin importar la etiología de la amiloidosis o el grado de engrosamiento de la pared, se sigue observando el patrón de deformidad antes descrito. Con estos hallazgos se hace posible el identificar pacientes en estadios más tempranos y además diferenciarlos de otras patologías como la CMH u otras cardiomiopatías restrictivas
En cuanto a la disfunción diastólica, esta se ha visto directamente relacionada con el nivel de infiltración. Al inicio se puede observar un patrón de relajación anormal; el cual progresa hasta un patrón de llenado restrictivo. Caracterizado por un marcado acortamiento del tiempo de desaceleración (<150ms) y una velocidad de la onda E mayor a la de la onda A (E/A >2) (4).
Actualmente también se utiliza el índice E/e’, el cual tiene la ventaja de que puede verse anormalmente elevado aun en estadios de disfunción diastólica tempranos (6). En un estudio realizado por Schiano-Lomoriello, et al., se concluyó que un índice E/e’ mayor o igual a 12.3 tenía una sensibilidad de 69.7% y especificidad de 83.3% para detectar amiloidosis cardiaca.
A pesar de los avances que se han dado en el campo de la ecocardiografía, todavía no es posible realizar el diagnóstico de amiloidosis cardíaca con solo este estudio. Por lo que debe complementarse con otras técnicas.
Resonancia Magnética
Por lo general se utiliza este método, posterior a la realización del ecocardiograma. Este brinda una mayor precisión para calcular el grosor y volumen de los ventrículos; al igual que otros parámetros morfológicos mencionados anteriormente (2).
Una mayor ventaja que posee la resonancia magnética (RM) sobre los demás métodos diagnósticos, es la posibilidad de utilizar la técnica del realce tardío de gadolinio (RTG). El amiloide tiene la característica de poder retener este medio de contraste, y a diferencia de un corazón sano, este medio se “lavará” con mayor dificultad. En general se menciona que la técnica presenta una sensibilidad de 80% y una especificidad del 94% (1). Al igual que el uso del Doppler tisular, esta técnica puede detectar la amiloidosis cardíaca aún en fases tempranas. A medida que avanza la patología, las imágenes pueden revelar un realce global del corazón; el cual es un factor independiente para peor pronóstico (6).
Otra técnica que ofrece la RM, es el mapeo en la secuencia T1. Se basa en la reconstrucción de imágenes pre y post exposición al gadolinio; representando el tiempo de relajación longitudinal o T1. Al comparar las imágenes se obtiene un cálculo del volumen extracelular; por lo que un volumen elevado y un tiempo T1 disminuido sería lo esperable en la amiloidosis cardiaca (1).
En el estudio dirigido por Karamitsos et al., al comparar pacientes con amiloidosis primaria, pacientes con estenosis aórtica y pacientes sanos; concluyeron que el mapeo T1 presenta una alta precisión en el diagnóstico de amiloidosis cardíaca. Además, presentó una mayor sensibilidad que la del RTG.
Cintigrafía
El uso de radioisótopos en la medicina ha presentado grandes avances en el diagnóstico y pronóstico de distintas enfermedades, entre ellas, la amiloidosis. Existen distintos radiomarcadores, los más utilizados son: 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico (99mTc-DPD) y tecnecio pirofosfato (99mTc-PYP) (1).
La tomografía por emisión de positrones (PET por sus siglas en inglés) es una de las técnicas de imagen nuclear más comúnmente utilizadas y puede ser útil cuando la RM no es una opción viable, o como prueba complementaria (cuando todavía existe duda sobre el diagnóstico). Es importante mencionar que existen tres ventajas adicionales que brinda esta prueba. La primera es que la imagen producida muestra todos los tejidos afectados por el depósito de amiloide. La segunda es que presenta una gran capacidad para diferenciar entre amiloidosis primaria y familiar (con un 97% de sensibilidad y 100% de especificidad). Aunque se desconoce el mecanismo exacto, se ha observado que la amiloidosis familiar presenta una marcada captación del radioisótopo; mientras que la captación es mínima en la primaria. Y finalmente, este método presenta mayor sensibilidad que la ecocardiografía y la RM para detectar la enfermedad en fases tempranas (6).
Diagnóstico histopatológico
A pesar de los grandes avances en los estudios imagenológicos, el gold standard, continúa siendo la demostración histopatológica de los depósitos de amiloide (1).
Por razones de seguridad, como primera opción se recurre a la biopsia de tejido extracardiaco, tales como la mucosa rectal, grasa abdominal u otros órganos posiblemente afectados (ej.: hígado). La biopsia por aguja fina de estos tejidos presenta una sensibilidad del 75% y una especificidad del 92%, para el diagnóstico de amiloidosis (1). En caso de un resultado negativo, pero alta sospecha por clínica y estudios de gabinete; el siguiente paso sería la biopsia de tejido cardiaco.
La presencia de amiloide se detecta con tinción de Rojo Congo y posteriormente con birrefringencia verde-manzana al exponerlo a luz polarizada. Una vez hecho el diagnóstico se deberá identificar el tipo de amiloide (por medio de métodos inmunohistoquímicos), ya que de eso dependerá el manejo (2).
Conclusiones
Al correlacionar los hallazgos electrocardiográficos y ecocardiográficos del paciente, con lo mencionado en literatura; observamos signos muy sugestivos de amiloidosis cardíaca. Sin embargo, como se mencionó en el artículo, estos hallazgos no son suficientes para realizar el diagnóstico.
Ahora bien, en el contexto de este paciente con un diagnóstico ya confirmado de amiloidosis AL, si es posible concluir que el paciente presenta los elementos suficientes para explicar que los datos de insuficiencia cardiaca se deben a una miocardiopatía de tipo restrictiva secundaria al depósito de amiloide.














