Introducción
Metilendioximetanfetamina (MDMA), conocida con nombres como: Éxtasis, XTC, E, Droga del Amor o Molly fue sintetizada próxima a la Primera Guerra mundial en 1914 como arma química1, aunque otros registros la establecen en 19122. Su uso fue divergido a droga de abuso que usualmente era utilizada por personas jóvenes y se vinculaba a Festivales con Música Electrónica, eventos “Rave”3,4 y en centros nocturnos1,5. En el ámbito ilegal se le considera erróneamente una droga segura; sus efectos son similares a los de las anfetaminas y de psilocibina por lo que es modestamente alucinogénica4.Respecto al uso de la MDMA como droga de abuso la misma usualmente esta alterada por otras sustancias, y tiene una presentación física usual en polvo (Molly) o en tableta (Éxtasis) aunque se le han señalado otras presentaciones y una gran diversidad de nombres como Eve (aunque la droga con este nombre usualmente se compone de MDA); en los 90 llegó a ser la droga de elección en las fiestas que duraban toda la noche y conocidas por el anglicismo “Raves”6.
Acorde al Informe Europeo sobre Drogas del 2021 ha habido un aumento en la cantidad incautada de MDMA en la Unión Europea entre el 2009 y el 2019 de un 456%; además el MDMA se ha constituido en la tercera droga más consumida en esa región con 0.9% o 2,6 millones de personas de consumo durante el último año y 10.4 millones o 3.6% de población a lo largo de la vida de personas entre 15 y 64 años7.
Es difícil valorar el consumo de MDMA en las presentaciones de venta ilegal porque su concentración puede variar mucho, incluso al punto de no estar presente o estar compuesto predominantemente por otras drogas4. El MDMA tiene la consideración de Droga de Abuso1 a la que se le atribuye alteración de percepción, efectos estéticos, anímicos y sexual, con mayor percepción de efectos por los usuarios nuevos que quienes la consumen de forma frecuente8.
Desde la perspectiva médico legal de una sustancia de abuso es necesario es necesario evaluar todos los elementos de juicio que se abordan al MDMA, porque este se ha compuesto por un interés adicional al reincidir su uso como medicamento en conjunto con psicoterapia para tratar el abuso de sustancias, trastornos de estrés postraumáticos asociados a violencia doméstica y abuso sexual. Tanto por analizar la farmacodependencia que se le ha objetivado al producto, los efectos de la droga en el cuerpo, futuro fármaco para tratar afecciones de difícil respuesta develó un interés principal sobre la toxicomanía del MDMA en un caso Médico legal con adherencia de un polvo granular blanco en el tabique nasal en sujeto masculino.
Materiales y Métodos
En la redacción de este artículo se planteó como objetivo abordar la pregunta de la autoridad judicial respecto a si el usuario asocia hallazgos compatibles con toxicomanía y se exploró esta interrogante desde la perspectiva del consumo de MDMA, hallazgo que fue evidente en un laboratorio de toxicología solicitado por el perito del caso. Mediante el servicio de Toxicología del Poder Judicial de Costa Rica se realizó un análisis de orina con extracción en fase sólida y Cromatografía de gases con detector de masas (GC/MS) que determinó un positivo presuntivo para MDMA. Con la finalidad de esclarecer las interrogantes ante la toxicomanía por MDMA se realizó una búsqueda bibliográfica en la base de datos de Clinical Key, UptoDate, Scielo, PubMed, revistas digitales como: Journal of Clinical Psychopharmacology, Behavioural Pharmacology, Addictive Disorders and Their Treatment, American Journal of Forensic Medicine and Pathology con el descriptor de la Salud “MDMA”, continuando con la revisión de la bibliografía en los artículos o capítulos de libros encontrados.
Aspectos relativos a Medicina Legal
Es necesario aclarar que el concepto de Farmacodependencia ha sido atribuido desde la perspectiva médico legal como una condición de dependencia física, psicológica o ambas presentes en una persona hacia una droga, producto de la administración continua o periódica. A su vez se entiende como droga a una sustancia que modifica la función generando un cambio en el organismo o en el comportamiento1.
Psicotrópico es el término que se le adjudica a una droga que actúa en el sistema nervioso central generando efectos neurofisiológicos, en tanto que el estupefaciente es una droga no indicada por un médico que actúa en el sistema nervioso central produciendo sumisión física o psicofísica, reconocida por el síndrome de abstinencia que genera. La dependencia psíquica se interpreta como una sustancia que hace dependiente al individuo para el desempeño de sus actividades diarias para reducir o eliminar el impacto emocional de la ansiedad, agitación y otros fenómenos psíquicos a la ausencia del consumo en tanto que la psicofísica se interpreta como una droga que se hace necesaria para el funcionamiento del organismo en la que su supresión puede llevar al colapso y muerte; como: La morfina, heroína, babitúricos1.
Otro proceso que genera los estupefacientes son las adaptaciones en el organismo que hace que quienes la usen y deseen conseguir el mismo efecto previo deben aumentar la dosis, fenómeno que se conoce como hábito; en cambio el acostumbramiento es la capacidad del organismo para tolerar cantidades de este tipo drogas que usualmente en individuos sin acostumbramiento sería tóxicas o incluso mortales1. Con respecto al hábito en MDMA a este se le ha atribuido como un fenómeno empírico el cual se desarrolla rápidamente, llevando a un aumento de dosis con el fin de obtener la experiencia sin igual que obtuvieron en la primera dosis, dado que sus efectos positivos disminuyen rápidamente9, por lo que algunos individuos incrementan la dosis con el fin de conseguir los mismos efectos psicoactivos10,11.
Un investigador de la Universidad de California nombró al MDMA dentro del grupo de drogas de diseño dado que corresponden a presentaciones y efectos que simulan fármacos abandonados o prohibidos por la ley1, además que cuando comenzaron a producirlos para uso no médico, la combinación de efectos similares a anfetamina y mescalina se buscó intencionalmente y se logró en forma confiable el diseño apropiado de la molécula del fármaco12.
Respecto al MDMA y la farmacodependencia por la disminución de placer como de efectos gratificantes cuando se utiliza de manera frecuente, así como el hecho de que uso rutinario exacerba la frecuencia de efectos no deseados, usualmente es un fenómeno que reduce el incentivo para consumir la droga a un punto de dependencia13,14. La anfetamina y metanfetamina pueden generar dependencia psicofísica como la cocaína1,6,15, misma que ha sido señalada con su reaparición en los años iniciales a 1980 y con experiencia en este aspecto 50 años antes6.
Un grupo de Canadá estudio los efectos en una rata hija cuando su madre le expresaba poco cuidado como: pocos periodos de amamantamiento, cuidado de la madre respecto a la limpieza de su hija, contacto físico y otros aspectos que revelaron la metilación de algunos genes, como del receptor de glucocorticoi-des16, como en los genes para el BDNF y la subunidad NR2A del NMA17. Para el individuo que asocia estas alteraciones, le presentan en su conducta mediante un aumento en el nivel de estrés, disminución en la capacidad para resolver problemas y la resolución de laberintos, así como vulnerabilidad para la adicción a las drogas17,18. Esa observación pone en relieve que la farmacodependencia no es sólo es dependiente de la actividad farmacológica, sino de la vulnerabilidad estructural de los genes revelados en la familia e incluso que el ambiente haga una cuota en cuanto a desarrollar la vulnerabilidad del individuo19.
En personas farmacodependientes usualmente se presenta impulsividad que es la reacción precipitada a un estímulo sin considerar los riesgos de esa acción19. En estudios por imágenes una hipofunción de la corteza prefrontal derecha, en particular de la tercera circunvolución frontal derecha, se asocia a una conducta de impulsividad, es decir que cuando un individuo que no es impulsivo sufre un trauma cráneo encefálico y asocia daño orgánico en esta región se vuelve impulsivo20. Dado que los sistemas subcorticales de motivación, recompensa y castigo están bajo la regulación cortical, de la corteza prefrontal derecha, cuando esta corteza es disfuncional presupone el riesgo de enfermedades como la farmacodependencia20.
Molécula de MDMA
El nombre de MDMA responde a la sustancia química identificada como N-metil 3,4metilendoxianfetamina o 3,4 metilendioximetanfetamina y es por las letras iniciales Metilendioximetanfetamina que produce el acrónimo MDMA. Como su nombre lo indica la MDMA se deriva de la metanfetamina 6(Ver figura 1).
La molécula en estudio difiere de la anfetamina y de la metanfetamina en que tiene un grupo de metilendioxi (-O-CH2-O-) agregado en las posiciones 3 y 4 del anillo aromático de la molécula de anfetamina, esto comparte algunas de las características de la sustancia alucinógena mescalina, y es por esa estructura que se le atribuye al MDMA los efectos farmacológicos de una mezcla entre anfetaminas y mescalina. Dado que la estructura del MDMA también comparte similitud con: Epinefrina, dopamina y serotonina; además la mayoría de sus efectos biológicos se asemejan a estas moléculas naturales6. (Ver figura 1).
Una estructura muy similar al MDMA es el del N-etil-3,4-milendioxianfetamina (MDA), la cual varía únicamente en la estructura de origen que es de una anfetamina y no de una metanfetamina es decir en tener un grupo metil asociado al nitrógeno en la metanfetamina y en la anfetamina no (Ver figura 1).
Como la anfetamina, MDA y MDMA son compuestos totalmente sintéticos, los 3 fueron sintetizados en 18856, 1910 y en 19122, respectivamente. La anfetamina se mercantilizo como reductor de peso en 1930, pero su venta, luego se redujo por el riesgo de dependencia y otros efectos adversos12. El MDA se patentó como un inhibidor de la tos en 1956, tranquilizador en 1960 e inhibidor del apetito en 1961, pero no se comercializó para ninguno de sus usos12. EL MDMA se pretendió monetizar como un inhibidor del apetito, aunque nunca se comercializó y sólo se utilizó de forma no médica6.
Epidemiología
Una forma de cuantificar el incremento en el consumo del MDMA es el incremento de las consultas por esta droga al Servicio de Emergencia. En Estados Unidos dichas consultas incrementaron de 10227 en el 2004 a 22498 en el 201121. En los años 90 se efectuó una encuesta a 3021 jóvenes de Alemania entre 14 y 24 años, que evidenció que abuso único de Éxtasis es poco común y sólo fue reflejado por el 2.6 % de quienes lo consumían22. Dentro de los usuarios crónicos lo usual era consumirla en conjunto con otras drogas, por ejemplo el 26% consumía opiáceos, 46% alucinógenos, 59% cocaína, el 97% cannabinoides y el 48% otras sustancias; por lo que el abuso ilegal de sustancias múltiples es más común en el usuario de Éxtasis que en aquellos que no lo usan y quienes consumían por primera vez el MDMA tenían mayor riesgo de consumirlo de forma crónica4,22.
Otro de los factores relacionados con el consumo de éxtasis es el sexo, puesto que más común en hombres que en mujeres4. El número de parejas sexuales en estudiantes universitarios en Estados Unidos también se asoció a un incremento en la probabilidad de consumo de éxtasis, siendo en quienes lo consumen el abuso de varias sustancias la regla4,23. Prosiguiendo con el uso éxtasis, las personas que lo usaron notifica-ron mayormente sexo anal desprotegido y mayor incidencia de enfermedades sexuales que quienes nunca lo habían utilizado24.
En el Este de Alemania, cerca del año 2005 un artículo reveló que el incremento del consumo Éxtasis se asociaba con un incremento en los crímenes relacionados con esa droga, la cuál era de uso no común en la población afrodescendiente, y representó para las personas con una enfermedad mental un aumentó en la probabilidad del consumo futuro de éxtasis25.
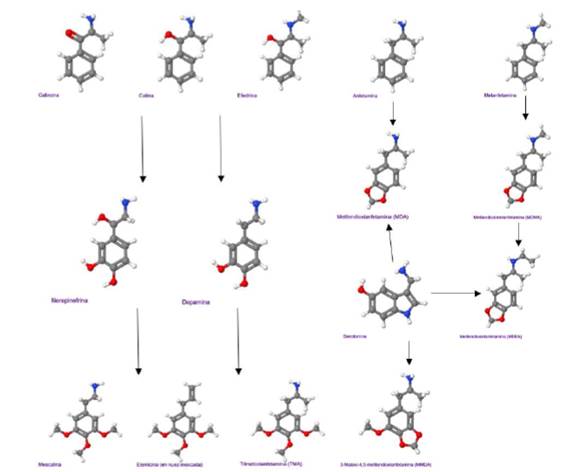
Figura 1. Estructuras químicas del MDMA, MDEA y Drogas similares comparadas con los neurotransmisores monoamina. Las flechas solo representan la mayor cercanía estructural de las moléculas y no las vías de síntesis o metabolismo6. En las estructuras los átomos de hidrogeno son de color blanco, carbono de color gris, azul nitrógeno y oxígeno color rojo. Figura tomada de Harold Kalant. The pharmacology and toxicology of “ecstasy” (MDMA) and related drugs. CMAJ. 2001 Oct 2; 165(7): 917-928 [Citado el 11 de Agosto del 2021]. Disponible desde: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC81503/
Clínica
Un estudio sugirió que se desarrolla hábito a los efectos del MDMA, pero las reacciones adversas tienden a aumentar si se continua su uso26, o cuando se asocia a actividad física intensa como bailar enérgi-camente27. A tal punto la actividad física favorece la toxicidad del MDMA en sus diferentes presentaciones, droga a la cual se le ha atribuido generar: aumento de la excitación y estado de alerta que se acompaña de aumento en la tensión que usualmente se manifiesta como aumento en la tensión muscular y en un constante movimiento inquieto de las piernas, visión borrosa, dolor de cabeza, pérdida del apetito e incluso la rigidez y dolor en la parte baja de la espalda y los músculos de las extremidades es muy común en presentarse 2 a 3 días después de su uso2,13,28-30. Pápulas rojizas con distribución en rostro y perioral tipo acné31, psoriasis guta-ta32, hipertermia e incluso hipertermia prolongada por 2 meses33, taquicardia, toxicidad cardíaca34, isquemia miocárdica transitoria4, espasmo coronario35, fibrilación atrial36, hipotensión, disección aórtica37, pneumo-mediastino espontáneo38, pneumomediastino por ruptura esofágica39, hemoneumotórax40, gingivitis necrotizante (en aplicación local)41, boca seca con aumento del riesgo de erosión del esmalte y caries dentales42, hepatitis aguda en una presentación que varía desde asintomática hasta falla hepática aguda43 (Ver Figura 2) lesión renal transitoria del túbulo proximal44, insuficiencia renal aguda, retención urinaria4, coagulación intravascular diseminada, rabdomiólisis, pérdida del conocimiento, desregulación autonómica45, edema cerebral con síndrome de secreción inapropiada de la hormona antidiurética46, deterioro en el flujo sanguíneo cerebral47,hemorragia subaracnoidea no asociada a aneurimas48.
La microangiopatía inducida por drogas puede ser provocada por el MDMA la cual se caracteriza por hemólisis microangiopática ejemplificada con esquistocitos en el frotis de sangre periférica, anemia, trombo-citopenia leve a grave, aumento del lactato deshidrogenasa, una prueba de antiglobulina directa negativa (Coombs)49.
En su uso agudo asocia una disfunción inmune asociada a la concentración de MDMA en plasma50 por lo que incluso se ha relacionado con reactivación del herpes zoster, infección secundaria a inmunosupre-sión para los casos en que se ha descartados otras causas51, metahemoglobinemia adquirida52, hiponatremia53-55, hiponatremia severa4, hiponatremia con edema cerebral con evolución fatal56-58 e hiperkalemia con toxicidad fatal por MDMA59. Además, en un caso con consumo de MDMA y heroína en orina se le atribuyó causar una mielopatía aguda60. La toxicidad del MDMA a las neuronas dopaminérgicas resultó en cambios residuales a la respuesta de la dopamina4,61 y se le relacionó con el Parkinson y una parálisis bilateral del nervio ab-ducens62, aunque para el caso del Parkinson se le contemplaron dudas 61. También se ha relacionado con el desarrollo de algunas enfermedades neurodegenerativas63, y de un déficit cognitivo en demencia como en el accidente cerebrovascular64.
El MDMA puede desarrollar síndrome serotoninérgico mediante la estimulación por liberación masiva de la serotonina, el cual es una condición potencialmente mortal caracterizada por la triada de: disfunción autonómica, actividad neuromuscular anormal y alteración del estado mental65-67.
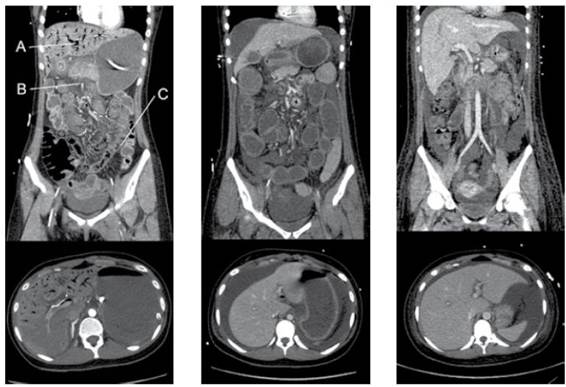
Figura 2 Imágenes de una mujer de 20 años que fue admitida con hiperpirexia y sin respuesta después de la ingesta de MDMA. Desarrollo rabdomiólisis y daño agudo hepático, renal y cardíaco que requirió un sistema de soporte multiorgánica. La imagen de tomografía computarizada de la izquierda hace representación a una vista abdominal con distensión, hemato-quecia, y elevación del lactato arterial, demostrado por pneumatosis extensa en la vena portal hepática (A), con presencia de gas en la vena mesentérica superior (B) y neumatosis en la pared de los vasos pequeños(C). Figura tomada de Maharaj R., Pingitore A., Bernal W., et. al.: MDMA-induced acute liver failure and transient abdominal pneumatosis. Am J Gastroenterol 2015 [Citado el 17 de Septiembre del 2021]; 110: pp. 963. Disponible desde: https://www.proquest.com/openview/a1007e0b628bb12c2710a6d13c6f08f2/1.pdf?pq-origsite=gscholar&cbl=2041977
La imagen del centro hace referencia a la mejoría clínica en la tomografía computarizada en el día 3, que mostro una resolución casi completa de la neumatosis intestinal, pero con una pérdida marcada del volumen hepático. En la imagen de la derecha se observa la resolución del íleo paralitico que resolvió con un manejo conservador al día 11, que muestra mejora en la apariencia de los intestinos y restauración del volumen hepático. En su egreso registró una función hepática normal en el día 28.
Un metaanálisis sobre los efectos agudos en las primeras 24 horas del consumo de éxtasis, reveló que los efectos somáticos eran los más frecuentes, registrando que el 80% o más de los usuarios refirió bruxismo, problemas dentales, cambios en la temperatura del cuerpo, fatiga física o mental, taquicardia, sudoración en las palmas de las manos, boca seca, sed e incremento de la energía; a su vez algunos sujetos se quejaron de dolor en el estómago o intestinal, incapacidad para orinar, dificultad para respirar, TICS musculares, nausea, vómitos, dolor de cabeza, mareo, dolor muscular68.
Trastorrnos psicológicos, psicomáticos y psiquiátricos asociados relacionados con MDMA
Producto del éxtasis se ha atribuido mejora el ánimo, bienestar, aumento de la sensibilidad emocional, poca ansiedad, alteraciones moderadas del pensamiento sin alucinaciones ni reacciones de pánico, dificultad para concentrarse, bloqueo del pensamiento y dificultad para tomar decisiones69. Luego de su consumo en el segundo día las quejas mentales o anímicas más comunes son: Dificultad para concentrarse, depresión, ansiedad y fatiga13,70. Una minoría de los que consumen éxtasis desarrollan psicosis tóxica, convulsiones, aunque estas se atribuyen a la vulnerabilidad genética del individuo para desarrollar dichas complicaciones71.
Con respecto a la psicopatología y la cognición en relación con efecto de éxtasis, un estudio entre consumidores habituales, consumidores con 2 años de abstinencia, consumidores de múltiples drogas sin experiencia en éxtasis y no consumidores de drogas reveló que en comensales habituales y en abstinencia tienen peor psicopatología que los usuarios consumidores de múltiples drogas. Agregado a ello quien ha usado éxtasis asoció una puntuación alta en factores específicos en el cuestionario SCL 90 R como: somatización, trastorno obsesivo compulsivo, ideaciones paranoides, depresión, ansiedad, ansiedad fóbica, desorden de sensibilidad interpersonal, alteración el apetito y trastorno del sueño inquieto72. Hay que mencionar además que al uso MDMA se le ha incluido la presencia de flashbacks, ansiedad, insomio73, ataques de pánico74-75, psicosis76, efectos subagudos de somnolencia, depresión, ansiedad, irribilidad77. Efectos crónicos de trastorno de pánico74,78,79, psicosis4,10,76, flashbacks76, desorden de depresión mayor4,74, alteración en la memoria. Dado que el desarrollo de estas condiciones sólo se presenta en algunos sujetos, el progreso de estas condiciones puede ser atribuido a vulnerabilidades individuales en el sujeto como al uso de MDMA en dosis altas4. Respecto a las dosis altas algunos autores las ubican a un consumo de por vida de 500 tabletas de éxtasis, atribuyendo con ella una susceptibilidad a la neurotoxicidad (posiblemente asociada al sistema seroto-ninérgico80) en el hipocampo que puede aparecer tanto en edades tempranas o agravar un deterioro de la memoria en los años siguientes81.
En el caso de usuarios con consumo de múltiples drogas con consumo de éxtasis y sin consumo de éxtasis se concluyó que en quienes consumían éxtasis presentaron un déficit significativo en el reconocimiento de patrones visuales complejos y la memoria de trabajo espacial en comparación con farmacodependientes de múltiples drogas que no consumían éxtasis82.
Fisiopatología
La intoxicación por MDMA puede desencadenar un síndrome serotonininérgico83, representado por la tríada de: Alteración del estado mental, disfunción autonómica y actividad neuromuscular anormal84, patología que de no controlarse podría ocasionar daño orgánico e incluso la muerte. La serotonina liberada por la MDMA a su vez puede estimular la liberación de la hormona antidiurética del hipotálamo y de la glándula pituitaria ocasionando hiponatremia por hemodilución mediante ingesta de fluidos e incluso por síndromes de pérdida de sal, pudiendo incluso llegar a ser esta severa85. Incluso se podría generar una complicación severa de hiponatremia como el Síndrome de Ayus-Arieff, donde el edema cerebral causa edema pulmonar neurogénico mediado de forma central mediante el incremento en la liberación de catecolaminas y la lesión capilar86.
Cuando hay hiperkalemia, esta se asocia a un estado hipermetabólico en el cuál la filtración glomerular esta reducida y hay un inicio en la rabdomiólisis la cual por destrucción de la célula muscular aumenta la concentración del ion potasio59.
La toxicidad por MDMA ocasiona disfunción multiorgánica múltiple mediante hipertermia desencadenada por la estimulación de la serotonina87, en tanto que en la falla multiorgánica a su vez genera edema pulmonar no cardiogénico3,84,88-91. Un edema pulmonar no cardiogénico en un usuario con eutermia y sin falla multiorgánica es inusual92-93. Como consecuencia del uso por MDMA, esta sustancia ha sido asociada a desencadenar metahemoglobinemia adquirida, representándole al usuario desaturación de oxígeno y estrés respiratorio51. Continuando con la toxicidad de la droga en el hígado es posible que ocurra un daño seve-ro88,94 (Ver figura 2), en el corazón este efecto lo representa el espasmo coronario por disfunción endotelial35. La anemia asociada al consumo de éxtasis se atribuye a un efecto secundario al estrés oxidativo, probable-mente por la toxicidad de la droga95.
Para el caso del pneumomediastino espontáneo este puede ser ejemplificado por maniobras Valsalva a repetición como el esfuerzo de bailar, vómitos inducidos por la droga, e incluso relaciones sexuales con períodos prolongados96-97. A su vez en el pneumomediastino por ruptura esofágica es en encausado al contenido de un aditivo corrosivo en el éxtasis que ocasione la ruptura esofágica o que por la misma dismotilidad intestinal, genera esta ruptura esofágica39. El Hemoneumotórax que se le relacionó con el consumo de MDMA se atribuyó a la ruptura de las bulas como de adherencias vasculares apicales98.
Se le enlista retención urinaria por la liberación de la noradrenalina, la cual mediante la estimulación de los receptores alfa adrenérgicos media la retención urinaria, mecanismo que también se le atribuye a la disfunción del cuello vesical4.
La reacción acneiforme con pápulas rojizas y espinillas con distribución acneica en rostro y perioral se relacionó posiblemente al MDMA por estimular mediante la liberación de serotonina y afectar indirecta-mente las terminaciones nerviosas de las glándulas ecrinas por otros péptidos; por lo cual a través la estimulación sebácea favorece el desarrollo de espinillas31.
El daño hepático producido por una droga tiende a ser resultado de la propiedad hepatotóxico; pudiendo clasificarse en tipo I por lesiones que aparecen en la mayoría de los individuos y que dependen de la cantidad y dosis administrada, las cuales generan un daño directo en causa de un desequilibrio funcional intracelular o por compromiso en la membrana celular por lo que produce una necrosis focal o zonal. La tipo 2 es independiente de la dosis y del tiempo lo que puede ser generado por: A. Hipersensibilidad por un proceso inmunitario en la que mediante propiedades antigénicas da lugar a la sensibilización de linfocitos de manera que en exposiciones posteriores mediante una respuesta inmunitaria retardada genera necrosis hepatocelular y B. Idiosincrasia metabólica individual que facilita la acumulación de reactivos en las células hepáticas por un metabolismos individual deficiente que usualmente se exacerba o se produce bajo condiciones ambientales y genéticas suficientes para generar alteraciones funcionales o daño estructural. Para el tipo II la muerte celular es mediada por necrosis difusa, centrolobulillar, periportal o incluso células del lobulillo hepático (necrosis masiva)99.
Un uso agudo del MD se ha relacionado una cinética de estimulación con el cortisol, de lo cual resalta una disminución en el porcentaje de células CD4, CD8, Linfocitos T maduros (CD3), aunque el número de leucocitos permanece estable y con un pico de efectos en el sistema inmune en un lapso de 1 a 2 horas54. La disminución en la cuenta de células T CD como en la respuesta de los linfocitos se debe a una estimulación mitogénica de Fitohemaglutinina A, siendo esta a su vez dosis dependiente de la MDMA50. En un estudio con 18 usuarios masculinos de éxtasis a los que se les administro 100 miligramos de éxtasis a las 4 y 24 horas, los linfocitos T CD 4 redujeron un 30%, con la respuesta a la estimulación mitogénica de la Fitohemaglu-tinina A del 68%, una hora y media después de la primera dosis, como un incremento del 103% en el número de las células asesinas naturales o NK100. A las 4 horas la respuesta linfoproliferativa se reduce un 87%, el número de células T CD un 40%, en tanto que las células NK aumentan un 141%, en tanto que a las 24 horas la segunda dosis incrementa las alteraciones celulares usuales. Pese a que a las 24 horas del cese del consumo hay una restauración parcial del sistema inmune50,100, la repetición en las dosis de éxtasis incrementa los intervalos en los que la respuesta inmune se compromete y tienden a un riesgo mayor de infección en los consumidores habituales de la droga100.
Las convulsiones pueden ser provocadas por la alteración en el balance de la vía excitatoria e inhibitoria de los neurotransmisores asociado al efecto del MDMA en el cerebro65,101. Respecto al deterioro del flujo cerebral demostrado en tomografías computarizada por emisión de fotón único (SPECT por sus siglas en inglés), es un fenómeno atribuido a la vasoconstricción por la disminución en la serotonina inducida por el éxtasis47,48.
El síndrome serotoninérgico puede presentar en rangos que varían desde benigno hasta letal102-105. Su origen se debe a la estimulación del sistema serotoninérgico en el sistema nervioso central de los receptores postsinápticos 5-HT1A y 5HT2A106, pero tampoco se le responsabiliza a un solo receptor de causarla102. Dado su origen en el incremento de actividad del sistema serotoninérgico cualquier droga o combinación de drogas que incremente la neurotransmisión serotoninérgica puede causarlo107.
Respecto a microangiopatías trombóticas inducidas por drogas, corresponde a un tema que se tiende a categorizar en los síndromes que son mediados por respuesta inmune, como en los que pueden ocurrir después de la exposición de cualquier cantidad de droga108, por un mecanismo dependiente de anticuerpos, idiopática y síndromes no inmunes los cuales son dosis dependientes109,110. Ante la exposición de la droga se induce la formación de anticuerpos dependientes de la droga que causan toxicidad directa en los tejidos provocando la formación de trombos con gran cantidad de plaquetas en los capilares o arteriolas pequeñas. En algunas ocasiones el mecanismo de producción es no dosis dependiente e incluso no se sabe si lo que la produjo es el fármaco conocido u otro compuesto agregado110.
La enfermedad valvular puede ser originada por el incremento en la actividad serotoninérgica inducida por el MDMA111. El ecocardiograma y los hallazgos patológicos en las válvulas cardíacas observados en pacientes con enfermedad valvular inducida por drogas es similar a la enfermedad carcinoide cardíaca con compromiso valvular112. El vínculo entre ambas patologías se asocia a la elevación de la serotonina en el suero y plasma de la mayoría de paciente con la enfermedad carcinoide113; La activación de los receptores de 2B-Serotonina que se encuentran en la válvula mitral y aórtica, son necesarios para inducir enfermedad valvular111. Un estudio in vitro mostró que el MDMA y su metabolito N-desmetilado, 3,4-metilendioxianfetamina activo el receptor de serotonina 5-hidroxitriptamina 2B (5-HT2B), obteniendo una respuesta mutagénica prolongada en las células intersticiales valvulares humanas 1114.
Farmacología
Rutas de Administración y Dosis:
El MDMA en su presentación usual en tableta al cual se le conoce como Éxtasis, en tanto que en su presentación en polvo Molly, puede estar mezclada con diferentes componentes91. Al igual que en las anfetaminas, el MDMA y sus compuestos relacionados son aminas que pueden existir como bases libres, sales o ácidos. Las bases libres son volátiles y se pueden comercializar en inhaladores, aunque el grupo metilendioxi presente en el MDMA y el MDEA elevan tanto el punto de ebullición de la base libre que hacen muy difícil el poder esnifar el vapor de estos compuestos2. Las sales no son volátiles, pero, son solubles en agua y pueden por tanto ser administradas de forma intravenosa, oral o esnifarla al convertirla en polvo115-116.
El éxtasis o la tableta típica de MDMA en Europa y Norteamérica tiene un aspecto profesional con gran diversidad de estampados en ellas, aunque su composición en la tableta con respecto al MDMA varia117-118. La sustancia heterogénea que se comercializa en las calles puede no estar compuesta solo de MDMA y puede albergar adulterantes sintéticos más fáciles de obtener como feniletilaminas psicoactivas (2CB, 2CT2, 2CT7, DOM), Bromo-dragonfly, triptamina (DMT, 5 Meo-DMT y Foxy)119-120, cafeína, efedrina, metanfemina, para-metoximetanfetamina(PMA), ketamina, sales de baño (MDPV o metilendioxipirovalerona)121, meti-lendioxianfetamina (MDA), metilendioxietilanfetamina (MDEA), 3,4-metilendioxi-fenil-N-metilbutamina (MBDB)193,122 o diversas mezclas de estas sustancias6,123-124, no obstante la gran mayoría consiste solo de una droga activa125.
Respecto al consumo de tabletas por usuario este puede variar mucho; en Europa, Norte América y Australia se utiliza usualmente en fiestas, en lugar del consumo solitario126. Esto porque su popularidad permite postponer la fatiga haciendo que la persona baile por horas, para este propósito la dosis común va de 1 a 2 tabletas29,127, aunque ocasionalmente hay consumo altos de hasta 10 tabletas en conjunto con otras drogas128-130 que conllevan a efectos tóxicos e incluso fatales131.
Pese a que la dosis recreativa de MDMA es de 1-2 mg/kg, las píldoras usualmente contienen entre 50 a 150 mg de MDA (metabolito del MDMA)117-118, e incluso la cantidad de MDMA varia hasta 70 veces en diferentes lotes de tabletas, con cantidades que van de 0 a más de 100 mg6.
Farmacocinética
El MDMA usualmente se ingiere en pastillas de forma oral6, por lo cual se absorbe rápidamente en el tracto intestinal método que lleva a un inicio de sus efectos entre 30 y 60 minutos, como de un efecto pico reportados a los 90132 y 120 133-134 minutos y un pico en los niveles del cerebro entre 60 y 180 minutos135,así como una vida media de 8 a 9 horas132. En un estudio con voluntarios las dosis de 50 mg, 75 mg y 125 mg, representaron para los consumidores un pico en las concentraciones en sangre de 106 ng/ml, 131 ng/ml y 236 ng/ml, respectivamente, las cuales son concentraciones que se relacionan con niveles bajos debido a que el fármaco pasa fácilmente a los tejidos y se une a sus componentes6.
La metabolización del MDMA es realizada principalmente en el hígado en el sistema microsomal por el citocromo P450 en la isoforma 2D6 (CYP2D6)136, mediando la contribución con el citocromo P450, isoformas 1A2 y 3A4 (CYP1A2 y CYP3A4, respectivamente)137,138. El CYP2D6 degrada mayormente el MDMA mediante la 4-hidroxi-3-metoximetanfemina (HMMA); aunque para sujetos con pobre actividad de esta enzima exhiben en plasma mayor cantidad de MDMA y menor de HMMA. Otro de sus metabolitos es el MDA que se produce en menor cantidad e involucra los citocromos CYP3A4 y CYP2B6139.
En la degradación del MDMA actúan diversas enzimas, en donde algunas parecen estar saturadas en concentraciones pequeñas del fármaco, por lo que a medida que hay un incremento en la dosis y se saturan, las enzimas de mayor afinidad generan cambios desproporcionales en las concentraciones sanguíneas y cerebrales del fármaco, asociando que pequeños aumentos en la dosis se relacionen con grandes aumentos en la toxicidad140. Los metabolitos oxidativos primarios como glucurónido y conjugados de sulfato se excretan en la orina 141, aunque hasta un 75% del MDMA se excreta en la orina sin cambio136,142.
Del total de los citocromos hepáticos el citocromo P450 isoforma 2D6 soló representa el 1 al 2 % del total143,144, pero es responsable del metabolismo en aproximadamente 20 a 30% de los fármacos que son co-mercializados145,146. Dicha enzima presenta un polimorfismo genético que se clasifica en individuos por un fenotipo de pobre, extenso, metabolización ultrarrápida (PM, EM y UM, respectivamente)147; en donde más de 70 alelos se han descrito respecto a la conformación de esos fenotipos146. Para el caso de quienes presen-tan un metabolismo pobre se debe alelos homocigotos que presentan un borramiento del gen que genera una proteína inactiva y se les conoce colectivamente como alelos nulos, en cambio cuando hay presencia de alelos funcionales homocigotas se debe a un incremento de la proteína activa que produce el fenotipo de metabolización ultrarápida148. Muchos otros alelos generan una actividad disminuida pero no ausente del citocromo 2D6, lo que manifiesta un metabolizador intermedio y usualmente se le clasifica como de metabolización extensa (EM)149.
Es necesario destacar que algunas personas tienen una susceptibilidad individual al MDMA que se relaciona con un metabolismo alterado del Citocromo P450 CYP2D6, ya sea inhibido farmacológicamente o por un metabolismo defectuoso (presente en el 5-9% de caucásicos)4,122. El MDMA puede inhibir su propio metabolismo150, a razón de que la enzima que lo metaboliza principalmente disminuye su actividad porque para su recuperación es necesario se sintetice de nuevo con una vida media de recuperación para el citocromo 2D6 de 51-70 horas151-152. Un modelo de cinética in vivo sobre los efectos del MDMA relaciono que puede tomar hasta 260 horas recuperar el 90% de la actividad de CYP2D6 después de una dosis recreacional153. De igual forma la gravedad de la toxicidad metabólica del MDMA también puede depender de factores ambientales un espacio cerrado y la temperatura del lugar 6.
Dado que la vida media del MDMA es de 8 horas, toma aproximadamente 5 vidas medias eliminar el 95% de la droga para ser limpiado del cuerpo, por lo que la persistencia de los efectos secundarios puede estar presentes 2 días luego de su uso6,133,134. Debido a que algunos de los metabolitos del MDMA son farma-cológicamente activos, el efecto de estos o este (Su metabolito activo principal es MDA) podrá ser más larga que la del MDMA6, que para el caso del MDA tiene una vida media de 16-30 horas154.
Farmacodinamia
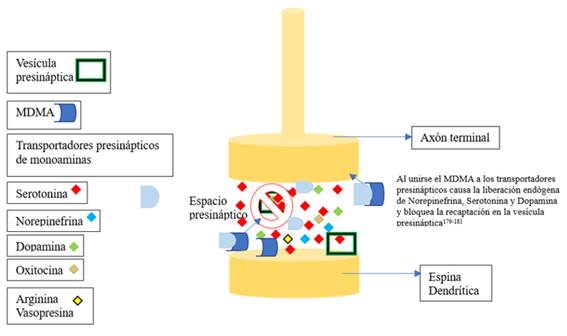
La 3,4-metilendioximetanfetamina o MDMA es una metanfetamina simpaticomimética que al unirse a los transportadores presinápticos de monoaminas causa la liberación endógena de norepinefrina, dopamina y serotonina155-157 y bloquea la recaptación de estos en la vesícula presináptica117,158,159 (Ver figura 3). La libe-ración de serotonina y norepinefrina contribuye a los efectos psicotrópicos de la MDMA en los seres humanos160-164. Agregado a ello también induce la liberación de oxitocina, a la que se le atribuye disminuir en la sensación de miedo165, además de la liberación de Arginina Vasopresina que induce la hiponatremia86.
El MDMA penetra la barrera hematoencefálica e interacciona con los sitios de reconocimiento en el cerebro, pero con quienes muestra una mayor afinidad es con los transportadores de serotonina, seguido de los de norepinefrina y dopamina. Se ha reportado la unión con receptores alfa 2 adrenérgico, serotonina (5-HT2), H1 de Histamina, betaadrenérgicos y los D1 y D2 de dopamina165,166.
Usualmente al hablar de los efectos del MDMA se toma como perspectiva que en exposición aguda de esta sustancia hay una marcada elevación de la 5-HT c3,4-metilendioximetanfetamina o MDMA es una metanfetamina simpaticomimética que al unirse a los transportadores presinápticos de monoaminas causa la liberación endógena de norepinefrina, dopamina y serotonina155-157 y bloquea la recaptación de estos en la vesícula presináptica117,158,159. La liberación de serotonina y norepinefrina contribuye a los efectos psicotrópicos de la MDMA en los seres humanos160-164. Agregado a ello también induce la liberación de oxitocina, a la que se le atribuye disminuir en la sensación de miedo165, además de la liberación de Arginina Vasopresina que induce la hiponatremia86.
El MDMA penetra la barrera hematoencefálica e interacciona con los sitios de reconocimiento en el cerebro, pero con quienes muestra una mayor afinidad es con los transportadores de serotonina, seguido de los de norepinefrina y dopamina. Se ha reportado la unión con receptores alfa 2 adrenérgico, serotonina (5-HT2), H1 de Histamina, betaadrenérgicos y los D1 y D2 de dopamina165,166.
Usualmente al hablar de los efectos del MDMA se toma como perspectiva que en exposición aguda de esta sustancia hay una marcada elevación de la 5-HT extracelular, la cual es generada por la liberación del 5-HT y de prevenir su recaptación al revertir la acción de la proteína transportadora 167,168. Esta droga además interactúa con el transportador de monoamina vesicular, que es responsable de re empaquetar la 5-HT citosólica libre en vesículas; al unirse el MDMA al transportador de monoamina vesicular se inhibe el reenvasado de 5-HT por lo que aumenta los niveles de 5-HT dentro de la célula y una salida sustancia de 5-HT a la sinapsis; respecto la noradrenalina y la dopamina tienen aumentos mediante un mecanismo similar165.
extracelular, la cual es generada por la liberación del 5-HT y de prevenir su recaptación al revertir la acción de la proteína transportadora 167,168. Esta droga además interactúa con el transportador de monoamina vesicular, que es responsable de reempacar la 5-HT citosólica libre en vesículas; al unirse el MDMA al transportador de monoamina vesicular se inhibe el reenvasado de 5-HT por lo que aumenta los niveles de 5-HT dentro de la célula y una salida sustancia de 5-HT a la sinapsis; respecto la noradrenalina y la dopamina tienen aumentos mediante un mecanismo similar165.
Por los efectos de la liberación de neurotransmisores se produce taquicardia, hipertensión y hipertermia117,135, mediando usualmente la norepinefrina como cardio estimulante y psicoestimulante en la respuesta del MDMA162,169. Aunque el MDMA tiene la capacidad de inducir respuesta por estos neurotransmisores, la concentración necesaria de MDMA para estimular la liberación de serotonina es 10 veces inferior que la necesaria para que se libere norepinefrina y dopamina9,83,170,171.
Los consumidores de MDMA tienden a alcanzar la experiencia de los efectos deseados una hora después de la administración oral158. Usualmente cuando hay un aumento de MDMA en el plasma, incrementan en los efectos buenos de la droga162. Quien consume MDMA disminuye la actividad de la amígdala y ínsula derecha en respuesta a disminuir los estímulos emocionales negativos e incrementa la actividad en la corteza superior frontal, así como la conectividad entre la amígdala y el hipocampo172-175.
La norepinefrina se asocia a los efectos psicoestimulantes del MDMA; aunque no se sabe cuáles receptores adrenérgicos están involucrados176-178. Otros estudios indican que los receptores adrenérgicos alfa 1 regulan los aspectos de la adicción psíquica, incluyendo la inducción de estimulación locomotora179-183, la liberación de dopamina en el sistema mesolímbico181,184,185, la administración a si mismo186 y la búsqueda de la droga186,187. Los efectos del receptor adrenérgico 1 alfa, también potencia los efectos psicoestimulantes sobre el sistema de dopamina, que se cree media principalmente los efectos gratificantes y reforzantes de las drogas de abuso188. A nivel cardiovascular los efectos del MDMA respecto al aumento de presión y taquicardia se relacionan con los receptores alfa y beta, esto porque al utilizar medicamentos que bloqueen estos receptores disminuye el efecto de la respuesta cardíaca asociado con el consumo de MDMA189-192.
En dosis de 1.5 mg/kg asocia efectos circulatorios que producen aumentar la frecuencia cardíaca en 28 latidos por minuto, la presión sistólica en 25 milímetros de mercurio, en 7 a la presión diastólica y el gasto cardíaco en dos litros por minuto193.
Al producir MDMA usualmente se obtiene combinaciones racémicas de sus estereoisómeros, pero los estereoisómeros difieren de uno a otro en aspectos importantes6. El estereoisómero S(+) MDMA es más potente que R(-) MDMA en producir los efectos subjetivos característicos del éxtasis194,195; además algunos estudios a su vez sugieren que el isómero R(-) tiene características como las que produce que el mescalina o el ácido lisérgido, en tanto que el isómero S(+) corresponde con propiedades similares a la anfetamina. A su vez los isómeros S(+) y R(-) de MDMA como de MDA difieren en las curvas de dosis respuesta respecto a la función serotoninérgica como de neurotoxicidad196. Agregado a ello los isómeros de MDMA también difieren en la velocidad a la que se convierten en sus correspondientes metabolitos de MDA197.
Debido a que tanto la cantidad MDMA como los componentes pueden variar en una tableta o en el polvo, la respuesta a la dosis también puede ser diferente de una persona a otra, y de igual forma este aspecto puede generar sobredosis desapercibidas198. Usualmente el ambiente en que se usan puede potenciar su toxicidad199, aunque dosis altas puras de MDMA han sido consideradas seguras al haber sido expuestas en algunos casos y sobrevivir198,200-201. El hecho de que alguna persona pueda resistir una dosis muy alta y pura no imposibilite las fatalidades por MDMA en otras personas, las cuáles han sido atribuidas a hipertermia, rab-domiólisis severa y hiperkalemia198; incluso se han usado para cometer suicidio6. Dado que la mayoría de los casos con toxicidad y muerte se asocian a concentraciones entre 0.5 y 10 mg/l202, e incluso se reportan en concentraciones tan bajas como 0.11-0.55 mg/l, la cual se encuentra dentro del rango normal o un poco por encima, hace remembranza a la gravedad de los factores ambientales al producir una fatalidad6. Probablemente la variabilidad de la dosis dependa del ambiente y de capacidad enzimática de cada individuo en un momento por lo que controversialmente la dosis letal 50 no ha sido calculada para el hombre, pero si ha determinado para mamíferos como ratas en 49 mg/kg, perros 14 mg/kg y macacos Rhesus en 22mg/kg203.
Interacciones con MDMA en forma de éxtasis:
Etanol: Nueve hombres sano con una media de 23 años, a los que se les aplicó un diseño cruzado, doble ciego, aleatorizado y control con placebo para la interacción de una dosis única de éxtasis de 100 mg y alcohol a 0.8 g/kg, reveló que la combinación de ambos productos revirtió la sedación del etanol aunque no disminuyó el deterioro psicomotor del procesamiento visual generado por el alcohol y amplió la sensación de euforia provocad por éxtasis y la concentración plasmática de éxtasis aumentó un 13%204.
Medicamentos:
Fármacos Serotoninérgicos: El éxtasis en combinación con otras sustancias serotoninérgicas como los antidepresivos inhibidores de la monoamino oxidasa (IMAO) y inhibidores reversibles de la monoaminooxi-dasa (RIMA) pueden causar complicaciones potencialmente letales asociadas con la presencia del síndrome serotoninérgico205.
Los inhibidores selectivos de la recaptación de serotonina (ISRS) se relacionan con reacciones adversas psiquiátricas por potenciar los efectos neuroquímicos e influir en el comportamiento4. La Moclobemida como inhibidor de la monoamino oxidasa A, aumenta los niveles de serotonina y se le ha asociado a muertes que tuvieron interacción con éxtasis206. Mediante la inhibición del citocromo CYP2D6 la cual es la vía principal por la que se metaboliza el MDMA, el Ritonavir genera interacciones clínicas relevantes207.
La doxazocina como un inhibidor de los receptores adrenérgicos alfa, redujo las elevaciones de MDMA en presión arterial, temperatura corporal, taquicardia y el estado de ánimo moderadamente atenuado, por lo que algunos autores interpretan que induce que los receptores alfa 1 se relacionan con la respuesta aguda cardio estimulante, de menor forma con la termogenia y los efectos eufóricos del MDMA en humanos186.
Neurotoxicidad a la serotonina
En altas dosis el MDMA induce una liberación masiva de serotonina no solo generando síntomas psicóticos agudos, sino también asociando daños químicos6.
Con respecto a los efectos a largo plazo en los usuarios con consumo de MDMA, cuando estos fue-ron examinados sin consumo de la droga, los niveles de serotonina y sus metabolitos en líquido cefalorra-quídeo fueron anormalmente bajos208, así como un número reducido de moléculas transportadoras de serotonina209-211, incremento en el número de células gliales212, alteración en los patrones del metabolismo de la glucosa y en el flujo sanguíneo en ciertas partes del cerebro213,214.
Electroencefalografías han identificado una disminución en la simetría bilateral de frecuencia y patrones de onda en usuarios de MDMA, similares a los cambios del envejecimiento y demencia215, y un cambio en la respuesta al estímulo auditivo que se identificó en usuarios con consumo de MDMA y no se manifestó en quienes consumían a cannabis o alguna otra droga216.
Muchos estudios han demostrado que el grado de cambio en la función de serotonina es proporcional a la duración e intensidad del consumo de MDMA, haciendo compatible que el uso de MDMA sea la causa más que la consecuencia deficiente de la serotonina6.
Hallazgos patológicos:
En el espectro de los hallazgos patológicos su mecanismo de daño se correlaciona con hipertermia y por un efecto tóxico4. Usualmente las muertes se ven asociadas a daño hepático significativo, lesión orgánica al cerebro con sangrado focal, edema macroscópico, signos neuronales, cambios hipóxicos, e incluso en un caso que falleció por intoxicación de agua, la glándula pituitaria estaba necrótica y se acompañaba de edema cerebral4.217,218. Otro de los mecanismos de daño que produce patologías tiende a ser la respuesta idiosincrática del éxtasis218.
Las vísceras pueden mostrar estasis poli visceral, petequias subserosas difusas; el corazón reveló bandas de contracción, necrosis con inflamación4,217, miocitólisis coagulativa, áreas de hemorragia suben-docárdica. Conviene aclarar que en los casos con necrosis coagulativa sin necrosis por infarto el mecanismo sugiere que es a causa de sobrecarga adrenérgica218.
En los pulmones puede estar presente la hemorragia subpleural e intraalveolar con edema severo e incluso en formaciones micro trombóticas en los capilares pulmonares. El hígado también reveló esteatosis micro vesicular, necrosis centrolobulillar con precipitación de fibrina en toda el área afectada por necrosis; en el riñón se demostró trombos de fibrina en los glomérulos, necrosis tubular aguda, mioglobina en el túbulo proximal218.
Con respecto a los casos con daño hepático. la biopsia percutánea ha demostrado rasgos de hepatitis aguda colestásica, colangitis, así como la presencia de histiocitos y eosinófilos que sugieren una respuesta de hipersensibilidad219.
Para el caso de mielopatía aguda con consumo de MDMA y heroína avaluada en una prueba de orina, el proceso patológico invadió principalmente las células de la asta anterior, representando así la muerte de las neuronas motoras, que continuó con las raíces nerviosas y el plexo lumbar a causa de la degeneración walle-rina.60
Valoración en toxicología de la presencia del MDMA
Analizar el cabello puede estimar si se utilizaron drogas en las últimas 4 semanas, con una relación aceptable acorde a lo indicado por quien menciona uso del éxtasis, aunque su estudio no muestra el patrón de uso del éxtasis, dosis ni dosis acumulativa de por vida220.
Un análisis que se ha utilizado para detectar la presencia de déficits en la memoria de los usuarios de éxtasis y sus cambios con regiones específicas del cerebro ha sido el N Acetilaspartaro; él cual es un marcador de disfunción cerebral o pérdida neuronal en la espectroscopia por resonancia magnética de protón220.
La técnica más común en la cuantificación del MDMA para tabletas de éxtasis es la cromatografía por gas, la cual se puede a acoplar a varios detectores: Espectrometría de masas, detector de nitrógeno fósforo, de ionización de llama. Determinar la pureza del éxtasis se puede cuantificar con la espectroscopia del infrarrojo cercano y la resonancia magnética nuclear cuantitativa de hidrógeno (1H-qNMR) que son técnicas que no necesitan un paso de separación221-223. Dado que la 1H-qNMR establece directamente en un área la cantidad de núcleos, facilita las herramientas forenses dado que no siempre se tiene un patrón del analito en estudio, además de que puede identificar y cuantificar otras sustancias presentes en una tableta de éxtasis 221,224,225.
Muertes asociadas a MDMA
Fue hasta 1987 cuando se atribuyeron las primeras muertes por MDMA en Estados Unidos226. En un estudio de Nueva York de enero de 1997 al 2000: 19366 muertes fueron relacionadas con éxtasis, aunque apenas en 13 de estas la causa de muerte fue por intoxicación aguda de MDMA y 2 por combinación de causas naturales y efectos de la droga227. Como el consumo de MDMA se asocia a un ambiente con incremento de la actividad física y termorregulación alterada como lugares cerrado con muchas personas en donde se haga ejercicios, estas condiciones ambientales puede favorecer a desarrollar inconsciencia, convulsiones, hipertermia, hiponatremia severa, taquicardia, hipotensión, coagulación intravascular diseminada, insuficiencia renal aguda y el fallecimiento4,, así como hipertensión, hipertemia, delirio, hemorragia intracraneana, estatus epiléptico y la muerte228, aunque por el simple hecho de la presencia de su consumo no se le puede atribuir al fármaco una muerte relacionada con su toxicidad.
Dado que el consumidor habitual de éxtasis tiende a abusar de otras drogas, las muertes relacionadas con el consumo de éxtasis tienden en su mayoría a que se hallen otras sustancias, tal y como se reveló en el Programa Nacional de Muertes por Abuso de Sustancias en Inglaterra y Gales en el periodo de 1996 al 2002, donde se registró 202 muertes, 75% de ella en menores de 29 años y con una incidencia de 4 hombres por cada mujer; agregado a ello únicamente en el 17% de ellas existió un consumo único de éxtasis, en tanto que las otras hubo un consumo predominantemente de alcohol, cocaína, anfetamina y opiáceos218.
En relación con el éxtasis y su dosis, la naturaleza de su toxicidad es impredecible probablemente por la variabilidad en sus componentes y del sujeto dado que en algunos casos la muerte puede ocurrir con una tableta y en otros a pesar de una gran ingesta de tabletas sobreviven4. En gran parte de los casos que mueren hay daño hepático significativo asociado a necrosis, otros tienen en corazón necrosis con bandas de contracción o necrosis con inflamación. Se ha establecido que para sujetos jóvenes con uso de drogas de novo o en quienes no las hayan utilizado previamente y reportan en el servicio de emergencias una pequeña ingesta de éxtasis con hepatomegalia, ictericia inexplicable, alteraciones en la función hepática y en ausencia de exposición a otras sustancias debe ser atribuida al consumo de esta droga e incluso la hepatotoxicidad puede ser la causa de su muerte229-231.
Uso del MDMA en medicina:
Efectos deseables del MDMA son: Aumento en la vigilia, en la resistencia y la sensación de energía, la excitación sexual, aplazamiento de fatiga y somnolencia29,70,232, sensación de bienestar, euforia, capacidad sensorial aguda, mayor sociabilidad, incremento de la sensación de cercanía a otras personas, extraversión y mayor tolerancia a las opiniones y sentimientos de otras personas13,28,70.
En la década de 1970 se le encontró su uso como agente terapeútico233,234, sin embargo, por su potencial de abuso las agencias gubernamentales de Estados Unidos colocaron restricciones estrictas para su uso158,235.
Alexander Shulgin en 1980 utilizó el Éxtasis en conjunto con la psicoterapia como un medio para mejorarla, estableciendo la sospecha de que esta droga mejora la vida, el estado de ánimo y asocia efectos cognitivos que perduran después de su uso; incluso contempló que en usuarios con predisposición psiquiátrica puede aumentar la separación de la toxicomanía aguda y crónica4.
Un estudio doble ciego con placebo controlado con 13 individuos sanos a los que se les suministró una dosis recreativa de MDMA de 1.7 mg/kg, determinó que el MDMA produjo un estado de mejor humor, bienestar, mayor capacidad de respuesta emocional, despersonalización leve, desrealización, trastornos del pensamiento, ansiedad, cambio en su sentido del espacio y tiempo, mayor conciencia sensorial y mayor impulso psicomotor236.
A pesar de que para el Trastorno de estrés postraumático hay tratamientos de primera línea que involucran combinaciones de farmacología y psicoterapia237, la respuesta es insuficiente en considerables cantidades de personas, en donde incluso abandonan del tratamiento238. Un tratamiento alternativo que se encuentra en desarrollo es la Psicoterapia asistida con 3,4-metilendioximetanfetamina; la cual ha sido valorado por la FDA como una terapia innovadora al completar el ensayo de fase 2239-241 y que continuo con un ensayo fase 3 en varios sitios242,243, como Israel, Estados Unidos y Canada 244. Dado su exposición en la terapéutica en el estudio de fase 2 se informó una tasa de éxito cercana al 60% en más de 100 casos con TEPT grave239-241,245. En el 2021 un estudio fase 3 concluyo que el MDMA en conjunto con la psicoterapia es altamente efectivo al tratar síndrome de estrés Postraumático severo y predomina su beneficio al comparar con sus co-morbilidades244.
Los efectos del MDMA tienen como terapéutica sus efectos incrementar las interacciones, disminuir las respuestas adversas a las expresiones faciales negativas, al rechazo social246; además incrementó la conducta prosocial y cooperativa247 quien en conjunto con la psicoterapia lo convierte en un tratamiento efectivo para el TETP248-252. La posibilidad de revivir la memoria sin una experiencia emocional extremamente negativa lo convierte en una terapéutica para los usuarios que usualmente abandonaban el tratamiento al revivir esos recuerdos 252-255.
El MDMA también ha sido contemplado para el tratamiento de ciertos desordenes de la salud mental y de adicción239,248-252,256-262, en particular como complemento de la psicoterapia tradicional. Incluso se ha generalizado para los desórdenes de ansiedad263, trastornos del estado de ánimo260, autismo 261,254, y abuso de sustancias256,265.
Al presentar 2 enantiómeros con diferente perfil neuroquímico, las opciones de tratamiento MDMA podrían ser más selectivas. El enantiómero R(-) es un liberador menos potente en la liberación de dopamina y más potente para liberar 5-HT266,267. Es importante que enantiómero del MDMA o esta sustancia en mezcla racémica produce efectos prosociales, ansiolíticos facilitando la extinción del miedo en pruebas preclínicas, pero el isómero R(-) produce menos efectos tóxicos que el S (+)268, e incluso menor potencial de abuso 269-271.
Áreas anatómicas diana en el funcionamiento del MDMA
Las estructuras anatómicas en las que se ha evidenciado actividad MDMA mediante la disminución de los transportadores de serotonina son el giro del cíngulo posterior, núcleo caudado izquierdo, tálamo, corteza occipital, lóbulo temporal medial, hipocampo y el tronco encefálico272. El deterioro de la memoria, el menor rendimiento en pruebas de memoria verbal se asocia al deterioro en la corteza prefrontal273, también hay una disminución en la respuesta de la amígdala izquierda, menor activación en el lóbulo temporal anterior izquierdo, y mayor actividad en circunvolución frontal superior y en la corteza dorsal prefrontal medial 274,275.
El tálamo alberga el núcleo dorso medial en su región medial, a su vez la parte medial del tálamo es responsable de la interacción de una gran variedad de información sensitiva como la olfatoria, la visceral y la somática, relacionando a su vez esta esta con sentimientos, emociones y estados subjetivos276. Una zona grande del cerebro que se localiza delante del área precentral e incluye las circunvoluciones frontales superior, media e inferior, la circunvolución orbitaria, la mayor parte de la circunvolución frontal y la mitad anterior de la circunvolución del cíngulo es la corteza prefrontal; dado que esta estructura participa en la elaboración de la personalidad del sujeto, regula la profundidad de los sentimientos de una persona e influye en la iniciativa y el juicio de un sujeto277, es de suma importancia. En la Figura 4 se puede apreciar algunas de estructuras del cerebro en las que el MDMA asocia como diana cuando se le utiliza en terapéutica.
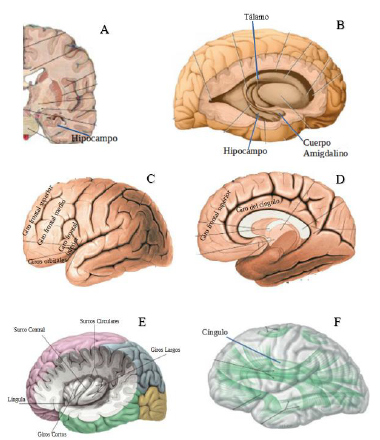
Figura 4 A. Corte Coronal a nivel de los cuerpos mamilares que permite distinguir la estructura del hipocampo en el cerebro278, B. Vista lateral del hemisferio cerebral derecho diseccionado para mostrar la posición del núcleo279, C. Visión del lado izquierdo, del hemisferio cerebral izquierdo278, D. Visión medial del hemisferio cerebral derecho278, E. Vista lateral del hemisferio izquierdo de la língula, giros cortos, giros largos, surco circular y surco central de la ínsula, F. Hemisferio cerebelar izquierdo con representación de los Tractos de asociación, asociaciones de neuro fibras, fibras arqueadas y fibra arcuata278.
Imagen A, C, D, E y F modificadas de Friedrich Paulsen y Jens Waschke. Atlas of Anatomy Sobotta: Head, Neck and Neuro-anatomy. Capítulo 12: Brain and Spinal Cord. Décimo sexta Edición. Elsevier: Múnich, Alemania 2018. pp 257-440, correspondientes respectivamente con las letras A, C, D, E y F a: Fig.12.29a, 12.25a, 12.25b, 12.21, 12.30. Imagen B modificada de figura 7-15 de Richard S. Snell PhD. Neuroanatomía Clínica. Capítulo 07: El Cerebro. Séptima Edición. Wolters Kluers Health: España 2014.
Tratamiento de efectos adversos causados por MDMA
En relación con las convulsiones provocadas por el consumo de MDMA, cuando se presente con o sin hiponatremia son tratadas con benzodiacepinas y la corrección del sodio en caso necesario. El mecanismo por el que el MDMA induce las convulsiones hace ilógico el tratamiento con fenitoína, esto porque la fenitoína es un agente que bloquea los canales de sodio y el mecanismo producción de las convulsiones por MDMA es debido a un balance alterado en la vía excitatoria e inhibitoria de los neurotransmisores65,101.
En relación con las otras patologías que se puedan inducir por el consumo de MDMA, así como las condiciones individuales que señalan la pauta a seguir el tratamiento necesario, así como la divergencia con el tema de estudio, se prefirió no abordar otras áreas de esta temática.
Presentación de Resultados
A propósito de un caso de toxicomanía con consumo de MDMA en el servicio de clínica médico forense:
Usuario de 29 años, con escolaridad hasta sexto año de escuela, que fue valorado el 11 de marzo del 2020 a las 13:00 horas por el Servicio de Clínica Médico Forense por solicitud de la autoridad judicial con la finalidad de “Determinar si el imputado es adicto a algún tipo de drogas”. Al preguntarle sobre la presencia de toxicomanías indicó que su preferencia es por el alcohol y la marihuana agregando que:
1-Inició el consumo de alcohol a los 11 años con cerveza. Mantiene un consumo mínimo de 1-2 cervezas por semana y máximo 3 cervezas. Con último consumo “una cerveza ahora el fin de semana, el do-mingo como a las 11 de la noche”, indicando que consume la cerveza sola, sin mezclarla con otros componentes.
2-Fumo cigarrillos de tabaco desde los 15 años, con consumo de 10-12 cigarrillos al día que mantiene hasta la actualidad. Con último consumo “ahorita temprano antes de entrar”, a las 13:00 horas aproximadamente.
3-Consume marihuana desde los 17 años, con consumo gradual que incrementó hasta 3 gramos al día de hoy, mediante fumado “lo compro, lo descapullo, en boleta especial, lo enrolo y lo fumo”. Estableció que el último fue ahora a las 12 medio día, “un puro, tal vez pueda ser menos de 1 gramo, como 0.8, tal vez”. Refiere consumirla porque lo relaja del estrés diario “lo hace más fácil”, refiere que ha consumido menos cantidad, por cambios emocionales con predominio de tristeza.
4-Indicó un consumo de cocaína mediante inhalación que inició a los 20 años, con consumo ocasional si acaso 1 al mes de 2 líneas, especificando que su último consumo fue hace más de 1 mes.
5-Negó consumir: Crack, sales de baño, heroína, raíz de ayahuasca, reina de la noche, ketamina, metanfetaminas, u otra droga.
Con respecto a su estado actual indicó que se sentía bien y concilia el sueño de forma adecuada. Como antecedentes personales patológicos presentó una lumbalgia ciática en el 2017 con su respectiva atención en el INS, negó: Antecedentes quirúrgicos y traumáticos, antecedentes psiquiátricos, antecedentes penitenciarios.
Acerca de su examen físico se realizó en presencia del Tutor del caso en donde fue posible distinguir que la persona utilizaba vestimenta particular en condición limpia y con un estado general bueno, hidratado, con sudoración tenue. Ingresó al consultorio por sus propios medios mediante deambulación sin apoyo. Fue colaborador en la entrevista, mostró un afecto eutímico, tono de voz adecuado para edad y sexo con uso de lenguaje popular. Conducta auditiva normoyente con adecuada comunicación y coordinación. Orientando en espacio, persona y tiempo. Un pensamiento de contenido real, con curso coherente y productivo, en ausencia de delirio negando la presencia de alucinaciones visuales o auditivas. No se asoció alteraciones en su sensibilidad, su capacidad intelectual estaba conservada, memoria reciente, remota y tardía conservadas. Capacidad de abstracción conservada, juicio conservado, con capacidad para realizar cálculos inadecuados.
Función piramidal, cerebelosa y vestibular sin plejías ni paresias, movimientos musculares y postura adecuada. Coordinación de movimiento sin alteraciones. Signo de Romberg positivo. Fuerza y tono muscular conservado y simétrico en miembros superiores e inferiores, reflejos osteotendinosos normorefléxdicos en las cuatro extremidades.
Su rostro es simétrico con presencia de pápulas rojizas acneiformes y clavillos en nariz, mejillas, comisura labial derecha. Ojos con pupilas midriáticas de 7 mm, normorreactivas a la luz con reflejo fotomotor y consensual positivo, movimientos extraoculares conservados, ausencia de pterigiones, indemnidad corneal, campimetría dentro de los rangos normales. Fondo de ojo normal, en ausencia de papiledema. Mímicas faciales y movilidad de lengua simétrica y conservada. Oídos con pabellones auriculares bien conformados e implantados, conductos auditivos externos permeables, membranas timpánicas semitransparentes sin rupturas, conducta normoyente, sostiene conversación a volumen usual. Nariz bien conformada sin cicatrices ni desviación de la pirámide nasal, hipertrofia del cornete nasal inferior derecho, tabique con hiperemia de forma difusa, que ante la exploración en narina derecha muestra cavitación en tabique con desecación. Agregado a ello en la exploración de la narina derecha en la región proximal del tabique nasal asocia adherencia de sustancia blanquecina de consistencia levemente granular similar a un polvo de color blanquecino, en ausencia de puntilleo hemorrágico y perforación anexo a la sustancia adherida. La boca tiene apertura conservada, con `piezas dentales naturales, conservadas, presencia de mancha sepia en piezas dentales en arcada dental superior e inferior, en ausencia de prótesis dental.
El cuello era cilíndrico, simétrico, bien conformado, en ausencia de sitios de punción, limitación de movimiento o quejas de dolor ante la exploración. Tórax simétrico, bien conformado con leve ginecomastia, sin anormalidades de forma ni limitación de movimiento o evidencia de sitios de punción. A la auscultación con ruidos cardíacos rítmicos sin soplos y campos pulmonares bien ventilados sin ruidos agregados. Abdomen con ausencia de sitios de punción, auscultación con peristalsis dentro de límites normales, palpándose blando, depresible en ausencia de masas, visceromegalias, sacos herniarios y sin aquejar dolor en la exploración. En las extremidades superiores no se registró sitios de punción ni hiperqueratosis en pulpejos, aunque si existía mancha sepia en pulpejo del dedo pulgar en la mano izquierda, sin aquejar alteraciones en la sensibilidad. Para las extremidades inferiores no se registró sitios de punción ni alteraciones en la sensibilidad; además tanto las extremidades superiores como inferiores fueron simétricas, con masa muscular normotónica, fuerza muscular conservada, arcos de movilidad conservados, reflejos osteotendinosos presentes y simétricos, sin alteraciones en la marcha de puntillas o talones.
Ante la Solicitud de la Autoridad Judicial, los hallazgos en la historia clínica y en la exploración física se solicitó una pericia conexa a Toxicología del Departamento de Ciencias Forenses para un análisis de drogas de abuso en Orina de: Cannabis, cocaína, opiáceos; así como en sangre Etanol y congéneres. Ante la solicitud del estudio, Toxicología recogió 2 tubos de sangre periférica de 9 ml y 2 tubos de orina con 12 ml que se analizaron con Extracción en fase Sólida (SPE), Cromatografía de gases con detector de masas (GC/MS) y Inmunocromatografía de flujo lateral. Toxicología a su vez documentó en orina un positivo presuntivo para MDMA, metanfetaminas, confirmatorio para cannabinoides por detectar carboxy-delta-9THC y no se detectó: Anfetaminas, benzodiacepinas, metabolitos de cocaína, morfina, EDDP (metabolito de meta-dona), oxicodona, ketamina, K2 (cannabinoides sintéticos) ni fentanilo. Agregado a ello el personal de toxicología determinó que “La presencia del metabolito carboxy delta-9-THC permite asegurar que hubo exposición a productos de cannabis en el organismo del imputado”
Discusión
Años previos han dado un precepto negativo, atribuido al MDMA. En estudios en animales se resaltó el potencial tóxico en humanos del MDMA, esto porque esta droga puede dañar selectivamente el axón de las neuronas de serotonina (5-HT) en los cerebros de los animales con los que se ha experimentado, en don-de incluso en monos la dosis tóxica es muy cercana a la de seres humanos280.
Mediante tomografía por emisión de positrones con un radioligando que marca selectivamente el transportador de serotonina (5-HT) se analizaron los resultados en humanos usuarios de MDMA sin consumo previo en 3 semanas y otros quienes negaron su uso previo; estableciendo que para los usuarios habituales de MDMA se presenció hechos que llevaron a la conclusión de neurotoxicidad por: 1. Disminución global y regional en la unión del ligando transportador 5-HT, 2.Redución el número de neuronas 5HT en comparación con los controles281.
Otro estudio de tomografía por emisión de positrones demostró que los transportadores de serotonina habían disminuido en los usuarios con ingesta actual de MDMA en el giro cingulado posterior, núcleo caudado izquierdo, tálamo, corteza occipital, lóbulo temporal medial, hipocampo y en el tronco encefálico272. Agregado a lo anterior se registró que las mujeres tienen mayores volúmenes de transportadores de serotonina que los hombres y en cuanto a los cambios del transportador de serotonina para los usuarios con consumo actual de MDMA, fueron los hombres quienes registraron deficiencia en la corteza occipital, lóbulos temporales mediales a comparación de las mujeres que tuvo disminución en todas las áreas excepto en la corteza auditiva272. Aunque en el estudio previo los cambios en el sistema de transporte de serotonina eran reversibles después de la abstención de MDMA272, otros autores contemplan que las consecuencias funcionales de las neuronas 5-HT en la corteza cerebral no son reversibles por el deterioro en la memoria de los consumido-res de éxtasis282.
Pese a que algunos estudios sostienen el MDMA como una neurotoxina por su asociación con el deterioro cognitivo en consumidores habituales y abstinencia de su uso por más de dos años72, también se asoció el deterioro en la memoria con patología neuronal en la corteza prefrontal en consumidores de éxtasis, por un menor rendimiento en pruebas de memoria verbal asociando a estos resultados a mayor pérdida o disfunción neuronal en los consumidores éxtasis por un daño neuronal serotoninérgico y deterioro de la memoria273.Una investigación evaluó la respuesta al éxtasis en periodos agudos y prolongados durante la etapa perinatal, adolescente y de adulto; sugiriendo que los adultos son más sensibles a una disminución del sistema de serotonina a largo plazo en tanto que los usuarios jóvenes la neuroplasticidad cerebral o el reacomodo a sus funciones es rápida y sustancial283.
El MDMA ha vuelto a retomar el ámbito en el área terapéutico que se le dio en los años 70 y 80; mediante investigaciones que evalúan la eficacia del MDMA en conjunto con psicoterapia para tratar enferme-dades de difícil abordaje y para facilitar el proceso de reconsolidación de memoria ante un evento traumático que ha hecho que su tratamiento supere los riesgos de su uso284. Sus efectos medicamentosos provocan disminuir la respuesta en la amígdala izquierda ocasionando disminución en la respuesta ante expresiones faciales de enojo274, e incluso mejora los resultados y la tasa de abandono al tratamiento285.
El MDMA cambia la respuesta en regiones del cerebro encargadas de la memoria, emociones, atención, aprendizaje284, estos cambios se pueden visualizar en un estudio por neuroimagen en individuos sanos a los que al uso MDMA se visualizó: menor activación en el lóbulo temporal anterior izquierdo, mayor activación de la circunvolución frontal superior y de la corteza dorsal prefrontal medial275, reducción del flujo sanguíneo en la amígdala286,287 y en el hipocampo286; reducir la conectividad entre la corteja medial prefrontal y el hipocampo en estado de reposo286, disminuir la actividad en la corteza insular288 e incremento el flujo sanguíneo en la corteza prefrontal ventromedial287. En la figura 4, se ejemplifican los cambios en el cerebro ante el uso de MDMA que se mencionaron previamente284.
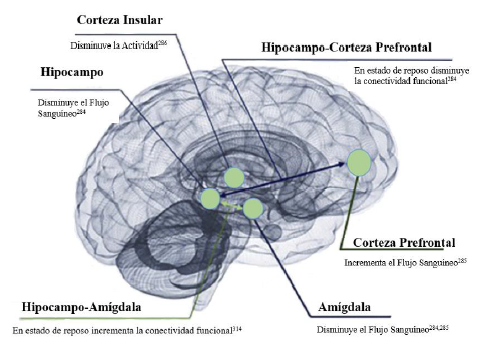
Figura 5 Efectos del MDMA en el cerebro contemplados por neuroimagen. Fuente: Imagen Modificada de Figura 1 de Allison A. Fedducia, y Michael C. Mithoefer. MDMA-assisted psycotherapy for PTSD: Are memory reconsolidation and fear ex-tinction underlying mechanisms?. Prog. Neuropsychopharmacol. Biol. Psychiatry PROG NEURO-PSYCHOPH, 8 de Junio 2018 [Citado el 30 de Agosto del 2021]: 84(Parte A): p. 221-228. Disponible en línea desde: https://doi.org/10.1016/j.pnpbp.2018.03.003
Objetivar el daño psíquico del usuario es un proceso difícil ya que al momento de demostrarlo depende de la experiencia personal del perito y la subjetividad en el momento de interpretar los datos e incluso establecer un estado anterior patológico podría agravar la complejidad del caso. Aunque en Costa Rica la estimación del daño psíquico se realiza a través de una valoración por un especialista en Psiquiatría, en España al momento de atribuir que una causa medie como efecto entre un daño cerebral o la aparición de psicosis esta debe estar vestida de traumático físico, asociado a aspectos como: a) ocurrencia del traumatismo y lesión cerebral consecutiva; b) síntomas inmediatos, pérdida de conciencia o síndrome confusional; c) que un cuadro esquizofrénico tenga como eje al trauma como elemento dañino, origen de persecución y perjuicio289.
En cuanto a la detección de una sustancia química exógena en el material biológico objetivo de la pericia, la gran cantidad de sustancias disponibles representan una limitación al momento en que el laboratorio elabora una investigación de tóxicos, ya que usualmente estos van dirigidos en favor de las estadísticas en la mayoría de casos290.
Usualmente el toxicólogo divide su análisis en dos métodos: 1. Test Generales y 2. Métodos cuantitativos fiables. Para la Prueba General se busca detectar un gran número de sustancias, de modo que los resultados negativos permitan centrar la atención en unos pocos grupos por lo que la muestra de orina da una gran ventaja en este método, en donde la concentración del tóxico puede llegar incluso a ser 100 veces mayor que en la sangre y dado la ausencia usual de proteínas, hay mínimas interferencias. Para los métodos cuantitativos fiables su presencia usualmente se confirma por dos métodos analíticos independientes, con procesos químicos independientes en base a la necesidad de un proceso cuantitativo exacto característico de la toxicología forense290.
Al interpretar una prueba de toxicología por medicina forense es necesario evaluar cuáles medicamentos pueden inducir un resultado positivo para un compuesto que se relaciona con toxicomanía; por ejemplo la selegilina es un inhibidor de la monoaminooxidasa (IMAO) que se utiliza para el tratamiento de la enfermedad de Parkinson y genera como metabolitos principales l-metanfetamina y l-anfetamina, así como la fenil propanoloamina que se encuentra en descongestionante nasal también presenta L-metanfetamina y l-anfetamina en su degradación, aunque en un cociente menor, por lo que estos fármacos pueden generar un falso positivo en un procedimiento por toxicología mediante un método que carezca de estudios de procedimientos quirales que permitan distinguir los diferentes isómeros de metanfetamina y anfetaminas291.
Aunque es posible que un producto que se venda de forma ilegal anunciándose en él un contenido principal de MDMA o con la etiqueta de MDMA puede que este producto tenga muy poca o nula cantidad de esta droga, y aun así en el 2019 la Unión Europea reveló que el contenido de droga promedio para los comprimidos de MDMA incautados en Europa osciló entre 118 y 210 miligramos de MDMA por comprimido, con un aumento de MDMA en los comprimidos de 149% en comparación con el 2009. Incluso la pureza media del MDMA en polvo registrada en el 2019 fue de 88% y en el 2020 del 81%7.
El DSM V clasifica la intoxicación aguda por MDMA en el diagnóstico de “Intoxicación por otros alucinógenos”, estableció como criterios diagnósticos: A- Consumo reciente de un alucinógeno distinto de fenciclidina, B- Comportamiento o cambios psicológicos clínicamente significativos durante o poco después del consumo de la sustancia como ansiedad, depresión notable, ideas de referencia, un juicio alterado por ideas paranoides. C- Cambios en la percepción que suceden estando plenamente despierto y alerta (intensificación subjetiva de las percepciones, despersonalización, pérdida de contacto con la realidad, ilusiones, alucinaciones, sinestesias) que aparecen poco o después del consumo de alucinógenos. D- Dos o más de los siguientes signos que aparecen durante o poco después de consumir el alucinógeno: 1. Dilatación pupilar, 2. Taquicardia, 3. Sudoración, 4. Palpitaciones, 5. Visión borrosa, 6. Temblores, 7. Incoordinación. E- Los signos o síntomas no se pueden atribuir a ninguna otra afección médica y no se explican mejor por otro trastorno mental, incluida una intoxicación por otra sustancia. En donde el tiempo de persistencia de los síntomas se asocia al producto como en el MDMA que puede durar varias horas o más292.
Conclusiones
En la historia médico legal el usuario manifestó un consumo reciente de alcohol, tabaco, marihuana, cocaína, alteración en la capacidad de cálculo y en su exploración física asoció midriasis pupilar, hiperemia del tabique nasal al inspeccionarse desde la narina derecha, en donde se demostró la presencia de una sustancia blanca granular en presentación de polvo adherida al tabique nasal y cavitación en la región distal del tabique. Una exploración bucal reveló mancha sepia en arcada dental superior e inferior, así como mancha sepia en el pulpejo del dedo pulgar de la mano izquierda.
Los hallazgos encontrados tanto en la historia médico legal como en el examen físico son compatibles con el consumo reciente y crónico de sustancias de abuso psicotrópicas fumadas e inhaladas que fueron demostrados mediante un estudio de toxicología con un positivo presuntivo por MDMA, metanfetaminas y un confirmatorio de cannabinoides al detectar carboxy-delta-9THC.
Dado de que el estudio que reveló la presencia de MDMA y metanfetaminas no es confirmatorio, se podrían utilizar técnicas como la resonancia magnética nuclear cuantitativa de hidrógeno (1H-qNMR), que permite disminuir el tiempo de procesamiento por separación, facilitar la identificación de cualquier sustancia de una droga ilegal y cuantificar la sustancia química sin necesidad de utilizar un análisis estándar, en comparación con los métodos cromatográficos que si lo requieren. Incluso este método permite reducir costos al no requerir un material de referencia con certificado, agiliza el análisis forense y puede enfrentarse a una composición de muestras impredecibles293. Valorar las posibilidades de otros métodos de análisis se enfoca en distinguir métodos que permitan una mayor capacidad de respuesta al servicio forense, aunque se esclarece que el servicio de Toxicología si determinó el MDMA y metanfetaminas en una inmunocromatografía de flujo lateral que corresponde a un test de screening general y no es una prueba que permita distinguir la sustancia de forma específica.
A pesar de las limitaciones en los análisis de los estudios por toxicología, previo a esa prueba era posible concluir que el usuario mostró signos clínicos que pueden estar relacionados pero no son específicos del consumo agudo y crónico de sustancias de abuso psicotrópicas fumadas e inhaladas.
La sustancia adherida en el tabique nasal y el resultado de toxicología de un positivo presuntivo para MDMA y metanfetaminas, junto con el confirmatorio del metabolito carboxy delta-9-THC, permiten distinguir que el usuario es compatible con una toxicomanía con abuso reciente de Molly y confirmatoria por cannabinoides.