En la dieta de las abejas melíferas (Apis mellifera L.) el polen es el mayor recurso de proteínas, minerales, vitaminas y aceites vegetales, esenciales para el crecimiento y desarrollo de las larvas y abejas jóvenes (Ahmed, 2008; Brodschneider & Crailsheim, 2010; Nicolson, 2011). Ellas recolectan el polen removiéndolo de las anteras de las flores, los acopian en sus corbículas (cargas corbiculares) y almacenan en celdas especiales para su posterior consumo (Thorp, 2000; Sá-Otero, Marcial-Bugarin, Armesto-Batzan, & Diaz-Losada, 2002; Baldi-Coronel, Grasso, Chavez-Pereira, & Fernández, 2004; Ramirez & Montenegro, 2004).
Los bosques tropicales y subtropicales son una importante fuente de recursos utilizados como bienes y servicios fundamentales para el bienestar de las poblaciones humanas (Balvanera, 2012). Una de las áreas boscosas más importante en Argentina son las Yungas subtropicales, también conocidas como selva tucumano-boliviana o selva tucumano-oranense (Cabrera, 1971, 1994; Malizia, Pacheco, Blundo, & Brown, 2012), ubicada en el sur de Bolivia y noroeste de argentina (entre los 19 ° y ٢٩ ° de latitud Sur) con una superficie aproximada de 56 000 km2. Estos bosques tienen gran importancia en términos de biodiversidad y provisión de bienes y servicios ambientales (Brown, Pacheco, Lomáscolo, & Malizia, 2006), entre ellos la apicultura que contribuye a la polinización de numerosas especies y la obtención de productos diferenciados (e. g. miel, polen, cera). En este sentido, esta actividad ayudará a las comunidades que allí viven a valorar la biodiversidad favoreciendo la inclusión de prácticas de conservación del bosque como parte del manejo (Chamorro-Garcia, León-Bonilla, & Nates-Parra, 2013).
Para determinar la relación entre las abejas y los recursos florales, se realizan estudios palinológicos de las cargas corbiculares, lo que permite identificar las diferentes plantas que contribuyen a la dieta de las colmenas (Basilio, 2000; Saya-Rivera & Huamán Mesía, 2009). En efecto, la caracterización de la flora melífera de una región puede ser usada para determinar el origen botánico o geográfico de la miel y polen (Andrada, 2003; Forcone, Aloisi, Ruppel, & Muñoz,. 2011). Esta información puede ser usada para destacar las especies vegetales significativas para el desarrollo y mantenimiento de la colonia, como también para planificar cosechas de cargas corbiculares para su comercialización (Montenegro, Gómez, & Avila, 1992).
El análisis de los recursos poliníferos utilizados por Apis mellifera ha sido abordado por diversos autores de Sudamérica (Sayas Rivera & Huamán Mesía, 2009; Chamorro-Garcia et al., 2013; Montenegro, Pizarro, Mejias, & Rodriguez, 2013; Salamanca, Mónica, Tangarife, & Casas, 2014). En Argentina se encuentran los trabajos de Tellería (1993); Basilio (2000); Faye, Planchelo, & Molineli (2002); Andrada (2003); Andrada & Tellería (2005); Nabb & Tamame (2007); Forcone et al., (2011); Forcone & Ruppel (2012) y para el noroeste argentino solo el reporte de Burgos, Sánchez, & Lupo (2015) para la región del Chaco Serrano de la provincia de Jujuy.
En este contexto, el presente trabajo tiene como objetivo identificar la flora polinífera utilizada por A. mellifera en el sector oeste de las Yungas, en la provincia de Jujuy y analizar sus variaciones a lo largo de dos periodos productivos consecutivos. Esto aporta al conocimiento del recurso ofrecido por el bosque y las especies que son de importancia para las colmenas. Además, esta información contribuye a potenciar la producción y comercialización de las cargas corbiculares a partir de su valor agregado, y ayuda a los apicultores a un adecuado manejo de las colmenas.
Materiales y métodos
Área de estudio: La recolección de las cargas corbiculares se realizó en un apiario ubicado en la localidad de Tilquiza (24º05’ S & 65º17’ W; 1 500 msnm), departamento Dr. Manuel Belgrano, Jujuy, Argentina. La vegetación del área corresponde al Distrito de Selva Montana de la Provincia Fitogeográfica de las Yungas, caracterizado por la presencia de especies arbóreas como Allophylus edulis (A.St.-Hil., A.Juss. & Cambess.) Radlk., Blepharocalyx salicifolius(Kunth) O. Berg, Celtis brasiliensis (Gardner) Planch, Ilex argentina Lillo, Juglans autralis Griseb., Prunus tucumanensis Lillo., Zanthoxylum coco Gillies ex Hook. f. & Arn., entre otros. Entre las especies arbustivas y herbáceas se encuentran Baccharis salicifolia (Ruiz & Pav.), Boehmeria caudata Sw., Cestrum lorentzianum Griseb., Piper tucumanum C. DC, Urera baccifera (L.) Gaudich., entre otras (Cabrera, 1994). En cuanto a la geomorfología es un área montañosa y el clima es subtropical serrano, con temperaturas medias que varían de 13 °C a 25 °C. La precipitación media anual oscila entre 649 a 1 472 mm, concentradas en la época estival (Chafatinos & Nadir, 1990; Buitrago, 1999).
La forestación (especialmente de Pinus sp. y Eucalyptus sp.) y la ganadería de subsistencia son las principales actividades productivas de la zona (Braun Wilke et al., 2013). Allí, la apicultura es una actividad complementaria y la ciudad de San Salvador de Jujuy es el principal mercado de comercialización para los productos apícolas.
Recolección de cargas corbiculares: El muestreo se realizó mensualmente durante dos periodos productivos apícolas consecutivos, desde setiembre 2011 a marzo 2012 y de setiembre 2012 a marzo 2013. Para el área de estudio se considera periodo productivo apícola a los meses comprendidos entre setiembre y marzo, simultáneo a la etapa de mayor floración de las especies vegetales. Las muestras se recolectaron con trampas caza polen colocadas en las entradas de cinco colmenas seleccionadas al azar de un total de 25, entre las 9:00 y 13:00, por ser estas las horas de mayor actividad de las abejas (Louveaux, 1958, Sayas Rivera & Huaman Mesía, 2009).
Recolección de especies vegetales: Con el fin de conocer la disponibilidad de recursos alimentarios y contribuir a la palinoteca de referencia del sitio de estudio, durante cada visita se recolectaron las especies vegetales en flor mediante la metodología estándar de herborización. Se realizaron transectas en un radio aproximado de 2 km desde el apiario, teniendo en cuenta la topografía del área y su accesibilidad.
Procesamiento de las muestras: Para cada mes se unificaron las cargas corbiculares cosechadas y con el uso de un mortero se disgregaron, homogeneizaron, y tomándose el valor promedio de 0.5 g del total, se procedió a su tratamiento por Acetólisis (Erdtman, 1960; Burgos et al., 2015). Cuando fue necesario (cargas corbiculares aglutinadas a restos vegetales, propóleo, cera y segmentos de abejas) las muestras se diluyeron en alcohol etílico 96 % previamente al proceso de Acetólisis.
Observación microscópica: Para las observaciones se utilizaron los microscopios ópticos Zeiss ISC KS2 y Leica DM 500 con cámara digital incorporada (ICC50). Se trabajó con una magnificación de 40X para el conteo y de 100X para la medición, identificación y obtención de las microfotografías de los tipos polínicos. La identificación se realizó con el uso de atlas palinológicos (Markgraf & D´ Antoni, 1978; Pire, Anzoátegui, & Cuadrado, 1998, 2002, 2006, 2013) y la confrontación con la Palinoteca de Referencia del Laboratorio de Palinología (PAL-JUA) de la Facultad de Ciencias Agrarias de la Universidad Nacional de Jujuy. La nomenclatura de los tipos polínicos se estableció de acuerdo a Joosten & De Klerk (2002) y De Klerk & Joosten (2007). En aquellos casos en los que no se asignó una categoría taxonómica, se utilizó en término “tipo”, con los cual se supone que el polen tiene semejanza con alguna especie, género o familia botánica. En el caso del tipo polínico Eupatorium, por sus características palinológicas reúne a las especies Austroeupatorium inulifolium (Kunth) R.M. King & H. Rob. y Campovassouria cruciata (Vell.) R.M. King & H. Rob., dos especies representativas en el área de estudio.
En cada muestra se efectuó el conteo de un mínimo de 600 granos de polen y se determinaron las clases de frecuencia para cada tipo polínico adaptando la clasificación propuesta por Louveaux, Maurizio, & Vorwhol (1978) para mieles, en la que se considera Dominante (D): > 45 %, Secundario (S): 16-45 %, Menor importancia (M): 3-15 % y Trazas (T): < 3 %. La frecuencia de ocurrencia de los tipos polínicos en el total de las muestras fue determinada de acuerdo a Feller-Demalsy, Parent, & Strachan (1987), como muy frecuente (MF: > 50 % de las muestras), frecuente (F: > 20 - 50 %), poco frecuente (PF: 10 - 20 %) o raro (R: < 10 %). Se calcularon además los valores de importancia de las familias (IF) mediante las siguientes fórmulas (Nates-Parra et al., 2013): IFi= ∑ Promedio AR especies de i * N° de muestras i / N° total de muestras, donde i representa la familia botánica.
La riqueza polínica de cada muestra se estableció adaptando el índice de riqueza específica (S) propuesto por Moreno (2001) y para comparar estadísticamente ambos periodos de estudio, se realizó una prueba t de Student (α = 0.05) para muestras pareadas usando el software R (R Develoment Core Team, 2017).
Análisis de Agrupamiento: Con el fin de observar las variaciones de los recursos poliníferos a través de los periodos estudiados, se realizó un diagrama polínico con el programa Tilia 2.0.14 (Grimm, 2011) teniendo en cuenta la abundancia y frecuencia de los tipos polínicos en las muestras. Para la confección de la base de datos, se ingresaron 14 muestras con una cantidad de 46 variables, equivalentes a los tipos polínicos identificados. Además, para determinar los potenciales periodos de recolección de las abejas, se efectuó un análisis de agrupamiento de las muestras y para la comparación se empleó el Coeficiente de Disimilitud de Edwards & Cavalli-Sforza.
Amplitud del nicho trófico: En este estudio el término nicho trófico se utiliza para expresar la variable recursos florales visitados por A. mellifera. Para evaluar la amplitud del nicho trófico de A. mellifera en cada mes de muestreo se utilizó el índice estandarizado (Bst) propuesto por Colwell & Futuyma (1971): Bst = (Bobs - Bmin) / (Bmax - Bmin), donde Bobs corresponde al índice de Levins (B = 1/∑pi 2, siendo pi la frecuencia relativa de los tipos polínicos), Bmin =1 (la amplitud de nicho mínima posible) y Bmax = n (la amplitud de nicho máxima posible). Los valores de este índice varían desde 0 a 1, indicando una amplitud de nicho baja a alta respectivamente. Para su cálculo se utilizó el programa Microsoft Excel. Asimismo, para comprobar si existen diferencias estadísticas entre los periodos estudiados, se realizó un test de comparación (Prueba t de Student, α = 0.05) utilizando el software R (R Develoment Core Team, 2017).
Resultados
Para los períodos estudiados se hallaron un total de 46 tipos polínicos, de los cuales 14 se identificaron a nivel de especie, 24 a nivel de género, 8 a nivel de familia y un tipo polínico indeterminado (Cuadro 1). Del total, el 66 % pertenece a la flora nativa, el 21 % a la flora exótica y el 13 % a flora de origen indeterminado.
Cuadro 1: Recursos poliníferos utilizados por Apis mellifera en la localidad de Tilquiza (Sector Oeste de las Yungas) Jujuy-Argentina. Table 1: Pollen loads used by A. mellifera in Tilquiza (Western of Yungas) Jujuy, Argentina
| Polínicos | Muestras de polen corbicular | |||||||||||||||
| 2011-2012 | 2012-2013 | |||||||||||||||
| Set | Oct | Nov | Dic | Ene | Feb | Mar | FO | Set | Oct | Nov | Dic | Ene | Feb | Mar | FO | |
| Amaranthaceae | ||||||||||||||||
| Amaranthus | T | T | 29 | |||||||||||||
| Asteraceae | T | T | T | T | 57 | |||||||||||
| Baccharis | M | T | M | M | 57 | T | T | 29 | ||||||||
| Elephantopus mollis | T | 14 | ||||||||||||||
| Eupatorium | D | M | 29 | |||||||||||||
| Gnaphalium | T | M | 29 | |||||||||||||
| Senecio | T | M | T | 43 | M | M | 29 | |||||||||
| Vernonia | T | 14 | ||||||||||||||
| Viguiera | S | 14 | T | D | 29 | |||||||||||
| Taraxacum | T | T | 29 | |||||||||||||
| Cactaceae | D | 14 | ||||||||||||||
| Cucurbitaceae | ||||||||||||||||
| Sicyos | S | 14 | T | 14 | ||||||||||||
| Caprifoliaceae | ||||||||||||||||
| Tipo Sambucus | M | 14 | ||||||||||||||
| Celtidaceae | ||||||||||||||||
| Celtis | T | T | T | T | 57 | T | 14 | |||||||||
| Euphorbiaceae | T | D | T | 43 | ||||||||||||
| Croton | M | 14 | ||||||||||||||
| Sebastiania | S | D | D | T | T | M | 86 | M | T | 29 | ||||||
| Escalloniaceae | ||||||||||||||||
| Escallonia schreiteri | M | T | M | 43 | ||||||||||||
| Fabaceae | M | T | 29 | |||||||||||||
| Sub fam. Mimosoideae | ||||||||||||||||
| Acacia aroma | M | M | 29 | T | T | 29 | ||||||||||
| Anadenanthera colubrina | T | T | T | 43 | S | M | 29 | |||||||||
| Mimosa | D | S | T | 43 | M | D | 29 | |||||||||
| Parapiptadenia excelsa | S | T | T | 43 | D | 14 | ||||||||||
| Juglandaceae | ||||||||||||||||
| Juglans australis | T | M | 29 | M | M | T | 43 | |||||||||
| Myrtaceae | T | T | 29 | |||||||||||||
| Blepharocalyx salicifolius | T | S | S | M | M | 71 | S | 14 | ||||||||
| Eucalyptus | T | T | 29 | D | T | 29 | ||||||||||
| Moraceae | ||||||||||||||||
| Morus | M | 14 | M | 14 | ||||||||||||
| Oleaceae | ||||||||||||||||
| Ligustrum | M | T | 29 | T | 14 | |||||||||||
| Fraxinus | T | 14 | T | 14 | ||||||||||||
| Onagraceae | T | T | 29 | |||||||||||||
| Pinaceae | T | 14 | T | T | 29 | |||||||||||
| Poaceae | M | T | 29 | S | M | M | 43 | |||||||||
| Zea mays | T | 14 | T | T | 29 | |||||||||||
| Ranunculaceae | ||||||||||||||||
| Clematis | S | 14 | T | S | 29 | |||||||||||
| Rosaceae | ||||||||||||||||
| Prunus tucumanensis | M | 14 | ||||||||||||||
| Rubiacea | ||||||||||||||||
| Randia micracantha | T | 14 | ||||||||||||||
| Rutaceae | ||||||||||||||||
| Zanthoxylum | D | T | 29 | |||||||||||||
| Salicaceae | ||||||||||||||||
| Salix humboldtiana | T | T | 29 | |||||||||||||
| Sapindaceae | ||||||||||||||||
| Allophylus edulis | T | T | T | 43 | ||||||||||||
| Serjania | T | 14 | ||||||||||||||
| Solanaceae | ||||||||||||||||
| Vassobia breviflora | T | 14 | ||||||||||||||
| Verbenaceae | ||||||||||||||||
| Clerodendrum foetide | T | 14 | ||||||||||||||
| Cantinoa | T | 14 | ||||||||||||||
| Vitaceae | ||||||||||||||||
| Tipo Cissus | S | D | T | 43 | ||||||||||||
| Iridaceae | ||||||||||||||||
| Herbertia | T | T | 29 | |||||||||||||
| Indeterminado | S | T | 29 | T | T | 29 | ||||||||||
| RIQUEZA POLÍNICA | 11 | 12 | 6 | 8 | 8 | 11 | 20 | 8 | 8 | 10 | 5 | 8 | 14 | 5 | ||
Clases de Frecuencias: D: Dominante, S: Secundario, M: Menor importancia, T: Traza. FO: Frecuencia de ocurrencia.
Frequency clases D: Dominant, S: Secundary, M: Minor importance, T: Traza. FO: Frequency occurrence.
Desde el punto de vista estadístico la riqueza polínica no presentó diferencias significativas entre ambos periodos (Prueba de t, t(12) = 0.21, P > 0.05). Para el periodo 2011-2012 la riqueza varió entre 6 y 20 tipos polínicos por muestra y un promedio de 11 tipos polínicos, y para el periodo 2012-2013, entre 8 y 14 tipos polínicos por muestra con un valor promedio de 8.
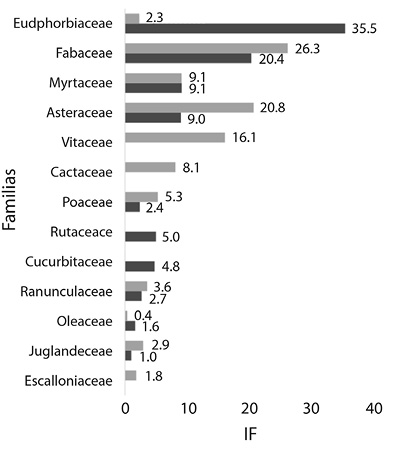
En el total de tipos polínicos se encuentran representadas 25 familias botánicas siendo las de mayor riqueza polínica las familias Asteraceae y Fabaceae, con 9 y 5 tipos polínicos respectivamente. No obstante, de acuerdo al índice de importancia de familia (IF), Euphorbiaceae presentó el mayor valor para el periodo 2011 - 2012, seguidas por las familias Fabaceae, Asteraceae, Myrtaceae y Rutaceae. En el periodo 2012 - 2013, la familia Fabaceae mostró el mayor valor de IF seguidas por las familias Asteraceae, Vitaceae, Myrtaceae y Cactaceae, entre otras (Figura 1).
Los recursos polínicos dominantes durante el primer periodo estudiado (2011-2012) fueron Zanthoxylum en setiembre, Sebastiania en noviembre y diciembre, Mimosa en enero y Euphorbiaceae en febrero. En el segundo periodo (2012 - 2013) se presentaron como dominantes Cactaceae en setiembre, Parapiptadenia excelsa en octubre, Eupatorium en noviembre, tipo Cissus en diciembre, Eucalyptus en enero, Mimosa en febrero y Viguiera en marzo.
De acuerdo a la frecuencia de ocurrencia, los tipos polínicos muy frecuentes durante el periodo 2011 - 2012 fueron: Baccharis, Blepharocalyx salicifolius, Celtis, Sebastiania y representantes de la familia Asteraceae. En el periodo 2012-2013 no se presentaron tipos polínicos muy frecuentes.
Análisis de agrupamiento: De acuerdo al análisis efectuado se identificaron dos grupos principales, A y B, subdivididos a su vez en los subgrupos A1 y A2, y B1 y B2 respectivamente (Figura 2). El subgrupo A1 abarca los meses de setiembre a diciembre de 2011 y en orden decreciente de importancia se caracterizó por la presencia de Sebastiania en octubre (41.5 %), noviembre (61.9 %) y diciembre (78.5 %), seguido por Zanthoxylum en setiembre (49.8 %) y Blepharocalyx salicifolius con valores entre 2.74 % y 29 % durante todo el periodo. Otros recursos utilizados son Baccharis en los meses de setiembre (16 %), noviembre (0.6 %) y diciembre (5.1 %), Senecio en setiembre (2.6 %), octubre (3 %) y diciembre (0.7 %), Parapiptadenia excelsa en octubre (19 %) y noviembre (0.5 %), Acacia aroma en octubre (3.1 %) y noviembre (8 %), y Juglans australis en setiembre (2.3 %) y octubre (4.7 %). El subgrupo A2, que comprende el periodo entre enero 2012 a octubre del mismo año, se caracterizó por altos valores de Mimosa en enero (83.3 %) y febrero (31 %), seguido por representantes de las familias Euphorbiaceae (febrero 64.8 %) y Cactaceae (setiembre 58.6 %), y los tipos polínicos Sicyos (marzo 35.7 %) y Parapiptadenia excelsa (octubre 48.9 %). Otros recursos de importancia para este periodo fueron Clematis (marzo 18.7 %), Viguiera (marzo 20.2 %), tipo Sambucus (setiembre 12.3 %), Escallonia schriterie (setiembre 9.9 %), Juglans australis (setiembre 10.2 % y octubre 9.9 %), Baccharis (octubre 16.4 %) y Sebastiania (enero 1.2 %, febrero 1.7 %, marzo 3.3 % y octubre 11.9 %).
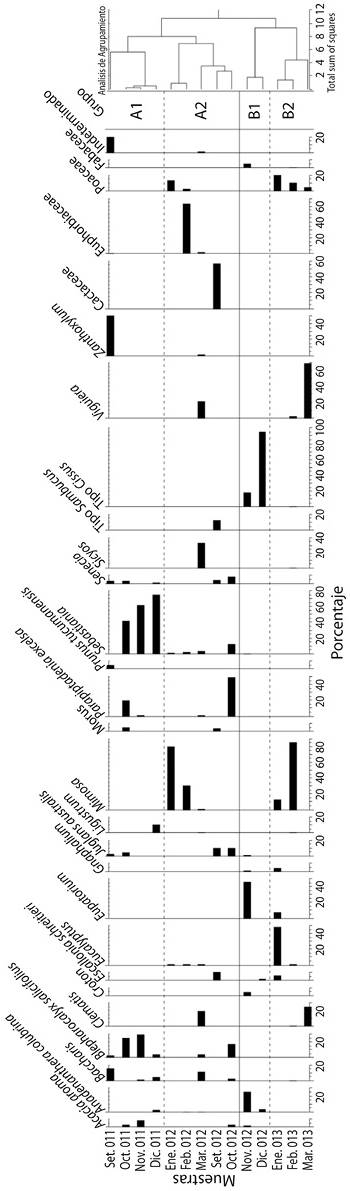
Figura 2 Diagrama polínico de los recursos poliníferos utilizados por Apis mellifera L. en la localidad de Tilquiza (Sector Oeste de la Yungas) Jujuy- Argentina durante los periodos 2011-2012 y 2012-2013.
El subgrupo B1, que abarca los meses de noviembre y diciembre 2012, se caracterizó por la presencia de tipo Cissus (noviembre 18 % y diciembre 95.8 %), acompañado de Eupatorium (noviembre 45.9 %) y Anadenanthera colubrina (noviembre 24.5 % y diciembre 3 %). Por último, el subgrupo B2, que abarca enero, febrero y marzo 2013, se caracterizó por la presencia de Mimosa (enero 13.2 %, y febrero 85.8 %), seguido de Eucalyptus (enero 48.7 %), Viguiera (febrero 1.7 % y marzo 70.2 %), Clematis (marzo 24.3 %), y representantes de la familia Poaceae (enero 20.5 %, febrero 14.4 % y marzo 5.1 %).
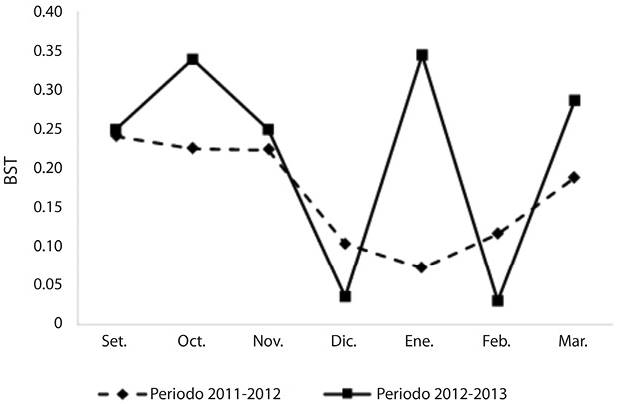
Amplitud de nicho trófico: Los valores de amplitud de nicho trófico calculados para el periodo 2011-2012 varían entre 0.07 y 0.24, con un valor promedio de 0.17 y para el periodo 2012-2013 entre 0.03 y 0.34 con un valor promedio de 0.22 (Figura 3). La comparación de ambos periodos no presentó diferencias significativas (Prueba de t, t (12) = 0.22, P > 0.05). En general, se observó que durante el inicio del periodo productivo los valores obtenidos son superiores (0.24, 0.25) a los registrados a mitad de la temporada (0.1, 0.03). Durante esta etapa inicial, Zanthoxylm, Cactaceae, Prunus tucumanensis, Baccharis, Morus, tipo Sambucus y Escallonia schreiterie, entre otros, constituyen los principales aportes a la dieta de la abeja. La baja amplitud de nicho registrada en diciembre se asocia a la dominancia del forrajeo de pocas especies vegetales (por ejemplo, de Sebastiania y Cissus en diciembre 2011 y 2012 respectivamente). No obstante, un caso particular fue el observado en enero 2013 (0.34), donde si bien Eucalyptus y Poaceae se destacaron como los tipos polínicos dominante y secundario respectivamente, la utilización de los recursos poliníferos abarcó a Eupatorium, Escallonia schreiterie, Gnaphalium y Mimosa. Por último, a finales de la temporada estival (marzo 2012 y 2013) los valores del índice tienden a aumentar, vinculado al uso de recursos como Baccharis, Cantinoa, Clematis, Poaceae, Serjania, Sebastiania, Sicyos, Viguira, entre otros.
Discusión
Las familias botánicas que presentaron mayor riqueza polínica en las cargas corbiculares examinadas fueron Asteraceae y Fabaceae, concordante a lo observado en sectores del Chaco Serrano de la provincia de Jujuy (Burgos et al., 2015) y en otras zonas del país (Tellería, 1993; Andrada, 2003; Naab & Tamame, 2007; Faye et al., 2002; Forcone et al., 2011; Forcone & Ruppel, 2012). En este sentido, Ramalho, Kleinert-Giovannini, & Imperatriz-Fonseca (1990) destacan la importancia de estas familias como las principales fuentes de polen para A. mellífera y las abejas sin aguijón (Apidae, Meliponini) en hábitats neotropicales (Flores & Sánchez, 2010; Flores, Lupo, & Hilgert, 2015). Asimismo, esta oferta potencialmente responda a la disponibilidad y accesibilidad de recursos, siendo esta familia una de las principales para el noroeste argentino (Zuloaga, 1999).
Si bien no se presentaron diferencias estadísticas en la riqueza polínica en ambos periodos, si se observaron variaciones en la composición de los taxa utilizados. En los inicios del primer periodo, Blepharocalyx salicifolius, Sebastiania y Zanthoxylum fueron los principales ingresos a la dieta de la colmena, mientras que para el segundo lo fueron Cactaceae, Eupatorium, Parapiptadenia excelsa y tipo Cissus. Hacia finales de la primera temporada, recursos provenientes de especies de Sicyos y de la familia Euphorbiaceae son las principales fuentes de polen, a diferencia de lo observado en la segunda temporada, con altos valores de abundancia de especies de Eucalyptus y Viguiera. Estas diferencias pueden responder a diversos criterios de selección de los recursos, como son la disponibilidad y fenología floral, como también el valor nutricional, el tamaño, la ornamentación y la producción de los granos de polen, entre otros factores (Márquez, 2009; Montoya-Pfeiffer, 2011).
Dentro de la familia Asteraceae (valores de IF de 9.01 y 20.77 en los períodos estudiados) los tipos polínicos relevantes fueron Eupatorium y Viguiera. En el caso de Eupatorium, que abarca a dos especies arbustivas (Austroeupatorium inulifolium y Campovassouria cruciata) y abundantes en el área de estudio (Martin, 2014), su importancia reside en la selección de estos recursos por parte de las colmenas que responden a una oferta de fuentes accesibles y abundantes en el ambiente (Fagúndez, 2011). Asimismo, se destaca su importancia como un recurso nectarífero para A. mellifera en el área de estudio, hecho observado en estudios previos (Sánchez, 2013; Méndez, Sánchez, Flores, & Lupo, 2016; Sánchez, & Lupo, 2017). Por otra parte Viguiera, que incluye especies herbáceas y subarbustivas del área (Obs. pers.), también pudo verse en sectores del Chaco Serrano en la provincia de Jujuy durante las temporadas 2010-2011 (Burgos et al., 2015).
La familia Cactaceae (IF = 8.14) es exclusiva del continente americano y con una mayor diversidad de especies en ambientes tropicales áridos (Boyle & Anderson, 2002; Ortega Baez & Godinez Alvarez, 2006). Sin embargo, es interesante destacar la presencia de Rhipsalis floccosa Pfeiff., R. lorentziana Griseb. y especies del género Trichocereus (A. Berger) Riccob. en las Yungas argentinas, importantes recursos alimenticios para las comunidades locales y diferentes grupos de animales que habitan estos bosques (Schmeda-Hirschman, Feresin, Tapia, Hilgert, & Theoduloz 2005). En este sentido, confirmando su importancia melífera se encuentran los trabajos de Burgos et al. (2015) en el Chaco Serrano, de Flores et al., (2015) en las yungas septentrionales (localidad de Baritú, Salta, Argentina) y de Montenegro et al., (2013) en la zona central de Chile.
En este estudio se pudo ver que la importancia polinífera de la familia Euphorbiaceae (IF = 35.5), lo cual se complementa con lo hallado por Sánchez (2013) y Méndez et al., (2016) para el área de estudio, quienes destacan la importancia nectarífera para A. mellifera. Posiblemente su relevancia resida en la gran diversidad de especies presentes en hábitats neotropicales (Ramalho et al., 1990) y en el norte de Argentina (Zuloaga, 1999) con fuentes de polen y néctar accesibles para las colmenas.
Dentro de esta familia, Sebastiania es un recurso importante durante el inicio de la temporada, igual a lo observado en el examen de cargas polínicas del Chaco Serrano (Burgos et al., 2015) y en mieles de las zonas de estudio (Méndez et al., 2016; Sánchez & Lupo, 2017). En áreas cercanas al sitio de muestreo, Sebastiana commersoniana y S. brasiliensis son elementos abundantes en las comunidades vegetales de la matriz boscosa (Martin, 2014; obs. pers.), lo cual probablemente explique su utilización por parte de las colmenas.
En otros sitios de Yungas de la provincia de Jujuy, se observó otro tipo polínico dominante perteneciente a esta familia e identificado como Croton, formando parte de la dieta polínica de A .mellifera (Méndez, en prep.). Todos estos registros evidencian la importancia de esta familia como fuente de polen para las abejas melíferas en las Yungas.
Dentro de la familia Fabaceae (IF = 20.40 y 26.27), Mimosa se menciona por primera vez como recurso polinífero para la zona. Estudios previos destacan su importancia nectarífera para la zona de estudio (Sánchez & Lupo, 2017) y para sectores del Chaco serrano (Burgos & Sánchez, 2014), como también para áreas tropicales y subtropicales de Brasil y Colombia donde son frecuentemente utilizados por las abejas para su alimentación (Aguilar Sierra & Henry Smith, 2009; De Novais, Lima, & Do Santos, 2010; Alves & Santos, 2014).
En cuanto a Parapiptadenia excelsa, especie frecuente en los distintos de pisos de Yungas (Brown, 2007), su presencia durante el mes de octubre estaría vinculado con el periodo de floración de la especie (octubre a noviembre) (Digilio & Legname, 1966; Cazón, 2009) y su abundancia en cercanías al sitio de muestreo, donde se encuentra formando un mesobosque mesotropical sub húmedo junto a Erythrina falcata Benth. entre los 1 424 y 1 455 msnm (Martin, 2014). Resultados similares se registraron en colmenas ubicadas en el ecotono yungas - chaco (Burgos et al., 2015). Asimismo, es un recurso nectarífero relevante para colmenas de A. mellifera (Sánchez & Lupo, 2011; Burgos & Sánchez, 2014; Méndez et al., 2016; Sánchez & Lupo, 2017), Plebeia intermedia en la localidad de Baritú, Salta (Flores et al., 2015), y Tetragonisca angustula en la localidad de Los Naranjos, Salta (Flores & Sánchez 2010).
La Familia Myrtaceae (IF = 9.10 y 9.13) es considerada una de las principales familias proveedoras de recursos melíferos en zonas neotropicales (Ramalho et al., 1990). En ella, Eucalyptus presenta un importante valor apícola (Basilio, 2000; Fagúndez & Caccavari, 2006; Nates-Parra, 2013). Esta especie exótica, relacionada con la actividad antrópica, se encuentra disponible en la zona de estudio por ser principalmente un área de producción forestal (Braun Wilke et al., 2013). En sectores del noroeste argentino es uno de los principales recursos poliníferos de las colmenas (Burgos et al., 2015), como también en sectores de la región pampeana argentina y el Bajo Delta del Paraná registrándose como recurso dominante en colmenas de A. mellifera y Xylocopa augusti Lepeletier de Saint Fargeau (Telleria, 1995; 1999; Basilio, 2000; Lucia, Tellería, Ramello, & Abrahamovich, 2017). En el sur de Brasil, se observó también su importancia polinífera tanto en colmenas de A. mellifera como en especies de meliponas (Luz et al., 2011; Hilgert Moreira, Nascher, Callegari-Jacques, & Blocthein, 2014).
En la familia Rutaceae (IF = 4.99), Zanthoxylum se destacó como un recurso importante durante setiembre 2011. Su utilización también es significativa en colmenas de Plebeia sp. (Flores, en prep.)
La familia Vitaceae (IF = 16.14), representada únicamente por el tipo Cissus, que es identificado por primera vez como recurso polinífero significativo para A. mellifera en Argentina. En estudios previos, Méndez et al., (2016) lo citan como un recurso nectarífero importante para la región del noroeste argentino, a diferencia de lo reportado para las mieles de la zona central de Entre Ríos y el Delta Medio del Río Paraná (Fagúndez & Caccavari, 2006; Caccavari & Fagúndez, 2010), y en mieles de P. intermedia en el norte de Salta (Flores et al., 2015), donde se registra con valores traza y de menor importancia.
A. mellifera es un insecto de habito generalista, característica que le permite adaptarse a los diferentes ambientes (Goulson, 2003; Da Luz, Thome, & Barth, 2007). En este trabajo los valores de índice de amplitud de nicho trófico se encuentran por debajo de 0.5, indicando preferencias por los recursos florales en el área y temporadas estudiadas. Montoya Pfeiffer (2011), mencionan que en ambientes diversos las abejas utilizan menor diversidad de recursos.
Durante el inicio de la temporada apícola, los valores de amplitud de nicho trófico hallados en ambos periodos (Bst = 0.24, 0.25) estarían directamente relacionados con el inicio de la actividad de la colmena, donde los requerimientos para la reproducción y reclutamiento de las abejas es mayor, favoreciendo su estado nutricional (Jacksic, 2001; Alaux, Ducloz, & Le Conte, 2010). Durante diciembre, en ambientes similares las curvas de floración si bien muestran una disminución en relación a setiembre y octubre, en general mantienen valores significativos de disponibilidad (Brown, 1995; Boletta, Vides-Almonacid, Figueroa, & Fernández, 1995). Por lo tanto, los bajos valores del índice reflejarían el forrajeo sobre solo unas pocas especies dominantes, este patrón también se observó para otros ambientes (Andrada & Tellería, 2005). A finales de las temporadas estudiadas el incremento de los valores del índice se relacionaría con un comportamiento de forrajeo orientado a acopiar reservas de alimentos para el período de invernada (Alaux et al., 2010).
En general, en un sector de la Selva montana de las Yungas en Jujuy, las especies nativas son el principal aporte a la dieta de A. mellifera en los periodos estudiados. Si bien no se presentan diferencias en cuanto a la riqueza polínica y en consecuencia en los valores de amplitud de nicho trófico en los periodos analizados, la composición de tipos polínicos identificados varía. Estas variaciones se relacionan con los distintos factores que afectan la selección de los recursos, tantos extrínsecos (disponibilidad y fenología floral) como intrínsecos (calidad nutricional, producción, tamaño y ornamentación de los granos de polen, entre otros).
La baja amplitud de nicho trófico evidencia la preferencia floral que se da en un ambiente tan diverso como las Yungas, y su dinámica a lo largo de los periodos productivos podría responder a una demanda individual y poblacional dependiente de los requerimientos de la colmena.
Si bien en la provincia de Jujuy la producción y comercialización de polen corbicular está limitada al consumo personal, el conocimiento generado en este estudio, además del aporte sobre la dieta de A. mellifera en estos bosques subtropicales, servirá de base para potenciar la producción y comercialización de este recurso apícola a partir del valor agregado por su origen botánico.












 uBio
uBio